Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta zoológica mexicana
On-line version ISSN 2448-8445Print version ISSN 0065-1737
Acta Zool. Mex vol.25 n.2 Xalapa Aug. 2009
Artículos originales
Especies del género Anicetus Howard (Hymenoptera: Encyrtidae) del Nuevo Mundo
Species of the genus Anicetus Howard (Hymenoptera: Encyrtidae) from the New World
Vladimir A. TRJAPITZIN 1,2 y Enrique RUÍZ CANCINO1
1 UAM Agronomía y Ciencias, Universidad Autónoma de Tamaulipas, 87149 Cd. Victoria, Tam., MÉXICO. Autor corresponsal: eruiz@uat.edu.mx
2 Instituto Zoológico, Academia de Ciencias de Rusia, 199034 San Petersburgo, RUSIA.
Recibido: 30/08/2007.
Aceptado: 10/03/2009.
RESUMEN
Se describen dos especies nuevas de México, Anicetus myartsevae sp. nov. del Estado de Tamaulipas y A. villarreali sp. nov. del Estado de Nuevo León. Se incluyen características taxonómicas de Anicetus, la clave para la identificación de las hembras de siete especies del género presentes en el Nuevo Mundo y la sinopsis de las especies americanas con datos de distribución geográfica, hospederos y biología.
Palabras clave: Anicetus, Nuevo Mundo, México, especies nuevas.
ABSTRACT
Two new species from Mexico, Anicetus myartsevae sp. nov. from the State of Tamaulipas and A. villarreali sp. nov. from the State of Nuevo León, are described. Taxonomical characteristics of Anicetus, the key to females of seven species of this genus present in the New World, and a synopsis of the American species with data on geographic distribution, hosts and biology, are included.
Key words: Anicetus, New World, Mexico, new species.
INTRODUCCIÓN
Los encírtidos son endoparasitoides primarios de otros artrópodos o hiperparasitoides de otros himenópteros, unas pocas especies son depredadoras de huevos de escamas Coccidae. En México se reporta la presencia de 156 géneros y 164 especies (Trjapitzin et al. 2004 a). La publicación de información acerca de especies relevantes en el control biológico clásico y en el manejo integrado de plagas de plantas cultivadas es importante para el desarrollo de dichos campos. Anicetus es un género bien conocido pero poco estudiado en América. Todas sus especies con hospederos conocidos son parasitoides primarios de escamas suaves y de escamas cerosas (Homoptera: Coccoidea). Algunas especies de Anicetus han sido empleadas en programas de control biológico clásico con gran éxito.
En el Nuevo Mundo se conocen solamente 7 especies de Anicetus, de un total de 43 especies descritas en la fauna mundial. De ellas, A. argentinus (Fidalgo) comb, nov., A. myartsevae sp. nov., A. primus (Howard), A. quintanai De Santis, A. toumeyellae Milliron y A. villarreali sp. nov. son nativas mientras que A. annulatus Timberlake es originaria de Asia oriental y fue introducida por ecesis (con sus hospederos) a California, Estados Unidos (EU), México, Honduras, Haití, República Dominicana, Trinidad y a las Islas Bermudas.
MATERIAL Y MÉTODOS
El primer autor estudió el material de las colecciones del Instituto Zoológico de la Academia de Ciencias en San Petersburgo, Rusia (ZISP), del Museo de Insectos del Departamento de Entomología de la Universidad de California en Riverside, EU (UCR), del Departamento de Entomología del Museo de Historia Natural de la Academia de Ciencias de California en San Francisco, EU (CAS), del Departamento de Entomología del Museo Nacional de Historia Natural en Washington, D.C., EU (USNM) y del Museo de Insectos de la UAM Agronomía y Ciencias de la Universidad Autónoma de Tamaulipas en Cd. Victoria, México (UAT). Se utilizó también literatura relevante, especialmente De Santis (1964), Annecke (1967) y Trjapitzin (1989) con fines comparativos e informativos. Además de los datos de distribución del material estudiado y descripciones originales, se consultó a Noyes (2005).
RESULTADOS
Género Anicetus Howard, 1896
Especie tipo: Anicetus ceylonensis Howard, 1896, según monotipia.
Sinónimos:
Asteropaeus Howard, 1898; especie tipo: Asteropaeus primus Howard, 1898, según monotipia. Sinonimizado por Peck, 1951:500.
Habrolepopterygis Girault, 1915; especie tipo: Habrolepopterygis felix Girault, 1915, según designación original. Sinonimizado por Girault, 1916:302.
Paraceraptrocerus Girault, 1920; especie tipo: Paraceraptrocerus africanus Girault, 1920, según designación original. Sinonimizado por Trjapitzin, 1989:302.
Krishnieriella Mani, 1935; especie tipo: Krishnieriella ceroplastodis Mani, 1935, según designación original. Sinonimizado por Hayat, 1976:49.
La especie tipo (en Howard & Ashmead 1896) fue descrita de Sri Lanka (antes Ceilán), donde emergió de Vinsonia stellifera Westwood.
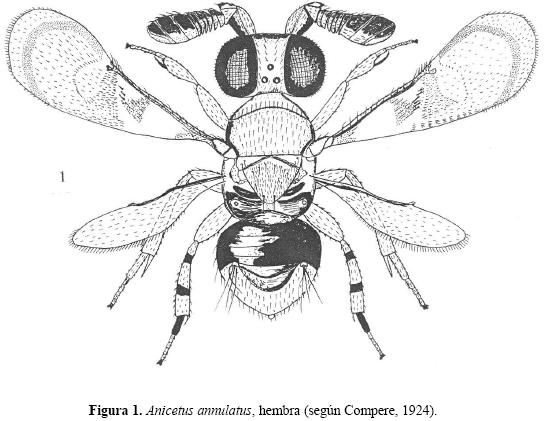
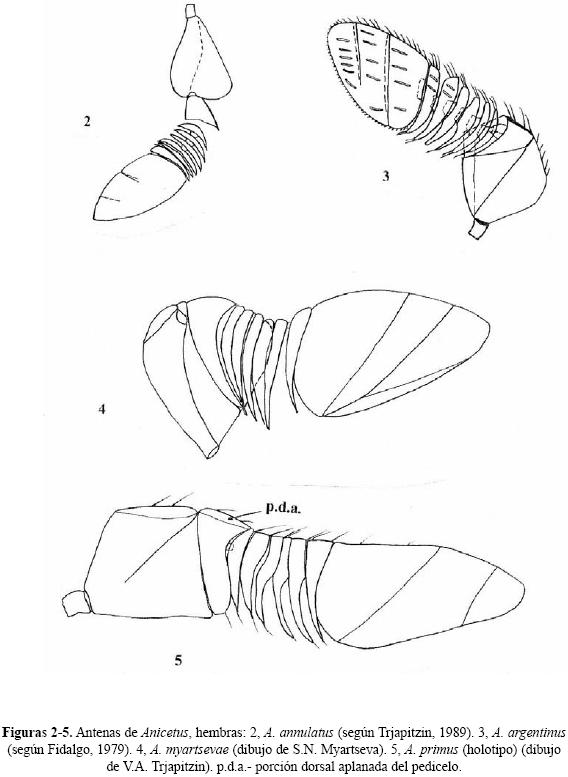
Diagnosis del género. Hembra. Cuerpo muy compacto y a veces algo aplanado. Frontovértice más o menos estrecho. Antenas fuertemente ensanchadas y comprimidas (Figs.1, 2–6); escapo subtriangular (Fig. 2) o subrectangular (Figs. 4–6); funículo de 6 artejos fuertemente transversales; maza grande, triarticulada o solamente con vestigios de separación entre los artejos (Fig. 2), más o menos oblicuamente truncada; escapo y pedicelo muy frecuentemente con una proyección dorsal. Mandíbula con un número variable de dientes en diferentes especies. Pronoto corto. Mesoescudo entero (sin líneas parapsidales). Alas anteriores amplias, ahumadas; el ahumado de la ala siempre bordeado por una banda subapical curva más oscura (Fig. 1); a veces, alas muy cortas. Paraterguitos del abdomen ausentes. Ovipositor no saliente, un poco saliente o muy saliente de la punta del abdomen.
Macho. Antenas largas, filiformes; escapo fusiforme; pedicelo subcónico; artejos del funículo subcilíndricos, comúnmente más largos que anchos y con largas pestañas dispuestas generalmente en verticilos; maza entera, corta. Alas anteriores hialinas.
Posición sistemática. Anicetus pertenece a la subfamilia Encyrtinae, a la tribu Cerapterocerini (Trjapitzin 1973; Noyes & Hayat 1984; Trjapitzin 1989).
Distribución geográfica. Las especies de Anicetus son conocidas en todos los continentes, sin embargo, se encuentran más distribuídas en zonas subtropicales y tropicales; en zonas templadas son raras.
Hospederos. Son parasitoides primarios de escamas de la familia Coccidae. Sólo A. russeus Annecke (de la República Sudafricana) parasita una especie de otra familia, la escama de laca Tachardina sclerosa Munting (Homoptera: Kerridae).
Tipo de desarrollo de inmaduros. Sólo ha sido estudiado para A. annulatus Timberlake. El huevo y la larva de esta especie son del tipo encirtoide (Compere 1924; Maple 1947).
Literatura básica del género. Howard, en: Howard & Ashmead, 1896:639–640; Howard, 1898:231–232 (Asteropaeus); Girault, 1915:86–87 (Habrolepopterygis); 1920:184–185 (Paraceraptrocerus); Mani, 1935:421–423 (Krishnieriella); Tachikawa, 1963:122–133; De Santis, 1964:372–376; Annecke, 1967:105–130 (Anicetus), 106, 130–156, 166–169 (Paraceraptrocerus); Trjapitzin, 1989:302–305; Fatima & Shafee, 1993:41–48.
La revisión mundial de las especies de Anicetus fue publicada por Annecke (1967), la clave para la identificación de las especies paleárticas por Trjapitzin (1989) y la revisión de las especies de India por Fatima & Shafee (1993). Anteriormente, no existía ninguna revisión de las especies americanas.
Usos en control biológico. Algunas especies de Anicetus tienen un papel importante en el control natural de escamas cerosas y escamas blandas en cítricos, mango, palmas, cafeto, morera, jacaranda, crotos, higueras, anonas, maracuyá y neem (Melia azedarach).
Un ejemplo importante en el control biológico clásico fue la introducción de Anicetus beneficus Ishii et Yasumatsu, parasitoide de la escama cerosa Ceroplastes rubens Maskell, una plaga seria de los cítricos en Japón (Yasumatsu 1958). Este eficiente parasitoide había sido encontrado solamente en la Prefectura de Fukuoka de la Isla de Kyushu, de donde fue distribuido a huertas citrícolas de dicha isla y de las islas Shikoku y Honshu. Posteriormente, A. beneficus fue introducido a Corea del Sur y Australia. Es posible que A. beneficus haya entrado a Japón desde China, donde había sido obtenido de C. rubens (Kennett et al. 1999).
La introducción de dos especies de Anicetus desde la República Sudafricana hacia Australia, A. communis Annecke y A. nyasicus (Compere) para combatir Ceroplastes destructor Newstead en cítricos, logró excelentes resultados (Malipatil et al. 2000). El programa de introducción de algunas especies de Anicetus de China, Japón y Vietnam, efectuado en el período 1950–1980 en la zona subtropical de la costa del Mar Negro en Georgia y el Territorio de Krasnodar (Rusia) para el control de las escamas cerosas Ceroplastes japonicus Green y C. sinensis Del Guercio, plagas de cítricos y otras plantas, no tuvo éxito. Esta situación puede ser explicada por el desconocimiento de la sistemática de Anicetus y por la especialización parasítica de sus especies. Posteriormente, se descubrió que era necesario introducir A. ohgushii Tachikawa de Japón o China contra C. japonicus (Izhevsky 1990).
Comentarios taxonómicos.– El nombre genérico Paraceraptrocerus Girault (Girault 1920) fue sinonimizado con Anicetus por Mercet. Este punto de vista fue aceptado por Nikolskaya (1952, 1963), Peck (1963), Subba Rao (1965) y Trjapitzin (1965, 1989). Sin embargo, Annecke (1967) restableció a Paraceraptrocerus basándose en la forma del escapo antenal (subtriangular en Anicetus y subrectangular o subtrapezoidal en Paraceraptrocerus). Noyes & Hayat (1984) presentaron a Paraceraptrocerus como un género aparte pero con la reserva de que probablemente pudiera ser sinónimo de Anicetus. En el presente trabajo se acepta el criterio de Mercet y se trata a Paraceraptrocerus como sinónimo de Anicetus.
Annecke (1967) dividió las hembras de Anicetus sensu stricto en 7 grupos de especies:
1. Grupo de A. primus (Howard): funículo antenal aproximadamente tan largo o más corto que el primer artejo de la maza medido a lo largo de su margen dorsal.
2. Grupo de A. ceylonensis Howard: escapo y pedicelo redondeados dorsalmente y más o menos convexos; frontovértice reticulado, mate detrás del ocelo anterior, liso y brillante anteriormente.
3. Grupo de A. graminosus Annecke: escapo y pedicelo redondeados dorsalmente y más o menos convexos; frontovértice completamente reticulado.
4. Grupo de A. chinensis Girault: margen dorsal del escapo convexo, margen dorsal del pedicelo fuertemente cóncavo; márgenes laterales del pedicelo fuertemente ensanchados anteriormente, este artejo se prolonga arriba y abajo, cubriendo la base del funículo.
5. Grupo de A. ceroplastes Ishii: margen dorsal del escapo y del pedicelo aplanado; pedicelo no fuertemente cóncavo y sus márgenes laterales no fuertemente ensanchados; pedicelo no prolongado dorsalmente o sólo ligeramente y con una prolongación ventral moderada.
6. Grupo de A. parvus Compere: escapo aplanado dorsalmente; pedicelo convexo, redondeado dorsalmente.
7. Grupo de A. abyssinicus Annecke: escapo convexo, redondeado dorsalmente; pedicelo aplanado dorsalmente.
Al dividir Anicetus en estos grupos de especies, Annecke (1967) no estudió personalmente A. primus (Howard) de México. Sin embargo, estableció el grupo de A. primus e incluyó en él a la especie sudamericana A. quintanai De Santis. V.A. Trjapitzin visitó en 2002 el Museo Nacional de Historia Natural en Washington, D.C. y estudió el holotipo de A. primus. La antena de esta especie (Fig. 5) tiene el escapo subtrapezoidal como el género Paraceraptrocerus (incluído actualmente en Anicetus); el escapo de A. quintanai es semejante. Por esta razón, se cambia el nombre del grupo de A. primus por el de A. africanus, la especie tipo de Paraceraptrocerus. Se incluye aquí en el grupo de A. africanus a todas las especies de Paraceraptrocerus tratadas por Annecke (1967) y también A. primus, A. quintanai, A. argentinus (Fidalgo 1979, comb. nov.) y A. myartsevae sp. nov. del Nuevo Mundo.
SINOPSIS DE LAS ESPECIES
Anicetus annulatus Timberlake
Literatura para América. Timberlake, 1913: 294, 304 [EU (California)–como Anicetus sp. n.]. Depositado en USNM. Smith, 1923:336–337 (tentativa de introducción no exitosa a California); Compere, 1924:116–117, 117–118 (tentativa no exitosa de propagación en laboratorio en California); Timberlake, 1924:432–433 (California); Dozier, 1937:124 (República Dominicana, Haití); Maple, 1947:60 (California); Gressitt et al., 1954:5–9 (tentativa de introducción a California sin éxito); Simmonds, 1957:8 (Bermudas); Peck, 1963:450 (introducción a California); Hart et al., 1966:70 (Texas); Bartlett, 1978:61, 69 (tentativas no exitosas de introducción a California); De Santis, 1979:228 (México); 1981:16 (Trinidad); Trjapitzin, 1989:302 (California–introducido; República Dominicana; Haití; Trinidad); Lampson & Morse, 1992:375 (tentativa de introducción a California sin éxito); Cave y Márquez, 1994:5–6 (Honduras); De Santis & Fidalgo, 1994:58 (República Dominicana; Haití, Bermudas); Kenneth, 1988:445–457; Trjapitzin, 1998:53 (México); Trjapitzin & Ruíz, 2000:636 (ecesis a México); González y Woolley, 2001 (CD – México); Trjapitzin et al., 2004 a:739 (en lista de especies de Encyrtidae en México); Trjapitzin et al., 2004 b:48 (presencia en islas del Caribe).
Distribución geográfica. Región Neártica: Estados Unidos (California, Texas), México (Nuevo León); Región Neotropical: Honduras, Jamaica, República Dominicana, Haití, Trinidad, Bermudas, Colombia; Región Indo–Malaya (Región Oriental): India, Tailandia; Región Paleártica: China (Sichuan, Guandong, Taiwán), Japón, Croacia; Región Australiana: Australia; Oceanía: Islas Hawaii.
Material estudiado (de América). Estados Unidos: 1) Sacramento, Calif., Nov. 22, 1912, 146460 (P.H. Timberlake), 1 hembra; laminilla con antena y ala anterior del especimen: Anicetus annulatus Timb., female, ant. & wings, ex Coccus hesperidum on orange, Capital Grounds, Sacramento, Cal., Nov. 22, 1912, 146440 (Ph. Timberlake) [UCR]; 2) Anicetus annulatus Timb. (en laminilla), antena, alas, 1922, ex Coccus sp. on Aralia, on Yenyo Marin Beach (San Francisco, Cal.) (Geo. Compere collector; reared by H. Compere), 1 hembra [UCR]; 3) Whittier [California], 2nd generation propagated, lab., Nov. 11, 1922 (?) (H. Compere) + 1 macho (en laminilla) [UCR]; 4) 1 mile south of Centerville near Niliss, Calif., Dec. 1, 1940 (Flanders & Finney); 1 hembra + 1 hembra (en laminilla) [UCR]; 5) Riverside, Calif., Parasite Laboratory, 4/25/51, ex stock collection, Anicetus annulatus from foreign collector, 1 hembra [UCR]; 6) Host: Soft Brown [Coccus hesperidum]; date: 2/13/52. Insectary stock (coll. B.B.). Anicetus annulatus (det. Compere). Div. Biol. Cont. Univ. Cal. 132, 3 hembras, 4 machos (en laminillas) [UCR]; 7) Riverside, Cal., ex soft brown scale [Coccus hesperidum], 4/25/51, reared from 1 female, Anicetus possibly annulatus from Formosa, laboratory stock, 8 machos [UCR]; 8) Anicetus annulatus, soft brown, 2/13/52, Riverside, CES (Citrus Experimental Station), insectary stock (Bartlett), 7 hembras, 4 machos (det. H. Compere) [UCR]; 9) Wells, Texas, Sept. 25, 1962, Coccus hesperidum (J.W. Ballock, 1 hembra (en laminilla) [USNM]. México: 1) on cut flowers from Mexico, Brownsville [Texas] # 20615, 10.XII.1937 (C.L. Parnell), 1 hembra [NMNH]; 2) Linares, N.L., April 12, 1954, Coccus hesperidum on Nerium oleander (De Bach), 1 hembra + 1 hembra en laminilla [UCR]. Jamaica: 1) Portland Par., parasite, 3.IV.1975 (E.E. Grissell), 1 hembra, 4 machos [USNM]; 2) St. George, Aripo Valley, 3 machos (det. J.S. Noyes, 1978) [NMNH]. República Dominicana: Santo Domingo, reared from Lecanium scale on rose, April 1927 (Giuseppe Russo), 1 hembra [USNM]. Haití: Source Caxcaw, reared from petit calceon Bauhinia divaricata material, Dec. 8, 1930 (H.L. Dozier), 1 hembra (en laminilla) [USNM].
Trinidad: 1) Curepe, CIBC lab. Grounds, Moericke trap. 30.III – 30.IV. 1974 (M.N. Beg), 1 hembra Anicetus annulatus (det. J.S. Noyes, 1978); misma localidad, 27.VIII – 7.IX.1974, 1 hembra [UCR]; 2) St. Augustine, Dec. 18, 1935 (A.R. Melville), ? Anicetus (det. J. Noyes), 3 machos [UCR]; 3) Curepe, Sta. Margarita, Circular Rd., 10– 24.VIII.1974 (F.D. Bennett), 1 hembra (det. J.S. Noyes, 1978) [CISP]; 4) St. George, El Jucuche, rain forest (west slope), 26.6.1976, 1 macho (det. J.S. Noyes) [ZISP]. Colombia: Guanata, Apr. 24, 1973, Coccus viridis, 1 hembra (det. Burks) [USNM].
Hospederos. Escamas suaves Coccus hesperidum Linnaeus, C. pseudomagnoliarum Kuwana, C. viridis Green y Eucalymnatus tesselatus Signoret. En regiones subtropicales, A. annulatus prefiere atacar a C. hesperidum; en las tropicales puede parasitar a C. viridis. No ataca escamas cerosas Ceroplastes spp.
Posición sistemática. Esta especie pertenece al grupo de Anicetus ceylonensis Howard (Annecke 1967). Es muy afín a A. toumeyellae Milliron de EU y a A. eous Trjapitzin, 1965 de Rusia (Trjapitzin 1965, 1989). A. annulatus difiere de A. toumeyellae por la presencia de dos manchas oscuras en la tibia posterior (Figura 1); de A. eous difiere por tener dos vestigios de suturas en la maza antenal (A. eous sólo tiene uno).
Comentarios. En California, EU, A. annulatus fue mencionada (como Anicetus sp. n.) por primera vez por Timberlake (1913) en su trabajo sobre los parasitoides de Coccus hesperidum. Más tarde (Timberlake 1919 a) señaló, después de analizar los restos del hospedero parasitado, que A. annulatus era un parasitoide primario. Según Compere (1924), los primeros especímenes de esta especie fueron recibidos por él en California a partir de Coccus hesperidum en planta de Azalia tomada del barco japonés "Taiyo Maru" que viajaba entre Asia oriental y San Francisco. En el laboratorio de Whittier (ahora en Los Ángeles), los parasitoides fueron propagados por 3 generaciones pero la cantidad de machos aumentó con cada generación mientras que la de hembras disminuyó. Finalmente, esta cría se perdió cuando emergieron sólo machos. Posteriormente, algunos machos y hembras de A. annulatus fueron criados de C. hesperidum y C. pseudomagnoliarum enviados por C.P. Clausen desde Yokohama, Japón. Algunas parejas de esta importación se liberaron en plantas infestadas de C. hesperidum y Eucalymnatus tessellatus en San Marino (parte norte de Los Ángeles). Sin embargo, A. annulatus había sido descrita como nueva especie no de California sino de las Islas Hawai (Timberlake 1919 b), donde había sido obtenida de la escama suave de las palmas E. tessellatus. Ese mismo año, Timberlake (1919 a) había escrito, en su importante artículo sobre el origen de la fauna de encírtidos de las Islas Hawai, que el parasitoide podía haber entrado a las islas hace mucho tiempo desde Asia oriental con sus hospederos aunque él no contaba con materiales asiáticos: su predicción resultó ser cierta. A. annulatus es común en Japón (Tachikawa 1963), se ha encontrado en China (Timberlake 1924; Peng 1960; Annecke 1967; Noyes & Hayat 1984; Liao et al 1987; Trjapitzin 1989), en Taiwán (Bartlett 1978; Lampson & Morse 1992), en Thailandia (Nakao et al. 1977) y en India (Hayat & Subba Rao 1981; Srinavasa 1985).
En 1931 y 1951, hubo tentativas fallidas de introducir A. annulatus a California desde Australia y Taiwán contra la escama Saissetia oleae Olivier en cítricos y olivares, en 1950 y 1951 desde Japón contra Coccus pseudomagnoliarum en cítricos (Gressitt et al. 1954; Kennett 1988) y en 1951 desde Taiwán contra la misma plaga (Bartlett 1978). Sin embargo, el parasitoide se distribuyó en California a través de la zona de San Francisco y Sacramento en el norte y hasta la frontera mexicana en el sur. Parece ser que el parasitoide entró casualmente a California antes de 1913 por ecesis con sus hospederos (ver material estudiado) aunque no se pueden excluir la posibilidad de aclimatación de algunas poblaciones introducidas deliberadamente. Además de California, este parasitoide se reporta de Texas, donde se obtuvo de Coccus hesperidum en huertas citrícolas del Valle del Bajo Río Grande (Hart et al. 1966).
En México, A. annulatus ha sido registrado por Burks (1967) y De Santis (1979) pero estos autores no indicaron las localidades. Trjapitzin et al. (1998) no encontraron a dicha especie en el Estado de Tamaulipas y recomendaron su introducción a México. Posteriormente, V.A. Trjapitzin visitó el Museo del Departamento de Entomología de la Universidad de California en Riverside y encontró en la colección 2 hembras de A. annulatus obtenidas en 1954 por el Profesor Paul De Bach en el Estado de Nuevo León que emergieron de Coccus hesperidum en Nerium oleander. Por tanto, es posible que el parasitoide haya entrado a México por ecesis con su hospedero común, C. hesperidum (Trjapitzin & Ruíz 2000); también se indica su ecesis probable desde Asia oriental (Trjapitzin et al. 2004 b).
El estudio de la literatura y de las colecciones en Riverside y Washington revela que A. annulatus también entró a Centroamérica y algunas islas de las Indias Occidentales: a Honduras (Cave y Márquez 1994), a Jamaica (nuevo registro), a República Dominicana y Haití (Dozier 1937), a Trinidad (De Santis 1981) y a Colombia (nuevo registro). Según Simmonds (1957) y Hilburn et al. (1990), esta especie se obtuvo de C. hesperidum en las Islas Bermudas.
En Europa, A. annulatus se reporta solamente de Croacia, en las islas Uglian (Hoffer 1970) y Mljet (Hoffer 1982) del Adriático. Trjapitzin (1989) supuso que el parasitoide podía entrar a Croacia por ecesis desde Asia oriental o de otras regiones del mundo; también expresó la idea de que esta especie podía haber sido introducida casualmente primero a Albania desde China (en el período de amistad entre esos países) y de Albania a Croacia. No hay duda de que este parasitoide todavía no ocupa toda su área potencial de distribución.
Anicetus argentinus (Fidalgo 1979), comb. nov.
(Figura 3)
Fidalgo, 1979: 45–49 (Paraceraptrocerus). Hembra. Depositado en Fundación Miguel Lillo, Argentina.
Distribución geográfica. Argentina (Provincia de Formosa) (Fidalgo, 1979).
Hospedero. Ceroplastes sp., una especie de escama cerosa, en Aspidosperma quebrachoblanco.
Posición sistemática. Pertenece al grupo de Anicetus africanus ya que su escapo antenal es subcuadrado (Fig. 3) y, según la clave de Annecke (1967) queda como A. italicus (Masi), una especie del Mediterráneo. Difiere de A. italicus por tener el pedicelo pequeño, subtriangular, y los primeros dos artejos del funículo no diminutos.
Anicetus myartsevae., sp. nov
(Figura 4)
Hembra. Cabeza 1.5X más ancha que su altura. Anchura máxima de la cabeza 4.4X la anchura mínima del vértice. Márgenes interiores de los ojos ligeramente divergentes hacia adelante. Frontovértice cerca de 2.7X más largo que ancho. Ángulo apical de los ocelos algo menor de 90°; distancia del ocelo posterior al margen del ojo no mayor que el diámetro del ocelo. Carina fronto–facial aguda, un poco cóncava. Cara excavada; escrobas antenales profundas, encorvadas exteriormente; elevación media de la cara con una fina quilla longitudinal media casi en toda su longitud pero no alcanza la abertura oral; escrobas unidas arriba en la base de la pared vertical superior de la excavación de la cara. Tórulos antenales situados inmediatamente abajo del nivel de los márgenes inferiores de los ojos; distancia entre tórulos un poco mayor que la distancia entre un tórulo al margen del ojo (8:7) y 2X mayor que la distancia al borde de la boca. Espacio malar algo menor que el diámetro máximo del ojo (13:15). Margen de la boca (abertura oral) fuertemente cóncavo, su anchura un tercio de la anchura máxima de la cabeza. Antena muy característica (Fig. 4). Parte dorsal del escapo con una área horizontal; borde ventral del escapo recto y lado externo con un adelgazamiento para recibir el pedicelo. Pedicelo con la porción dorsal horizontal. Funículo antenal tan largo como el primer artejo de la maza medido en el lado dorsal. Maza muy grande, triarticulada, con suturas completas, truncada fuertemente oblicua en su parte ventral. Mesoescudo más ancho que largo (23:15). Escutelo un poco más ancho que largo (8:7) y apenas más corto que el mesoescudo. Metapleuras bien desarrolladas aunque estrechas. Alas no acortadas. Ala anterior 2.3x más larga que ancha. Propodeo muy corto en su parte media, en vista dorsal cubierto completamente por el ápice del escutelo. Gáster corto, más o menos redondo, algo más largo que el escutelo (18:13). Ovipositor oculto.
Frontovértice amarillo parduzco. Cara casi del mismo color, con dos bandas transversales más o menos oscuras: una banda más estrecha y más pálida está situada debajo de la quilla frontofacial y la otra banda, más ancha y más oscura, sigue a través de toda la cara al nivel de los tórulos antenales, esta banda ocupa también las partes correspondientes a los espacios malares. Borde de la boca oscuro. Radícula antenal negra. Lado interior del escapo más o menos pardo anaranjado con borde ventral ampliamente negro. Pedicelo y funículo más o menos oscurecidos. Maza oscura con brillo metálico bronceado. Parte dorsal del pronoto amarillo parduzco. Mesoescudo violeta verdoso azulado, pardo amarillento en su parte anterior. Axilas y escutelo anaranjado parduzco, sólo la parte apical del escutelo con un fuerte brillo violeta azulado verdoso. Tégulas pardo amarillento con ápices negros. Mesopleuras violeta en su mayor parte. Metapleuras violeta oscuro. Parte basal de la ala anterior (menos de un tercio de la longitud alar) (15:53) no ahumada, hialina y sin pubescencia discal (lo ahumado puede verse solamente en la base misma de la ala); el resto de la ala es ahumado como es común para las especies de Anicetus, solamente una pequeña área que sigue los ápices de las venas postmarginal y estigmática no es ahumada; ápice de la ala (cerca de 1/10 de su longitud) un poco ahumada. Un grupo de pelos largos negros debajo de la vena submarginal. Patas más o menos oscuras con los ápices de las tibias claros; tarsos amarillentos con el último artejo oscuro. Lados del propodeo verde muy brillante. Dorso del gaster violeta con lados verdes muy brillantes.
Frontovértice casi liso, algo brillante; frente con puntitos esparcidos y con pelos microscópicos muy cortos pero algunos gruesos, especialmente una hilera transversal de tales pelos situada cerca del borde de la carina frontofacial. Cara, debajo de los ojos, con escultura reticulada casi estriada y muy fina; elevación media de la cara finamente punteada. Lado interno del escapo antenal burdo y más o menos transversalmente reticulado, con puntitos pilíferos de pelos negros; borde dorsal de la antena con pelos negros largos y fuertes. Mesoescudo con reticulación transversal bastante fina y con pelos adheridos más o menos a la superficie del esclerito; estos pelos son más claros en la porción del mesoescudo con brillo metálico. Escutelo mate, con escultura no visible y al menos con 10 pelos largos negros. Mesopleuras con reticulación diminuta, más lisas en su parte posterior. Longitud del cuerpo: ca. 1 mm.
Macho desconocido.
Holotipo (hembra). México: Tamaulipas, Cd. Victoria, UAT, ex Coccidae en Psidium guajava, 14–05–1999 (S.N. Myartseva). Antena y ala anterior en el preparado microscópico No. 2002–2. En la Colección UCR.
Etimología. Se dedica a la colectora, Profesora Svetlana Nikolaevna Myartseva, reconocida especialista de Chalcidoidea de la UAM Agronomía y Ciencias, UAT, México.
Posición sistemática. Anicetus myartsevae sp. nov. pertenece al grupo de A. africanus debido a que su escapo antenal es subcuadrado, y al subgrupo de A. primus. En A. myartsevae y A. primus, la ala anterior tiene un mechón de pelos negros largos debajo de la vena submarginal; las diferencias entras estas especies están anotadas en la clave.
Anicetus primus (Howard 1898)
(Figura 5)
Howard, 1898:231–232 (Asteropaeus). Depositado en USNM. Girault, 1917:6; Peck, 1963:450; De Santis, 1964:374; Annecke, 1967:130; De Santis, 1979:229; Trjapitzin & Ruíz, 1995:10; González y Woolley, 2001 (CD –México); Trjapitzin et al., 2004a:739.
Distribución geográfica. México (Estado de Sonora: Guaymas) (Howard, 1898).
Hospedero. Escama cerosa Ceroplastes sp. en árbol de leguminosa.
Material estudiado: El primer autor estudió en 2002 el holotipo de A. primus (en preparado microscópico) en USNM.
Posición sistemática. Esta especie pertenece al grupo de Anicetus africanus porque su escapo antenal (Fig. 5) es subtrapezoidal. Es afín a A. myartsevae sp. nov., las diferencias entre ellas están indicadas en la clave.
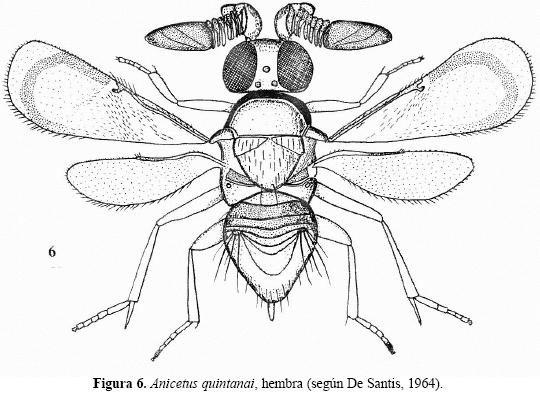
Anicetus quintanai de Santis 1964
(Figura 6)
De Santis, 1964:374–376. Annecke, 1967:130; De Santis & Fidalgo, 1994:58.
Distribución geográfica. Argentina (Provincia de Buenos Aires) (De Santis 1964), Chile (De Santis & Fidalgo 1994).
Hospederos. Cochinilla de aguaribay Ceroplastes sp. en Argentina (De Santis 1964) y Ceroplastes sp. en maracuyá en Chile (De Santis & Fidalgo 1994).
Posición sistemática. Pertenece al grupo de Anicetus africanus. Difiere de A. primus y de A. myartsevae sp. nov. por la ausencia de un mechón de pelos largos debajo de la vena submarginal de la ala anterior (Fig. 6). Datos tomados de la descripción original.
Anicetus toumeyellae Milliron 1959
Milliron, 1959:28–30. Depositado en USNM.
Peck, 1963:450; Annecke, 1967:107, 112; Burns & Donley, 1970:232; Noyes et al., 1997:297.
Distribución geográfica. Estados Unidos (Delaware, Tennessee) (Milliron, 1959).
Hospedero. Esta especie fue descrita del estado de Delaware, EU, donde emergió de la escama suave Toumeyella liriodendri Gmelin sobre Magnolia. Dicha escama es plaga común de Liriodendron tulipifera y a veces puede causar pérdida de algunos árboles; también se encuentra en magnolias, tilos, gardenias y nogales. A. toumeyellae emerge de las 'pupas' de los machos de la escama (Burns & Donley 1970).
Material estudiado. Estados Unidos: Newark, Del., July 1950, ex soft scale on Magnolia (Donald Mc Gregory), 1 female (paratype) [UCR]; misma localidad, ex Toumeyella liriodendri (Gmel.), July 30, 1950 (H.E. Milliron), 1 female (paratype) [UCR]; 4 paratipos en CAS.
Posición sistemática. Pertenece al grupo de especies de Anicetus ceylonensis. Es afín a A. annulatus, de la cual difiere en la ausencia de manchas oscuras en la tibia posterior.
Anicetus villarreali sp. nov.
Hembra. Cabeza más ancha que alta (4:3). Frontovértice estrecho, ca. 1/5 la máxima anchura de la cabeza (3:14) y 3X más largo que ancho. Ocelos pequeños que forman un triángulo casi equilátero; distancia del ocelo posterior al margen del ojo un poco mayor al diámetro del ocelo. Sienes ausentes. Carina frontofacial aguda, algo cóncava. Cara fuertemente excavada; escrobas antenales casi rectas lateralmente, se unen arriba a la base de la pared vertical superior de la excavación de la cara; elevación media de la cara con una quilla longitudinal fina, no alcanza la abertura oral. Tórulos antenales situados inmediatamente debajo del nivel de los márgenes inferiores de los ojos; distancia entre tórulos 5X la distancia mínima del tórulo al borde inferior de la cabeza. Escapo antenal subtriangular, 1.5X más largo que ancho y tan largo como el pedicelo y el funículo juntos; maza triarticulada con suturas completas, tan larga como el pedicelo y el funículo juntos, 1.5X más larga que ancha; primer artejo de la maza 2X más corto que el funículo (medido a lo largo del margen dorsal de la antena); truncación de la maza no muy fuerte. Mesoescudo aproximadamente 2X más ancho que largo. Escutelo algo más largo que el mesoescudo y tan ancho como largo. Alas muy cortas: alas anteriores alcanzan solamente el margen posterior del segundo terguito del gáster (IV abdominal); rudimento de la ala anterior cerca de 2.8X más largo que ancho; vena submarginal bien desarrollada, recta pero algo encorvada y ensanchada en su parte apical; celda costal bastante ancha, aproximadamente 10X más larga que ancha; vena marginal gruesa, cerca de 2X más larga que ancha; venas postmarginal y estigmática muy cortas, casi iguales, la distancia de sus ápices al ápice alar 6X menor que la longitud alar. Metapleuras representadas por rudimentos estrechos. Espolón de la tibia media más corto que el primer artejo del tarso correspondiente. Propodeo muy corto en su parte media y algo angular en las partes posteriores laterales. Gáster algo más largo que el mesosoma (el ejemplar estudiado fue secado al punto crítico). Vainas del ovipositor un poco salientes.
Color general del cuerpo amarillo parduzco, en algunas partes con un ligero brillo dorado. Parte superior de la cavidad facial y escrobas antenales oscuras. Cara con una banda transversal oscura que atraviesa los tórulos antenales y se prolonga a los espacios malares, donde se curva y alcanza el orificio oral; en la elevación media de la cara, esta banda es más estrecha y sube en forma angular. Bordes del escapo antenal más o menos negros u oscurecidos; funículo pardo amarillento; maza ennegrecida. Palpos amarillos. Rudimentos de las alas anteriores ahumados en la mitad apical. Coxas anteriores blanquecinas, coxas medias y posteriores ennegrecidas, más las posteriores. Espolón oscurecido en la tibia media.
Frontovértice casi liso, sin escultura visible. Mesoescudo muy superficialmente reticulado, con pelos más o menos blanquecinos, cortos. Escutelo con reticulación diminuta y profunda, con más de 20 pelos negros mucho más largos que los del mesoescudo. Parte ahumada del rudimento de ala anterior con pelos negros. Mesopleuras con escultura superficial, poligonal, de celdas bastante grandes y con finas líneas oscuras longitudinales. Gáster con escultura superficialmente reticulada. Longitud del cuerpo: 1.2 mm.
Macho desconocido.
Holotipo (hembra). México, N.L. [Nuevo León], Mun. Escobedo, Hda. El Canadá, 12–VII–1983 (G. Gordh). Anicetus, det. John S. Noyes, 1988. Depositado en UCR.
Etimología. Se dedica la especie al Dr. Américo Villarreal Anaya, cardiólogo, ex Director del Hospital General de Cd. Victoria, Tamaulipas, México.
Posición sistemática. Lo más probable es que A. villarreali pertenezca al grupo de especies de A. ceylonensis y es afín a A. toumeyellae. Se distingue de A. toumeyellae por presentar la maza antenal con suturas completas y las alas muy cortas.
Comentarios. Anicetus villarreali es la segunda especie conocida del género con alas muy cortas. La primera, mencionada por Noyes et al. (1997) es una especie no descrita, probablemente de EU, que presenta la pubescencia del disco del rudimento de ala anterior cubierta con pelos blanquecinos; A. villarreali tiene pelos negros en esa área.
Anicetus sp.
Bennett & Hughes (1959) comunicaron de la tentativa de introducción de una especie de Anicetus no identificada de India (vía California) a las Islas Bermudas en 1956–1957, para combatir la escama Pulvinaria psidii Maskell. Tal como anota Cock (1985), la misma especie (?) fue importada de Taiwán, también vía California. Anicetus no se estableció en Bermudas en P. psidii (Noyes & Hayat, 1994).
"Anicetus sp."
Según Cock (1985), esta especie no identificada fue introducida en 1961 desde Trinidad a Barbados contra Icerya purchasi Maskell (Homoptera:Margarodidae), con resultados desconocidos. En realidad, dicha especie es Homosemion bennetti Annecke, 1967.

AGRADECIMIENTOS
A la Sra. Verónica Abres–Pulawski (San Francisco, CA, EU), por su ayuda cordial; a la Sra. Elisaveta Ya. Chouvakhina (Sociedad Entomológica de Rusia, San Petersburgo, Rusia), por sus consejos críticos; a los doctores David G. Furth, Eric E. Grissell, Michael E. Schauff y Michael W. Gates (Departamento de Entomología, Museo Nacional de Historia Natural, Instituto Smithsoniano, Washington, D. C., EU), por el permiso de trabajar en las colecciones del Departamento y por su amable ayuda; al Dr. Alejandro González Hernández (Facultad de Ciencias Biológicas, Universidad Autónoma de Nuevo León, San Nicolás, N. L., México), por su ayuda cordial; a la Profesora Svetlana N. Myartseva (UAM Agronomía y Ciencias, UAT, Cd. Victoria, Tamaulipas, México), por su amable ayuda; al Dr. Wojciech J. Pulawski (Departamento de Entomología, Museo de Historia Natural, Academia de Ciencias de California, San Francisco, CA, EU) por permitir trabajar con las colecciones del Departamento y por su amable colaboración; al Dr. Serguei V. Triapitsyn (Colección Entomológica, Universidad de California–Riverside, EU) por el préstamo de material, envío de literatura y por su ayuda cordial; al Dr. Marc G. Volkovich (Instituto Zoológico, Academia de Ciencias de Rusia, San Petersburgo, Rusia) por su amable ayuda; al Dr. James B. Woolley (Departamento de Entomología, Texas A & M University, College Station, TX, EU), por el envío de literatura, y al Dr. Robert L. Zuparko (Museo Essig, Universidad de California, Berkeley, CA, EU), por su ayuda cordial.
LITERATURA CITADA
Annecke, D. P. 1967. The genera Anicetus Howard, 1896, Paraceraptrocerus Girault, 1920 and allies, with descriptions of new genera and species (Hymenoptera: Encyrtidae). Transactions of the Royal Entomological Society of London 119 (4):99–169. [ Links ]
Bartlett, B. R. 1978. Coccidae (pp. 57–74). In: Clausen, C. P. (Ed.). Introduced parasites and predators of arthropod pests and weeds: a world review. USDA Handbook N 480. Washington, EU. i–vi + 545 pp. [ Links ]
Bennett, F. D. & L W. Hughes. 1959. Biological control of insect pests in Bermuda. Bulletin of Entomological Research 50 (3):423–426. [ Links ]
Burks, B. D. 1967. Chalcidoidea. In: Krombein, K. V. & B. D. Burks (Eds.). Hymenoptera of America North of Mexico, Synoptic Catalog. USDA Agricultural Monograph No. 2, Supplement 2:213–282. [ Links ]
Burns, D. P. & D. E. Donley. 1970. Biology of the tuliptree scale Toumeyella liriodendri (Homoptera: Coccidae). Annals of the Entomological Society of America 63 (1):228–235. [ Links ]
Cave, R. D. y G. Márquez. 1994. Parasitoides de Diaspididae, Coccidae y Aleyrodidae atacando cítricos en Honduras. CEIBA (Tegucigalpa) 35 (1):3–8. [ Links ]
Cock, M. J. W. (Ed.). 1985. A review of biological control of pests in the Commonwealth Caribbean and Bermuda up to 1832. Commonwealth Institute of Biological Control, Technical Communication No. 9. Commonwealth Agricultural Bureaux, Slough, U.K. vi + 218 pp. [ Links ]
Compere, H. 1924. A preliminary report on the parasitic enemies of the citricola scale (Coccus pseu–domagnoliarum (Kuwana)) with descriptions of two new chalcidoid parasites. Bulletin of the Southern California Academy of Science 23 (4): 113–123. [ Links ]
De Santis, L. 1964 (1963). Encírtidos de la República Argentina (Hymenoptera: Chalcidoidea). Anales de la Comisión de Investigación Científica, Provincia de Buenos Aires, Gobernación 4:9–422. [ Links ]
De Santis, L. 1979. Catálogo de los himenópteros calcidoideos de América al sur de los Estados Unidos. La Plata (Argentina). 488 pp. [ Links ]
De Santis, L. 1981. Catálogo de los himenópteros calcidoideos de América al sur de los Estados Unidos. Primer Suplemento. Revista Peruana de Entomología 24(1): 1–38. [ Links ]
De Santis, L. y P. Fidalgo. 1994. Catálogo de himenópteros calcidoideos. Serie de la Academia Nacional de Agronomía y Veterinaria (Buenos Aires) 13:1–154. [ Links ]
Dozier, H. L. 1937. Descriptions of miscellaneous chalcidoid parasites from Puerto Rico (Hymenoptera). Journal of Agriculture of the University of Puerto Rico 21 (2): 121–135. [ Links ]
Fatima, A. & S. A. Shafee. 1993. Studies on the taxonomy of the Indian encyrtids (Hymenoptera: Encyrtidae). Aligarh Muslim University Publication, Zoological Series on Indian Insect Types 15: I–VIII +1–141. [ Links ]
Fidalgo, A. P. 1979. Una nueva especie de Paraceraptrocerus de Formosa, Argentina (Hymenoptera, Encyrtidae). Neotropica 25 (73):45–49. [ Links ]
Girault, A. A. 1915. Australian Hymenoptera Chalcidoidea – VII. The family Encyrtidae with description of new genera and species. Memoirs of the Queensland Museum 4:1–184. [ Links ]
Girault, A. A. 1916. New miscellaneous chalcidoid Hymenoptera with notes on described species. Ann. Entomol. Soc. Amer. 9 (3): 291–308. [ Links ]
Girault, A. A. 1917. Descriptiones Hymenopterorum Chalcidoidicarum variorum cum observationibus. V. Hillmead Press, Glenndale, Maryland (priv. Publ.). 16 pp. [ Links ]
Girault, A. A. 1920. New serphidoid, cynipoid and chalcidoid Hymenoptera. Proceedings of the United States National Museum 58 (2332): 177–216. [ Links ]
González H. A. y J. B. Woolley. 2001. Identificación y distribución de los géneros de Encyrtidae (Hymenoptera: Chalcidoidea) en México. UANL. México. CD. [ Links ]
Gressit, J. L. S. E. Flanders & B. Bartlett. 1954. Parasites of citricola scale in Japan, and their introduction into California. Pan–Pacific Entomologist 30 (1):5–10. [ Links ]
Hart, W. G., J. W. Ballock & S. Ingle. 1966. The brown soft scale, Coccus hesperidum L. (Hemiptera: Coccidae) in citrus groves in Rio Grande Valley. Journal of Rio Grande Valley Horticultural Society 20:70–73. [ Links ]
Hayat, M. 1976. Krishneriella Mani, 1935, a synonym of Anicetus Howard, 1896 (Hym, Encyrtidae). Entomologist's Monthly Magazine 11: 49–50. [ Links ]
Hayat, M. & B. R. Subba Rao. 1981. A systematic catalogue of Encyrtidae (Hymenoptera: Chalcidoidea) from the Indian subcontinent. Colemania 1 (2): 103–125. [ Links ]
Hilburn, D. J., P. M. Marsh & M. E. Schauff. 1990. Hymenoptera of Bermuda. Florida Entomologist 73(1):161–176. [ Links ]
Hoffer, A. 1970. First contribution to the knowledge of the Yugoslavian Encyrtidae (Hem., Chalcidoidea). Studia Entomologica Forestalia (Praha) 1 (10): 151–168. [ Links ]
Hoffer A. 1982. Encyrtidae des Nationalparkes Uljet. 3. Beitrag zur Kenntnis der Arten der Familie Encyrtidae (Hymenoptera, Chalcidoidea) Jugoslaviens. Acta Entomologica Jugoslavica 12 (1–2):35–64. [ Links ]
Howard, L. O. 1898. On some new parasitic insects in the subfamily Encyrtinae. Proceedings of the United States National Museum 21:231–248. [ Links ]
Howard, L. O. & W. H. Ashmead. 1896. On some reared parasitic hymenopterous insects from Ceylon. Proceedings of the United States National Museum 18 (1035):633–648. [ Links ]
Izhevsky, S. S. 1990. Introduction and applications of entomophags. Moscow, VO "Agropromizdat". 223 pp. (en ruso). [ Links ]
Kennett, C. E. 1988. Results of exploration for parasitoids of citricola scale, Coccus pseudomagnoliarum (Homoptera, Coccidae), in Japan and their introduction in California. Kontyu 56 (2):445–457. [ Links ]
Kennett, C. E., J. A. McMurtry & J. W. Beardsley. 1999. Chapter 27. Biological control in subtropical and tropical crops, pp. 713–742. In: Bellows, T.S. & T.W. Fisher (Eds.). Handbook of biological control. Principles and applications of biological control. Academic Press. San Diego. xviii + 1046 pp. [ Links ]
Lampson, L J. & J. G. Morse. 1992. A survey of black scale, Saissetia oleae (Hom.:Coccidae) parasitoids (Hym.:Chalcidoidea) in southern California. Entomophaga 37 (3):373–390. [ Links ]
Liao Dinxi, Li Xueli, Pang Xionfei & Chen Tailu. 1987. Hymenoptera: Chalcidoidea (1). Economic Insect Fauna of China 34:I–X + 241 pp. (en chino). [ Links ]
Malipatil, M. B., K. L. Dunn & D. Smith. 2000. An illustrated guide to the parasitic wasps associated with citrus scale insects and mealybugs in Australia. Knoxfield (Victoria, Australia). Agriculture Victoria. 152 pp. [ Links ]
Mani, M. S. 1935. A new encyrtid chalcid genus Krishnieriella gen. nov. from India. Records of Indian Museum 37 (4):421–423. [ Links ]
Maple, J. D. 1947. The eggs and first instar larvae of Encyrtidae and their morphological adaltations for respiration. University of California Publications in Entomology 8 (2): I–VIII + 25–122. [ Links ]
Meyer, J. B., C. A. Nalepa & C. Devorshak. 2001. A new species of Anicetus (Hymenoptera: Encyrtidae) parasitizing terrapin scale, Mesolecanium nigrofasciatum (Hemiptera: Coccidae). Florida Entomologist 84 (4):686–690. [ Links ]
Milliron, H. E. 1959. A new Anicetus parasite of the tuliptree scale (Hymenoptera: Encyrtidae). Annals of the Entomological Society of America 52 (19:28–30. [ Links ]
Nakao S., S. Takagi, T. Tachikawa & T. Wongsiri. 1977. Scale insects collected on citrus and other plants and their hymenopterous parasites in Thailand. Insecta Matsumurama, N.S. 1:61–72. [ Links ]
Nikolskaya, M. N. 1952. Chalcids of the fauna of the USSR (Chalcidoidea). Moscow–Leningrad, Academy of Sciences of the USSR. 547 pp (en ruso). [ Links ]
Nikolskaya, M. N. 1963. The chalcid fauna of the USSR (Chalcidoidea). Jerusalem, Israel Program for Scientific Translations. 593 pp. [ Links ]
Noyes, J. S. 2005. Taxapad. Chalcidoidea. The Natural History Museum. Londres. CD. [ Links ]
Noyes, J. S. & M. Hayat. 1984. A review of genera of Indo–Pacific Encyrtidae (Hymenoptera: Chalcidoidea). Bulletin of the British Museum (Natural History), Entomology ser. 84 (3): 131–395. [ Links ]
Noyes, J. S. & M. Hayat. 1994. Oriental mealybug parasitoids of the Anagyrini (Hymenoptera: Encyrtidae) with a world review of Encyrtidae used in classical biological control and an index of encyrtid parasitoids of mealybugs. Wallingford, England, CAB International. viii + 554 pp. [ Links ]
Noyes, J. S., J. B. Woolley and G. Zolnerowich. 1997. Encyrtidae , pp. 170–320. In: Gibson, G.A.P., J.T. Huber & J.B. Woolley (Eds.). Annotated keys to the genera of Nearctic Chalcidoidea (Hymenoptera). NRC Research Press, Ottawa, Ontario, Canada. 794 pp. [ Links ]
Peck, O. 1951. Superfamily Chalcidoidea, pp. 410–594. En: Muesebeck, C.F.W., K.V. Krombein & H.K. Townes (Eds.). Hymenoptera of America North of Mexico vol. 2. USDA . EU. [ Links ]
Peck, O. 1963. A catalogue of the Nearctic Chalcidoidea (Insecta:Hymenoptera). Canadian Entomologist. Supplement N 30:1–1092. [ Links ]
Peng Jun–yun. 1960. Comparative analysis of a complex of entomophags–parasites of coccids and whiteflies, damaging citrus cultures in Sicuani and Georgian SSR. Autoreferat of dissertation. Leningrad Agricultural Institute. 18 pp. (en ruso). [ Links ]
Simmonds, F. J. 1957. A list of Coccidae of Bermuda and their parasites. Bulletin of Department of Agriculture, Bermuda 30:1–12. [ Links ]
Smith, H. S. 1923. Biological control work. Monthly Bulletin of the California Department of Agriculture 12 (7–12):334–342. [ Links ]
Srinavasa, M. V. 1985. A new record of Anicetus annulatus Timberlake (Encyrtidae: Hymenoptera) as a parasite of Coccus viridis (Green) (Coccidae: Homoptera) attacking coffee. Plant Protection Bulletin (India) 37 (3/4): 37. [ Links ]
Subba Rao, B. R. 1965. A key to species of Anicetus Howard, 1896 (Hymenoptera: Encyrtidae), and descriptions of new species from India. Proceedings of the Royal Entomological Society of London (B) 34:71–75. [ Links ]
Tachikawa, T. 1963. Revisional studies on the Encyrtidae of Japan (Hymenoptera: Chalcidoidea). Memoirs of Ehime University, Sect. 6 (Agr.) 9 (1): 1–264. [ Links ]
Timberlake, P. H. 1913. Preliminary report on the parasites of Coccus hesperidum in California. Journal of Economic Entomology 6 (3):293–303. [ Links ]
Timberlake, P. H. 1919 a. Observations on some sources of Hawaiian Encyrtidae (Hymenoptera). Proceedings of the Hawaiian Entomological Society 4 (1): 183–196. [ Links ]
Timberlake, P. H. 1919 b. Descriptions of new genera and species of Hawaiian Encyrtidae (Hymenoptera). Proceedings of the Hawaiian Entomological Society 4 (19:197–231. [ Links ]
Timberlake, P. H. 1924. Records of the introduced and immigrant Chalcid–flies of the Hawaiian Islands (Hymenoptera). Proceedings of the Hawaiian Entomological Society 5 (3):418–449. [ Links ]
Trjapitzin, V. A. 1965. New species of encyrtids (Hymenoptera, Encyrtidae) from the Primorye Territory. Entomologicheskoye Obozreniye 44 (4): 885–906 ( en ruso). [ Links ]
Trjapitzin, V. A. 1973. Classification of the parasitic Hymenoptera of the family Encyrtidae (Chalcidoidea). Part II. Subfamily Encyrtinae Walker, 1837. Entomologicheskoye Obozreniye 52 (2):416– 429 (en ruso). (En inglés: Entomological Review, Washington 52 (2):287–295). [ Links ]
Trjapitzin, V. A. 1989. Parasitic Hymenoptera of the fam. Encyrtidae of Palaearctics. Leningrad. Nauka. 488 pp. (en ruso). [ Links ]
Trjapitzin, V. A. 1998 (1997). Encyrtidae y el control biológico de plagas en México. Revista de la Universidad Autónoma de Tamaulipas (México) 56:53–55. [ Links ]
Trjapitzin, V. A., F. D. Bennett, E. Ruíz C. & J. M. Coronado B. 2004 b. Annotated checklist of encyrtids (Hymenoptera: Chalcidoidea: Encyrtidae) of Central America, the West Indies and Bermuda. Universidad Autónoma de Tamaulipas. México. 205 pp. [ Links ]
Trjapitzin, V. A., E. Ruíz C., J. M. Coronado B. y E. Chouvakhina. 1998. Encyrtidae (Hymenoptera: Chalcidoidea) de México y su evaluación desde el punto de vista del control biológico de insectos plaga. Reporte Anual de Investigación, CIDAFF – UAT, X Aniversario 1988–1998:10–11. [ Links ]
Trjapitzin, V. A. & E. Ruíz C. 1995. Annotated check–list of encyrtids (Hymenoptera: Chalcidoidea: Encyrtidae) of México. Folia Entomológica Mexicana 94:7–32. [ Links ]
Trjapitzin, V. A. & E. Ruíz C. 2000. Ecesis of Encyrtidae (Hymenoptera:Chalcidoidea) into México. Abstracts, Book II – XXI International Congress of Entomology, Brazil, August 2000:636 (no. 2520). [ Links ]
Trjapitzin, V. A., E. Ruíz C. y J. M. Coronado B. 2004 a. Encyrtidae, pp. 735–742. En: J.E. Llorente B., J. J. Morrone, O. Yáñez O. e I. Vargas F. (Eds.). Biodiversidad, taxonomía y biogeografía de artrópodos de México. Vol. IV. UNAM–CONABIO. México. 790 pp. [ Links ]
Yasumatsu, K. 1958. An interesting case of biological control of Ceroplastes rubens Maskell in Japan. Proceedings 10th International Congress of Entomology (Montreal, 1956) 4:771–775. [ Links ]














