Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta zoológica mexicana
On-line version ISSN 2448-8445Print version ISSN 0065-1737
Acta Zool. Mex vol.24 n.3 Xalapa Dec. 2008
Artículos originales
Identificación, distribución y plantas hospederas de diez especies de Agromyzidae (Insecta: Diptera), de interés agronómico en México
Rogelio E. PALACIOS-TORRES1, Jesús ROMERO-NÁPOLES1, Jean ÉTIENNE3, José L. CARRILLO-SÁNCHEZ1, Jorge M. VALDEZ-CARRASCO1, Hiram BRAVO-MOJICA1, Stephen D. KOCH2, Víctor LÓPEZ-MARTÍNEZ4 y Antonio P. TERÁN-VARGAS5
1 Fitosanidad, Colegio de Postgraduados. Km 36.5 carr. México-Texcoco CP 56230, Montecillo, Texcoco, Estado de México, MEXICO. palaciost@colpos.mx , jnapoles@colpos.mx , josecarr@colpos.mx, jvaldez@colpos.mx, bravomj@colpos.mx
2 Recursos Naturales, Colegio de Postgraduados. Km 36.5 carr. México-Texcoco CP 56230, Montecillo, Texcoco, Estado de México, MÉXICO. sdkoch@colpos.mx
3 Institut National de la Recherche Agronomique (INRA), Centre Antilles-Guyane, Domaine Duclos, F-97170 Petit-Bourg, GUADELOUPE, FRENCH WEST INDIES (FWI). jean.etienne2@wanadoo.fr
4 Facultad de Ciencias Agropecuarias, Universidad Autónoma del Estado de Morelos. Av. Universidad No. 1001. Col. Chamilpa, CP 62210, Cuernavaca, Morelos, MÉXICO. vilomar74@yahoo.com.mx
5 Campo Experimental Sur de Tamaulipas CIR noreste, INIFAP, Km 55 carr. Tampico-Mante 89610 Est. Cuauhtémoc, Tamaulipas MÉXICO. teranva@hotmail.com
Recibido: 17 de septiembre de 2007
Aceptado: 20 de mayo de 2008
RESUMEN
Se presentan diez especies de Agromyzidae de interés agronómico en Texcoco, (Estado de México), Altamira, (Tamaulipas), Magdalena Contreras, (D. F) y Nativitas, (Tlaxcala). Se proporciona una descripción del adulto, distribución y plantas hospederas de cada especie, además de una clave para su identificación con fotografías que ilustran las características del edeago y bomba eyaculadora por especie. Las especies identificadas fueron: Amauromyza abnormalis (Malloch), Liriomyza brassicae (Riley), Liriomyza sabaziae Spencer, Liriomyza trifolii (Burgess), Melanagromyza minimoides Spencer, Melanagromyza neotropica Spencer, Melanagromyza splendida Frick, Melanagromyza tomaterae Steyskal, Melanagromyza viridis (Frost) y Ophiomyia lantanae (Froggatt).
Palabras clave: minadores, barrenadores, edeagos, bombas eyaculadoras, clave ilustrada, nuevos registros.
ABSTRACT
Ten species of Agromyzidae of agronomic interest in Texcoco, (state of Mexico); Altamira, (state of Tamaulipas), Magdalena Contreras, (Mexico City), and Nativitas, (state of Tlaxcala) are presented. A description of the adults, their geographic distributions and their host plants, are provided. In addition a key with photographs of the aedeagus and sperm pumps of all species are provided. The species included are: Amauromyza abnormalis (Malloch), Liriomyza brassicae (Riley), Liriomyza sabaziae Spencer, Liriomyza trifolii (Burgess), Melanagromyza minimoides Spencer, Melanagromyza neotropica Spencer, Melanagromyza splendida Frick, Melanagromyza tomaterae Steyskal, Melanagromyza viridis (Frost) and Ophiomyia lantanae (Froggatt).
Key words: leaf miners, stem borers, aedeagus, sperm pumps, illustrated key, new records.
INTRODUCCIÓN
La familia Agromyzidae está conformada por moscas pequeñas cuya longitud alar varía de 1.25 mm a 4.3 mm. En estado larvario se alimentan internamente de hojas, tallos, semillas y raíces de un amplio rango de especies vegetales, tanto dicotiledóneas como monocotiledóneas, así como de helechos (Spencer & Stegmaier 1973; Spencer & Steyskal 1986). También hay árboles que son hospederos de agromícidos; Phytobia pruni (Grossenbacher) se alimenta del cambium del tallo de Crataegus sp., de Prunus avium L. y de P. domestica L. en Nueva York, E.U.A (Spencer & Steyskal 1986). Phytobia betulae Kangas hace túneles en la madera del abedul (Betula pendula Roth y B. pubescens Ehrh.) en Finlandia, que demeritan la calidad de ésta (Ylioja et al. 1998).
En México se tienen registradas sólo 27 especies de agromícidos; destacan por su diversidad los géneros Melanagromyza Hendel y Liriomyza Mik (Martínez & Etienne 2002). Algunas especies de estas moscas pueden causar daños severos a los cultivos (Spencer & Stegmaier 1973). Tal es el caso de Melanagromyza splendida Frick, especie polífaga que se alimenta barrenando tallos de varias plantas cultivadas como cártamo, girasol, lechuga y zanahoria (Étienne et al. 1993). Otra especie como Liriomyza sativae Blanchard, se alimenta en plantas de 32 familias y 130 géneros (Étienne & Martínez 2003a); este último género cuenta con varias especies polífagas y muchas de éstas de distribución cosmopolita que atacan plantas cultivadas por todo el mundo. Debido a lo anterior, los minadores de esta familia han recibido la mayor atención, y son las especies más estudiadas y más mencionadas en la literatura científica.
En nuestro país, poco se conoce a esta familia de dípteros, por lo cual es necesario crear conocimiento de este grupo, destacando a las especies que interactúan con cultivos y a su vez, enriquecer el acervo de la entomofauna registrada en México.
Por lo anterior, y con la finalidad de contribuir al conocimiento de Agromyzidae asociados a cultivos en México, se describen aquí las principales características taxonómicas y algunos aspectos biológicos de las especies; se ofrece también una clave ilustrada con fotografías del edeago, bomba eyaculadora y otras características para la identificación de las especies.
MATERIAL Y MÉTODO
Colecta de material biológico. Durante agosto de 2001 a julio de 2006 se realizaron colectas de puparios de agromícidos sobre varias especies vegetales de interés agrícola y malezas de cuatro zonas rurales de México. Distrito Federal: San Nicolás Totolapan, Magdalena Contreras; Estado de México: Chapingo; Montecillo, Santiago Cuautlalpan, Texcoco; Tamaulipas: Estación Cuauhtémoc, Altamira; Tlaxcala: San Miguel del Milagro, Nativitas. El material entomológico obtenido se trasladó al laboratorio de Manejo Integrado de Plagas del Colegio de Postgraduados, donde se colocaron en recipientes redondos confeccionados como jaulas de 12 cm de diámetro y 7 cm de alto, previamente etiquetados, para esperar la emergencia de los adultos. Posteriormente los adultos fueron montados y etiquetados. El material vegetal se prensó y se trasladó al Herbario-Hortorio del Colegio de Postgraduados donde fueron montados y etiquetados para su determinación taxonómica.
Identificación de las especies de Agromyzidae Los adultos fueron identificados por el primer autor mediante el uso de las claves y esquemas de los genitales del macho de Spencer (1963; 1973), Steyskal (1972), Spencer & Stegmaier (1973), Spencer & Steyskal (1986) y Spencer et al. (1992). A su vez, las especies fueron corroboradas por el especialista del grupo, Dr. Jean Étienne.
Extracción de genitales. Para extraer los genitales se separó el abdomen del resto del cuerpo del díptero. Se introdujo en una solución de hidróxido de potasio al 10%, para macerar el tejido, por diez minutos a 80 °C. Se lavó con agua destilada a 80 °C por diez minutos, con el fin de eliminar el hidróxido de potasio. Con la preparación inmersa en alcohol al 70%, se separó la cutícula y tejidos del abdomen, hasta dejar limpios y expuestos los genitales completos.
Descripción morfológica. Para el estudio e ilustración de las características del edeago y bomba eyaculadora de cada especie, las estructuras se montaron sobre un portaobjetos inmersas en gel transparente para cabello con glicerina, para que éstas se mantuvieran en una posición estable. Para otras características morfológicas empleadas en la clave, se emplearon insectos adultos completos. El estudio y fotografías se hicieron en un microscopio Tessovar de Carl Zeiss y en un Fotomicroscopio III de Carl Zeiss, ambos con una cámara digital Pixera Professional®.
La quetotaxia de la cabeza y mesonoto se estudió con microscopía electrónica de barrido. Para esto, el material conservado en alcohol al 70% se deshidrató gradualmente con alcohol etílico absoluto. Se secó por el método del punto crítico y se cubrió con oro. Las observaciones y fotografías se hicieron en un microscopio electrónico de barrido JEOL 35-C.
Las mediciones de frente, ojos, genas y alas se hicieron con el analizador de imágenes Image Tool (Wilcox, et al. 2002).
Identificación de las plantas hospederas. Las especies vegetales fueron determinadas por el M. en C. Ricardo Vega Muñoz, curador del Herbario-Hortorio del Colegio de Postgraduados y corroboradas por el Dr. Stephen D. Koch especialista en taxonomía vegetal.
Biología y hábitos de las especies. Los datos para este apartado se obtuvieron mediante muestreos y observaciones directas del comportamiento de cada especie, en campos de cultivos, así como en zonas aledañas a éstos.
Deposito del material. El material entomológico está depositado en la colección entomológica del Colegio de Postgraduados, y el material vegetal con ejemplares de respaldo quedo depositado en el Herbario-Hortorio de Recursos Naturales del Colegio de Postgraduados, ambas colecciones del Campus Montecillo.
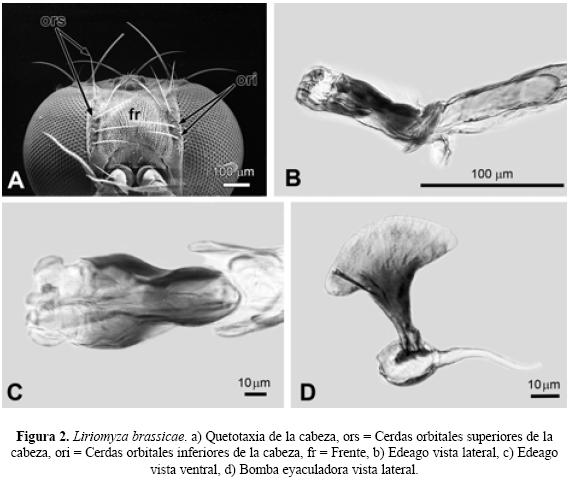
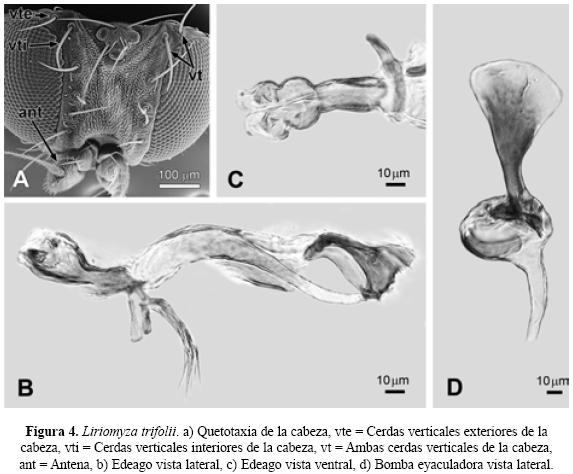
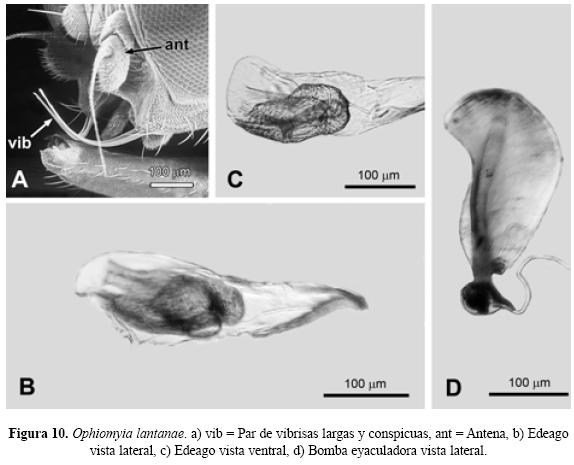
Abreviaturas y definiciones. Para este artículo se decidió seguir la nomenclatura de la quetotaxia de mesonoto y cabeza en inglés usada por (Spencer 1963; Spencer 1973, Spencer & Stegmaier 1973, Spencer 1983, Spencer & Steyskal, 1986). Por otra parte se emplearon abreviaturas de otras estructuras de los dípteros con el fin de facilitar su ubicación en el texto: acr (acrostichal hairs), hileras de sedas entre las cerdas dorsocentrales (Fig.1, A); dc (dorsocentral bristles), cerdas dorsocentrales del mesonoto (Fig.1, A); ori (lower fronto-orbital bristles), cerdas fronto-orbitales inferiores de la cabeza (Fig.2, A); ors (upper fronto-orbital bristles), cerdas fronto-orbitales superiores de la cabeza (Fig.2, A); vte (outer vertical bristles), cerdas verticales exteriores de la cabeza (Fig.4, A); vti (inner vertical bristles), cerdas verticales interiores de la cabeza (Fig.4, A); vt (both vertical bristles), ambas cerdas verticales de la cabeza (Fig.4, A). snd, subcosta no totalmente desarrollada a todo lo largo de la vena R1, venación (Subfamilia Phytomyzinae) (Fig.1, B); sd, Subcosta bien desarrollada a todo lo largo de la vena R1, venación (Subfamilia Agromyzinae) (Fig.8, A), ant, antena (Fig.4, A); cal, caliptra; mag, margen caliptral; fl, flecos (Fig.7, A); fr, frente (Fig.2, A); hal, halterios; sct, escutelo (Fig.1, A); vib, par de vibrisas largas y conspicuas (Fig.10, A).






DISCUSIÓN
Especies estudiadas
SUBFAMILIA PHYTOMYZINAE
Amauromyza (Cephalomyza) abnormalis (Malloch)
Agromyza abnormalis Malloch, 1913: 320.
Phytobia (Amauromyza) abnormalis: Frick, 1959: 378.
Amauromyza (Cephalomyza) abnormalis: Spencer, 1981: 148.
Material examinado. Tlaxcala: 28 y 26♂, San Miguel del Milagro, 13.vii.2005, en tallos de Amaranthus hypocondriacus L., colectó Rogelio E. Palacios. Estado de México: 1 y 1 , Chapingo, Texcoco, 30.vii.2005, en tallos de Amaranthus hypocondriacus L., colectó Rogelio E. Palacios. 2 y ♂, Chapingo, Texcoco, 15.ix.2005, en tallos de Amaranthus hypocondriacus L., colectó Rogelio E. Palacios. 1 y ♂, Chapingo, Texcoco, 20.ix.2005, en tallos de Amaranthus hypocondriacus L., colectó Rogelio E. Palacios.
Diagnosis. Cabeza. En vista frontal la frente tiene dos veces la anchura del ojo, y se proyecta por encima de éste. Dos pares de cerdas fronto-orbitales superiores (ors) de similar longitud y tres pares de cerdas fronto-orbitales inferiores (ori) similares en longitud. Las (ors) son más largas que las (ori). Sedas orbitales cortas y en número reducido. Triángulo ocelar claramente distinguible. Antena con el tercer segmento redondeado y con pubescencia; arista con sedas largas y claramente distinguibles. Gena angulosa y aproximadamente de la mitad de la altura del ojo. Ojos glabros en ambos sexos. Mesonoto. Presenta (3+1) pares de cerdas dorsocentrales (dc) y cuatro hileras de sedas (acr) entre las cerdas dorsocentrales. Ala. Longitud en el macho de 2.06 mm y en la hembra de 2.41 mm. En ambos sexos la Costa se extiende hasta la M1+2. Color. Frente, antena, triángulo ocelar, halterios, mesonoto, escutelo, abdomen y patas de color negro; caliptra obscura con el margen y flecos negros. Edeago vista lateral. Distifalo de cutícula oscura; en su parte superior presenta una protuberancia en forma de pico (Fig. 1, C), y Edeago vista ventral. Distifalo con una constricción muy ligera en su parte media y la parte distal redondeada (Fig. 1, D). Bomba eyaculadora. Apodema de la bomba ovalado y de dimensiones similares al bulbo (Fig. 1, E).
Plantas hospederas. Familia Amarantaceae: Amaranthus cruentus L., A. hibridus L., A. hypocondriacus L. (Bautista et al. 1997).
Distribución. Canadá, Estados Unidos, México (Tulyehualco, Xochimilco, Distrito Federal; Montecillo, Texcoco, Estado de México y San Miguel del Milagro, Nativitas, Tlaxcala) (Spencer & Steyskal 1986; Bautista et al. 1997, Torres et al. 2004).
Biología y hábitos. Las larvas se alimentan barrenando el tallo del amaranto Amaranthus hypocondriacus L., donde se pueden encontrar hasta 35 larvas de diferentes estadios alimentándose sobre un tallo, la larva al completar su desarrollo hace un orificio de salida para pupar en el suelo y completar su ciclo.
Discusión. Esta especie se describió en los países vecinos del norte; en nuestro país es registrada por primera vez en 1997 atacando al amaranto (Bautista et al. 1997). Sin embargo no ha sido estudiada a profundidad; se desconoce su biología, enemigos naturales y su efecto negativo sobre la producción de amaranto.
Por otra parte, Spencer & Steyskal (1986) mencionan a dos variedades de la especie que presentan algunas diferencias en la morfología del edeago, ubicadas en California en los Estados Unidos y Québec en Canadá. Las características morfológicas del edeago de la especie estudiada en este escrito son con específicos a la especie canadiense.
Liriomyza brassicae (Riley)
Oscinis brassicae Riley, 1884: 322.
Liriomyza brassicae: Frick, 1952a: 402.
=Liriomyza hawaiiensis Frick, 1952b: 513.
=Liriomyza bulnesiae Spencer, 1963: 360.
Material examinado. Estado de México: 8 y 9♂, Santiago Cuautlalplan, Texcoco, 05.vi.2005, en hojas de Lantana cámara L., colectó Rogelio E. Palacios. 6 y 8♂ , Ciudad de Texcoco de Mora, 27.V.2006, en hojas de Lantana cámara L., colectó Rogelio E. Palacios. 1 y 1♂ , Ciudad de Texcoco de Mora, 04.vi.2006, en hojas de Lantana cámara L., colectó Rogelio E. Palacios.
Diagnosis. Cabeza. Frente con un 0.33 en proporción del total del ancho de la cabeza, apenas más ancha que el ojo. Dos pares de cerdas fronto-orbitales superiores (ors) y dos pares de cerdas fronto-orbitales inferiores (ori). Sedas orbitales escasas y claramente distinguibles. Las dos cerdas verticales exteriores (vte) insertadas sobre cutícula negra y las dos cerdas interiores (vti) insertadas sobre superficie de cutícula amarilla. Antena con el tercer segmento de forma redonda y pubescencia de color blanquecino, arista oscura y pubescente. Gena 1/3 la altura del ojo. Ojos en ambos sexos lisos. Mesonoto. Presenta (3+1) pares de cerdas dorsocentrales (dc) y cuatro hileras de sedas (acr) entre las cerdas dorsocentrales. Ala. Longitud en el macho 1.43 mm y en la hembra 1.49 mm. En ambos sexos la Costa se extiende hasta la M1+2. Color. Frente, antena, órbitas ocelares, escutelo y halterios amarillos. Triángulo ocelar, arista, tibias y tarsos oscuros. Caliptra grisácea con el margen y flecos negros. Edeago vista lateral. Distifalo terminando en forma de U, de una coloración más clara que el resto del edeago (Fig. 2, B), y Edeago vista ventral. Distifalo presenta ligera constricción poco antes de llegar a su parte media y la parte más distal de coloración clara (Fig. 2, C). Bomba eyaculadora. Presenta un tallo estrecho y en su parte distal se ensancha pronunciadamente, con sus dos extremos redondos (Fig. 2, D).
Plantas hospederas. Familia Brassicaceae: Barbarea sp., Brassica oleracea L, Cakile sp., Cheiranthus sp., Eruca sp., Hirschfeldia sp., Isatis sp., Lepidium sp., Matthiola sp., Moricandia sp., Nasturtium sp., Raphanus sp., Rorippa sp. Familia Capparaceae: Capparis sp., Cleome aculeata L., Cleome rutidosperma D.C., Gynandropsis sp. Familia Tropaeolaceae: Tropaeolum sp. Familia Fabaceae: Pisum sp. (Spencer & Steyskal 1986; Etienne & Martínez 2003a, Etienne & Martínez 2003b). Nuevo registro: Familia Verbenaceae: Lantana camara L.
Distribución. Argentina, Brasil, Canadá, Estados Unidos, Guadalupe, Guyana, Hawai, Martinica, Venezuela, además las regiones afrotropical, australiana/Pacífico, neártica oriental y paleártica (Spencer & Stegmaier 1973; Spencer & Steyskal 1986, Étienne & Martínez 2003a, Étienne & Martínez 2003b). Nuevos registros: Santiago Cuautlalplan, Texcoco y Ciudad de Texcoco de Mora Edo. de México.
Biología y hábitos. La larva se alimenta de la hoja de L. camara L., las lesiones son en forma de círculo, en ocasiones pueden ser irregulares, estas se tornan oscuras, empiezan en un punto central y la larva continúa alimentándose, haciendo el círculo más grande, el cual llega a tener un radio de 1 a 2 cm aproximadamente, es posible observar a dos minas unirse que se pueden distinguir por presentar dos círculos unidos, además se pueden observar hasta cinco larvas sobre un foliolo, es decir cinco lesiones circulares. Cuando la larva completa su desarrollo realiza un orificio por la parte del envés y se tira al suelo para pupar. La hoja presenta los daños circulares y en ocasiones las hojas se logran desprender. Esta especie es muy abundante en la zona de Texcoco, Edo. de México ocasionando gran daño sobre las hojas de esta planta ornamental.
Discusión. Spencer (1963) describe a esta especie como Liriomyza bulnesiae, en su descripción el autor indica que ésta presenta caliptra gris, margen caliptral negro y flecos grisáceos y que ambas cerdas verticales (vt) de la cabeza están insertadas sobre cutícula negra. A su vez, Spencer & Stegmaier (1973) sinonimizan a L. bulnesiae como L. brassicae, pero mencionan que la caliptra presenta coloración amarilla, el margen caliptral y los flecos negros y la cerdas verticales (vt) insertadas sobre cutícula negra. De tal manera que el material examinado sobre L. camara L. es más similar al material examinado por Spencer (1963) sólo difiriendo en la coloración de la cutícula donde se insertan las cerdas verticales internas (vti), ya que ésta es amarilla. Además todos los ejemplares mantienen los caracteres específicos en el edeago y bomba eyaculadora. Por otra parte, es el primer registro en México y el primero sobre un miembro de la familia botánica Verbenaceae, Lantana camara L.
Liriomyza sabaziae Spencer
Liriomyza sabaziae Spencer, 1963: 366.
Material examinado. Estado de México: 12 y 9♂ , Montecillo, Texcoco, 31.viii.2005, en hojas de Galinsoga quadriradiata Ruiz & Pav., colectó Rogelio E. Palacios. 4 y 3♂ , Ciudad de Texcoco de Mora, 29.x.2005, en hojas de Galinsoga quadriradiata Ruiz & Pav., colectó Rogelio E. Palacios. Tamaulipas: 2 y 2♂, Estación Cuauhtémoc, Altamira, 06. xii. 2005, en hojas de Carthamus tinctorius L. colectó Rogelio E. Palacios.
Diagnosis. Cabeza. Frente con 0.41 en proporción del total del ancho de la cabeza, esta misma 1.5 veces más o menos el ancho del ojo, dos pares de cerdas fronto-orbitales superiores (ors) de mayor longitud que los dos pares de cerdas fronto-orbitales inferiores (ori). Sedas orbitales escasas y distinguibles. Los dos pares de cerdas verticales (vt) insertadas sobre cutícula negra. Antena con el tercer segmento de forma redonda y con pubescencia, arista con sedas largas. Gena 1/5 la altura del ojo. Los ojos en ambos sexos glabros. Mesonoto. Presenta (3+1) pares de cerdas dorsocentrales (dc) y cuatro hileras de sedas (acr) entre las cerdas dorsocentrales. Ala. Longitud en macho 1.4 mm y en la hembra 1.5 mm, en ambos sexos la Costa se extiende hasta la M1+2. Color. Frente, antena, órbitas ocelares, escutelo, halterios y fémur amarillos. Triángulo ocelar, arista, tibias, tarsos, caliptra, margen caliptral y flecos negros. Edeago vista lateral. Distifalo en su parte distal presenta dos lóbulos bien definidos (Fig. 3, A), y Edeago vista ventral. Parte basal del distifalo con la mitad de la anchura de la parte distal; la parte distal con una franja transversal de cutícula clara (Fig. 3, B). Bomba eyaculadora. Tallo estrecho que en su parte distal se ensancha abruptamente, con sus dos extremos agudos; coloración obscura en toda la estructura (Fig. 3, C).
Plantas hospederas. Familia Asteraceae: Baccharis sp., Bidens pilosa L., Carduus sp., Cirsium sp., Dalia sp., Galinsoga caracasana (D.C.) Sch.Bip., Gnaphalium sp., Sabazia urticaefolia D.C., Silybum sp. (Spencer 1963; Spencer 1983, Spencer & Steyskal, 1986). Nuevos registros: Familia Asteraceae Carthamus tinctorius L. y Galinsoga quadrirradiata Ruiz & Pav.
Distribución. Brasil, Colombia, Costa Rica, Estados Unidos, Venezuela (Spencer 1963; Spencer 1973, Spencer & Steyskal 1986). Nuevos registros: Montecillo y Ciudad de Texcoco de Mora, Edo de México; Estación Cuauhtémoc, Altamira, Tamaulipas.
Biología y hábitos. La larva se alimenta del interior de la hoja de G. quadriradiata Ruiz & Pav. ocasionando gran número de minas en la superficie de la hoja, en C. tinctorius L. se observaron un número reducido de minas, la larva al completar su desarrollo se tira al suelo para pupar.
Discusión. Spencer (1983) encontró minas vacías en G. quadriradiata, Ruiz & Pav. asumiendo que L. sabaziae Spencer se alimentó de ésta; sin embargo, ahora se confirma como hospedero y se registra por primera vez en México.
Liriomyza trifolii (Burgess)
Oscinis trifolii Burgess, 1880: 201.
Liriomyza trifolii: Frick, 1952a: 405.
=Liriomyza phaseolunata Frost, 1943: 256.
=Liriomyza alliovora Frick, 1955: 88.
Material examinado. Tamaulipas: 55 y 42♂, Estación Cuauhtemoc, Altamira, 06.xii.2005, en hojas de Capsicum annum L., colectó Rogelio E. Palacios. 41 y 39♂ , Estación Cuauhtémoc, Altamira, 07.xii.2005, en hojas de Capsicum annum L., colectó Rogelio E. Palacios.
Diagnosis. Cabeza. Frente 0.43 en proporción del total del ancho de la cabeza. Presenta dos pares de cerdas fronto-orbitales superiores (ors) y dos pares de cerdas fronto-orbitales inferiores (ori). Sedas orbitales escasas y distinguibles. Los dos pares de cerdas verticales (vt) insertadas sobre cutícula de color amarillo. Antena con el tercer segmento de forma redondeada y con presencia de pubescencia, arista oscura y con pubescencia. Gena 1/3 la altura del ojo. Ambos sexos presentan los ojos glabros. Mesonoto. Presenta (3+1) pares de cerdas dorsocentrales (dc) y cuatro hileras de sedas (acr). Ala. Longitud en macho 1.25 mm y en la hembra 1.46 mm, la Costa se extiende hasta la M1+2 en ambos sexos. Color. Frente, antena, órbitas ocelares, escutelo y halterios amarillos. Triángulo ocelar, arista, tibias y tarsos, caliptra, margen caliptra y flecos negros. Edeago vista lateral. Distifalo de cutícula clara, con bandas esclerosadas en sus bordes superior e inferior; termina en una abertura amplia (Fig. 4, B), y ventral. Distifalo presenta una fuerte constricción en su parte media y una marcada hendidura longitudinal (Fig. 4, C), Bomba eyaculadora. Con una tallo delgado que se ensancha en su parte distal, sin rebasar el diámetro del bulbo (Fig. 4, D).
Plantas hospederas. Familia Alliaceae: Allium porum L, A. schoenoprasum L. Familia Apiaceae: Daucus carota L. Familia Asteraceae: Baccharis halimifolia (L.), Bidenspilosa L., Chrysanthemum sp., Dahlia sp., Erechtites hieracifolia (L.), Eupatorium sp., Flaveria trinervia (Spreng.) C. Mohr, Gaillardia aristata Pursh, Gerbera jamesonii Bolus ex Hooker F, Helianthus sp., Lactuca sp., Tagetes sp., Tridax procumbens L, Zinnia sp. Familia Capparaceae: Cleome viscose L. Familia Cucurbitaceae: Citrullus lunatus Schrad., Cucumis sp., Cucurbita sp. Familia Euphorbiacea: Ricinus communis L. Familia Fabaceae: Phaseolus sp., Pisum sp., Trifolium repens L., Vigna sp. Familia Malvaceae: Hibiscus sp. Familia Poaceae: Avena sativa L. Familia Solanaceae: Capsicum sp., Solanum nigrum L. Familia Zygophyllaceae: Kallstroemia maxima (L.) Torr. & Gray, Tribulus terrestris L. (Spencer 1963; Spencer & Stegmaier 1973, Spencer 1973, Spencer 1983; Spencer & Steyskal 1986, Spencer et al. 1992, Étienne & Martínez 2003a).
Distribución. Argentina, Bahamas, Barbados, Brasil, Canadá, Chile, Colombia, Costa Rica, Cuba, Estados Unidos, Guadalupe, Guyana, Islas Canarias, Islas Vírgenes, Israel, Kenia, Malta, México, Perú, República Dominicana, San Martín, Trinidad, Venezuela, además las regiones afrotropical, australiana, Pacífico, oriental y paleártica (Spencer 1983; Spencer & Steyskal 1986, Etienne & Martínez 2003a). Nuevo registro: Estación Cuauhtémoc, Altamira, Tamaulipas.
Biología y hábitos. Especie polífaga que entre sus hospederos incluye varios cultivos; el minado de las hojas presenta formas serpenteadas, al completar su desarrollo la larva realiza un orifico por la parte final de la mina y se tira al suelo para pupar.
Discusión. Esta especie quizá sea una de las más agresivas en diversos lugares del mundo. En este estudio, ésta fue la más abundante, ya que fue posible observar varios individuos posados sobre las hojas de las plantas, además en esta zona es necesario el control químico del insecto, para disminuir los efectos negativos en el cultivo. En el apartado de distribución se incluye al sur de Tamaulipas, como nuevo registro de distribución más exacto.
SUBFAMILIA AGROMYZINAE
Melanagromyza minimoides Spencer
Melanagromyza minimoides Spencer, 1966: 13.
=Melanagromyza radicicola Steyskal, 1981: 40.
Material examinado. Estado de México: 8 y 9♂ , Chapingo, Texcoco, 27.V.2005, en aquenios de Simsia amplexicaulis (Cav.) Pers., colectó Rogelio E. Palacios. Tlaxcala: 43 y 25♂, San Miguel del Milagro, Nativitas, 17. vi. 2005, en aquenios de Simsia amplexicaulis (Cav.) Pers., colectó Rogelio E. Palacios.
Diagnosis. Cabeza. Frente con 0.37 en proporción del total del ancho de la cabeza. Dos pares de cerdas fronto-orbitales superiores (ors) y dos pares de cerdas fronto-orbitales inferiores (ori). Sedas orbitales largas y abundantes. Órbitas ocelares y triángulo ocelar claramente distinguibles. Antena con el tercer segmento en forma redondeada y con la presencia de sedas, arista con pubescencia diminuta aparentando estar lisa o desnuda. Gena 1/6 la altura del ojo. Los ojos en ambos sexos glabros. Mesonoto. Presenta dos pares de cerdas dorsocentrales (dc) y de 11 a 12 hileras (acr) de sedas entre los (dc). Ala. En el macho de 1.46 mm, hembra 1.85 mm. Color. Frente, antena, triángulo ocelar, órbitas ocelares, halterios y patas de color negro, caliptra gris con el margen y flecos café oscuro. Mesonoto, escutelo y abdomen negros con coloración metálica verde. Edeago vista lateral. Basifalo y distifalo totalmente separados por cutícula membranosa (Fig. 5, A), y Edeago vista ventral. Distifalo en su parte basal presenta dos lóbulos, no presenta constricción y termina más angosto que en el resto de éste. El basifalo en forma de Y, separado del resto del edeago (Fig. 5, B). Bomba eyaculadora. Apodema de la bomba de longitud notoriamente mayor que su anchura máxima. En su parte distal termina en forma redonda y con un tallo longitudinal que separa una zona anterior más pequeña que la posterior (Fig. 5, C).
Plantas hospederas. Familia Asteraceae: Aster simmondsii Small, Borrichia frutescens (L.) D.C., Helenium nudiflorum Nutt., Helianthus annus L., Heliopsis helianthoides (L.) Sweet, Melanthera deltoidea Michx., Rudbeckia laciniata L., Verbesina euceliodes (Cav.) Benth.Et Hook. Ex A. Gray, V. laciniata (Poir.) Nutt, V. virginica L., Viguieria sp. (Spencer & Stegmaier, 1973; Valladares et al. 1982, Spencer & Steyskal 1986, Spencer et al. 1992) Nuevo Registro: Familia Asteraceae: Simsia amplexicaulis (Cav.) Pers.
Distribución. Argentina, Bolivia, Estados Unidos, Guadalupe, Uruguay, Venezuela (Spencer 1973; Valladares et al. 1982, Spencer & Steyskal 1986, Spencer et al. 1992, Zerbino 2001). Nuevos Registros: Chapingo, Texcoco, Edo. de México y San Miguel del Milagro, Nativitas, Tlaxcala.
Biología y hábitos. La larva se alimenta sobre el aquenio de S. amplexicaulis (Cav.) Pers., dejando sólo la cubierta del fruto, pupando en el lugar de alimentación.
Discusión. El motivo de que esta especie se considere en este escrito, es por ser el primer registro en México, además en Sudamérica, causa pérdidas económicas sobre el cultivo de girasol (Helianthus annus L.), por lo cual no se debe ignorar a esta especie para México, aunque no se ha reportado sobre girasol, existe la posibilidad de que se asocie a este cultivo en el futuro.
Melanagromyza neotropica Spencer
Melanagromyza neotropica Spencer, 1963: 319.
Material examinado. Distrito Federal: 12 y 8♂ , San Nicolás Totolapan, Magdalena Contreras, 05.xi.2004, en aquenios de Tagetes erecta L., colectó Rogelio E. Palacios. Estado de México: 2 y 1♂, Chapingo, Texcoco, 19.viii.2005 en aquenios de Tagetes erecta L., colectó Rogelio E. Palacios. 1 y O♂, Chapingo, Texcoco, 06.X.2005, en aquenios de Tagetes erecta L., colectó Rogelio E. Palacios. 5 y 2♂, Chapingo, Texcoco, 13.X.2005, en aquenios de Tagetes erecta L., colectó Rogelio E. Palacios. 4 y 3♂, Chapingo, Texcoco, 28.X.2005, en aquenios de Tagetes erecta L., colectó Rogelio E. Palacios. 2 y 3♂, Chapingo, Texcoco, 04.xi.2005, en aquenios de Tagetes erecta L., colectó Rogelio E. Palacios. 2 y 5♂, Chapingo, Texcoco, 11.xi.2005, en aquenios de Tagetes erecta L., colectó Rogelio E. Palacios. 5 y 6♂, Chapingo, Texcoco, 25.xi.2005, en aquenios de Tagetes erecta L., colectó Rogelio E. Palacios.
Diagnosis. Cabeza. Frente con 0.38 en proporción del total del ancho de la cabeza, la frente apenas más ancha que el ojo, dos pares de cerdas fronto orbitales superiores (ors) de igual longitud y dos pares de cerdas fronto orbitales inferiores (ori) de igual longitud. Sedas orbitales irregulares y abundantes. Triángulo ocelar y órbitas ocelares claramente distinguibles. Tercer segmento antenal de forma redonda y pubescente, arista con pubescencia fina. Gena aproximadamente 1/6 la altura del ojo, presencia de finas sedas a la altura de los (ors) en ambos sexos apreciándose más abundantes en el macho. Mesonoto. Presenta dos pares de cerdas dorsocentrales (dc) y de 10 a 12 hileras de sedas (acr) entre las cerdas dorsocentrales (dc). Patas mesotoráxicas presentan dos espinas en la parte media de la tibia. Ala: Longitud en el macho de 2.37 y en la hembra de 2.43 mm y donde la Costa se extiende hasta la M1+2 en ambos sexos. Color. Frente, antena, triángulo ocelar, órbitas ocelares, halterios y patas de color negro. Mesonoto y escutelo negro con reflejos verde metálico y el abdomen presenta la coloración negra con reflejos metálicos cobrizos, caliptra blanca con el margen y los flecos de coloración pálida. Edeago vista lateral. Distifalo termina curvo hacia arriba (Fig.6, A), y Edeago vista ventral. Distifalo en su parte basal presenta dos lóbulos pequeños, con una ligera constricción en su parte media. Los brazos del basifalo forman una U no muy bien marcada (Fig.6, B). Bomba eyaculadora. Grande de forma ovalada y simétrica, con el tallo central bien definido (Fig.6, C).
Plantas hospederas. Familia Asteraceae: Bidens pilosa L. (Spencer, 1984). Nuevo Registro: Familia Asteraceae: Tagetes erecta L.
Distribución. Argentina, Brasil, Chile, Colombia, Costa Rica, Ecuador, El Salvador, México (Cuernavaca, "Morelos"), Perú, Venezuela (Spencer 1963; Spencer 1973, Spencer 1984, Sasakawa 2005). Nuevos Registros: Chapingo, Texcoco, Estado de México; San Nicolás Totolapan, Magdalena Contreras, Distrito Federal.
Biología y hábitos. La larva se alimenta sobre los aquenios de la inflorescencia de T. erecta L. destruyéndolos por completo, al completar su desarrollo ésta pupa en el último aquenio consumido. En la región de San Nicolás Totolapan, se observaron cinco ejemplares pupando en una inflorescencia, en la zona de Chapingo se pudieron observar sólo dos ejemplares por inflorescencia.
Discusión. En la literatura consultada se han registrado varias especies de agromícidos que se alimentan en tallos y hojas de cempasúchitl; este es el primer registro de un agromícido que ataca los aquenios de esta planta ornamental. Lo consideramos como un fitófago asociado, sin que su daño represente interés económico. Esta especie fue descrita por Spencer (1963), quien menciona como localidad tipo Cuernavaca, sin especificar la entidad federativa, lo que se asume que se refiere al estado de Morelos.
Melanagromyza splendida Frick
Melanagromyza splendida Frick 1953: 207.
Material examinado. Tamaulipas: 2 y 1♂, Estación Cuauhtémoc, Altamira, 15.iii.2005, en tallos de Carthamus tinctorius L., colectó Antonio P. Terán. 3 y 2♂, Estación Cuauhtémoc, Altamira, 10.ii.2006, en tallos de Carthamus tinctorius L., colectó Rogelio E. Palacios. 3 y 3♂, Estación Cuauhtémoc, Altamira, 11.ii.2006, en tallos de Carthamus tinctorius L., colectó Rogelio E. Palacios. 52 y 33♂, Estación Cuauhtémoc, Altamira, 13.ii.2006, en tallos de Carthamus tinctorius L., colectó Rogelio E. Palacios. 42 y 40♂, Estación Cuauhtémoc, Altamira, 14.ii.2006, en tallos de Carthamus tinctorius L., colectó Rogelio E. Palacios.
Diagnosis. Cabeza. Frente 0.41 en proporción del ancho total de la cabeza, con un ancho de la frente de 1.25 a 1.5 veces con respecto al ojo. Dos pares de cerdas fronto-orbitales superiores (ors) de igual longitud y dos pares de cerdas fronto-orbitales inferiores (ori) de igual longitud. Sedas orbitales en gran cantidad en varias líneas y de longitud considerable. Triángulo ocelar y órbitas ocelares claramente distinguibles, las orbitas ocelares en su parte media se ensanchan. Antena con el tercer segmento redondo y con pubescencia, arista con pubescencia diminuta. Gena 1/5 a 1/6 la altura del ojo y hundida en el centro. En los ojos de ambos sexos se pueden apreciar con pilosidad a la altura de (ors) donde en el macho es más abundante. Mesonoto. Presenta dos pares de cerdas dorsocentrales (dc) y 12 hileras de sedas (acr) aproximadamente entre los (dc). Ala.- macho 2.06 mm, hembra 2.41 mm aproximadamente. Color. Frente, antena, triángulo ocelar, órbitas ocelares y halterios negros, caliptra blanca con el margen y flecos blancos. Mesonoto y escutelo color negro con presencia de reflejos metálicos verdes, el abdomen de color negro con reflejos verdes- cobrizos. Edeago vista lateral. Distifalo en su parte distal baja se aprecian dos terminaciones separadas (Fig.7, B), y Edeago vista ventral. Distifalo no presenta constricción y termina con dos líneas medias separadas. Los brazos del basifalo forman una U bien definida con su base plana (Fig.7, C). Bomba eyaculadora. El tallo central del apodema no llega al borde distal y el contorno del margen distal es aplanado (Fig.7, D).
Plantas hospederas. Familia Apiaceae: Apium graveolens L., Daucus carota L. Familia Asteraceae: Ambrosia artemisiifolia L, Bidens pilosa L., Carthamus sp., Erechtites hieracifolia (L.) Raf. Ex D.C., Flaveria linearis Lag., Gaillardia pulchella Foug., Gnaphalium sp, Helianthus sp., Lactuca sp., Parthenium sp., Tagetespatula L., Xanthium sp., Zinnia sp. (Spencer & Steigmaier 1973; Spencer & Steyskal 1986, Étienne et al.1993).
Distribución. Bahamas, Chile, Estados Unidos, Hawaii, Jamaica, México (Culiacán, Sinaloa) (Spencer & Steigmaier 1973; Domínguez y Carrillo 1976, Étienne et al. 1993). Nuevo Registro: Estación Cuauhtémoc, Altamira, Tamaulipas.
Biología y hábitos. El inicio de la infestación ocurre cuando el cultivo está en la etapa de plántula. La larva se alimenta barrenando los tallos del cártamo Carthamus tinctorius L. y es posible encontrarla en ramas de plantas más desarrolladas, se han observado infestaciones de 96.8% en el sur de Tamaulipas. El insecto pupa dentro del tejido vegetal, se pueden observar hasta ocho individuos sobre un mismo tallo.
Discusión. En la literatura consultada esta especie de Melanagromyza es la única que se ha observado sobre especies vegetales de dos familias botánicas, mostrando ser polífaga. Con lo cual muestra un potencial de plaga en otros cultivos, resaltando que en el presente estudio sólo fue encontrada en cártamo. Además es el primer registro en el estado de Tamaulipas.
Melanagromyza tomaterae Steyskal
Melanagromyza tomaterae Steyskal, 1972: 266.
Material examinado. Estado de México: 3 y 2♂, Chapingo, Texcoco, 30.viii.2001, en tallos de Physalis ixocarpa Brot. Variedad CHF1-Chapingo, colectó Rogelio E. Palacios. 8 y 3♂, Chapingo, Texcoco, 15.vi.2002, en tallos de Physalis ixocarpa Brot., colectó Rogelio E. Palacios. 4 y 2♂, Chapingo, Texcoco, 16.viii.2002, en tallos de Physalis patula Mili., colectó Rogelio E. Palacios. 2 y 1♂, Montecillo, Texcoco, 15.ix.2002, en tallos de Jaltomata procumbens (Cav.) J.L. Gentry., colectó Rogelio E. Palacios. 2 y 2♂, Chapingo, Texcoco, 02.vii.2005, en tallos de Physalis ixocarpa Brot. Diamante Mejorado, colectó Rogelio E. Palacios. 4 y 3♂, Montecillo, Texcoco, 23.vi.2006, sobre tallos de Physalis ixocarpa Brot. Variedad CHF1-Chapingo, colectó Rogelio E. Palacios. Tlaxcala: 5 y 6♂, San Miguel del Milagro, 06.vi.2005, en tallos de Physalis ixocarpa Brot. Criollo, colectó Rogelio E. Palacios. 36 y 25♂, San Miguel del Milagro, 17.vi.2005, en tallos de Physalis ixocarpa Brot. Criollo, colectó Rogelio E. Palacios. 3 y 2♂, San Miguel del Milagro, 13.vii.2005, en tallos de Physalis ixocarpa Brot. Criollo, colectó Rogelio E. Palacios.
Diagnosis. Cabeza. Frente con 0.36 en proporción del total del ancho de la cabeza. Dos pares de cerdas fronto-orbitales superiores (ors) de similar longitud y dos pares de cerdas fronto-orbitales inferiores (ori) de igual longitud; las (ors) más largas que las (ori). Sedas orbitales en gran cantidad, triángulo ocelar y órbitas ocelares claramente distinguibles. Antena con el tercer segmento de forma redonda y con presencia de pubescencia; arista con sedas largas. Gena 1/6 en tamaño comparado con la altura del ojo y hundida en el centro. Los ojos en ambos sexos, se pueden observar finas sedas a la altura de (ors) siendo más abundantes en el macho. Mesonoto. Presenta dos pares de cerdas dorsocentrales (dc) y 12 a 13 hileras de sedas (acr) entre las dorsocentrales (dc). Ala. Longitud en macho de 2.67 mm, en la hembra de 3.06 mm, en ambos sexos la Costa se extiende hasta la M1+2. Color. Frente, antena, triángulo ocelar, órbitas ocelares y halterios negros. Las patas mesotoráxicas de color negro con dos espinas del mismo tamaño en la tibia, el mesonoto, escutelo y abdomen negro con un patrón verduzco metálico sobre todo en el macho, en la hembra el patrón más marcado sobre el mesonoto, escutelo y abdomen negro es el color azul metálico, caliptra blanca con el margen y flecos pálidos. Edeago vista lateral. Distifalo en su parte distal presenta dos extensiones asemejando una tenaza, donde la extensión baja es más ancha (Fig. 8, B), y Edeago vista ventral. Distifalo no presenta constricción, en su parte media es ancho y se hace angosto hacia su parte distal. Los brazos del basifalo alargados, unidos en sus dos extremos (Fig. 8, C). Bomba eyaculadora. En su parte media ensanchado y termina en punta, con el centro bien definido (Fig.8, D).
Plantas hospederas. Familia Solanaceae: Lycopersicon esculentum Mill., Physalis ixocarpa Brot. ex Hornem (Steyskal 1972; Spencer 1973; Bautista & Morales, 2000). Nuevos Registros: Familia Solanaceae: Jaltomata procumbens (Cav.) J. L. Gentry y Physalis patula Mill,
Distribución. Colombia, Ecuador, México (Chapingo; Felipe Neri, Tenango del Aire, Edo. de México, Coatlán del Río, Tlayacapan, Yautepec, Morelos, Tecamachalco, Puebla), Venezuela (Steyskal 1972; Spencer 1973, Havránek 1987, Bautista & Morales 2000) Nuevo Registro: San Miguel del Milagro, Nativitas, Tlaxcala.
Biología y hábitos. La larva de Melanagromyza tomaterae Steyskal barrena el tallo y es posible encontrarla en ramas de sus hospederas, en la zona de Tlaxcala se pueden observar hasta 20 individuos de larvas de diferentes estadios y puparios en una misma planta, efectuando un 51.49% de infestación en un muestreo realizado al final del ciclo del cultivo, además de la presencia de dos barrenadores, Trichobaris championi Barber (Coleoptera: Curculionidae) y una larva de lepidóptero de la familia Gelechiidae, que en conjunto las tres especies llegan a infestar hasta un 66.41% de las plantas en un cultivo senescente. En Montecillo, Edo de México, es posible observar 14 individuos del díptero por planta al final del ciclo de cultivo.
El daño que ocasiona el insecto al horadar el tallo favorece la entrada de fitopatógenos como Fusarium oxysporum Sheld (Morales et al. 2002).
Discusión. El esquema de Spencer (1973) no presenta el edeago completo en vista lateral, falta una parte del distifalo. En vista ventral sí presenta las características de la especie. Se utilizaron los esquemas de los genitales publicados por Steyskal (1972), donde se aprecia el edeago completo.
Por otra parte, esta especie en Sudamérica, ataca al jitomate Lycopersicon esculentum Mill. En nuestro país se han realizado colectas sobre esta misma solanácea en la zona de estudio, sin registrar al insecto. Nuevo registro para el estado de Tlaxcala.
Melanagromyza viridis (Frost)
Agromyza viridis Frost, 1931: 77.
Melanagromyza viridis: Frick, 1952a: 380.
=Melanagromyza helianthi Spencer, 1963: 314.
Material examinado. Tlaxcala: 31 y 15♂, San Miguel del Mlagro, 17.vi.2005, en aquenios de Simsia amplexicaulis (Cav.) Pers., colectó Rogelio E. Palacios. Estado de México: 31 y 15♂, Chapingo, Texcoco, 26.vi.2005, en aquenios de Simsia amplexicaulis (Cav.) Pers., colectó Rogelio E. Palacios. 5 y 2♂, Chapingo, Texcoco, 08.vii.2005, en aquenios de Helianthus annuus L., colectó Rogelio E. Palacios. 15 y 22♂, Chapingo, Texcoco, 08.vii.2005, en aquenios de Helianthus annuus L., colectó Rogelio E. Palacios. 3 y 3♂, Chapingo, Texcoco, 23 .vi.2006, en aquenios de Helianthus annuus L., colectó Rogelio E. Palacios. 5 y 2♂, Chapingo, Texcoco, 24.vii.2006, en aquenios de Tithonia tubiformis (Jacq.) Cass., colectó Rogelio E. Palacios.
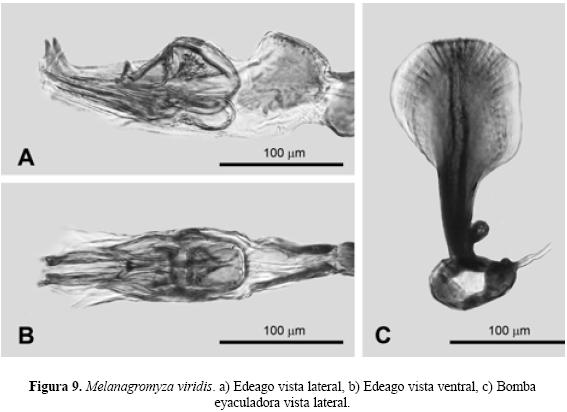
Diagnosis. Cabeza. Frente con 0.41 en proporción del total del ancho de la cabeza. Dos pares de cerdas fronto-orbitales superiores (ors) de similar longitud y dos pares de cerdas fronto-orbitales inferiores (ori) de similar longitud con separación pronunciada entre éstas. Sedas orbitales largas y escasas en una sola línea. Triángulo ocelar y órbitas ocelares brillosas. Antena con el tercer segmento de forma redondeada y pubescente, arista con diminutas sedas aparentando estar lisa o desnuda. Gena aproximadamente 1/4 la altura del ojo. Los ojos en ambos sexos con pubescencia a la altura de los (ors), más abundante en el macho. Mesonoto. Presenta dos pares de cerdas dorsocentrales (dc) y 11 hileras de sedas (acr) entre las cerdas dorsocentrales (dc). Ala. Macho aproximadamente de 2 mm, hembra de 2.5 mm, extendiéndose la Costa hasta la M1+2 en ambos sexos. Color. Frente, antena, triángulo ocelar, órbitas ocelares, halterios y patas de color negro. Mesonoto y escutelo negro con coloración metálica verde, el abdomen negro con reflejos metálicos verdes y en ocasiones también cobrizos, caliptra, margen y flecos de color blanco. Edeago vista lateral. Distifalo con extremos agudos dirigidos hacia arriba formando un ángulo casi recto (Fig. 9, A), y Edeago vista ventral. Distifalo presenta ligera constricción en su parte media y termina con dos extensiones paralelas pronunciadas. Los brazos del basifalo forman una V (Fig. 9, B). Bomba eyaculadora. El tallo central del apodema llega al borde distal y el contorno del margen distal es redondo (Fig. 9, C).
Plantas hospederas. Familia Asteraceae: Calendula officinalis L., Encelia sp., Helianthus debilis Nutt., Tithonia rotundifolia (Mill.) S. F. Blake, Zinnia sp. (Spencer & Stegmaier 1973; Spencer & Steyskal, 1986). Nuevos Registros: Familia Asteraceae: Helianthus annuus L., Simsia amplexicaulis (Cav.) Pers. y Tithonia tubiformis (Jacq.) Cass.
Distribución. Chile, Cuba, Estados Unidos, México (Cuernavaca, "Morelos"; Tlahualilo, "Durango"), Trinidad (Spencer 1963; Spencer & Stegmaier 1973; Spencer & Steyskal 1986). Nuevos Registros: Chapingo, Texcoco; Montecillo, Texcoco, Edo de México y San Miguel del Milagro, Nativitas, Tlaxcala,
Biología y hábitos. La larva se alimenta sobre los aquenios, consumiendo varios por completo, la larva al completar su desarrollo pupa en el último aquenio consumido, fueron observados hasta cinco individuos por cabezuela en Helianthus annuus L.
Discusión. La distribución de esta especie en nuestro país se baso en Spencer (1963) en Cuernavaca y Tlahualilo, lo que hace suponer que estas localidades se ubican en los estados de Morelos y Durango, respectivamente. Es la única información al respecto, lo que sugiere que el estado de México y Tlaxcala son nuevos registros de distribución de esta especie; a su vez también representa el primer registro de esta especie alimentándose de los aquenios del girasol en México; aparentemente no hay daño económico sobre esta oleaginosa.
Ophiomyia lantanae (Froggatt)
Agromyza lantanae Froggatt, 1919: 665.
Ophiomyia lantanae: De Meijere, 1925: 253.
=Agromyza longicauda Curran, 1928: 65.
Material examinado. Estado de México: 1♂, Montecillo, Texcoco, 09.ix.2005, red entomológica de golpeo sobre Lantana cámara L., colectó Rogelio E. Palacios. 1, Montecillo, Texcoco, 12.ix.2005, red entomológica de golpeo sobre Lantana camara L., colectó Rogelio E. Palacios.
Diagnosis. Cabeza. Frente con 0.42 en proporción del total del ancho de la cabeza. Dos pares de cerdas fronto-orbitales superiores (ors) y tres pares de cerdas fronto-orbitales inferiores (ori). Sedas orbitales no muy numerosas. Triángulo ocelar y órbitas ocelares claramente distinguibles. Antena con el tercer segmento redondo en su forma y con pubescencia; la arista tiene una fina pubescencia. Gena 1/6 de la altura del ojo y hundida en el centro. El macho presenta un par de vibrisas largas y conspicuas, además la presencia de diminutas sedas aisladas en el ojo a la altura de las (ors), en la hembra el ojo es glabro. Mesonoto. Presenta dos pares de cerdas dorsocentrales (dc) y 10 a 11 hileras de sedas (acr) entre las cerdas dorsocentrales (dc). Ala. Longitud en macho 1.6 mm y en la hembra 2.10 mm. En ambos sexos la costa se extiende hasta la M1+2. Color. Frente, antena, triángulo ocelar, halterios, mesonoto, escutelo, abdomen y patas de color negro. Caliptra y margen caliptral gris obscuro con flecos negros. Edeago vista lateral. Distifalo que en su parte basal presenta dos lóbulos bien definidos, en su parte distal presenta dos extensiones. Los brazo del basifalo igual de largos que el distifalo completo (Fig.10, B), y Edeago vista ventral. Distifalo totalmente asimétrico con la membrana que lo rodea evidente (Fig. 10, C). Bomba eyaculadora. Apodema de la bomba asimétrico con su contorno anterior sinuoso (Fig. 10, D).
Planta hospedera. Familia Verbenaceae: Lantana camara L.
Distribución. Argentina, Australia, Brasil, Sri Lanka, Costa Rica, Cuba, El Salvador, Estados Unidos, Filipinas, Formosa, Guadalupe, Honduras, India, Malaya, Melanesia, México, Micronesia, Panamá, Papua Nueva Guinea, Polinesia, Puerto Rico, Singapur, Trinidad, Vietnam, región África del Este (Spencerl963; Spencer & Stegmaier 1973; Sasakawa 2005). Nuevo Registro: Montecillo, Texcoco, Edo de México.
Biología. La larva se alimenta sobre la semilla de L. cámara L, y pupa en el mismo sitio de alimentación (Froggatt 1919).
Discusión. Esta especie fue ampliamente distribuida en las áreas tropicales del viejo mundo para el control de Lantana (Spencer & Steyskal 1986). La ubicación de su distribución en nuestro país no fue encontrada en la literatura consultada, por lo que podemos suponer que para el Estado de México es nuevo registro. Cabe mencionar que de todas las especies estudiadas esta fue la única que no se pudo observar su daño sobre el hospedero, ya que los ejemplares fueron capturados con red de golpeo sobre su hospedero.
|
| Clave de identificación de Agromyzidae (Insecta: Diptera) de interés agronómico en México |
|
|
|
| 1. | Subcosta bien desarrollada a todo lo largo de la vena R1, (Subfamilia Agromyzinae) (Fig. 8, A) ............................................................................................................2 |
| 1'. | Subcosta no totalmente desarrollada a todo lo largo de la vena R1, (Subfamilia Phytomyzinae) (Fig. 1, B) .................................................................................7 |
| 2. | Macho con un par de vibrisas largas y conspicuas (Fig.10, A). El mesonoto y abdomen normalmente de color negro. Edeago en vista lateral con el distifalo que en su parte basal presenta dos lóbulos bien definidos y en su parte distal presenta dos extensiones. Los brazos del basifalo igual de largos que el distifalo completo (Fig.10, B), y Edeago vista ventral con el distifalo totalmente asimétrico con su membrana que lo rodea evidente (Fig.10, C), y bomba eyaculadora con el apodema de la bomba asimétrico con su contorno anterior sinuoso (Fig. 10, D)......................Ophiomyia lantanae (Froggatt) |
| 2'. | Macho sin el par de vibrisas largas y conspicuas. El mesonoto y abdomen normalmente con coloración metálica verde, azul ó cobriza....................................................... 3 |
| 3. | Caliptra, margen caliptral y flecos blancos o pálidos (Fig. 7, A) ................................4 |
| 3'. | Caliptra, margen caliptral y flecos oscuros. Edeago en vista lateral con el basifalo y distifalo totalmente separados por cutícula membranosa (Fig. 5, A), y Edeago vista ventral con el distifalo que en su parte basal presenta dos lóbulos, no presenta constricción y termina más angosto que en el resto de éste. El basifalo en forma de Y, separado del resto del edeago (Fig. 5, B), y bomba eyaculadora con el apodema de la bomba de longitud notoriamente mayor que su anchura máxima. En su parte distal termina en forma redonda y con un tallo longitudinal que separa una zona anterior más pequeña que la posterior (Fig. 5, C).....................Melanagromyza minimoides Spencer |
| 4. | Margen caliptral y flecos blancos .......................................................................5 |
| 4'. | Margen caliptral y flecos pálidos ....................................................................... 6 |
| 5. | Edeago en vista lateral con el distifalo que en su parte distal baja se aprecian dos terminaciones separadas (Fig. 7, B), y Edeago vista ventral el distifalo no presenta constricción y termina con dos líneas medias separadas. Los brazos del basifalo forman una U bien definida con su base plana (Fig. 7, C), y bomba eyaculadora con el tallo central del apodema que no llega al borde distal y el contorno del margen distal es aplanado (Fig. 7, D) ............................................... Melanagromyza splendida Frick |
| 5'. | Edeago en vista lateral con el distifalo mostrando dos extremos agudos dirigidos hacia arriba formando un ángulo casi recto (Fig. 9, A), y Edeago vista ventral el distifalo presenta ligera constricción en su parte media y termina con dos extensiones paralelas pronunciadas. Los brazos del basifalo forman una V (Fig. 9, B), y bomba eyaculadora con el tallo central del apodema que llega al borde distal y el contorno del margen distal es redondo (Fig. 9, C)................................................Melanagromyza viridis (Frost) |
| 6. | Edeago en vista lateral con el distifalo que en su parte distal presenta dos extensiones asemejando una tenaza, donde la extensión baja es más ancha (Fig. 8, B), y Edeago vista ventral el distifalo no presenta constricción, en su parte media es ancho y se hace angosto hacia su parte distal. Los brazos del basifalo alargados, unidos en sus dos extremos (Fig. 8, C), y bomba eyaculadora que en su parte media es ancha y termina en punta, con el centro bien definido (Fig. 8, D)..................................................................Melanagromyza tomaterae Steyskal |
| 6'. | Edeago en vista lateral con el distifalo que termina curvo hacia arriba (Fig. 6, A), y Edeago vista ventral el distifalo en su parte basal presenta dos lóbulos pequeños, con una ligera constricción en su parte media. Los brazos del basifalo forman una U no muy bien marcada (Fig.6, B), y bomba eyaculadora grande de forma ovalada y simétrica, con el tallo central bien definido (Fig. 6, C)................. Melanagromyza neotropica Spencer |
| 7. | Escutelo, halterio (Fig. 1, A); frente (Fig. 2, A) y antenas (Fig. 4, A) de color amarillo..8 |
| 7'. | Escutelo, halterio, frente y antenas de color oscuro. Edeago en vista lateral con el distifalo de cutícula oscura; en su parte superior presenta una protuberancia en forma de pico (Fig. 1, C), y Edeago vista ventral el distifalo muestra una constricción muy ligera en su parte media y la parte distal redondeada (Fig. 1, D), y bomba eyaculadora con el apodema de la bomba ovalado y de dimensiones similares al bulbo (Fig. 1, E) ...................................................................... Amauromyza abnormalis (Malloch) |
| 8. | Cerdas verticales exteriores e interiores de la cabeza (vt) (Fig. 4, A) insertadas sobre cutícula de coloración amarilla. Edeago vista lateral con el distifalo de cutícula clara, con bandas esclerosadas en sus bordes superior e inferior; termina en una abertura amplia (Fig.4, B), y Edeago vista ventral el distifalo presenta una fuerte constricción en su parte media y una marcada hendidura longitudinal (Fig.4, C), y bomba eyaculadora con una tallo delgado que se ensancha en su parte distal, sin rebasar el diámetro del bulbo (Fig.4, D)..............................................................Liriomyza trifolii (Burgess) |
| 8'. | Cerdas verticales exteriores de la cabeza (vte) (Fig. 4, A) insertadas sobre cutícula de coloración negra ............................................................................................ 9 |
| 9. | Cerdas verticales de la cabeza (vt) insertadas sobre cutícula de coloración negra. Edeago vista lateral con el distifalo que en su parte distal presenta dos lóbulos bien definidos (Fig. 3, A), y Edeago vista ventral la parte basal del distifalo con la mitad de la anchura de la parte distal; la parte distal con una franja transversal de cutícula clara (Fig. 3, B), y bomba eyaculadora con el tallo estrecho que en su parte distal se ensancha abruptamente, con sus dos extremos agudos; coloración obscura en toda la estructura (Fig. 3, C)................................................... Liriomyza sabaziae Spencer |
| 9'. | Cerdas verticales exteriores de la cabeza (vte) insertadas sobre cutícula de coloración negra y el par de cerdas verticales interiores de la cabeza (vti) (Fig.4, A) insertadas sobre cutícula de coloración amarilla. Edeago vista lateral con el distifalo terminando en forma de U, de una coloración más clara que el resto del edeago (Fig. 2, B), y Edeago vista ventral el distifalo presenta constricción poco antes de llegar a su parte media y la parte más distal de coloración clara (Fig. 2, C), y bomba eyaculadora presenta un tallo estrecho y en su parte distal se ensancha pronunciadamente, con sus dos extremos redondos (Fig. 2, D)..........................................Liriomyza brassicae (Riley) |
DISCUSIÓN
Los géneros representados en esta investigación son Melanagromyza Hendel con cinco especies, Liriomyza Mik con tres especies, Amauromyza Hendel y Ophiomyia Braschnikov, ambas con una especie, de los cuales tres son nuevos registros para México: Liriomyza brassicae (Riley), L. sabaziae Spencer y Melanagromyza minimoides Spencer.
Las especies más abundantes sobre sus plantas hospederas fueron: A. abnormalis (Malloch), L. brassicae (Riley), L. trifolii (Burgess), M. splendida Frick y M. tomaterae Steyskal.
Se registran a Lantana camara L. como nueva planta hospedera de L. brassicae (Riley). Carthamus tinctorius L. y Galinsoga quadrirradiata Ruiz & Pav. como nuevas plantas hospederas de L. sabaziae Spencer. Simsia amplexicaulis (Cav.) Pers., nueva planta hospedera de M. minimoides Spencer. Tagetes erecta L. nueva planta hospedera de M. neotropica Spencer. Jaltomata procumbens (Cav.) J. L. Gentry y Physalis patula Mill nuevas plantas hospederas de M. tomaterae. Helianthus annuus L., Simsia amplexicaulis (Cav.) Pers. y Tithonia tubiformis (Jacq.) Cass. como nuevas plantas hospederas de M. viridis (Frost).
Agradecimientos. Al Consejo Nacional de Ciencia y Tecnología (CONACYT) por el apoyo económico con número de registro 157621 que brindó al primer autor para realizar los estudios correspondientes al Doctorado en Ciencias en Fitosanidad - Entomología y Acarología- del Colegio de Postgraduados. Los autores agradecen al área de Microscopía Electrónica y a la Biól. Greta Hanako Rosas Saito (C.P. campus Montecillo) por las facilidades prestadas para la realización del estudio fotográfico. También queremos expresar nuestro agradecimiento al M. en C. Ricardo Vega Muñoz (Herbario C.P. campus Montecillo), por su valiosa colaboración en la ubicación taxonómica del material vegetal.
LITERATURA CITADA
Bautista M., N, G. Vejar C. & M. van Tschirnhaus. 1997. First record of the amaranth borer fly Amauromyza abnormalis (Malloch) (Diptera: Agromyzidae) in Mexico. Southwestern Entomologist 22(4): 461-463. [ Links ]
Bautista M., N. & O. Morales G. 2000. Melanagromyza tomaterae Steyskal (Diptera: Agromyzidae) plaga del tomate (Physalis ixocarpa Brot.) en México. Folia Entomologica Mexicana 110: 129-130. [ Links ]
Burgess, E. 1880. The clover oscinis (Oscinis trfolii, Burgess n. sp.). United States Department of Agriculture, Report 1879: 200-201. [ Links ]
Curran, C. H. 1928. Insects of Porto Rico. Scientific Survey Porto Rico and Virgin Islands 11: 65. [ Links ]
De Meijere, J. C. H. 1925. Die Larven der Agromyzinen. Tijdschrift voor Entomologie 67: 195- 293. [ Links ]
Domínguez., R. Y. & J. L. Carrillo. S. 1976. Lista de insectos en la colección entomológica del Instituto Nacional de Investigaciones Agrícolas. Folleto Misceláneo No. 29. México. 245 pp. [ Links ]
Étienne, J., M. Martínez & A. Huc. 1993. Les Mouches Mineuses (Dipteres, Agromyzidae) d'Importance Agronomique aux Antilles, Pp 1261-1272. In: ANPP- Troisieme Conference Internationale Sur Les Ravageurs en Agriculture, Montpellier 7-9 Decembre 1993. [ Links ]
Étienne, J. & M. Martínez. 2003a. Les Agromyzidae de l'île de Saint-Christopher (Saint-Kitts) aux Antilles (Diptera). Bulletin de la Société Entomologique de France 108 (1): 89-95. [ Links ]
----------. 2003b. Les Agromyzidae de Guadeloupe: espèces nouvelles et notes additionnelles (Diptera). Nouvelle Revue de Entomologie (N.S.) 19(3): 249-272. [ Links ]
Frick, K. E. 1952a. A generic revision of the family Agromyzidae (Diptera) with a catalogue of New World species. University of California Publications, Entomology 8: 339-452. [ Links ]
----------. 1952b. Four new Hawaiian Liriomyza species and notes on other Hawaiian Agromyzidae (Diptera). Washington State Agriculture Experimental Station, Scientific Paper 1093: 509- 518. [ Links ]
----------. 1953. Further studies on Hawaiian Agromyzidae (Diptera) with descriptions of four new species. Washington State Agriculture Experimental Station, Scientific Paper 1182: 207- 215. [ Links ]
----------. 1955. Nearctic species in the Liriomyza pusilla complex, No. 3. Liriomyza alliovora, new name for the Iowa onion miner. Journal of the Kansas Entomological Society 28: 88-92. [ Links ]
----------. 1959. Synopsis of the species of agromyzid leaf miners described from North America (Diptera). Proceedings of the United States Natural Museum 108: 347-465. [ Links ]
Froggatt, W. W. 1919. The Lantana Fly. (Agromyza lantanae). Agricultural Gazette of New South Wales 30: 665-668. [ Links ]
Frost, S. W. 1931. New species of West Indian Agromyzidae (Diptera). Entomological News 42: 72-75. [ Links ]
----------. 1943. Three new species of Diptera related to Agromyza pusilla Meig. Journal of the New York Entomological Society 51: 253-263. [ Links ]
Havránek , D. 1987. Melanagromyza tomaterae (Diptera: Agromyzidae) a tomato pest in the states of Táchira and Mérida, Venezuela. The Florida Entomologist 70 (2): 294-296. [ Links ]
Malloch, J. R 1913. A revision of the species in Agromyza Fallén and Cerodontha Rondani. Annals of the Entomological Society of America 6: 269-336. [ Links ]
Martínez, M. & J. Étienne. 2002. Liste systématique et biogéographique des Agromyzidae (Diptera) de la région néotropicale. Bollettino di Zoologia Agraria e di Bachicoltura, Serie II, 34(1): 25-52. [ Links ]
Morales G., O., N. Bautista M., J. Valdez C. & J. L. Carrillo S. 2002. Identificación, biología y descripción de Melanagromyza tomaterae Steyskal (Diptera: Agromyzidae), barrenador del tomate Physalis ixocarpa Brot. Acta Zoologica Mexicana (nueva serie) 86: 145-153. [ Links ]
Riley, C. V. 1884. The cabbage Oscinis. Annual Report of the United States Department of Agriculture 1884: 322. [ Links ]
Sasakawa, M. 2005. The Neotropical Agromyzidae (Insecta: Diptera). Part 6. New or Little-Known Species from El Salvador and Guatemala. Species Diversity 10:151-169. [ Links ]
Spencer, K. A. 1963. A synopsis of the neotropical Agromyzidae (Diptera). Transactions of the Royal Entomological Society of London 115 (12): 291-389. [ Links ]
----------. 1966. New and interesting Agromyzidae from Florida. Stuttgart. Beitrage Naturkunde 158: 1–20. [ Links ]
----------. 1973. The Agromyzidae (Diptera) of Venezuela. Revista de la Facultad de Agronomía (Maracay) 7(2): 5-108. [ Links ]
Spencer, K. A. & C. E. Stegmaier. 1973. Agromyzidae of Florida, with a supplement on species from the Caribbean. Arthropods of Florida and neighboring land areas. Florida Department of Agriculture and Consumer Services., Gainesville, Florida, U.S.A. 205 pp. [ Links ]
----------. 1981. A revisionary study of the leaf-mining flies (Agromyzidae) of California. Division of Agriculture Sciences. University of California Special Publications 3273: 1- 489. [ Links ]
----------. 1983. Leaf Mining Agromyzidae (Diptera) in Costa Rica. Revista de Biología Tropical (San José) 31(1): 41-67. [ Links ]
----------. 1984. The Agromyzidae (Diptera) of Colombia, including a new species attacking potato in Bolivia. Revista Colombiana de Entomología 10 (1-2): 3-33. [ Links ]
Spencer, K. A & J. C. Steyskal. 1986. Manual of the Agromyzidae (Diptera) of the United States. United States Department of Agriculture. Washington. D. C. Agriculture Handbook. 638 pp. [ Links ]
Spencer, K.A., M. Martínez & J. Étienne. 1992. Les Agromzidae (Diptera) de Guadeloupe. Annales de la Société Entomologique de France (N.S.) 28 (3): 251-302. [ Links ]
Steyskal, G. C. 1972. Two new species of Melanagromyza Hendel (Diptera, Agromyzidae) that bore in tomato stalks in Colombia and Ecuador. Journal of the Washington Academy of Science 62 (3): 265-267. [ Links ]
----------. 1981. Six new species of Agromyzidae. Journal of the Washington Academy of Science 70: 36–43. [ Links ]
Torres S., G., A. Trinidad S., T. Reyna T., H. Castillo J., N. Bautista M. & F. de León G. 2004. Barrenación del tallo de amaranto por Hypolixus truncatulus (Coleoptera: Curculionidae) y Amauromyza abnormalis (Diptera: Agromyzidae). Acta Zoologica Mexicana (nueva serie) 20 (1): 131–140. [ Links ]
Valladares, G., N. Díaz & L. De Santis. 1982. Tres notas sobre dípteros agromícidos de la República Argentina y sus himenópteros parasitoides (Insecta). Revista de la Sociedad Entomológica Argentina 41 (1-4): 319-330. [ Links ]
Wilcox, D., B. Dove, D. Mc David & D. Geer. 2002. UTHSCSA Image Tool for Windows, Ver. 3.0. The University of Texas Health Science Center in San Antonio, U.S.A. [ Links ]
Ylioja, T., P. Saranpää., H. Roininan & M. Rousi. 1998. Larval tunnels of Phytobia betulae (Diptera: Agromyzidae) in birch Word. Journal of Economical Entomology 91: 181-185. [ Links ]
Zerbino M, S. 2001. Mosquita del capítulo del girasol Melanagromyza minimoides, nueva plaga. Agrociencia 5(1): 90-91. [ Links ]














