Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta zoológica mexicana
versión On-line ISSN 2448-8445versión impresa ISSN 0065-1737
Acta Zool. Mex vol.23 no.1 Xalapa abr. 2007
Bombyliidae (Insecta: Diptera) de Quilamura en el área de reserva Sierra de Huautla, Morelos, México
Omar Ávalos Hernández
Museo de Zoología, Facultad de Ciencias, Universidad Nacional Autónoma de México. Apartado postal 70-399, México 04510. MÉXICO. omar_avalos@yahoo.com
Recibido: 25 de noviembre 2005
Aceptado: 18 de octubre 2006
RESUMEN
México es un centro de diversidad para Bombyliidae, la séptima familia más diversa dentro del orden Díptera. Los bombílidos son importantes porque algunas especies son polinizadoras y otras controlan las poblaciones de otros insectos al ser parasitoides, por lo que tienen potencial para utilizarse en el control de plagas. Este trabajo tiene como objetivo describir la diversidad de esta familia en Quilamula, Morelos, localidad ubicada en la reserva Sierra de Huautla. Se recolectó durante 12 meses entre los años 2003 y 2004, utilizando red aérea y trampa Malaise. Se emplearon métodos de estimación de riqueza de especies, como curvas de acumulación de especies y modelos no paramétricos. Se encontraron 97 especies de las cuales cinco son registros nuevos para México y 12 nuevos para Morelos. El modelo de acumulación de especies que mejor se ajusta a los datos es el de Clench, sobre el exponencial y logarítmico. Éste modelo estima 113 especies en el área de estudio, de los cuales se capturó un 85.7%. Los modelos no paramétricos ICE, ACE y Chao2 subestiman la diversidad y Jack-Knife de segundo orden da un estimado cercano a del modelo de Clench. ICE y Chao2 son los estimadores no paramétricos que mejor se comportan. La riqueza de especies es mayor en época de lluvias y presenta su máximo en octubre sin embargo la abundancia es mayor en época de secas alcanzando un máximo en marzo. La distribución temporal y preferencia de hábitat de las especies concuerda con los hábitos parasitoides y antófilos de Bombyliidae. Se describen algunas conductas observadas durante el trabajo de campo, entre ellas lo que parece ser un comportamiento territorial y otro de apareamiento. Se presenta un clave para la identificación, ilustrada con figuras e imágenes fotográficas, para los géneros y algunas de las especies encontradas. Se encontró que el área de estudio es un sitio de alta diversidad para Bombyliidae.
Palabras Clave: Bombyliidae, Estimación de riqueza de especies, Curvas de acumulación de especies, Sierra de Huautla, Selva baja caducifolia.
ABSTRACT
Mexico is a diversity center for Bombyliidae, the seventh most diverse family within Diptera. Bombilids are important because some species are pollinators and other are parasotoids so they control other insect populations and have potential for being used for plague control. This study pretends to describe the diversity of Bombyliidae in Quilamula, Morelos, located in the reserve Sierra de Huautla. The field work was made during twelve months between 2003 and 2004, using aerial net and Malaise trap. Methods for species richness estimation were applied, like species accumulation curves and non-parametric models. Ninety seven species were captured from which five are new registers for Mexico and twelve new for Morelos. Clench's is the species accumulation model which best fits to the data, over exponential and logarithmic models. Clench model estimates 113 species in the study area, from which it was collected the 85.7%. The non-parametric models ICE, ACE, and Chao2 subestimates diversity and Jack-Knife 2 gives and estimate close to the Clench model estimate. ICE and Chao2 are the non-parametric models which best perform. The species richness is greater in rainy season with the maximum in October, although abundance is greater in dry season with the maximum in March. Temporal distribution and habitat preference of species agrees with parasitoids and flower-loving habits of Bombyliidae. Some behaviors observed during the field work are described, in particular what appears to be territorial and mate behaviors. An illustrated key for the genera and some species founded are presented. The study area is recognized as a diversity center for Bombyliidae.
Key Words: Bombyliidae, Species richness estimation, Species accumulation curves, Sierra de Huautla, Tropical Deciduous Forest.
INTRODUCCIÓN
Las moscas Bombyliidae o "moscas abeja" ocupan el séptimo lugar en diversidad dentro del orden Diptera, con 4547 especies descritas, de las cuales 384 (8.44%) se encuentran en México (Painter et al., 1978; Evenhuis & Greathead, 1999). Se distribuyen sobre todo en zonas áridas. En México la mayor diversidad se concentra en la Península de Baja California y la costa del Pacífico. Esta región del país se considera como un centro de diversidad para la familia a nivel mundial (Hull, 1973).
Los bombílidos son insectos heliófilos que desarrollaron convergencias con abejas y avispas. Desempeñan un papel relevante en el funcionamiento de los ecosistemas. Las larvas presentan hábitos depredadores, parasitoides o hiperparasitoides y controlan las poblaciones de otros insectos; los adultos se alimentan de polen o néctar y son polinizadores (Hull, 1973). Los huéspedes de los bombílidos pertenecen a los órdenes Orthoptera, Neuroptera, Coleoptera, Lepidoptera, Hymenoptera y Diptera (Yeates & Greathead, 1997).
El conocimiento sobre esta familia a nivel mundial está reunido en la obra de Hull (1973), la cual contiene descripciones y claves para los géneros, distribución geográfica, morfología y datos sobre sus huéspedes. Para las especies de México se cuenta con Biologia Centrali-Americana (Godman & Salvin, 1878-1901) donde se describen 83 especies de México. Reginald H. Painter y Elizabeth M. Painter produjeron diversos trabajos para México, tanto de Bombyliidae en general (Painter, 1939; Painter & Painter, 1962, Painter et al., 1978) así como monografías y descripciones de géneros en particular (Painter, 1926; Painter & Hall, 1960; Painter & Painter, 1969). Jack C. Hall es otro dipterólogo que ha publicado trabajos para la región de Neártica (Hall, 1972, 1976, 1981a, b; Hall & Evenhuis, 2003). Entre los autores actuales que estudian estos insectos están Neal L. Evenhuis y David J. Greathead, quienes publicaron un catálogo mundial (Evenhuis & Greathead, 1999).
En México los estudios faunísticos sobre Bombyliidae son escasos. El estudio faunístico más reciente se llevó a cabo en el Cañón de Lobos, Morelos, por Rodríguez-Ortuño (1989). Fuera de este trabajo sólo se presentan recolectas aisladas. La Colección Nacional de Insectos en el Instituto de Biología de la UNAM es la que mejor tiene representada la familia, con 52 especies de 37 géneros, con el 30% de los ejemplares determinados a nivel de especie, en su mayoría por Javier Butze y Neal Evenhuis.
En este estudio se describe la diversidad de las Bombyliidae en una localidad de la Reserva de la Biosfera Sierra de Huautla, Morelos, utilizando estimadores de riqueza de especie y comparando los resultados con los de otras áreas. Se presenta una lista de especies presentes en la localidad de estudio. También se comparan las estimaciones de la riqueza de especies de diferentes modelos no paramétricos y de acumulación de especies. Se comentan algunas asociaciones bióticas y preferencias de microhábitat. Además se presenta una clave para la identificación de los géneros y algunas especies.
MATERIALES Y MÉTODOS
Descripción del área de estudio. La Reserva de la biosfera Sierra de Huautla (Rebiosh) se localiza al sudeste de Morelos. Comprende parte de los municipios de Amacuzac, Jojutla, Puente de Ixtla, Tepalcingo y Tlaquiltenango y tiene una extensión de 59000 ha (DOF, 1999). Las recolectas se realizaron en el ejido Quilamula del municipio de Tlaquiltenango, dentro de las coordenadas 18° 30' 4.1" N - 98° 59' 52.6" O y 18° 32' 12.2" N - 99° 02' 05" O (Fig. 1). El área de estudio comprende un intervalo altitudinal desde 1080 a 1230 msnm y cubre un área de 15.25 km2.
La Rebiosh es reconocida como un área importante para la conservación. Además de ser un área natural protegida federal, se considera una Región Terrestre Prioritaria (RTP) (Arriaga-Cabrera et al., 2000) y un Área de Importancia para la Conservación de las Aves (AICA) (Argote-Cortés et al., 1999). La importancia de esta reserva radica en primera instancia, en su integridad ecológica (Arriaga-Cabrera et al., 2000). Dentro de la Rebiosh se localiza la única porción de Selva Baja Caducifolia (SBC) de la Cuenca del Balsas en un estado de conservación aceptable. Además, la Sierra de Huautla cuenta con una flora diferente a otras SBC del resto del país (Arias et al., 2002).
La Sierra de Huautla pertenece a la provincia fisiográfica del Eje Neovolcánico, subprovincia del Sur de Puebla (INEGI, 2004). Presenta un suelo tipo feozem háplico aunque también se registran leptosol y regosol (Maldonado-Almanza, 1997; Argote-Cortés, 2002). Abarca las cuencas hidrológicas del río Grande Amacuzac y del río Atoyac (INEGI, 2004). El clima es cálido subhúmedo con régimen de lluvias en verano y canícula en el mes de agosto. La temperatura oscila entre los 20 a 29 °C siendo mayo el mes más caluroso y los menos diciembre y enero (Ramírez-Albores & Ramírez-Cedillo, 2002). La precipitación media anual es de 600 a 1200 mm (Rzedowski, 1978) con un máximo de 800 a 1000 mm en septiembre y un mínimo de 5 mm en diciembre a marzo (Ramírez-Albores & Ramírez-Cedillo, 2002).
La SBC es característica de la Rebiosh, aunque también se pueden encontrar bosque templado (dominado por encinos) y selva mediana subcaducifolia (en las cañadas más húmedas). En la Rebiosh se han registrado 967 especies de plantas vasculares, la mayoría de afinidad neotropical (Arias et al., 2002).
Esta literatura se elaboró, con modificaciones, una clave para la identificación de los géneros y especies recolectados durante este trabajo.
Con los datos de la CNI y la literatura (Curran, 1930a, 1930b; Stone, 1962; Painter & Painter, 1969; Hall, 1976; Evenhuis, 1977; Painter et al., 1978; Evenhuis & Greathead, 1999; Hall & Evenhuis, 2003) se elaboró una lista actualizada de especies de Bombyliidae registradas para el estado de Morelos y para México. Para el ordenamiento sistemático se utilizó el "Catálogo Mundial de Moscas Abeja (Diptera: Bombyliidae)" de Evenhuis y Greathead (1999).
El material se etiquetó con los datos de recolecta y determinación y fue depositado en el la colección del Museo de Zoología de la Facultad de Ciencias de la UNAM.
Manejo de datos. De los ejemplares recolectados se hizo una base de datos con la información taxonómica, curatorial y geográfica de cada ejemplar. A partir de esta base se generaron archivos de entrada para los programas EstimateS 7.0 (Colwell, 2004) y Statistica 5.1 (StatSoft, 1998) para computar curvas de rarefacción y acumulación de especies así como estimadores no paramétricos.
Para el análisis de la fenología se ajustó la abundancia relativa de acuerdo con el esfuerzo de recolecta (abundancia relativa/esfuerzo de recolecta), a este nuevo valor se le llamará de ahora en adelante abundancia relativa ajustada (Vargas-Fernández et al., 1999). Se tabuló la abundancia relativa ajustada y riqueza de especies por mes. La época de secas se consideró de diciembre a mayo y la de lluvias de junio a noviembre.
Estimación de la riqueza de especies. Se hizo la estimación del total de especies del área por medio de funciones de acumulación de especies y por métodos no paramétricos (Moreno, 2001).
Funciones de acumulación de especies. Una función de acumulación de especies es la relación entre la incorporación de especies a un inventario y el esfuerzo de recolecta (Jiménez-Valverde & Hortal, 2003).
Existen cuatro tipos de curvas de acumulación de especies dependiendo de la unidad de replicación del esfuerzo de recolecta que se utiliza y si se aleatorizan las muestras o no. Según la unidad de esfuerzo de recolecta hablamos de curvas basadas en el número de individuos o en unidades de muestreo (trampa, horas-colector). Mientras que, según la aleatorización de los datos, existen curvas de acumulación propiamente dicho (sin aleatorizar los datos) o con los datos aleatorizados (Gotelli & Colwell, 2001). La aleatorización se realizó con el programa EstimateS 7.0 (Colwell, 2004).
La curva construida con los datos observados se llama curva empírica. Esta curva empírica se debe ajustar a un modelo para encontrar la asíntota y la pendiente de dicha curva, lo que nos indica la calidad del muestreo (Jiménez-Valverde & Hortal, 2003). Se han propuesto varios modelos para ajustar las curvas de acumulación de especies, en este trabajo se usaron tres: exponencial, logarítmico y ecuación de Clench (Soberón-Mainero & Llorente-Bousquets, 1993). Las expresiones matemáticas de los modelos son las siguientes:
- Modelo exponencial: S(t) = (a/b)*[1-exp(-b*t)]. Donde, S(t) es el número de especies estimado, a es la ordenada al origen (intercepción con el eje Y), es decir la tasa de incremento de la lista al inicio del muestreo, b es la pendiente de la curva y t es el número acumulativo de muestras (esfuerzo de recolecta).
- Modelo logarítmico: S(t) = (1/z)*[ln(1+z*a*t)]. Donde, z = 1-exp(-b).
- Ecuación de Clench. S(t) = (at) / (1+ b*t)
En los modelos de Clench y exponencial la asíntota se calcula como a/b, el modelo logarítmico no es asintótico. En los modelos asintóticos se puede calcular el esfuerzo necesario para alcanzar una determinada proporción de la fauna tq donde q = St/(a/b). Es decir, si se quisiera saber el esfuerzo para alcanzar el 90% de la fauna, q toma un valor de 0.9 (Soberón-Mainero & Llorente-Bousquets, 1993).
Para la ecuación de Clench tq= q /[b*(1-q)]
Para el modelo exponencial tq = 1/b ln[1/(1-q)]
El ajuste de las curvas se realizó con el programa Statistica 5.1 (StatSoft, 1998) con el método de ajuste Simplex & Quasi-Newton que, de acuerdo con Jiménez-Valverde y Hortal (2003) es uno de los métodos más robustos.
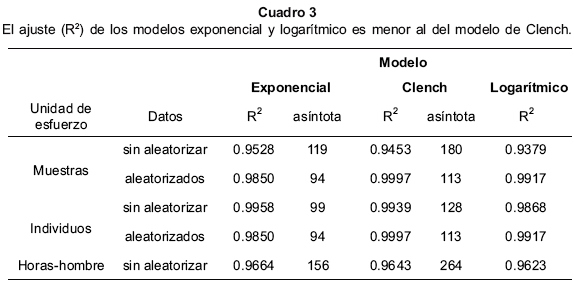
Se ajustaron las curvas con los tres modelos, utilizando tres esfuerzos de recolecta: muestras (día de recolecta), horas-colector e individuos. Para muestras e individuos se hizo el ajuste con los datos sin aleatorizar y aleatorizados 100 veces con el programa EstimateS 7.0 (Colwell, 2004). Para horas-colector solo se ajustaron los datos sin aleatorizar. Se utilizaron los coeficientes de determinación (R2) para evaluar el ajuste de las curvas. R2 toma valores de 0 a 1 siendo mejor el ajuste cuando se acerca a este último (Jiménez-Valverde y Hortal, 2003). R2 nos indica el porcentaje de variación que explica la variable independiente, en este caso el esfuerzo de recolecta.
Se calcularon y compararon curvas de acumulación de especies utilizando la aplicación 'Species Accumulation' (disponible en la red http://www.cimat.mx/Software/Info.php?m=1&ind=5) que compara los tres modelos mediante un algoritmo probabilístico (Díaz-Francés & Soberón-Mainero, 2005). Este programa calcula cuál de los tres modelos es el más probable de acuerdo con los datos presentados. También da un intervalo de probabilidad para el número total de especies para el modelo exponencial y de Clench.
Se interpolaron los datos para examinar el comportamiento de la asíntota en los modelos exponencial y de Clench. Para esto se hizo el ajuste con el 95, 90 y 85% del esfuerzo de recolecta total.
Métodos no paramétricos. Se basan en técnicas estadísticas de estimación de clases a partir de muestras y de técnicas de captura-recaptura (Colwell & Coddington, 1994). Suponen que entre más especies raras haya en las muestras mayor será el número de especies por descubrir (Jiménez-Valverde & Hortal, 2003).
En este estudio se utilizaron los estimadores: Chao 2 (fórmula corregida), Jack-Knife de segundo orden, Estimador de cobertura basado en abundancia (ACE) y Estimador de cobertura basado en incidencia (ICE).
Se comparó la curva de los métodos no paramétricos con los valores observados (empíricos) y las estimaciones de los modelos de acumulación de especies. Un buen estimador debe de alcanzar su asíntota antes que la curva de acumulación de especies y su valor debe aproximarse al empírico (Gotelli & Colwell, 2001).
RESULTADOS
Lista de especies. Se recolectaron 2448 ejemplares, pertenecientes a nueve subfamilias, 27 géneros y 97 especies (Cuadro 1). El 47% del material fue determinado a nivel de especie y el resto a género.
Se obtuvieron 12 nuevos registros para el estado de Morelos y cinco para el país. Con ello el total de especies para el estado se incrementa de 121 a 133 y el número de especies en México aumenta a 389.
La subfamilia con mayor diversidad fue Anthracinae, con el 79% de las especies encontradas. El grupo Tomophtalme representa el 81.5% de las especies capturadas (Cuadro 2).
Estimación de la riqueza de especies
Modelos de acumulación de especies. El modelo que mejor se ajusta a los datos es el de Clench con los datos aleatorizados (R2=0.9997) (Cuadro 3) con una asíntota que se mantiene constante aún al reducir el esfuerzo de recolecta en un 15%. El modelo exponencial con datos aleatorizados estima un número de especies menor al observado (Fig. 2).
Según el modelo de Clench el estimado de especies es de 113, por lo que se recolectó un 85.7% del total, 97 especies. Para recolectar el 95% de las especies (q=0.95), es decir 107 especies, se debe incrementar el esfuerzo de recolecta (tq) a 8027 individuos ó 154 días de recolecta.
El programa 'Species Accumulation' indica que el modelo logarítmico es 3.5 veces más probable que el modelo de Clench y 1 016 996 veces más probable que el exponencial.
La aplicación estimó 117 especies con el modelo de Clench con un intervalo de probabilidad del 5% de error de que el número total de especies esté entre 109 y 126. Valores más bajos o altos que éstos pueden descartarse por ser poco probables (Díaz-Francés & Soberón-Mainero, 2005).
Métodos no paramétricos. Tres de los estimadores no paramétricos subestiman la riqueza de especies en comparación con la estimada por la curva de acumulación de especies ajustada al modelo de Clench (Cuadro 4). Solo Jack-Knife de segundo orden genera una estimación mayor a la asíntota de la ecuación de Clench.
La figura 3 muestra la comparación entre la curva de acumulación de especies ajustada a la ecuación de Clench y los estimadores no paramétricos.
Fenología. La mayor abundancia relativa ajustada se presentó en los meses de febrero a mayo (Fig. 4), que coinciden con la época de secas. Mientras que la menor abundancia se presentó en los meses de junio a agosto, que es al inicio de la época de lluvias.
La riqueza de especies observada se mantuvo relativamente constante a lo largo del año, pero siendo mayor en época de lluvias. Se recolectaron 57 especies durante la época de secas y 82 especies en época de lluvias. En octubre se presentó la mayor riqueza con el 53% de las especies totales.
Sólo 15 especies son exclusivas de la época de secas, 40 de la época de lluvias y 42 aparecen en ambas épocas. En el apéndice 1 se presenta la abundancia a lo largo del año para cada especie.
Para géneros con tres o más especies se encontraron patrones fenológicos. Observamos que en algunos casos cada especie tiene su propia fenología sin un patrón claro como ocurre con Anthrax Scopoli, Chrysanthrax Osten Sacken, Exoprosopa Macquart, Geron Meigen, Hemipenthes Loew y Ligyra Newman. Otros géneros como Villa Lioy son predominantemente de época de secas, con solo 12 ejemplares (5.12% del total) recolectados en época de lluvias. Por otro lado tenemos a Bombylius Linnaeus que fue recolectado exclusivamente en lluvias y a Poecilanthrax Osten Sacken y Paravilla Hall de los que se recolectó el 78 y 98%, respectivamente, del total de individuos en lluvias.
DISCUSIÓN
Lista de especies. Al considerar los nuevos registros, en Quilamula están presentes el 73% del total de especies presentes en Morelos y el 25% de las especies de México.
Esto significa que hay una alta diversidad, considerando que el área muestreada representa el 0.3% de la superficie estatal.
De la subfamilia Bombyliinae se encontraron pocas especies (cuatro) (Cuadro 2), a pesar de ser una de las subfamilias más diversas a nivel mundial, posiblemente porque solo el 22% de las especies están en las regiones Neártica y Neotropical (Evenhuis & Greathead, 1999).
Al comparar ésta lista de especies con la presentada por Rodríguez-Ortuño (1989) para el Cañón de Lobos, Morelos, se encontró que las áreas comparten 23 géneros. En Quilamula se recolectaron cuatro géneros que no fueron capturados por Rodríguez-Ortuño (1989), a su vez en el Cañón de Lobos se encontraron cinco géneros no compartidos con el área de estudio. Los géneros exclusivos de Quilamula en relación al Cañón de Lobos son: (1) Apolysis Loew, 1860, (2) Heterotropus Loew, 1873, (3) Metacosmus Coquillett, 1891 y (4) Phthria Meigen, 1820.
La comparación entre las listas de especies de Quilamula y el Cañón de Lobos se hizo a nivel de género, dado que no fue posible hacerlo a nivel de especie, ya que para el Cañón de Lobos solo el 55% del material recolectado esta determinado a nivel de especie. Además es posible que la lista de especies de Cañón de Lobos este incompleta porque no se utilizaron modelos estadísticos para estimar el total de especies de la zona. Hacer comparaciones con listas incompletas puede llevar a conclusiones erróneas, como puede ser el subestimar o sobreestimar la riqueza de un área.
Las diferencias entre las listas de especies son considerables, tomando en cuenta que el Cañón de Lobos esta ubicado a solo 42 km al noroeste de Quilamula. Lo que nos demuestra la alta diversidad de Bombyliidae en esta zona del país.
Estimación de la riqueza de especies
Modelos de acumulación de especies. En las curvas con datos sin aleatorizar, la diferencia entre las curvas con diferente unidad de esfuerzo de recolecta (medido como individuos o unidades de muestreo) se puede tomar como una medida del grado de agregación de las especies. Si existe agregación espacial o temporal de las especies la estimación será menor en la curva basada en individuos (Gotelli & Colwell, 2001), como ocurre en este caso para los datos no aleatorizados. Sin embargo, estas diferencias se deben, más que a la agregación de las especies, a que el esfuerzo de recolecta no fue uniforme a lo largo del estudio. Este error en el muestreo resulta más evidente en la curva basada en horas-hombre, donde las estimaciones se elevan demasiado y el ajuste del modelo es inferior.
Con la aleatorización de los datos este sesgo en el muestreo y la heterogeneidad de los datos (agregación de las especies) se eliminan dando una curva 'ideal' suavizada (Colwell & Coddington, 1994). Las curvas aleatorizadas con diferentes unidades de esfuerzo para el mismo modelo dan el mismo valor de la asíntota y tienen el mismo ajuste (R2) (Cuadro 3).
La estimación del modelo de Clench y los resultados obtenidos con 'Species Accumulation' son congruentes. Las probabilidades de los modelos calculadas por la aplicación 'Species Accumulation' no nos permite elegir entre el modelo logarítmico o el de la ecuación de Clench porque no hay gran diferencia en sus probabildiades, pero si podemos descartar la estimación del modelo exponencial por ser poco probable.
Para los datos obtenidos el mejor modelo es el de Clench. La unidad de esfuerzo de recolecta no cambia las estimaciones si se aleatorizan los datos.
Métodos no paramétricos. Estadísticamente los métodos no paramétricos requieren de una cierta distribución de la especies para su desempeño (Colwell & Coddington, 1994), éstos suponen una probabilidad de captura de las especies que es constante a lo largo de todos los muestreos, aunque puede diferir de una especie a otra (Jiménez-Valverde & Hortal, 2003). Esta condición rara vez se cumple, ya que la mayoría de las especies presentan heterogeneidad espacial y temporal. Aun así son utilizados dada su simplicidad y facilidad de uso.
Chao 2 e ICE son los estimadores que mejor se comportan, sin tomar en cuenta los primeros muestreos cuando la mayoría de las especies son raras. Aunque ambos subestiman la riqueza.
Los estimadores no paramétricos son útiles cuando es poco el esfuerzo de recolecta. En este caso, a los 1500 individuos recolectados (ó 29 días de recolecta) la estimación de Chao 2, ICE y Jack-Knife de segundo orden varían poco, aun aumentando el esfuerzo de recolecta. ICE hace la mejor estimación con el menor esfuerzo de recolecta.
Jack-Knife de segundo orden estimó el mismo número de especies que el modelo de Clench utilizando la aplicación 'Species Accumulation'. Los otros métodos no paramétricos estimaron un número menor de especies al intervalo de probabilidad del programa (109 especies), es decir son estimaciones poco probables según este software.
Considerando el porcentaje de especies recolectado con respecto al estimado se puede decir que el método de recolecta fue el adecuado.
Fenología. La mayor abundancia en época de secas (Fig. 4) ya se había observado para otros grupos como Odonata, Hymenoptera y Syrphidae en trabajos realizados en este mismo ambiente (Zaragoza-Caballero et al., 2000). Esta mayor abundancia relativa se explica por una concentración de los individuos en los escasos cuerpos de agua. La falta de vegetación en la época de secas y la concentración de individuos cerca de cuerpos de agua puede aprovecharse por los bombílidos para localizar y atacar más fácil a sus huéspedes. Se sabe que vuelan con mayor frecuencia en zonas abiertas para poder encontrar a sus presas o sus nidos (Palmer, 1982). Esta relativa facilidad de encontrar huéspedes en época de secas puede ser la causa de la mayor abundancia de individuos.
La reducción de la abundancia en época de lluvias se explica porque en estos meses la vegetación es abundante pero la floración mínima, por lo que los recursos para los adultos son escasos y los huéspedes difíciles de localizar. Es hasta septiembre cuando la floración se encuentra en su máximo desarrollo, cuando la abundancia relativa ajustada vuelve a aumentar.
Se reconoce una disminución considerable en la riqueza de especies al inicio de la época de lluvias, posiblemente por las mismas razones que disminuye la abundancia relativa, aunque a la mitad de la época de lluvias la riqueza de especies aumenta y llega a su máximo cuando los recursos son abundantes, en octubre. Este desfasamiento entre el inicio de la época de lluvias y la riqueza de especies también se presenta en otras zonas y con otros grupos (Vargas-Fernández et al., 1999).
Los patrones generales de distribución temporal de las especies fueron como se esperaban: mayor diversidad en época de lluvias, mayor abundancia en época de secas. Sin embargo, muchas especies son multivoltinas, lo que no concuerda con lo citado en la literatura (Hull, 1973).
El género más abundante y diverso de Homeophtalme es Geron, que está presente todo el año. Toft (1983) encontró que este género no se comporta igual al resto de los Homeophtalme. Debido a su capacidad de alterar su patrón de uso de recursos dependiendo de la disponibilidad y competencia con otras especies (Toft, 1984).
Lepidanthrax Osten Sacken no exhibe una preferencia clara por la época de lluvias o secas, pero se aprecia un patrón en 10 de las 12 especies que se encontraron. Aparecen en octubre que es el mes que presenta las mejores condiciones para los bombílidos dada su riqueza. Permanecen durante época de secas y es hasta el mes de mayo que ya no se recolectan. Esto supone que estas especies están adaptadas tanto a época de lluvias como a secas. Lo que implica que: (1) puede competir por los recursos con otras especies durante la época de mayor densidad de especies; (2) está adaptada a la reducción de alimento en época de secas y; (3) tiene un amplio espectro de huéspedes. Lepidanthrax (de manera similar a Geron en Homeophtalme) es un género diferente al resto de Tomophtalme porque cuenta con una probóscide alargada, más larga que la cabeza. Toft (1983) propone que la probóscide alargada de Lepidanthrax les permite tener acceso al néctar y polen de flores alargadas al que otros Tomophtalme por sus probóscides cortas no pueden alcanzar.
La distribución temporal de las especies de insectos está ligada estrechamente a parámetros ambientales (Vargas-Fernández et al., 1999). Los factores ambientales determinan las condiciones óptimas para el crecimiento de las plantas de las que se alimentan los adultos. Pero en el caso de Bombyliidae, en la fenología también influye la disponibilidad de sus huéspedes. La presencia y abundancia de una especie puede estar determinada por los recursos ya sea para los adultos o para las larvas. Se esperaría que si el recurso limitante se presenta para el adulto, la diversidad sería mayor en los estadios inmaduros y viceversa. Ya que si no hay un límite la competencia interespecífica es menor y coexisten mayor número de especies (Toft, 1983).
Dado que la probóscide de los Homeophtalme les permite alcanzar el néctar y polen de flores más alargadas a las que los Tomophtalme no tienen acceso (Szucsich & Krenn, 2002), los Homeophtalme deberían mostrar una mayor diversidad, pero ocurre lo contrario. Lo que se puede interpretar como una competencia baja entre los adultos por el polen, que no influye en la diversidad. En cuanto a los estados inmaduros, la mayoría de las especies tienen poca especificidad en la selección de huéspedes (Yeates & Greathead, 1997). Por consiguiente la competencia entre las larvas también es baja, ya que pueden cambiar de huésped si éstos escasean. Sin embargo, la magnitud de la competencia solo se puede conocer llevando a cabo un estudio ecológico.
Además de los recursos existen otros tres factores que afectan la fenología: (1) la diferencia marcada en la composición florística de la época de lluvias y la de secas en la SBC; (2) el mimetismo que hace converger a los ciclos de vida del modelo y del imitador y; (3) las diferencias entre cada especie. En cuanto a este último punto tenemos, por ejemplo, que algunas especies no se alimentan siendo adultos (Oestranthrax Bezzi), mientras que en otras las hembras invierten ocho veces más tiempo en alimentación que los machos. Otras especies del género Villa tienen la capacidad de producir huevos sin alimentarse (Toft, 1983).
En resumen, las causas de la fenología de los Bombyliidae en la Sierra de Huautla son complicadas de reconocer, ya que interactúan por lo menos tres factores: (1) recursos para adultos e inmaduros, (2) mimetismo y (3) la estacionalidad de la SBC. La importancia de éstos en el ciclo de vida está determinado por un cuarto factor que representan las diferencias entre cada especie. Un estudio que pretenda cuantificar y evaluar los factores que influyen en la distribución temporal de las especies debería de incluir la fenología de los modelos, de las plantas de las que se alimentan los adultos y de los huéspedes de los estados inmaduros.
La distribución de la riqueza de especies a lo largo del año coincide en general con lo encontrado por Rodríguez-Ortuño (1989) para el Cañón de Lobos, Morelos. En ésta área la mayor diversidad se presenta en los meses de septiembre y octubre.
Asociaciones bióticas y observaciones sobre el comportamiento de las especies.
Durante el trabajo de campo se realizaron observaciones sobre el comportamiento y las asociaciones bióticas de algunas de las especies.
Anthrax. Como cita Hull (1973), las especies de este género se alimentan muy poco. Yeates y Greathead (1997) comentan que se dedican más a buscar los nidos de abejas en las paredes o rocas que son sus huéspedes. Solo a un ejemplar de las especies de Anthrax se le observó alimentarse. La mayoría de las veces la captura de representantes de este género fue cuando se encontraron posados sobre una roca y aún cuando fueran perturbados regresaban al mismo sitio. También como es sabido las especies de Anthrax suelen ser 'curiosas' y se acercan a los colectores, incluso posándose sobre ellos. Varios ejemplares fueron capturados de esta forma.
Aphoebantus. Se recolectó en áreas alejadas de los cuerpos de agua durante la temporada de secas. Aphoebantus y Lepidanthrax prefieren microhábitats secos. Aunque también se recolectó cerca de cuerpos de agua. En abril se observó a varios individuos apareándose a las orillas de arroyos. No se observaron ejemplares alimentándose.
Bryodemina valida. De esta especie vale la pena destacar el grado notable de mimetismo que presenta con varios géneros de Hymenoptera (Xylocopa y otros). Exhibe un vuelo rápido y no se distinguió preferencia alguna de microhábitat, llegándose a recolectar tanto en lugares soleados, así como con vegetación regularmente cerrada en el dosel.
Cyananthrax cyanopterus. Ésta especie presenta convergencia con avispas. Mimetizan el brillo tornasol de las alas y el cuerpo e incluso el patrón de vuelo. Se recolectó solo en dos visitas, en ambos casos cerca de un río; Hull (1973) cita que otros ejemplares también se han recolectado a orillas de ríos.
Exoprosopa minuscula. Presenta conducta territorial a las orillas de cuerpos de agua durante el mes de junio. Vuela estáticamente sobre un punto, ahuyentando a otros insectos que vuelan por ahí, incluso avispas, y si es perturbada por el colector regresa al mismo sitio. Esta conducta puede tener dos propósitos: proteger un sitio de apareamiento o búsqueda de huéspedes. Los ejemplares recolectados lejos de cuerpos de agua en áreas abiertas no presentan esta conducta.
Exoprosopa aztec. De esta especie se pudo observar al parecer una conducta de apareamiento. En el mes de abril se observaron varias parejas que presentaban la misma conducta. Mientras la hembra está posada en el suelo, el macho vuela estático sobre ella bajando a tocarla de forma rápida y repetida, después vuelve a quedarse estático repitiendo este movimiento en varias ocasiones.
Geron. Frecuentemente los ejemplares de este género se encontraban agrupados, recolectándose varios sobre la misma planta o en el mismo lugar. El agrupamiento de las especies de Geron es citado por Hull (1973).
Hemipenthes. Hemipenthes sp. 1 y Hemipenthes sp. 3 presentan conducta territorial sobre cuerpos de agua similar a la de Exoprosopa minuscula. Aunque Hemipenthes sp. 1 prefiere cuidar espacios un poco alejados del cuerpo de agua y se posa sobre el suelo, en lugar de estar volando estáticamente.
Lepidanthrax. Presenta una marcada preferencia de microhábitat por las áreas secas alejadas de los cuerpos de agua en época de secas. No fue recolectado cerca de dichos cuerpos. Todos los otros géneros recolectados en época de secas se encontraron solo cerca de cuerpos de agua (a excepción de Aphoebantus).
Lepidophora. Uno de los ejemplares de este género fue recolectado porque se posó sobre la red, de manera similar a como acostumbran hacerlo los individuos del género Anthrax. Aun cuando en el primer intento de recolectarlo no se tuvo éxito, el ejemplar permaneció y finalmente fue capturado. Las especies de Lepidophora no se distinguen por ser 'curiosas', pero al parecer tampoco son muy 'inquietas'.
Ligyra. Hay gran diversidad de preferencias de microhábitat en las tres especies recolectadas. Ligyra alacer se recolectó en caminos con poca vegetación, posadas sobre rocas y sobre arroyos. Ligyra sp. 1 se recolectó y observó únicamente posada sobre la arena de las orillas de arroyos. Ligyra evansi casi exclusivamente se encontró en cuerpos de agua de tamaño regular y muy expuestos al sol. L. alacer es muy similar a algunas especies de Exoprosopa y no se pueden distinguir por su apariencia, pero sí por su comportamiento. Las especies de Ligyra vuelan más rápido y son más 'inquietas' que las de Exoprosopa. También L. alacer es la única especie que se observó volando a una altura de aproximadamente de tres metros o más.
Ogcodocera leucoprocta. Ésta es la única especie que se recolectó en zonas con dosel cerrado, hábitat que no prefieren las demás especies. Palmer (1982) propone que en estas zonas encuentran mayor protección contra depredadores, aunque también les es más difícil encontrar a sus huéspedes.
Villa. Presentan comportamiento territorial igual a Hemipenthes sp. 3 y Exoprosopa minuscula.
Clave para la identificación taxonómica de Bombyliidae de Quilamula, Morelos, México.
| 1a | Margen posterior del ojo liso, sin indentación; sección basal de Rs generalmente corta; R2+3a menudo ramificada en forma oblicua de R4+5; occipucio variable..............................2 | |
| 1b | Margen posterior del ojo con indentación; sección basal de Rs larga; R2+3 generalmente ramificada en forma perpendicular de R4+5; occipucio con cavidad central profunda.....19 | |
| 2a | Occipucio ensanchado, bilobulado en la parte superior, con una cavidad central; margen occipital lejos del margen ocular; cuerpo casi desnudo; talla pequeña ........................................................... Metacosmus Coquillett (Fig. 6 f,g) | |
| 2b | Occipucio aplanado o redondo, sin una cavidad central; margen occipital cercano al margen ocular; cuerpo desnudo o con escamas; talla variable .......................................... 3 | |
| 3a | Pronoto prominente; sedas torácicas desarrolladas, curvadas hacia atrás; escamas en la base del ala; antenas largas cubiertas densamente por escamas largas .......................................................................................................................... Lepidophora Westwood (Fig. 6 d) | |
| 3b | Pronoto no desarrollado, difícil de ver; sedas torácicas no desarrolladas fuertemente; base del ala sin escamas; antenas no cubiertas por escamas, si lo están éstas son cortas y escasas .................................................................................... 4 | |
| 4a | Por lo menos las tibias media y posterior con sedas, además de las sedas preapicales y apicales; probóscide generalmente alargada; palpos uni o biarticulados; antenas juntas en la base ................................................................................................................ 5 | |
| 4b | Sedas en las patas ausentes además de las preapicales y apicales, si están presentes, entonces palpos biarticulados; probóscide corta o alargada; antenas juntas o separadas en la base ................................................................................................................. 9 | |
| 5a | Abdomen alargado y cilíndrico, en ocasiones expandido apicalmente; M1 termina en el margen del ala ....................................................................... Thevenetimyia Bigot (Fig. 7 i,j) | |
| 5b | Abdomen ancho y ovalado, nunca alargado; M1 generalmente termina en R4+5 lejos del margen del ala .................................................. Bombylius Linnaeus (Fig. 5 e).....................6 | |
| 6a | M1 termina en el margen del ala o en R4+5 cerca del margen del ala; con parches de escamas plateadas en el margen interno del ojo a la altura de la antena ............................................ Bombylius dolorosus Williston (B. dolorosus: rostro piloso; escapo largo y delgado; sedas presentes en el fémur posterior) | |
| 6b | M1 termina en R4+5 lejos del margen del ala; sin parches de escamas plateadas en el margen interno del ojo a la altura de la antena ......................................................................... 7 | |
| 7a | Por lo menos algunos terguitos abdominales con sedas negras, aunque estén restringidas a los márgenes laterales ................................... Bombylius io Williston (B. io: macho con cabeza amarilla a dorada, pilosidad negra completamente ausente) | |
| 7b | Abdomen sin sedas negras..............................................................................8 | |
| 8a | Celda anal cerrada en el margen del ala ........................................ Bombylius clio Williston | |
| 8b | Celda anal abierta en el margen del ala ....... Bombylius marilynae Evenhuis (B. marilynae: macho con alas ligeramente teñidas con amarillo o café en su porción basal; parte superior del occipucio sin pilosidad negra; fémures anaranjados a amarillos, punta de balancín blanca; escutelo sin sedas negras) | |
| 9a | Primer flagelómero achatado con un estilete que surge de un surco poco antes del ápice .......................................................................................................................... 10 | |
| 9b | Primer flagelómero delgado, puntiagudo; estilete terminal ............................................... 12 | |
| 10a | Vena transversal dm-cu ausente; celda dm ausente ................... Apolysis Loew (Fig. 5 d) | |
| 10b | Vena transversal dm-cu presente; celda dm completa ................................................... 11 | |
| 11a | Vena M2 ausente .............................................................. Oligodranes Loew (Fig. 7 a,b) | |
| 11b | Vena M2 presente ................................................................. Phthiria Meigen (Fig. 7 d,e) | |
| 12a | Vena M2 presente .................................................................. Heterotropus Loew (Fig. 6 b) (Heterotropus: probóscide se proyecta más allá del margen subcraneal; M1 y M2 surgen separadas del ápice de la celda dm). | |
| 12b | Vena M2 ausente ........... Geron Meigen (Fig. 5 k,l) .............. 13 (Geron: sedas de la gena curvadas hacia adelante) | |
| 13a | Frente de la hembra con escamas plateadas a blancas; tibia media del macho amarilla o naranja ........................................... Geron nevadensis Hall & Evenhuis (G nevadensis: vena transversal r-m más allá de mitad de la celda dm; frente de la hembra con un punto amarillo medio sobre el margen oral) | |
| 13b | Frente de hembra con escamas doradas; tibia media del macho parda o negra ......... 14 | |
| 14a | Escapo con sedas negras .................................................................................. 15 | |
| 14b | Escapo con sedas blancas, puede tener algunas sedas negras apicales ................... 16 | |
| 15a | Vena transversal r-m a la mitad de la celda dm; escutelo de macho con escamas amarillas ................................................................................................ Geron senilis (Fabricius) | |
| 15b | Vena transversal r-m más allá de la mitad de la celda dm; escutelo de macho sin escamas ................ Geron vitripennis Loew (G vitripennis: sedas y escamas en basicosta doradas) | |
| 16a | Basicosta con sedas y escamas amarillas; escutelo del macho con escamas amarillas dispersas......................................................................................................................17 | |
| 16b | Basicosta con sedas y escamas blancas; escutelo del macho con o sin escamas ...... 18 | |
| 17a | Vena transversal r-m a la mitad de la celda dm; margen oral amarillo ................................................................................................................. Geron notios Hall & Evenhuis | |
| 17b | Vena transversal r-m más allá de la mitad de la celda dm; margen oral pardo ....................................................................................... Geron weemsi Hall y Evenhuis | |
| 18a | Vena transversal r-m a la mitad de la celda dm..............................Geron parvidus Painter | |
| 18b | Vena transversal r-m más allá de la mitad de la celda dm ............ Geron nigripes Painter | |
| 19a | Vena R2+3 originandose de R4+5 antes de la vena transversal r-m de forma oblicua ........ 20 | |
| 19b | Vena R2+3 originandose de R4+5 cerca de la vena transversal r-m de forma perpendicular .....22 | |
| 20a | Venas CuA2 y A terminan separadas en el margen del ala .............................................................................................................. Aphoebantus Loew (Fig. 5 b,c) (Aphoebantus: primer flagelómero largo, más largo que el ancho de su base, base bulbosa) | |
| 20b | Venas CuA2 y A se unen antes de alcanzar el margen del ala o justo en el margen ......... 21 | |
| 21a | Vena R5 y M1 se unen apicalmente o terminan juntas en el margen del ala; vena transversal r-m mucho más allá de la mitad de la celda dm; primer flagelómero largo; cuerpo robusto ....................................................... Bryodemina valida Hull (Fig. 5 f) | |
| 21b | Vena R5 y M1 terminan en el margen del ala separadas; vena transversal r-m cerca de la mitad de la celda dm; abdomen ancho; talla pequeña ........................................... Ogcodocera leucoprocta (Wiedemann) (Fig. 6 i) | |
| 22a | Primer flagelómero con mechón de sedas terminal .......................................................... 23 | |
| 22b | Primer flagelómero sin mechón de sedas terminal ........................................................... 33 | |
| 23a | Con una vena transversal dispuesta entre dm-cu y CuA1, que divide a la celda m2 en una parte anterior y otra posterior ......................................... Xenox habrosus (Marston) (Fig. 7 l) | |
| 23b | Sin vena transversal dispuesta entre dm-cu y CuA1, celda m2 completa ........................................................................ Anthrax Scopoli (Fig. 5 a) ...........................24 | |
| 24a | Pigmentación del ala uniforme, no en manchas; si las alas son casi hialinas, entonces las sedas en el rostro se extienden casi hasta las antenas ............................................. 25 | |
| 24b | Pigmentación de alas en manchas o bandas a lo largo de las venas; si las alas son casi hialinas, entonces seda en el rostro restringidas a la mitad inferior y márgenes laterales ................................................................................. 30 | |
| 25a | Margen posterior de la álula convexo; ala no particularmente alarga ni delgada ................................................................... Anthraxgeorgicus (Say) (A. georgicus: esquina anterior del hipopleuron desnuda; fémur medio sin seda sobre la hilera anteroventral; cuerpo poco brillante; margen de pigmento en ala irregular; celda cup y lóbulo anal completamente pigmentados o con solo el extremo del lóbulo anal subhialino; pigmento en celda m2 no se extiende más que la longitud de la vena transversal r-m; tres quintos o más de la celda dm pigmentada; celda r5 no pigmentada más allá de la base de la celda m1) | |
| 25b | Margen posterior de la álula recto o ligeramente cóncavo; ala a menudo alargada y delgada .......................................................................................................................................... 26 | |
| 26a | Vena R4 se une con R2+3 por una vena transversal; fémur medio con una seda postmediana anterior................................................................................... Anthrax innubilipennis Marston (A. innubilipennis: alas casi hialinas; celdas c y sc y extremo basal del ala pigmentados) | |
| 26b | Vena R4 no se une con R2+3; fémur medio generalmente sin seda postmediana anterior ............................................................................................................................ 27 | |
| 27a | Macho ............................................................................................................. 28 | |
| 27b | Hembra ........................................................................................................... 29 | |
| 28a | Celda bm hialina en su parte media ............................................ Anthrax painteri (Marston) | |
| 28b | Celda bm pigmentada por completo...................................... Anthrax albosparsus (Bigot) (A. albosparsus: margen posterior del lóbulo anal cóncavo; sin escamas doradas) | |
| 29a | Lóbulo anal hialino; menos de la mitad de la celda cup pigmentada ................................................................................. Anthrax painteri (Marston) | |
| 29b | Lóbulo anal pigmentado en su base; más de la mitad de la celda cup pigmentada ............... Anthrax albosparsus (Bigot) (A. albosparsus: pigmento en celda r1 se extiende más allá de la punta de la vena R1; fémur medio sin seda postmedia anterior; sin escamas doradas) | |
| 30a | Celdas c y sc completamente hialinas, subhialinas o pigmentadas, sin áreas alternadas .................................................................................................................. Anthrax atriplex Marston (A. atriplex: escamas en los esternitos abdominales negras; mechón postalarblanco) | |
| 30b | Celdas c y sc con áreas hialinas y pigmentadas alternadas ........................................... 31 | |
| 31a | Bordes del pedicelo redondeados .................................................. Anthraxirroratus Say | |
| 31b | Bordes del pedicelo afilados ............................................................................. 32 | |
| 32a | Fémur medio sin una seda en el lado anterior sobre la hilera anteroventral; mechón postalar por lo general negro ....................................................... Anthrax cintalapa Cole | |
| 32b | Fémur medio con una seda en el lado anterior sobre la hilera anteroventral; mechón postalar por lo general blanco ............................................... Anthrax oedipus Fabricius | |
| 33a | Uñas con un diente pequeño basal; estilete distintivamente articulado en el ápice del primer flagelómero ........................................................................................ 34 | |
| 33b | Uñas simples sin diente basal; estilete no articulado en el primer flagelómero ............. 37 | |
| 34a | Celda r4 no dividida por una vena transversal ......... Exoprosopa Macquart (Fig. 5 j) .......35 | |
| 34b | Celda r4 dividida por una vena transversal ................ Ligyra Newman (Fig. 6 e) ............ 36 | |
| 35a | Abdomen en su porción ventral naranja rojizo; primero y segundo terguitos abdominales con escamas amarillo pálido; con dos bandas oscuras en las alas sin llegar al margen posterior; abdomen cubierto con escamas blancas .................... Exoprosopa aztec Painter | |
| 35b | Abdomen en su porción ventral con escamas negras, solo algunas blancas en los primeros tres esternitos; terguitos abdominales cinco y seis con escamas negras; dos a cuatro bandas de escamas blancas en el dorso del abdomen; mesonoto con escamas negras, algunas amarillas en el escutelo; alas hialinas excepto por el margen anterior ............................................................... Exoprosopa minuscula Painter | |
| 36a | Ala predominantemente hialina con el margen anterior pardo y manchas en el ápice de la celda r2+3, en la vena transversal r-m y base de las celdas m2 y cua1; frente con escamas plateadas en los machos y doradas en las hembras; abdomen con bandas de escamas blancas en los segundo, quinto, sexto y séptimo terguitos; región ventral del abdomen negra.................................................................................. Ligyra alacer Painter | |
| 36b | Ala con seis a ocho manchas subhialinas, borde anterior del ala pardo claro; cuerpo naranja rojizo, con escamas naranjas; escamas blancas en el segundo terguito ...................................................................................... Ligyra evansi Painter | |
| 37a | Vena R2+3 evidentemente curvada en forma de 'S' ........................................ 38 | |
| 37b | Vena R2+3 ligeramente curva .......................................................................... 39 | |
| 38a | Rostro redondeado, no proyectado cónicamente hacia adelante; venas R2+3 y R4 conectadas por una vena trasnversal ................................... Dipalta Osten Sacken (Fig. 5 j) | |
| 38b | Rostro proyectado cónicamente hacia adelante; venas R2+3 y R4 no conectadas por una vena transversal ................................................................... Neodiplocampta Curran (Fig. 6 h) | |
| 39a | Probóscide larga, proyectándose más allá del margen subcraneal ............................... 40 | |
| 39b | Probóscide corta, sin proyectarse más allá del margen subcraneal ................................ 55 | |
| 40a | Vena R2+3 conectada con R4 por una vena transversal ........ Stonyx Osten Sacken (Fig. 7 h) | |
| 40b | Vena R2+3 no conectada con R4 por una vena transversal .................................................... 41 | |
| 41a | Escamas del abdomen angostas; tibia anterior con sedas robustas; vena transversal dm-cu más larga que la porción media de CuA1 ............ Rhynchanthrax Painter (Fig. 7 g) | |
| 41b | Escamas de la porción basal del abdomen gruesas; tibia anterior con sedas cortas y débiles; vena transversal dm-cu no mucho más larga que la porción media de CuA1 ................................. Lepidanthrax Osten Sacken (Fig. 6 c) ......................................... 42 | |
| 42a | Escamas del abdomen brillantes, doradas o amarillas ................................................................................................................................................ Lepidanthrax photinus Hall (L. photinus: tomento abdominal de dos o tres colores; ala con al menos una mancha débil en la venza transversal r-m; escamas abdominales no forman bandas completas en todos los segmentos que las presentan; escamas negras en el cuarto segmento; mesonoto sin una banda de escamas blancas; macho con escamas color bronce del quinto al séptimo segmento, escamas negras en la base del cuarto segmento; hembra con coxas negras, celda br y la mitad de bm de color amarillo castaño) | |
| 42b | Escamas del abdomen brillantes blancas, plateadas o violáceas ................................... 43 | |
| 43a | Escamas del abdomen brillantes violáceas ................................. Lepidanthrax peristigus Hall (L. peristigus: Ala al menos con algunas manchas de color, sobre todo alrededor de la vena transversal r-m; macho con cabeza y cuerpo negro brillante, excepto por los segmentos abdominales apicales; hembra con terguitos abdominales castaños) | |
| 43b | Escamas del abdomen plateadas o blancas ........................................................................ 44 | |
| 44a | Macho ............................................................................................... 45 | |
| 44b | Hembra ............................................................................................................................ 50 | |
| 45a | Primer segmento abdominal predominantemente con sedas negras en los lados ...... 46 | |
| 45b | Primer segmento abdominal predominantemente con sedas blancas en los lados .... 47 | |
| 46a | Escamas brillantes en el cuarto segmento abdominal ocupando casi todo el segmento; base del segundo segmento abdominal con una banda de escamas blancas .............................................................................................................. Lepidanthrax proboscideus (Loew) | |
| 46b | Escamas brillantes en el cuarto segmento en forma de dos puntos a cada lado de la línea media sin llegar al margen lateral; escamas plateadas en la base del segundo segmento ....................................................................................... Lepidanthrax periphanus Hall | |
| 47a | Escamas brillantes desde el cuarto al séptimo segmento del abdomen, sin separación al centro, cubriendo todo el segmento ........................ Lepidanthrax proboscideus (Loew) | |
| 47b | Escamas brillantes comienzan desde el quinto o sexto segmento del abdomen .......... 48 | |
| 48a | Escamas brillantes en el sexto y séptimo segmento del abdomen ......................................................................................................................................... Lepidanthrax hyposcelus Hall (L. hyposcelus: segmentos dos a seis con mechones apareados de escamas negras) | |
| 48b | Escamas brillantes desde el quinto hasta el séptimo segmento del abdomen ............ 49 | |
| 49a | Escamas brillantes en el abdomen llegan al margen lateral pero no se sobreponen a las escamas negras del margen del abdomen; dorso del abdomen con una hilera media de escamas negras semierectas ....................................................... Lepidanthrax litus Hall | |
| 49b | Escamas brillantes en el abdomen llegan al margen lateral y se sobreponen a las negras del margen del abdomen; dorso del abdomen, por lo menos del segundo al cuarto segmento, con dos hileras pareadas de escamas negras ........................................ Lepidanthrax morphnus Hall | |
| 50a | Escamas del séptimo segmento del abdomen plateadas brillantes, no blancas opacas;con un par de manchas de escamas blancas pareadas en los segmentos abdominales cuatro y cinco .................................................... Lepidanthrax periphanus Hall | |
| 50b | Escamas en el abdomen blancas opacas, no brillantes; sin un par de manchas de escamas blancas pareadas en los segmentos abdominales cuatro y cinco .................. 51 | |
| 51a | Alula desarrollada, de ancho por lo menos igual a la mitad del largo .............................................................................................. Lepidanthrax litus Hall (L. litus: tórax sin banda de escamas blancas; sin escamas blancas en el segundo y cuarto segmentos abdominales) | |
| 51b | Alula no desarrollada, de ancho menor a la mitad del largo .............................................. 52 | |
| 52a | Sin escamas blancas en el cuarto segmento del abdomen ............................................................................ Lepidanthrax proboscideus (Loew) | |
| 52b | Con escamas blancas en el cuarto segmento del abdomen, por lo menos en el centro de la base en poca cantidad ..................................................................................................... 53 | |
| 53a | Mitad basal o más del fémur anterior negra ........................ Lepidanthrax hyposcelus Hall | |
| 53b | Patas castaño claro, a lo más coxas y trocánter negras .................................................. 54 | |
| 54a | Mechón metapleural con por lo menos algunas sedas negras, generalmente predominando el negro; segmentos basales de las antenas negros .................................................................................. Lepidanthrax morphnus Hall | |
| 54b | Mechón metapleural pálido, a lo mucho con tres sedas negras en la porción ventral; segmentos basales de las antenas castaño claro ................................. Lepidanthrax proboscideus (Loew) | |
| 55a | Alula ausente; lóbulo anal muy reducido; alas desproporcionadamente largas de color azul oscuro; celda dm alargada; mechón mesonotal anaranjado; cuerpo azul brilloso ................................................................................................ Cyananthrax cyanopterus Painter (Fig. 5 h) (C. cyanopterus: rostro cónico; abdomen alargado y ovalado, sin escamas) | |
| 55b | Alula presente o si está reducida o ausente no presenta las características mencionadas arriba ....................................................................................................................... 56 | |
| 56a | Tercer artejo antenal corto, ovalado, con una porción alargada estiliforme de grosor uniforme ...... Hemipenthes Loew (Fig. 6 a) (Hemipenthes: rostro redondo; bases de las alas pigmentadas; celda dm apicalmente expandida en su parte superior e inferior, bulbiforme; tibia anterior con sedas fuertes y uñas de igual tamaño que las medias y posteriores) | |
| 56b | Tercer artejo antenal largo o corto cónico, con una base ancha y atenuado hacia el ápice .........................................................................................................................................57 | |
| 57a | Ala hialina o subhialina; rostro redondo ...................................................................... Villa Lioy (Fig. 7 k)...............58 (Villa: mechón metapleural denso; celda dm puntiaguda en el ápice; tibia anterior sin sedas robustas y uñas más pequeñas que las medias y posteriores) | |
| 57b | Ala parcial o totalmente pigmentada; rostro cónico ............................................................ 59 | |
| 58a | Tomento en el dorso del abdomen amarillo o dorado, nunca blanco; patas negras .................................................................................................. Villa lateralis (Say) | |
| 58b | Tomento blanco en el segundo segmento del abdomen; patas nunca negras ........................................................................................................................Villa faustina (Osten Sacken) (V. faustina: macho con escamas brillantes plateadas en el séptimo segmento del abdomen) | |
| 59a | Tibia anterior con tres hileras de sedas robustas, uñas del mismo tamaño que las medias y posteriores ............................................... Paravilla Painter (Fig. 7 c)..................60 | |
| 59b | Tibia anterior sin sedas robustas, uñas pequeñas ....................................................... 69 | |
| 60a | Región ventral del tórax y abdomen no totalmente negro ............................................ 61 | |
| 60b | Región ventral del tórax y abdomen totalmente negro ................................................. 64 | |
| 61a | Patas castaño claro, por lo menos los fémures .................. Pavilla castanea (Jaennicke) (P. castanea: dorso del abdomen con tomento negro; pigmentación en el ala formando tres bandas distinguibles, una basal, una media y otra apical; pigmentación en celda r4+5 alcanzando el margen del ala) | |
| 61b | Patas completamente negras o cubiertas densamente de escamas negras ............... 62 | |
| 62a | Región pleural del abdomen sin sedas negras, si las hay no antes del quinto segmento ........................................................................................................................ Paravilla mexicana Hall (P. mexicana: sexto y séptimo segmentos abdominales con escamas plateadas) | |
| 62b | Sedas negras en la esquina apical posterior del segundo segmento abdominal; pigmentación en lóbulo anal no alcanza el margen del ala ............................................... 63 | |
| 63a | Mancha oscura en la base de la celda m1..................... Paravilla epheba (Osten Sacken) | |
| 63b | Sin mancha oscura o muy débil en la base de la celda m1................ Paravilla borea Hall | |
| 64a | Sedas postalares negras .................................................... Paravilla consul (Osten Sacken) (P. consul: sexto y séptimo segmentos abdominales con escamas amarillo pálido) | |
| 64b | Sedas postalares pálidas ................................................................................ 65 | |
| 65a | Quinto terguito abdominal con escamas amarillas laterales en su base ..................... 66 | |
| 65b | Quinto terguito abdominal completamente negro ........................................................ 67 | |
| 66a | Abdomen con bandas de escamas negras en los terguitos segundo a cuarto; sexto y séptimo segmentos con escamas plateadas................................. Paravilla eminens Hall | |
| 66b | Abdomen con escamas en el dorso en una disposición triángular en los segmentos segundo a cuarto; solo séptimo segmento con escamas blancas ....................................................................................... Paravilla extremitis (Coquillett) | |
| 67a | Sedas escutelares amarillas, algunas en el centro negras .......................................................................................... Paravilla extremitis (Coquillett) | |
| 67b | Sedas escutelares predominantemente negras ............................................................ 68 | |
| 68a | Escutelo con un conjunto de escamas negras en el centro; mitad basal o más del lóbulo anal pigmentado, sin llegar al margen del ala ................. Paravilla nigriventris Hall | |
| 68b | Escutelo con escamas amarillas; pigmentación en lóbulo anal solo en la porción más basal y en la vena A1.............................................................. Paravilla consul (Osten Sacken) | |
| 69a | Rostro con sedas pero sin escamas; ala generalmente larga y delgada en relación con el cuerpo; celda r4+5 alargada cerca del margen del ala; base de la celda dm curvada y con una prolongación ventroapical o anterobasal; terminación de la celda dm en punta.; generalmente ala pigmentada más allá de la mitad apical; color alrededor de las venas transversales del mismo tono que el resto del ala; contacto entre la celda dm y cua1 alargado, no en punta ......................................... Poecilanthrax Osten Sacken (Fig. 7 f) | |
| 69b | Rostro con sedas y escamas; ala no visiblemente alargada ni adelgadaza en relación con el cuerpo; celda r4+5 no visiblemente alargada cerca del margen del ala; base de la celda dm recta y sin una prolongación ventroapical o anterobasal; terminación de la celda dm redondeada; por lo menos la mitad apical o más del ala hialina; color más oscuro alrededor de las venas transversales; contacto entre la celda dm y cua1 puntiforme ............................................................................. Chrysanthrax Osten Sacken (Fig. 5 g) |
CONCLUSIONES
De un total de 97 especies, se obtuvieron 12 nuevos registros para Morelos y cinco para el país.
Con base en la ecuación de Clench en Quilamula hay un estimado de 113 especies de Bombyliidae, de las que se recolectó el 85%.
La ecuación de Clench es el modelo de acumulación de especies que mejor se ajustó a los datos empíricos.
Los modelos no paramétricos Chao 2, ICE y ACE subestiman la diversidad y Jack 2 la sobrestima.
Chao 2 e ICE son los modelos no paramétricos que funcionan mejor con poco esfuerzo de recolecta.
Se puede considerar a la Sierra de Huautla como un centro de diversidad de Bombyliidae para México dado que tiene el 73% del total de especies registradas para Morelos y el 25% de las especies registradas para México.
Hay mayor abundancia en la época de secas, pero mayor riqueza en época lluviosa.
Se distinguen patrones a nivel genérico, encontrándose géneros de época de secas y otros de lluvias.
La fenología de Bombyliidae no solo es determinada por la competencia intra e interespecífica de los adultos y la estacionalidad de la selva baja caducifolia. También influyen la presencia de huéspedes y modelos miméticos.
Algunos bombílidos exhiben conducta territorial y preferencias de microhabitat marcadas.
AGRADECIMIENTOS
El autor desea agradecer a las siguientes personas por sus comentarios al manuscrito: M. en C. Roxana Acosta Gutiérrez, M. en C. Armando Moisés Luis Martínez, Dr. Juan José Morrone Lupi, M. en C. Olivia Yáñez Ordóñez y especialmente al Dr. Jorge Enrique Llorente Bousquets por su apoyo, revisiones y sugerencias. Al Dr. Vicente Hernández Ortíz y al Dr. Neal L. Evenhuis por sus consejos y por facilitarme literatura. Al Dr. Harry Brailovsky Alperowitz y la M. en C. María Cristina Mayorga Martínez por permitirme consultar la Colección Nacional de Insectos en el Instituto de Biología de la U.N.A.M. Al Centro de Educación Ambiental Sierra de Huautla por facilitarme el uso de sus instalaciones. A Julio A. González Amador y Melissa López Barreto por su ayuda en el trabajo de campo. El financiamiento de esta investigación se dio por el Departamento de Biología Evolutiva de la Facultad de Ciencias, U.N.A.M. Así como por los apoyos recibidos por los proyectos: CONACyT 36488, PAPIME 202504, 200505 y PAPIIT 218502, 212006.
LITERATURA CITADA
Argote-Cortés, A. 2002. Distribución de la avifauna del bosque tropical caducifolio de la Sierra de Huautla. Tesis de Maestría, Facultad de Ciencias, UNAM, México, D.F. [ Links ]
Argote-Cortés, A., A. Bueno, J. E. Ramírez, J. E. Pérez, G. Ramírez, M. Martínez, J. P. Ferra & F. Urbina. 1999. AICA 40: Sierra de Huautla. En: Benítez, H., C. Arizmendi y L. Márquez. Base de Datos de las AICAS. CIPAMEX, CONABIO, FMCN y CCA. México. (http://www.conabio.gob.mx). [ Links ]
Arias, D. M., O. Dorado & B. Maldonado. 2002. Biodiversidad e importancia de la Selva Baja Caducifolia: La Reserva de la Biosfera Sierra de Huautla. Biodiversitas, 45: 7-12. [ Links ]
Arriaga-Cabrera, L., J. M. Espinoza-Rodríguez, C. Aguilar-Zúñiga, E. Martínez-Romero, L. Gómez-Mendoza & E. Loa-Loza (coord.). 2000. Regiones Terrestres Prioritarias de México. CONABIO, México, pp. 469-471. [ Links ]
Colwell, R. K. 2004. EstimateS: Statistical Estimation of Species Richness and Shared Species from samples (Software and User's Guide), Versión 7. http://viceroy.eeb.uconn.edu. [ Links ]
Colwell R. K. & J. A. Coddington. 1994. Estimating terrestrial biodiversity through extrapolation. Phil. Trans. R. Soc. Lond., 345: 101-118. [ Links ]
Curran, C.H. 1930a. New species of Lepidanthrax and Parabombylius (Bombyliidae, Ditpera). Amer. Mus. Novit., 404: 1-7. [ Links ]
----------. 1930b. New Diptera from North and Central America. Amer. Mus. Novit., 415: 1-10. [ Links ]
Diario Oficial de la Federación (DOF). 8 de septiembre de 1999. DECRETO por el que se declara área natural protegida, con el carácter de reserva de la biosfera, la región denominada Sierra de Huautla, ubicada en los municipios de Amacuzac, Puente de Ixtla, Jojutla, Tlaquiltenango y Tepalcingo, en el Estado de Morelos, con una superficie total de 59,030-94-15.9 hectáreas. [ Links ]
Díaz-Francés, E. & J. Soberón-Mainero. 2005. Statistical Estimation and Model Selection of Species-Accumulation Funtions. Conserv. Biol. 19(2): 569-573. [ Links ]
Evenhuis, N. L. 1977. New North American Bombyliidae (Diptera) with notes on some described species. Ent. News, 88 (5-6): 121-126. [ Links ]
----------. 1984. Revision of the Bombylius comanche group of the New World (Diptera: Bombyliidae). Int. J. Entomol., 26(4): 291-321. [ Links ]
Evenhuis, N. L. & D. J. Greathead. 1999. World catalog of bee flies (Diptera: Bombyliidae). Backhuys Publishers, Leiden. [ Links ]
Evenhuis, N. L. & A. L. Tabet. 1981. The Bombylius albicapillus group (Diptera: Bombyliidae) of the Nearctic region, with key and descriptions of new species. Ann. Entomol. Soc. Am., 74: 200-203. [ Links ]
Godman, F. D. & I. O. Salvin. 1878-1901. Biologia Centrali-Americana. Zoología, Insecta, Diptera. Vol. I, II y III. (http://www.sil.si.edu/digitalcollections/bca/). [ Links ]
Gotelli N. J. & R. K. Colwell. 2001. Quantifying biodiversity: procedures and pitfalls in the measurement and comparison of species richness. Ecol. Lett., 4: 379-391. [ Links ]
Hall, J. C. 1972. New North American Heterotropinae (Diptera: Bombyliidae). Pan-Pac. Entomol., 48(1): 37-50. [ Links ]
----------. 1976. A revision of the North and Central American species of Lepidanthrax Osten Sacken (Diptera: Bombyliidae). Trans. Amer. Entomol. Soc., 102: 289-371. [ Links ]
----------. 1981a. Bombyliidae, cap. 45: 589-602. In: McAlpine, J. F., B. V. Peterson, G. E. Shewell, H. J. Teskey, J. R. Vockeroth y D. M. Wood (eds.). Manual of Nearctic Diptera, vol. 1; Ottawa: Research Branch, Agriculture Canada, Monograph 27. [ Links ]
----------. 1981b. A review of the North and Central American species of Paravilla Painter (Diptera: Bombyliidae). Univ. California Publ. Entomol., 92: 1-190. [ Links ]
Hall, J. C. & N. L. Evenhuis. 2003. Review of the subgenus Geron (Geron) Meigen in the Nearctic Region (Diptera: Bombyliidae: Toxophorinae). Zootaxa, 181: 1-72. [ Links ]
Hull, F. M. 1973. The beeflies of the world. The genera of the family Bombyliidae. Smithsonian Institution Press, Washington, D. C. [ Links ]
Instituto Nacional de Estadística, Geografía e Informática (INEGI). 2004. Información Geográfica: Morelos. http://www.inegi.gob.mx/geo/default.asp?c=124&e=17. [ Links ]
Jiménez-Valverde, A. & J. Hortal. 2003. Las curvas de acumulación de especies y la necesidad de evaluar la calidad de los inventarios biológicos. Revta. Ibér. Aracnol., 8: 151-161. [ Links ]
Maldonado-Almanza, B. J. 1997. Aprovechamiento de los recursos florísticos de la Sierra de Huautla, Morelos, México. Tesis de Maestría, Facultad de Ciencias, UNAM, México, D.F. [ Links ]
Marston, N. 1970. Revision of New World species of Anthrax (Diptera: Bombyliidae), other than the Anthrax albofasciatus Group. Smithson. Contrib. Zool. 43. Smithsonian Institution Press, Washington, E.U.A., 149 p. [ Links ]
McAlpine, J. F. 1981. Key to families - adults, cap. 4: 89-124. In: McAlpine, J. F., B. V. Peterson, G. E. Shewell, H. J. Teskey, J. R. Vockeroth y D. M. Wood (eds.). Manual of Nearctic Diptera, vol. 1; Ottawa: Research Branch, Agriculture Canada, Monograph 27. [ Links ]
Moreno, C. E. 2001. Métodos para medir la biodiversidad. Manuales & Tesis SEA, Vol. 1, Zaragoza, España, 84 p. [ Links ]
Painter, R. H. 1926. The lateralis group of the Bombylid genus Villa. Ohio J. Sci., 26(4): 205-212. [ Links ]
----------. 1939. Notes on type specimens and descriptions of New North American Bombyliidae. Trans. Kansas Acad. Sci., 42: 267-297. [ Links ]
Painter, R. H. & J. C. Hall. 1960. A monograph of the genus Poecilanthrax (Diptera: Bombyliidae). Tech. Bull. 106, Agric. Exper. Stat., Kansas State Univ.: 1-132. [ Links ]
Painter, R. H. & E. M. Painter. 1962. Notes on and redescriptions of Types of North American Bombyliidae (Diptera) in European Museums. J. Kansas Entomol. Soc., 35(1): 2-164. [ Links ]
----------. 1969. New Exoprosopinae from Mexico and Central America (Diptera: Bombyliidae). J. Kansas Entomol. Soc., 42: 5-34. [ Links ]
Painter, R. H., E. M. Painter & J. C. Hall. 1978. A catalogue of the Diptera of the Americas South of the United States, Family Bombyliidae. Museu de Zoologia, Universidade de São Paulo, São Paulo, Brasil. [ Links ]
Palmer, M. K. 1982. Biology and behavior of two species of Anthrax (Diptera: Bombyliidae), parasitoids of the larva of Tiger Beetles (Coleoptera: Cicindelidae). Ann. Entomol. Soc. Amer., 75(1): 61-70. [ Links ]
Paramonov, S. J. 1949. Revision of the species of Lepidophora West. (Bombyliidae, Diptera). Rev. Entomol., 20: 631-643. [ Links ]
Ramírez-Albores, J. E. & M. G. Ramírez-Cedillo. 2002. Avifauna de la región oriente de la sierra de Huautla, Morelos, México. An. Inst. Biol., UNAM, Ser. Zool., 73(1): 91-111. [ Links ]
Rodríguez-Ortuño, V. 1989. Estudio faunístico de los Bombyliidae (Diptera) Cañón de Lobos, Morelos, México. Tesis Licenciatura - Biólogo. Facultad de Ciencias, UNAM, México, D.F. [ Links ]
Rzedowski, J. 1978. Vegetación de México. Limusa, México. [ Links ]
Soberón-Mainero, J. & J. Llorente-Bousquets. 1993. The use of species acumulation functions for the prediction of species richness. Conserv. Biol., 7(3): 480-488. [ Links ]
StatSoft, Inc. 1998. STATISTICA for Windows. http://www.statsoft.com. [ Links ]
Stone A. 1962. A catalog of the Diptera of America North of Mexico, p. 360-446. Agric. Res. Serv. U.S. Washington, D.C. [ Links ]
Szucsich, N. U. & H. W. Krenn. 2002. Flies and concealed nectar sources: morphological innovations in the probóscide of Bombyliidae (Diptera). Acta Zool. (Estocolmo), 83: 183-192. [ Links ]
Toft, C. A. 1983. Community patterns of nectivorous adult parasitoids (Diptera, Bombyliidae) on their resources. Oecologia, 57: 200-215. [ Links ]
----------. 1984. Resource shifts in bee flies (Bombyliidae): interactions among species determine choice of resources. Oikos, 43: 104-112. [ Links ]
Vargas-Fernández, I., J. Llorente-Bousquets & A. Luis-Martínez. 1999. Distribución de los Papilionoidea (Lepidoptera: Rhopalocera) de la Sierra de Manatlán (250-1,650 m) en los estados de Jalisco y Colima. Publ. Esp. Mus. Zool. UNAM, 11: 1-153. [ Links ]
Yeates, D. K. & D. Greathead. 1997. The evolutionary pattern of host use in the Bombyliidae (Diptera): a diverse family of parasitoid flies. Biol. J. Linn. Soc., 60: 149-185. [ Links ]
Zaragoza-Caballero, S., E. González-Soriano, F. Noguera-Martínez, E. Ramírez-García, A. Rodríguez-Palafox & R. Ayala. 2000. Biodiversidad en Insecta (Odonata, Coleoptera [Cantharoidea, Cerambycidae], Diptera [Syrphidae] e Hymenoptera [Apoidea, Vespidae])en tres zonas del Pacífico Mexicano. Memoria electrónica del Primer Congreso de responsables de proyecto de investigación en Ciencias Naturales. Consejo Nacional de Ciencia y Tecnología, México, D. F. [ Links ]