Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta zoológica mexicana
versión On-line ISSN 2448-8445versión impresa ISSN 0065-1737
Acta Zool. Mex vol.23 no.1 Xalapa abr. 2007
Tamaño y estructura poblacional de Crocodylus acutus (Cuvier 1807) (Reptilia: Crocodylidae) en el estero La Ventanilla, Oaxaca, México
Jesús García-Grajales1,3, Gustavo Aguirre-León1 y Armando Contreras-Hernández2
1 Dpto. de Biodiversidad y Ecología Animal, Instituto de EcologÃa A. C. Km. 2.5 Carretera Antigua a Coatepec No. 351. Congregación El Haya. Xalapa 91070, Veracruz, MÃXICO. gustavo.aguirre@inecol.edu.mx
2 Dpto. de Ecología Aplicada. c armando.contreras@inecol.edu.mx
3 Dirección actual: Universidad del Mar - Ciudad Universitaria Campus Puerto Ángel, Puerto Ángel, Distrito San Pedro Pochutla 70902, Oaxaca, MÉXICO. archosaurio@yahoo.com.mx
Recibido: 9 de diciembre 2005
Aceptado: 14 de octubre 2006
RESUMEN
Se estudió una población del cocodrilo de río (Crocodylus acutus) protegida por medio de la participación local en el estero La Ventanilla, Oaxaca, México, entre octubre del 2003 y mayo del 2004. Se estimó el tamaño, estructura y proporción de sexos de esta población para aportar información demográfica del cocodrilo de río mediante la aplicación de dos métodos de captura-recaptura. Se capturaron, midieron y marcaron 21 adultos (8 hembras, 13 machos), 11 subadultos (5 hembras, 6 machos), 88 juveniles (14 hembras, 62 machos) y 23 neonatos. La estimación del tamaño de la población mediante el modelo de Jolly-Seber resultó sesgada debido a que las pruebas de bondad de ajuste detectaron que las historias de captura no se ajustaron al supuesto de igual probabilidad de captura de este modelo. Las mismas historias de captura mostraron un ajuste significativo al modelo del estimador geométrico de frecuencia de capturas y las estimaciones de tamaño poblacional con este modelo fueron de 29.6 ± 9.1 adultos, 37.1 ± 6.6 subadultos y 682.5 ± 39.2 juveniles. La estructura por clases de tamaño de la población de C. acutus no sigue una distribución normal y la mayor parte de los organismos están distribuidos en las clases de menor tamaño (clase I=16.1%, clase II= 61.5%), con poca representación de subadultos (clase III= 9.19%) y de adultos (clase IV= 13.3%). La proporción de sexos esta significativamente sesgada hacia los machos (3 machos: 1 hembra). Este análisis proporciona información para el futuro diseño de estrategias de manejo de la población de C. acutus en el estero La Ventanilla.
Palabras Clave: Crocodylus acutus, tamaño poblacional, estructura poblacional por clases de tamaño, proporción de sexos, Oaxaca, México.
ABSTRACT
A population of the American crocodile (Crocodylus acutus) protected through local participation was studied at La Ventanilla estuary in the coast of Oaxaca, during 8 months (October 2003-May 2004). Size, structure and sex ratio of this population were evaluated in order to provide demographic information of the American crocodile using two capture-recapture methods. A total of 21 adults (8 females, 13 males), 11 subadults (5 females, 6 males), 88 juveniles (14 females, 62 males) and 23 neonates were captured, measured and individually marked. Goodness-of-fit tests for the Jolly-Seber model showed that our population data violated the assumption of equal probability of capture and resulted in a skewed estimate of population size. However, goodness-of- fit tests for the geometric estimator of the capture frequency model applied to the same capture-recapture data showed recapture frequencies conform to it. Population size estimates for this model were 29.6 ± 9.1 adults, 37.1 ± 6.6 subadults, and 682.5 ± 39.2 juveniles. Population structure does not fit the normal distribution (d=39.5, P>0.05), most individuals belonging to lower size classes (16.2% in class I, 61.5% in class II), with few subadults (9.1% in class III) and adults (13.3 %, I class IV). Overall sex ratio was significantly skewed towards males (3 males: 1 female). This analysis provides information for future management strategies for the C. acutus population at La Ventanilla estuary.
Key Words: Crocodylus acutus, population size, size class structure, sex ratios, Oaxaca, Mexico.
INTRODUCCIÓN
El cocodrilo de río (Crocodylus acutus) se distribuye en México por las costas Este y Norte de la Península de Yucatán, así como en los sistemas hidrológicos de los ríos Grijalva y Usumacinta (Ernst et al. 1999), por las costas del Pacífico desde el estado de Sinaloa hasta el estado de Chiapas, casi siempre limitándose a las regiones cercanas al mar (Álvarez del Toro & Sigler 2001, INE/SEMARNAP 2000), aunque en los grandes ríos como el Santiago y el Balsas penetran bastante arriba (Casas-Andreu & Reyna 1994). Los ríos, lagos, esteros y lagunas costeras son su principal hábitat (Álvarez del Toro 1974, Arteaga & Herrera 1997) y su tolerancia a la salinidad del agua de mar le permite sobrevivir en zonas de manglar e islas alejadas de la línea costera (Dunson 1981, Ellis 1981, Mazzotti 1989, Arteaga & Herrera 1997). C. acutus se encuentra considerado bajo protección especial en la lista de especies amenazadas de la Norma Oficial Mexicana (NOM-ECOL-059-2001) (Diario Oficial de la Federación 2001). En el ámbito internacional, está incluida en el Apéndice I de la Convención sobre Comercio Internacional de Especies Amenazadas de Flora y Fauna Silvestres (CITES) (Groombridge 1987) y catalogada como vulnerable en la lista roja de la Unión Internacional para la Conservación de la Naturaleza (IUCN 2006). Su hábitat está siendo transformado rápidamente y la mayoría de sus poblaciones se explotan sin la existencia de planes de manejo.
El cocodrilo de río es una de las especies de cocodrilianos más estudiados en México (Cupul-Magaña et al. 2002) y sus poblaciones han sido evaluadas en los últimos años en la costa del Pacífico mexicano principalmente en el estado de Jalisco; sin embargo, en algunos estados como Guerrero y Oaxaca no se ha reunido información demográfica sobre las poblaciones de cocodrilos ahí existentes, documentándose su presencia sólo mediante registros visuales (Álvarez del Toro 1974, Álvarez del Toro & Sigler 2001, Casas- Andreu et al. 1990).
La costa de Oaxaca ha sido propuesta como una unidad de conservación de alta prioridad para C. acutus, con base en la identificación de asociaciones regionales de hábitat que representan potencial variación en la ecología de esta especie y que son importantes para resguardar poblaciones viables a largo plazo (Thorbjanarson et al. 2006).
En 1997 se creó la Sociedad de Servicios Ecoturísticos La Ventanilla, S. C. de C. V de R. L. en la costa de Oaxaca, y desde entonces han aprovechado la fauna silvestre local de una manera no extractiva mediante recorridos en lanchas por el estero La Ventanilla, en donde se realizó el presente estudio de C. acutus. Esta forma de aprovechamiento ha desencadenado la protección del cocodrilo a través de la vigilancia de zonas de anidación en el área, la crianza de los cocodrilos recién eclosionados y su posterior liberación al medio silvestre cuando alcanzan tallas menos vulnerables a la depredación (García-Grajales 2005).
La mayoría de los estudios referentes al tamaño de las poblaciones realizados sobre C. acutus han considerado suficiente seguir los cambios de las poblaciones de cocodrilos mediante la estimación de índices de abundancia relativa derivados de conteos visuales nocturnos (Chabreck 1966), usados para comparar el tamaño poblacional en diferentes puntos en el espacio y el tiempo (Bayliss 1987, Nichols 1992).
Los objetivos de este estudio fueron estimar el tamaño poblacional de C. acutus mediante los modelos de captura-recaptura de Jolly-Seber y del estimador geométrico de frecuencia de capturas, determinar la estructura y la proporción de sexos de esta población en el estero La Ventanilla y aportar información demográfica de este cocodrilo para la costa de Oaxaca. La evaluación en este tipo de metodologías ayudará a definir las mejores formas de estimar el tamaño de poblaciones de cocodrilos y validar el uso de los métodos de captura-recaptura como una alternativa a los métodos convencionales de conteo de las poblaciones del cocodrilo de río.
MATERIALES Y MÉTODOS
Área de estudio. El estero La Ventanilla (15°40'35" y 15°40'34" N, 96° 35'59" y 96° 35'60" O) se alimenta directamente a través del Río Tonameca al poniente e indirectamente a través de los escurrimientos y filtraciones subterráneos al norte y nororiente de la cuenca de este río, que abarca 57,000 ha de superficie. El estero presenta una bocabarra arenosa que abre y cierra en los meses de junio o julio y/o diciembre o enero dependiendo de la precipitación y del intervalo de mareas, que es de 1.4 a 1.8 m en promedio en la costa de Oaxaca (Hubbs & Roden 1964). El Río Tonameca tiene un desarrollo corto y se origina en las partes altas del estado de Oaxaca, sin embargo, descarga volúmenes importantes en época de lluvias, formando áreas de inundación en su desembocadura, de las cuales forma parte el estero La Ventanilla (Marini 1999).
Los tipos de vegetación existentes en la zona son la selva baja caducifolia, manglares (Rhizophora mangle, Laguncularia racemosa), vegetación de zonas inundables con especies como el tule (Typha angustifolia), palo de agua (Bravaisia intergerrima) y zacate de canal (Echinochloa sp.), vegetación de dunas costeras con especies como pasto salado (Distichlis spicata) y verdolaga de playa (Sessuviumportulacastrum), cactáceas del género Opuntia y leguminosas arbustivas de poca cobertura como Prosopis sp. (Marini 1999).
El clima del área de estudio según la clasificación de Köppen modificada por García (1988), es A Wo (w) i, g, que corresponde al grupo climático cálido con una temperatura media anual mayor a 28°C y la del mes más frío superior a 18°C con lluvias concentradas en el verano y principios del otoño, generalmente de julio a octubre, isoterma con una oscilación menor a 5 °C, y temperatura media anual de 28°C con temperatura media máxima de 37°C y mínima de 23.2°C. La precipitación anual es de aproximadamente 1000 mm (Marini 1999, Martínez de Velasco 2000).
Captura de organismos. Para estimar el tamaño poblacional se utilizaron métodos de captura-marcaje y recaptura (Bayliss et al. 1986, Bayliss 1987, Hutton & Woolhouse 1989) en sesiones de trampeo mensuales de cuatro días consecutivos desde octubre de 2003 hasta mayo de 2004. El área del estero La Ventanilla en la que se capturaron los organismos comprendió aproximadamente 23 ha. La captura de crías y juveniles menores a 120 cm de longitud total se realizó durante noches de luna nueva con oscuridad total, y se hizo a mano y con ayuda de pértigas y domadoras, utilizando una lancha propulsada con remos y lámparas con luminosidad de 50,000 a 2,000,000 de candelas. La captura de cocodrilos subadultos y adultos mayores a 120 cm se realizó durante el día por medio de trampas fijas de lazada corrediza cebadas con pescado (Webb & Messel 1977) colocadas en varios puntos de la orilla del estero. Cada individuo fue marcado con un patrón único de cortes en las quillas caudales para su identificación posterior (Bayliss 1987) y fue liberado en el mismo sitio de captura. A los cocodrilos mayores a 120 cm se les colocó además un arete de plástico numerado en las crestas nucales (Bayliss et al. 1986, Hutton & Woolhouse 1989), lo que permitió efectuar recapturas visuales observando a los individuos con binoculares en periodos de muestreo subsecuentes.
La longitud total de los cocodrilos se midió por la parte ventral desde la punta del hocico hasta la punta de la cola (Medem 1983). Estos datos se agruparon en 4 clases de tamaño: clase I (23 a 60 cm), clase II (61 a 119 cm), clase III (120 a 219 cm) y clase IV (220 en adelante). Las clases de tamaño consideradas para este estudio siguen los criterios de Thorbjarnarson (1989) y se consideraron adultos reproductores de acuerdo con el tamaño mínimo a la primera puesta conocido para esta especie (Kushlan & Mazzotti 1989, Casas-Andreu 2003).
El sexo de los organismos se identificó mediante diferencias morfológicas entre pene y clítoris, visualmente en organismos entre 60 y 120 cm (Joanen & McNease 1987), y por palpación de la cloaca en organismos mayores a 120 cm (Chabreck 1966, Magnusson 1982). Para conocer la proporción de sexos se consideraron sólo los individuos de las clases II, III y IV.
En todas las sesiones de muestreo se contó con la experiencia en la captura de cocodrilos de integrantes de la Sociedad de Servicios Ecoturísticos La Ventanilla, como una forma de capacitación e intercambio de conocimientos para la continuidad de los esfuerzos de conservación del cocodrilo de río en esta localidad.
Análisis de datos. Para probar si la distribución de clases de tamaño seguía una distribución normal se utilizó la prueba de Kolmogorov-Smirnov y para probar si existían diferencias entre las longitudes totales promedio en las clases de tamaño consideradas se utilizó la prueba de Mann-Whithney (Zar 1999). Se utilizó una prueba de χ2 para determinar si existían diferencias en las proporciones de sexos encontradas en las clases de tamaño propuestas (Zar 1999).
Las historias de captura individuales se elaboraron registrando la presencia o ausencia de los organismos en cada una de las 8 sesiones de captura, en tres grupos de individuos que se consideraron sujetos a diferentes regímenes de mortalidad o patrones de actividad (machos adultos, hembras adultas y juveniles). Cuando esta información se reúne durante periodos de varios meses y entran o salen individuos de la población es recomendable usar modelos para poblaciones abiertas (Langtimm et al. 1996). Antes de aplicar un modelo para estimar el tamaño de una población abierta se evaluó si las historias de captura cumplían los supuestos para el análisis de captura-recaptura: 1) cada animal marcado presente en la población al tiempo (i) tiene la misma probabilidad de captura (pi), 2) cada animal marcado en la población inmediatamente después del tiempo (i) tiene la misma probabilidad de sobrevivencia al tiempo (i + 1), 3) las marcas no se pierden, ni se dejan de notar y 4) todas las muestras son instantáneas y los individuos son liberados inmediatamente después de la muestra (White et al. 1982, Begon 1989, Pollock et al. 1990, Pollock 1995). La validez de los supuestos 1 y 2 se examinó por medio de las pruebas de bondad de ajuste del programa RELEASE (versión 3) del programa MARK (White & Burnham 1999). La igualdad de probabilidad de captura para cada grupo de organismos y para los tres grupos combinados se evaluó con las pruebas 2 y 3 de bondad de ajuste. La prueba 2 detecta diferencias en la probabilidad de captura dentro de historias de captura individuales debido a alguna respuesta a la captura. La prueba 3 detecta diferencias en la probabilidad de captura entre individuos debido a historias de captura previas (el caso de los individuos transitorios, atrapados una vez y nunca recapturados: Burnham et al. 1987, Paradis et al. 1993). Los supuestos 3 y 4 fueron satisfechos con el diseño de los muestreos y con los procedimientos de marcaje de los individuos (corte de quillas, aretes plásticos permanentes y liberaciones inmediatas).
Se utilizaron dos modelos para analizar la población de cocodrilos del estero La Ventanilla. El tamaño de la población, las probabilidades de captura y la supervivencia para cada período de muestreo se estimaron con el modelo general de Jolly-Seber, que permite que las probabilidades de captura y sobrevivencia varíen entre las sesiones de muestreo. Se utilizó también el modelo del estimador geométrico de frecuencia de capturas el cual supone que: 1) no hay nacimientos fuera de la etapa reproductiva, 2) no ocurre inmigración 3) los animales marcados y los no marcados mueren y dejan el área de estudio a la misma velocidad, y 4) no se pierden las marcas. Este modelo no asume la igual probabilidad de captura para todas las sesiones de muestreo y estima el tamaño de la población mediante la fórmula (Edwards & Eberhardt 1967, Eberhardt 1969, Seber 1973, Caughley 1978):

donde Σ xnx es el número total de capturas, Σ nx es el número total de animales manipulados, y q= 1-p es el parámetro estimado de la distribución geométrica.
Las frecuencias esperadas (E) para el modelo fueron calculadas con la fórmula (Bayliss 1987):
E (Fi) = (S F i)(1-q) q i-1
en donde Fi es la frecuencia de captura en cada sesión de muestreo.
Las frecuencias esperadas se compararon con las frecuencias reales usando pruebas de bondad de ajuste d χ2 para probar la validez del modelo y sus supuestos.
RESULTADOS
En un periodo de 8 meses se capturaron 143 cocodrilos y se recapturaron 62 (43.3 %). El número de cocodrilos capturados fue máximo en noviembre y diciembre de 2003 y disminuyó en los periodos de muestreo subsecuentes (Fig. 1). El descenso en el número de capturas y recapturas de cocodrilos de enero en adelante pudo estar influenciado por el aumento de la profundidad del estero, al ofrecer condiciones para que los individuos se dispersaran. La bocabarra abrió en diciembre de 2003 y se cerró de nuevo en enero de 2004, aumentando la profundidad del estero (la diferencia entre el nivel máximo y el mínimo fue de aproximadamente 1 m ).
El tamaño corporal máximo de los machos de C. acutus fue de 362 cm y el de las hembras fue de 303 cm. Los machos adultos presentaron una longitud total media de 278.9 cm y las hembras adultas de 265.5 cm, siendo estas diferencias significativas (Mann-Withney, U= 96.5, P<0.05). Los machos subadultos presentaron un longitud total media de 152.8 cm y las hembras subadultas de 160 cm, pero estas diferencias no fueron significativas (Mann-Withney, U= 26, P> 0.05). Los machos juveniles tuvieron una longitud total media de 78.6 cm y las hembras juveniles de 71 cm, no encontrándose diferencias significativas (Mann-Withney, U= 520, P> 0.05). Los cocodrilos juveniles en los que no se pudo determinar el sexo tuvieron una longitud total media de 71.1 cm y las crías de 51 cm (Cuadro 1).
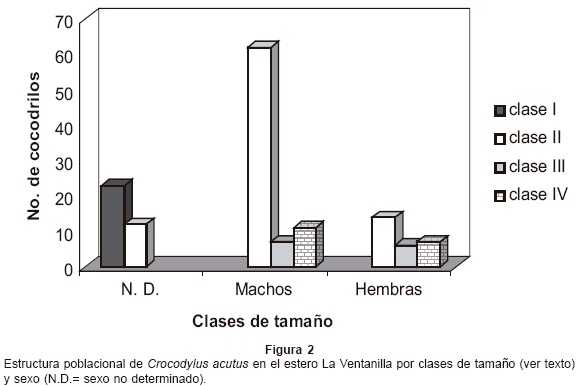
La estructura de la población de C. acutus no sigue una distribución normal (Kolmogorov Smirnov, d=39.5, P>0.05), ya que la mayor parte de los organismos están distribuidos en las primeras clases de tamaño (clase I= 16.1% y clase II= 61.5%), indicando que la población está conformada principalmente por juveniles y crías y en menor proporción por subadultos (clase III= 9.1%) y adultos (clase IV= 13.3%) (Fig. 2).
De los 143 cocodrilos capturados, 56.6% fueron machos, 18.9% fueron hembras y 24.5% fueron individuos en los que no se determinó el sexo. Para estimar la proporción de sexos de la población se tomaron en cuenta 108 organismos de sexo conocido de las clases II, III y IV. La proporción de sexos fue de 3 machos por cada hembra en la población siendo esta diferencia entre sexos significativa (χ2= 27, g.l.= 1, P<0.05).
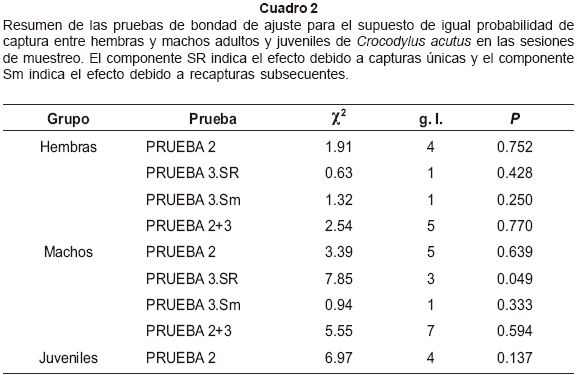
En la aplicación del modelo Jolly-Seber se encontró una violación al supuesto de igual probabilidad de captura al examinar los dos componentes de la prueba 3, prueba 3.SR y prueba 3.Sm, y solamente la prueba 3.SR fue significativa para los machos (χ2= 7.85, g.l.= 3 P= 0.049) (Cuadro 2). Esta prueba indica un efecto debido a los individuos capturados una vez y nunca recapturados (transitorios) en el área de estudio. Al examinar esta prueba por cada sesión de muestreo se encontró que los individuos transitorios tuvieron efecto significativo durante la segunda sesión de muestreo en noviembre (χ2= 10.47, g.l.= 1, P= 0.0012). Los resultados de las pruebas de bondad de ajuste indicaron que las probabilidades de captura y sobrevivencia fueron homogéneas para las hembras y juveniles, pero no para los machos. La probabilidad de captura por sesión de muestreo varió entre 0 y 50%. El número de cocodrilos adultos estimado por este modelo varió entre 11.7 y 24.4 individuos, sin embargo las historias de captura no dieron la información suficiente para calcular el error estándar y el intervalo de confianza en la tercera sesión de muestreo (diciembre). Para los subadultos, la probabilidad de captura por sesión de muestreo varió entre 0 y 14.2%, y el número estimado varió entre 9 y 16.2 individuos. La probabilidad de captura para los juveniles y crías no pudo ser calculada con este modelo y el número estimado varió entre 25 y 1024 individuos, no obstante, no fue posible calcular el error estándar y el intervalo de confianza para las sesiones de muestreo en los subadultos, juveniles y crías (Cuadro 3).
Las pruebas de bondad de ajuste aplicadas a las mismas historias de captura validaron los supuestos de las estimaciones de tamaño poblacional obtenidas con el estimador geométrico de frecuencia de capturas y las estimaciones de tamaño poblacional obtenidas con este modelo fueron 29.6 ± 9.1 adultos (χ2=15.28, g.l.= 7, P> 0.01), 37.1 ± 6.6 subadultos (χ2=0.32, g.l.= 7, P> 0.05) y 682.5 ± 39.2 juveniles (χ2=10.33, g.l.= 7, P> 0.05).
DISCUSIÓN
Los resultados de este estudio son los primeros de este tipo que se dan a conocer para C. acutus en la costa de Oaxaca y contribuyen al conocimiento sobre el tamaño y estructura poblacional y la proporción de sexos de esta especie en México.
La estimación del tamaño poblacional de C. acutus en La Ventanilla varió entre los dos modelos utilizados para el análisis, pero en ambos la mayor variación se observó en la estimación del número de juveniles. Con los resultados del modelo Jolly-Seber se detectó una violación al supuesto de igual probabilidad de captura únicamente en los machos debido al efecto de organismos transitorios que fueron capturados en la segunda sesión de muestreo (noviembre). El grado de sesgo en las estimaciones asociado con la ocurrencia de individuos transitorios en una población dependerá de donde provengan. Si estos individuos son de áreas fuera del sitio de estudio no representarán una severa violación al supuesto de igual probabilidad de captura, pero si son residentes no detectados que fueron capturados sólo cuando cambiaron su comportamiento en respuesta a algún factor ambiental pueden representar una violación al supuesto de igualdad en la probabilidad de captura entre individuos marcados y no marcados. Así, las diferencias en las probabilidades de captura entre residentes marcados y no marcados resultarán en una sobreestimación de la proporción de animales marcados en la población y consecuentemente en una subestimación de la abundancia (Langtimm et al. 1996). Bajo estos argumentos, el menor nivel de agua del estero en noviembre produjo una agregación de individuos en las partes con mayor profundidad, mientras que el aumento de este nivel en enero, asociado con el cierre de la bocabarra, y la elevación concurrente en la salinidad del agua produjo la dispersión de los individuos, en particular los más jóvenes, como se ha evidenciado en estudios de otros cocodrilianos (Ellis 1981 Hutton & Woolhouse 1989), provocando una variación dentro y entre las historias de captura de cocodrilos marcados y nunca recapturados. Esta situación contribuyó muy probablemente a la falta de información que el modelo Jolly-Seber requiere para obtener las estimaciones necesarias. Por ejemplo, las limitaciones del muestreo pueden resultar en una cantidad inadecuada de datos de recaptura, resultando en un estimado con error estándar e intervalo de confianza grandes (Lindeman 1990), y esto sugiere que pudo haber un sesgo en la estimación del número de individuos para los tres grupos de individuos considerados en el análisis con el modelo Jolly-Seber.
Se ha demostrado que los modelos de captura-recaptura pueden subestimar el tamaño poblacional, específicamente aquellos modelos que suponen que la probabilidad de captura es la misma para todos los miembros de al menos un segmento identificable de la población capturada. También se ha demostrado que el supuesto de igualdad de captura no siempre se cumple, al menos por los métodos de trampeo usuales (Eberhardt 1969, Begon 1983). Sólo en pocos estudios con diversas especies de vertebrados que han empleado el modelo Jolly-Seber se han realizado las pruebas de bondad de ajuste para verificar que no se violen los supuestos del modelo (Begon 1983, Lindeman 1990, Langtimm et al. 1996)).
El modelo del estimador geométrico de frecuencia de capturas se ha reconocido como adecuado para estimar la abundancia en estudios de captura-recaptura (Eberhardt 1969, Seber 1973, Bayliss 1987, Merediz-Alonso 1999). Su uso no implica suponer la igual probabilidad de captura (Edwards y Eberhardt 1967, Eberhardt 1969, Bayliss 1987, Merediz-Alonso 1999) por lo que se considera un modelo realista y robusto para la estimación de la abundancia (Eberhardt 1969, Seber 1973, Bayliss 1987, Merediz-Alonso 1999).
Las pruebas de bondad de ajuste al modelo geométrico mostraron que las frecuencias de recaptura de los adultos, subadultos y juveniles de C. acutus de La Ventanilla se ajustan a la distribución geométrica, por lo que las estimaciones obtenidas con este modelo pueden considerarse como más adecuadas para estimar el tamaño de esta población de cocodrilos.
Para agrupar a los organismos y representar la estructura poblacional de cocodrilianos se han propuesto varias clasificaciones de clases de tamaño, sin embargo, no son claros los criterios en los que se basan algunas de estas clasificaciones. Esto tiene implicaciones para el manejo de estos reptiles, ya que hay categorizaciones de tamaño corporal que no representan los verdaderos estadios de los organismos, especialmente en el caso de subadultos y adultos. Se puede subestimar la proporción real de subadultos al considerarlos dentro de las clases de adultos reproductores de menor talla y el uso de distintas clases de tamaño corporal, hasta 6 en algunos estudios, dificulta el análisis comparativo entre poblaciones. Esto puede dar lugar a no considerar las diferencias entre los individuos en términos de su sobrevivencia y fecundidad y a tomar decisiones erróneas al reubicar, reintroducir o cosechar individuos (Akçakaya et al. 1998).
Las clases de tamaño empleadas para la población de C. acutus de La Ventanilla estuvieron relacionadas con la actividad, microhábitat y movimientos de los individuos documentadas en estudios previos sobre esta especie (Rodda 1984, Gaby et al. 1985, Kushlan & Mazzotti 1989, Thorbjarnarson 1989, Sasa & Chaves 1992, Cedeño-Vázquez 2002). Así, estas categorías de tamaño coinciden en general con las propuestas por Platt & Thorbjarnarson (2000) para las poblaciones de C. acutus en Belice, aunque para el estudio en La Ventanilla se amplió el intervalo de la clase III desde los 120 a los 219 cm de longitud total, debido a que el tamaño reproductor mínimo conocido para esta especie en otras poblaciones silvestres es de 220 a 225 cm (Thorbjarnarson 1988, Kushlan & Mazzotti 1989, Casas-Andreu 2003). Además, cabe la posibilidad de que los individuos de talla menor sean fisiológicamente maduros pero que sean excluidos de la reproducción debido a factores sociales (Thorbjarnarson 1989), de manera que individuos de tallas menores cercanas a las que están asociadas con la reproducción pueden ser considerados subadultos cuando ya son reproductores.
Considerando la clasificación de Platt & Thorbjarnarson (2000) con fines de comparación, la población de C. acutus en el estero La Ventanilla está compuesta principalmente por organismos de las clases I y II (neonatos y juveniles, 77.6%), y en menor medida por organismos de la clase IV (adultos, 14.7%) y la clase III (subadultos, 7.7%). Estos resultados difieren de los encontrados en otras poblaciones de esta especie como en la Bahía de Chetumal y el Río Hondo, con 53.1% de subadultos, 34.3% de adultos y 6.3% de juveniles (Cedeño-Vázquez 2002) y poblaciones de Belice, con 39.1% de subadultos, 36.5% de adultos y 24.2% de juveniles (Platt & Thorbjarnarson 2000). Sin embargo, en otros cocodrilianos se han encontrado estructuras poblacionales muy similares a la de la población del cocodrilo de río en La Ventanilla, por ejemplo, en poblaciones de cocodrilo de pantano (C. moreletii) en la Reserva de la Biosfera Sian Ka'an en Quintana Roo (Merediz-Alonso 1999) y en el norte de Belice (Platt 1996), en poblaciones de caimán (Caiman crocodilusyacare) en los pantanales de Brasil (Campos et al. 1994) y en una población de caimán (C. c. crocodilus) en el norte de Surinam (Ouboter & Nanhoe 1989). Una estructura de tamaño dominada por individuos juveniles puede indicar que la población, o la porción afectada de la población, están recuperándose de sobreexplotación ocurrida en años anteriores (Seijas 1986, Llobet & Seijas 2003) o que es un efecto de las prácticas de protección de individuos de organismos de los primeros estadios.
En la población de C. acutus de La Ventanilla se encontró una alta tasa de sobrevivencia en los individuos más jóvenes. De esta manera, la estructura por clases de tamaño encontrada en esta población puede explicarse de varias maneras. En primer lugar, es evidente que la estructura poblacional puede estar moldeada por el efecto de las actividades humanas en La Ventanilla y la tasa de mortalidad de los juveniles puede ser baja posiblemente debido a las prácticas de manejo que la comunidad ha realizado desde hace varios años, al recolectar un porcentaje de crías después de la eclosión natural y mantenerlas en cautiverio durante el primer año de vida, evitándoles estar expuestas a la depredación natural. En segundo lugar, el reclutamiento puede ser elevado en La Ventanilla debido a la liberación de los cocodrilos mantenidos en cautiverio, y en tercer lugar, la cacería que se practicaba habitualmente hasta hace aproximadamente 20 años pudo haber tenido el efecto de reducir la proporción de adultos y de subadultos. Adicionalmente, el sistema de canales del estero La Ventanilla es utilizado por cocodrilos de todas las clases de edad y es un ambiente que mantiene un manglar protegido, lo que sugiere que no hay factores limitantes para la persistencia de esta población de cocodrilo de río.
En estudios con cocodrilianos se ha detectado que la medición de la proporción de sexos puede variar según el método de muestreo empleado (Thorbjarnarson 1997, Lance et al. 2000) y que la probabilidad de atrapar a un organismo puede variar en función de su tamaño corporal (Hutton & Woolhouse 1989). En el caso de las poblaciones de C. acutus en México, se conoce poco acerca de las proporciones de sexos debido a que la mayoría de los estudios se han realizado por medio de conteos visuales nocturnos registrando la presencia de los organismos, pero no el sexo. La proporción de sexos en cada clase de edad de la población de La Ventanilla está significativamente sesgada hacia los machos y en general fue de tres machos por cada hembra en la población. En otras poblaciones de C. acutus se ha observado que es común encontrar igualdad en la proporción de sexos (Kushlan & Mazzotti 1989, Cherkiss 1999, Platt & Thorbjarnarson 2000, Cedeño-Vázquez 2002), mientras que en poblaciones de varias especies de cocodrilianos se ha determinado que los juveniles y adultos generalmente no muestran proporciones de sexos equilibradas (Lance et al. 2000, Porras-Murillo 2004), debido a que la temperatura a la que se incuban los huevos en el nido determina el sexo (Ferguson & Joanen 1983, Ferguson 1985). La proporción de sexos en la población de cocodrilos de La Ventanilla se evaluó con información de individuos de todas las clases de tamaño, por lo que disminuye la probabilidad de incurrir en errores de muestreo al determinar esta proporción (Nichols & Chabreck 1980), y en otras poblaciones de cocodrilianos con alta representación de juveniles se han detectado proporciones elevadas de machos (Rootes & Chabrek 1992, Woodward et al. 1992). Este sesgo se ha explicado tomando en cuenta el efecto acumulado de condiciones climáticas secas y de la mayor temperatura de incubación resultante en los nidos (Bull & Charnov 1989, Aguilar-Miguel 1994, Piña et al. 2003), la mortalidad diferencial de los neonatos de uno y otro sexo (Lance et al. 2000), la dispersión de individuos previa a la madurez sexual (Tucker et al. 1998) y el despliegue de la conducta territorial de los adultos (Tucker et al. 1997). Adicionalmente, en la población de La Ventanilla la proporción de sexos puede estar afectada por la manipulación de los nidos realizada anteriormente por los pobladores locales.
El tamaño real de las poblaciones silvestres de cocodrilianos es difícil de estimar (Sarkis-Gonçalves et al. 2004) y el seguimiento de las poblaciones de estos reptiles presenta problemas, ya sea que estén basados en conteos visuales nocturnos (Woodward & Marion 1978, Magnusson 1982, Bayliss et al. 1986, Abercrombie & Verdade 1995, Pacheco 1994, Llobet & Goitia 1997, Escobedo-Galván 2003, Porras-Murillo 2003, 2004) o en la captura y recaptura de los organismos (Bayliss et al. 1986, Hutton & Woolhouse 1989, Brandt 1991, Merediz-Alonso 1999). En el caso de la información proveniente de conteos visuales nocturnos de cocodrilianos, se ha supuesto que la estandarización de las condiciones de conteo produce fracciones de muestreo que son iguales en promedio para las poblaciones a comparar, aunque el éxito de este tipo de estandarización depende de la habilidad para identificar todos los factores que influyen en la fracción de muestreo y controlar estos factores en alguna medida (Nichols 1992). Aunque los conteos visuales nocturnos pueden proporcionar índices de abundancia, pueden ser inexactos debido al sesgo en la detección visual de los individuos. La cantidad y estructura de la vegetación entre el observador y el cocodrilo es una de las causas más obvias de este sesgo, pero también influyen las dimensiones y la sinuosidad del cuerpo de agua, la posición del cocodrilo en el campo de visión del observador, y la relación de todos estos factores con la cautela del organismo bajo observación (Bayliss et al. 1986). Se ha sugerido también que el sesgo por visibilidad puede ser ignorado si se estandarizan rígidamente los procedimientos de muestreo (Caughley 1977) pero se ha demostrado que esto no siempre es posible debido a que la distribución de edades y tamaños de los cocodrilos son variables en el tiempo (Bayliss et al. 1986). Algunos estudios han sugerido que si la probabilidad de detección es una función de la edad y el tamaño de los individuos, entonces los índices derivados de conteos visuales nocturnos tienen una alta probabilidad de error y el análisis de tendencias en abundancia entre años usando índices inestables puede resultar inexacto (Bayliss et al. 1986). Sin embargo, también se ha mostrado que los conteos nocturnos de cocodrilos pueden ser suficientemente precisos y estar correlacionados con el tamaño real de las poblaciones, particularmente en estudios de largo plazo (Hutton & Woolhouse 1989, Sarkis-Gonçalves et al. 2004).
A medida que se acumule más información sobre el tamaño de la población de cocodrilos por captura y recaptura en el estero La Ventanilla se podrá contrastar con información a obtener por otros métodos como los conteos nocturnos, generar estimaciones de tamaño poblacional mínimo (Baker 2004) e interpretar los cambios temporales en la abundancia de la población. Sin embargo, la información más precisa sobre tamaño corporal y proporción de sexos deberá seguir obteniéndose por medio de captura y recaptura.
Para obtener información destinada a la toma de decisiones sobre el manejo de la población de C. acutus en el estero La Ventanilla, el seguimiento de la misma debe ser permanente. En este sentido, es recomendable realizar conteos bianuales durante los meses de agosto a noviembre, cuando la actividad de celo y cortejo y la expresión de la territorialidad son bajas, para garantizar la obtención de información sobre una porción significativa de la población.
Si bien la reintroducción al medio silvestre de animales criados en cautiverio ha sido una experiencia exitosa en el manejo del cocodrilo de río en el estero La Ventanilla, es necesario evaluar el éxito reproductor de C. acutus en condiciones naturales en este estero y considerar alternativas de manejo complementarias que favorezcan los procesos de conservación in situ de esta especie.
AGRADECIMIENTOS
Agradecemos muy especialmente a los integrantes de la comunidad de La Ventanilla y a los Servicios Ecoturísticos de La Ventanilla S. C. de R. L. de C. V., por su ayuda y participación durante el trabajo de campo y por el acceso a las actividades de la Unidad de Manejo para la Conservación de la Vida Silvestre SEMARNAT-UMA-EX-0009-OAXACA. Al Fish & Wildlife Service por el apoyo económico otorgado y al CONACYT por el apoyo a Jesús García Grajales como becario de posgrado. Al Instituto de Ecología, A.C. por el apoyo logístico y económico (cuenta 902-07-09). Gustavo Casas Andreu hizo sugerencias para mejorar una versión preliminar del escrito. Eduardo Sainz Hernández proporcionó información sobre la dinámica de esteros. Las observaciones de dos revisores anónimos contribuyeron a mejorar el contenido de este trabajo.
LITERATURA CITADA
Abercrombie, C L. & L.M. Verdade. 1995. Dinãmica populacional de crocodrilianos: elaboração e uso de modelos. Pp. 33-35. In: A. Larriera y L. Verdade (Eds.). La conservación y manejo de caimanes y cocodrilos en América Latina. Vol. I. Santa Fe, Argentina. [ Links ]
Aguilar-Miguel, X. 1994. Efecto de la temperatura de incubación sobre la determinación del sexo en Crocodylus acutus y Crocodylus moreletii. Tesis de Maestría en Ciencias. Inédita. Facultad de Ciencias. Universidad Nacional Autónoma de México. 63 pp. [ Links ]
Akçakaya, H. R., M.A. Burnham & L.R. Ginzburg. 1998. Applied population ecology: Principles and computer excercises using RAMAS. Ecolab 2.0. 2nd Edition. Sinauer Associates, Inc. Sunderland. 278 pp. [ Links ]
Álvarez del Toro, M. 1974. Los Crocodylia de México, estudio comparativo. I.M.R.N.R. México, D.F. 70 pp. [ Links ]
Álvarez del Toro, M. & L. Sigler. 2001. Los Crocodylia de México. 1a Edición. IMERNAR, PROFEPA. México. 134 pp. [ Links ]
Arteaga, A. & E. Herrera. 1997. Resultados preliminares del estudio sobre crecimiento, sobrevivencia y uso de hábitat de Crocodylus acutus introducidos en el embalse de Tacarigua, Edo. Falcon, Venezuela. Pp. 25-28. In: Memorias 4a Reunión Regional del Grupo de Especialistas en Cocodrilos de América Latina y el Caribe. Villahermosa, Tabasco, México. [ Links ]
Bayliss, P. 1987. Survey methods and monitoring within crocodile management programmes. Pp. 157-175. In: G.J.W. Webb., S.C. Manolis and P.J. Whitehead (Eds.). Wildlife management: Crocodiles and alligators. Surrey Beatty & Sons Pty. Ltd., Sydney. [ Links ]
Bayliss, P., G.J. W. Webb, P.J. Whitehead, K. Dempsey & A. Smith. 1986. Estimating the abundance of saltwater crocodiles, Crocodylus porosus Schneider, in tidal wetlands of the Northern Territory: a mark-recapture experiment to correct spotlight counts to absolute numbers, and the calibration of helicopter and Spotlight Counts. Australian Wildlife Research 13: 309-320. [ Links ]
Baker, J.D. 2004. Evaluation of closed capture-recapture methods to estimate abundance of Hawaiian monk seals. Ecological Applications 14: 987-998. [ Links ]
Begon, M. 1983. Abuses of mathematical techniques in ecology: aplications of Jolly's capture-recapture method. Oikos 40: 155-158. [ Links ]
----------, 1989. Ecología animal. Modelos de cuantificación de poblaciones. Editorial Trillas, México. 136 pp. [ Links ]
Brandt, L.A. 1991. Long-term changes in a population of Alligator mississippiensis in South Carolina. Journal of Herpetology 25: 419-424. [ Links ]
Bull, J.J. & E.L. Charnov. 1989. Enigmatic reptilian sex ratios. Evolution 43: 1561-1566. [ Links ]
Burnham, K.P., D.R. Anderson, G.C. White, C. Brownie & K.H. Pollock. 1987. Design and analysis methods for fish survival experiments based on release- recapture. American Fisheries Society Monograph 5: 1-437. [ Links ]
Campos, Z., G. Mourao & M. Coutinho. 1994. Night- light counts, size structures, and sex ratios in wild populations of yacare caiman (Caiman crocodilus yacare) in the Brazilian Pantanal. Vida Silvestre Neotropical 4: 46-50. [ Links ]
Casas-Andreu, G. 2003. Ecología de la anidación de Crocodylus acutus (Reptilia: Crocodylidae) en la desembocadura del río Cuitzmala, Jalisco, México. Acta Zoológica Mexicana (nueva serie) 89: 111-128. [ Links ]
Casas-Andreu, G. & T. Reyna Trujillo. 1994. Climate and distribution of Crocodylus acutus in the Mexican Pacific coast. Biogeographica (Paris) 70:69-75. [ Links ]
Casas-Andreu, G., T. Reyna Trujillo & F.R. Méndez de la Cruz. 1990. Estado actual de Crocodylus acutus en la costa del Pacífico de México. Revista Sociedad Mexicana de Historia Natural 41: 57-62. [ Links ]
Caughley, G. 1978. Analysis of vertebrate populations. John Wiley and Sons. Sidney, Australia. 125 pp. [ Links ]
Cedeño-Vázquez, J.R. 2002. Estado de conservación de Crocodylus acutus y Crocodylus moreletii en el Río Hondo, Bahía de Chetumal, y áreas anexas, Quintana Roo, México. Tesis de Maestría en Ciencias. Inédita. El Colegio de la Frontera Sur. México. 46 pp. [ Links ]
Chabreck, R.H. 1966. Methods of determining the size and composition of alligators populations in Louisiana. Proceeding 20th Annual Conference Southeastern Association of Game and Fish Commissioners 20: 105-112. [ Links ]
Cherkiss, M.S. 1999. Status and distribution of the American crocodile (Crocodylus acutus) in Southeastern Florida. Master of Science Thesis. Inédita. University of Florida, Lauderdale. 34 pp. [ Links ]
Cupul-Magaña, F.G., A. Rubio-Delgado, A. Reyes-Juárez & H. Hernández-Hurtado. 2002. Sondeo poblacional de Crocodylus acutus (Cuvier, 1807) en el estero Boca Negra, Jalisco. Ciencia y Mar 6: 45-50. [ Links ]
Dunson, W.A. 1981. Salinity relations of crocodiles in Florida Bay. Copeia 1981 (2): 374-385. [ Links ]
Diario Oficial de la Federación. 2001. Norma Oficial Mexicana NOM-O59-ECOL-2001, que determina las especies de flora y fauna silvestres terrestres y acuáticas, endémicas, amenazadas, en peligro de extinción y sujetas a protección especial. Órgano del Gobierno Constitucional de los Estados. Gobierno Federal, México. 56 pp. [ Links ]
Eberhardt, L. L. 1969. Population estimates from recapture frecuencies. Journal of Wildlife Management 33: 29-39. [ Links ]
Edwards, W.R. & L. Eberhardt. 1967. Estimating cottontail abundance from livetrapping data. Journal of Wildlife Management 31: 87-96. [ Links ]
Ellis, M.T. 1981. Tolerance of sea water by the American crocodile, Crocodylus acutus. Journal of Herpetology 15: 187-192. [ Links ]
Ernst C.H., F.D. Ross & C.A. Ross. 1999. Crocodylus acutus (Cuvier) American Crocodile. Catalogue American Amphibians and Reptiles 700:1-17. [ Links ]
Escobedo-Galván, A. 2003. Períodos de actividad y efecto de las variables ambientales en cocodrilos (Crocodylus acutus Cuvier 1807): Evaluando los métodos de determinación de la fracción visible. Ecología Aplicada 2: 136-140. [ Links ]
Ferguson, M.W.J. 1985. The reproductive biology and embriology of the crocodilians. Pp. 329-491. In: C. Gans, F.S. Biller and P. Maderson (Eds.). The Biology of Reptilia. Vol 14. John Willey & Sons, New York. [ Links ]
Ferguson, M.W.J. & T. Joanen. 1982. Temperature-dependent sex determination in Alligator mississippiensis. Journal of Zoology, London 200:143-177. [ Links ]
Gaby, R., M.P. McMahon, F.J. Mazzotti, W.N. Gillies & J. Wilcox. 1985. Ecology of a population of Crocodylus acutus at a power plant site in Florida. Journal of Herpetology 19: 189-198. [ Links ]
García, E. 1988. Modificaciones al sistema de clasificación climática de Köpen, para adaptarlo a las condiciones de la República Mexicana. Offset Larios S. A., México, D.F. 221 pp. [ Links ]
García-Grajales, J. 2005. Diseño de una estrategia de manejo del cocodrilo americano (Crocodylus acutus) en el estero La Ventanilla, Oaxaca, México. Tesis de Maestría en Ciencias (Manejo de Fauna Silvestre). Inédita. Instituto de Ecología A. C. Xalapa, Veracruz, México. 96 pp. [ Links ]
Groombridge, B. 1987. The distribution and status of the world crocodilians. Pp. 9-21. In: G.J.W. Webb, S.C. Manolis, and P.J. Whitehead (Eds.). Wildlife management: Crocodiles and alligators. Surrey Beatty & Sons Pty. Ltd., Sidney. [ Links ]
Hubbs, C.L. & G.I Roden. 1964. Oceanography and marine life along the Pacific coast of Middle America. pp. 143-186. In: R. Wauchope and R.C. West. (Eds.). Vol. I University of Texas Press, Austin. [ Links ]
Hutton, J.M. & M.E.J. Woolhouse. 1989. Mark-recapture to assess factors affecting the proportion of a Nile crocodile population seen during spotlights counts at Ngezi, Zimbabwe, and the use of spotlight counts to monitor crocodile abundance. Journal of Applied Ecology 26: 381-395. [ Links ]
INE/SEMARNAP. 2000. Proyecto para la conservación, manejo y aprovechamiento sustentable de los Crocodylia en México (COMACROM). INE/SEMARNAP. 107 pp. [ Links ]
IUCN 2006. 2006 IUCN Red List of Threatened Species. <www.iucnredlist.org> [ Links ].
Joanen, T. & L. McNease. 1987. Alligator farming research in Louisiana, USA. Pp. 329-340. In: G.J.W. Webb, S.C. Manolis, and P.J. Whitehead (Eds.). Wildlife management: Crocodiles and alligators. Surrey Beatty & Sons Pty. Ltd., Sidney. [ Links ]
Kushlan, J. & F.J. Mazzotti. 1989. Population biology of the American crocodile. Journal of Herpetology 23: 7-21. [ Links ]
Lance, V.A., R.M. Elsey & J.W. Lang. 2000. Sex ratios of American alligators (Crocodylidae): male or female biased? Journal of Zoology, London 252: 71-78. [ Links ]
Langtimm, C.A., C. K Dodd Jr. & R. Franz. 1996. Estimates of abundance of box turtles (Terrapene carolina bauri) on a Florida Island. Herpetologica 52: 496-504. [ Links ]
Lindeman, P.V. 1990. Closed and open model estimates of abundance and test of model assumptions for two populations of the turtle Chrysemyis picta. Journal of Herpetology 24: 78-81. [ Links ]
Llobet, A. & E. Goitia. 1997. Abundancia y estructura poblacional de Caiman yacare en lagunas de la llanura inundable de los ríos Ichilo y Chapare (Bolivia). Revista Boliviana de Ecología y Conservación Ambiental 2: 39-47. [ Links ]
Llobet A. & A. E. Seijas. 2003. Estado poblacional y lineamientos de manejo del caimán del Orinoco (Crocodylus intermedius) en el río Capanaparo, Venezuela. Pp. 117-129. In: R. Polanco-Ochoa (Ed.). Manejo de fauna silvestre en Amazonia y Latinoamérica. Selección de trabajos. V Congreso Internacional. CITES, Fundación Natura, Bogotá, Colombia. [ Links ]
Magnuson, W.E. 1982. Techniques of surveying for crocodiles. Pp. 389-403. In: Proceedings 5th Working Meeting of Crocodile Specialist Group, IUCN. Morges, Switzerland. [ Links ]
Marini, Z.F. 1999. Apropiación comunitaria y ordenamiento ecológico, principios de soberanía y sustentabilidad. Tesis de Maestría. Inédita. Instituto Tecnológico Agropecuario de Oaxaca, Oaxaca. 213 pp. [ Links ]
Martínez de Velasco, A.E. 2000. Plan maestro para el desarrollo turístico de la comunidad de Ventanilla, Oaxaca, basado en el principio del desarrollo sustentable. Tesis de Licenciatura. Inédita. Universidad Iberoamericana, México. 155 pp. [ Links ]
Mazzotti, F. J. 1989. Factors affecting the nesting success of the American crocodile, Crocodylus acutus, in Florida Bay. Bulletin of Marine Science 44: 220-228. [ Links ]
Medem, F. 1983. Los Crocodylia de Sur América. Vol. I. Colciencias. Carrera, Bogotá, Colombia. 270 pp. [ Links ]
Merediz-Alonso, G. 1999. Ecology, sustainable use by local people, and conservation of Morelet's crocodile (Crocodylus moreletii) in Sian Ka'an Biosphere Reserve, Quintana Roo, Mexico. Master of Science Thesis. Inédita. State University of New York. Syracuse. 58 pp. [ Links ]
Nichols, J.D. 1992. Capture-recapture models. Using marked animals to study population dynamics. BioScience 42: 94-102. [ Links ]
Nichols, J.D. & R.H. Chabreck. 1980. On the variability of alligator sex ratios. American Naturalist 116: 125-137. [ Links ]
Ouboter P.E. & L.M.R. Nanhoe. 1989. Notes on the dynamics of a population of Caiman crocodilus crocodilus in Northern Surinam and its implications for management. Biological Conservation 48: 243-264. [ Links ]
Pacheco, L.F. 1994. The effect of environmental variables on black caiman counts. Wildlife Society Bulletin 24: 44-49. [ Links ]
Paradis, E., G. Guedon & R. Pradel. 1993. Estimation of sex- and age-related survival rates in a microtine population. Journal of Wildlife Management 57: 158-163. [ Links ]
Piña, C. I., Larriera, A. & M. R. Cabrera. 2003. Effect of incubation period, sex ratio, hatchling success, and survivorship in Caiman latirostris (Crocodylia, Alligatoridae). Journal of Herpetology 37: 199-203. [ Links ]
Platt S.G. 1996. The ecology and status of Morelet's crocodile in Belize. Ph. D. dissertation. Inédita. Clemson University. 173 pp. [ Links ]
Platt, S.G. & J.B. Thorbjarnarson. 2000. Status and conservation of the American crocodile, Crocodylus acutus, in Belize. Biological Conservation 96: 13-20. [ Links ]
Pollock, K H. 1995. Capture-recapture models: an overview. Instituto Vasco de Estadística. EUSTAT, España.112 pp. [ Links ]
Pollock, K.H., J.D. Nichols, C. Brownie & J.E. Hines. 1990. Statistical inference for capture-recapture experiments. Wildlife Monographs 107: 1-97. [ Links ]
Porras-Murillo, L.P. 2003. Evaluación de la translocación del cocodrilo americano (Crocodylus acutus) como técnica de manejo de sus poblaciones silvestre. Tesis de Licenciatura. Inédita. Universidad Nacional, Campus Omar Dengo. Heredia, Costa Rica. 47 pp. [ Links ]
----------. 2004. Situación actual del cocodrilo americano (Crocodylus acutus) en los Ríos Jesús María, Tarcoles y Tusubres: Estructura poblacional e intercambio genético. Tesis de Maestría. Inédita. Universidad Nacional, Heredia, Costa Rica. 96 pp. [ Links ]
Rodda, G.H. 1984. Movements of juvenile American crocodiles in Gatun Lake, Panama. Herpetologica 40: 444-451. [ Links ]
Rootes, W.L. & R.H. Chabreck. 1992. Sex ratios of American alligators live-captured and harvested by baited hooks. Wildife Society Bulletin 20: 140-142. [ Links ]
Sarkis-Gonçalves F., A.M.V. Castro y L.M. Verdade. 2004. The influence of weather conditions on Caiman night-counts. Pp. 387-393. In: Crocodiles. Proceedings 17 th Working Meeting of the Crocodile Specialist Group. IUCN-The World Conservation Union. Gland, Switzerland. [ Links ]
Sasa, M. & G. Chaves. 1992. Tamaño, estructura y distribución de una población de Crocodylus acutus (Crocodylia: Crocodilidae) en Costa Rica. Revista de Biología Tropical 40: 131-134. [ Links ]
Seber, G.A.F. 1973. The estimation of animal abundance. Hafner Press, New York. 506 pp. [ Links ]
Seijas, A. E. 1986. Estimaciones de babas (Caiman crocodilus) en los Llanos occidentales de Venezuela. Vida Silvestre Neotropical 1: 24-30. [ Links ]
Thorbjarnarson, J. 1988. The status and ecology of the American crocodile in Haiti. Bulletin Florida State Museum of Biological Science 33: 1-86. [ Links ]
----------. 1989. Ecology of the American crocodile (Crocodylus acutus). Pp. 228-258. In: P.M. Hall (Ed.). Crocodiles: Their ecology, management and conservation. IUCN-The World Conservation Union Publications, Gland, Switzerland. [ Links ]
----------. 1997. Are crocodilian sex ratios female biased? The data are equivocal. Copeia 1997(2): 451-455. [ Links ]
Thorbjarnarson, J., F. Mazzotti, E. Sanderson, F. Buitrago, M. Lazcano, K. Minkowski, M. Muñiz, P. Ponce, L. Sigler, R. Soberon, A.M. Trelancia & A. Velasco. 2006. Regional habitat conservation priorities for the American crocodile. Biological Conservation 128: 25-36. [ Links ]
Tucker, A.D., C.J. Limpus, H.I. McCallum & K.R. Mc Donald. 1997. Movements and home range of Crocodylus johnstoni in the Lynd river, Queensalnd. Wildlife Research 24: 379-396. [ Links ]
Tucker, A.D., H.I. McCallum, C.J. Limpus & K.R. Mc Donald. 1998. Sex-biased dispersal in a long-lived polygynous reptile (Crocodylus johnstoni)? Behavioral Ecology and Sociobiology 44:85-90. [ Links ]
Webb, G.J.W. & H. Messel. 1977. Crocodile capture techniques. Journal of Wildlife Management 41(3): 572-575. [ Links ]
White, G.C., D.R. Anderson, K.P. Burnham & D.L. Otis. 1982. Capture- recapture and removal methods for sampling closed populations. Los Alamos National Laboratory Publication LA-8787-NERP. Los Alamos. New Mexico. 205 pp. [ Links ]
White, G.C. & K.P. Burnham. 1999. Program MARK: Survival estimation from populations of marked animals. Bird Study 46 (Supplement): 120-138. [ Links ]
Woodward, A R. & W.R. Marion. 1978. An evaluation of factors affecting night-light counts of alligators. Proceedings Annual Conference of the Southeastern Association of Fish Wildlife Agencies 32: 291-302. [ Links ]
Woodward, A.R., T.M. Moore & M.F. Delany. 1992. Experimental alligator harvest. Final report, Study No. 7567. Bureau of Wildlife Research, Florida Game and Fish Commision. Tallahassee. 188 pp. [ Links ]
Zar, J.H. 1999. Biostatistical analysis. Prentice-Hall. New Jersey. 663 pp. [ Links ]