Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta zoológica mexicana
On-line version ISSN 2448-8445Print version ISSN 0065-1737
Acta Zool. Mex vol.22 n.2 Xalapa Aug. 2006
Artículos originales
Ecología térmica de una población de la lagartija Sceloporus grammicus (Iguanidae: Phrynosomatinae) que ocurre en la zona Centro-Oriente de la Ciudad de México
Woolrich-Piña G. A1., J. A. Lemos-Espinal1, L. Oliver-López1, M. E. Calderón Méndez1, J. E. González-Espinoza1, F. Correa-Sánchez1 y R. Montoya Ayala2
1 Laboratorio de Ecología. Unidad de Biología, Tecnología y Prototipos (UBIPRO). FES-Iztacala UNAM. Av. De los Barrios s/n Col. Los Reyes Iztacala, 54090, Tlalnepantla Estado de México, México. woolrichg@correo.unam.mx.
2 Laboratorio de Cómputo. Unidad de Biología, Tecnología y Prototipos (UBIPRO). FES-Iztacala UNAM. Av. De los Barrios s/n Col. Los Reyes Iztacala, 54090, Tlalnepantla Estado de México, México.
Recibido: 3 de agosto 2004
Aceptado: 4 de abril 2006
RESUMEN
Estudiamos la ecología térmica de la lagartija Sceloporus grammicus que habita en la región central de la Ciudad de México. La temperatura corporal (Tc) promedio para estos organismos fue de 31.43 ± 0.1 °C. La Tc de Sceloporus grammicus estuvo positiva y significativamente correlacionada con la temperatura del aire [Ta] (n = 147, r = 0.451, P < 0.001; Tc 27.529 + 0.195 Ta) y con la temperatura del sustrato [Ts] (n = 147, r = 0.482, P < 0.001; Tc = 27.315 + 0.199 Ts) donde se encontraban. Observamos diferencias significativas entre la temperatura corporal de machos y hembras (ANCOVA con la Ts como covariable F1,146 = 8.71, P = 0.003), así como en la temperatura corporal presentada entre hembras preñadas y no preñadas (ANCOVA con la Ts como covariable F1,91 = 18.81 P < 0.001). Estos resultados sugieren que S. grammicus presenta una tendencia hacia la termorregulación activa y que el estadio reproductivo de las hembras puede influir su estrategia termorreguladora.
Palabras clave: Sceloporus grammicus, Ecología térmica, Termorregulación, Temperatura corporal, Estadio reproductivo, Ciudad de México.
ABSTRACT
The thermal ecology of the lizard, Sceloporus grammicus in Mexico City was studied. Mean body temperature (Tb) was 31.43 ± 0.1 °C. Body temperature was significantly and positively related to air temperature (Ta: n = 147, r = 0.451, P < 0.001; Tb = 27.529 + 0.195 Ta) and substrate temperature (Ts: n = 147, r = 0.482, P < 0.001; Tb = 27.315 + 0.199 Ts) occupied by the lizards. The body temperature was different between males and females (ANCOVA with Ts as the covariate F1,146 = 8.71, P = 0.003) and between pregnant females and unpregnant females as well (ANCOVA with Ts as the covariate F1,91 = 18.81 P < 0.001). These results suggested that S. grammicus is a lizard with active thermoregulation and that reproductive status can influence the thermoregulatory strategy of females.
Key word: Sceloporus grammicus, thermal ecology, thermoregulation, body temperature, reproductive status, Mexico City.
INTRODUCCIÓN
La temperatura es un factor ambiental que influye de manera directa sobre la temperatura corporal de los lacertilios (Zug et al., 2001). Esta temperatura corporal puede ser regulada por mecanismos conductuales y fisiológicos que permiten a las lagartijas mantener intervalos de temperaturas corporales máximos y mínimos (Ballinger et al., 1970; Huey y Pianka, 1977; Hertz, 1981; Stevenson 1985a; Huey y Bennett, 1987; Brown 1996; Lemos-Espinal et al., 1997a; y Anguilletta et al., 1999), debido a las variaciones diarias, estacionales y geográficas en la temperatura ambiental (Huey y Slatkin, 1976; Hertz y Huey, 1981; Stevenson 1985b; Bauwens et al., 1996 y Belliure et al., 1996). Estos organismos pueden ganar calor por radiación directa del sol (organismos heliotermos) o por estar en contacto con algún sustrato caliente (animales tigmotermos, Zug et al., 2001). Dichos mecanismos de obtención de calor, generalmente repercuten en la estrategia de la regulación térmica por parte de un lacertlilio, ya que puede darse por dos vías: mediante una termorregulación activa, en la cual, un organismo puede mantener su temperatura corporal por encima de la temperatura ambiental, y por medio de una regulación pasiva (termoconformismo) en la cual, un animal va incrementando su temperatura conforme aumenta la temperatura ambiental (Huey y Slatkin, 1976; Pough et al., 2001).
Los trabajos realizados por Cowles y Bogert (1944) y Bogert (1949a y b) han sido la base de la mayoría de los estudios sobre la termorregulación en lagartijas. Desde entonces se han realizado una serie de trabajos sobre termorregulación en lacertilios entre los que podemos destacar los estudios que relacionan la termorregulación con la fisiología, por ejemplo, locomoción, crecimiento, frecuencia cardiaca, flujo de sangre, glucosa en sangre, y transferencia de calor, entre otras (Dunham et al., 1989; Sinervo y Adolph, 1989, 1994; Sinervo, 1990; Benabib y Congdon 1992; O'Connor, 1999; Grenot et al., 2000; Dzialowski y O'Connor, 2001), así como estudios ecológicos y evolutivos que tratan de explicar la temperatura corporal que presentan las lagartijas actualmente (Ballinger et al., 1970; Waldschmidt y Tracy, 1983; Huey y Bennett, 1987; Grant y Dunham, 1988, 1990; Smith et al., 1993 y Smith y Ballinger, 1994a; Lemos-Espinal y Ballinger, 1995; Lemos-Espinal et al., 1997a y b). En la actualidad se considera que la termorregulación es un factor que puede explicar algunas características de historias de vida como son la madurez sexual, tamaño de la camada o de la puesta, tasas de crecimiento de las crías y supervivencia, entre otras (Stearns, 1976, 1992; Beuchat y Ellner, 1987; Sinervo y Adolph, 1989; Sinervo, 1990; Adolph y Porter, 1993; Anguilletta et al., 2000).
La ecología térmica de lagartijas puede relacionarse con diferencias en el microhábitat utilizado por ambos sexos (Beuchat, 1986; Gillis, 1991; Smith et al., 1993), así como a la condición reproductiva de las hembras, tanto en especies ovíparas como vivíparas (Vrcibradic y Rocha, 2004). Esta última relación puede establecerse debido a que la temperatura apropiada para optimizar el desarrollo embrionario tal vez difiera de la temperatura corporal alcanzada por las hembras (Beuchat, 1988; Andrews et al., 1997). Para algunas especies vivíparas, se han reportado tres tendencias mediante las cuales las hembras preñadas regulan su temperatura corporal. Por un lado, se ha observado que termorregulan a temperaturas corporales más bajas con respecto a las hembras no preñadas (Garrick, 1974; Beuchat, 1986; Tosini y Avery, 1996). Por otra parte, se ha encontrado que la regulación térmica de las hembras preñadas se lleva a cabo a una temperatura corporal mayor en relación a las hembras no preñadas (Stewart, 1984; Daut y Andrews, 1993; Rock et al., 2000). La última tendencia indica una termorregulación a temperaturas corporales similares entre hembras preñadas y no preñadas (Schwarzkopf y Shine, 1991; Lemos-Espinal y Ballinger, 1995).
El presente trabajo contribuye a incrementar el conocimiento sobre la ecología térmica de Sceloporus grammicus, razón por la cuál nos hemos planteado las siguientes preguntas:
1) ¿Cuál es la temperatura corporal promedio de S. grammicus? 2) ¿Existe una relación entre la temperatura corporal de estas lagartijas y la temperatura del microclima (sustrato y aire) ocupado por los organismos? 3) ¿Se presentan diferencias en la temperatura corporal de los lacertilios ocupando diferentes condiciones de microhábitat con respecto a la radiación solar (sol, sombra, nublado)? 4) ¿Son organismos heliotérmicos o tigmotérmicos? 5) ¿Esta población de Sceloporus grammicus muestra tendencias hacia la termorregulación o hacia el termoconformismo? 6) ¿Existen diferencias significativas entre la temperatura corporal de machos y hembras, así como entre la de hembras preñadas y no preñadas?
MATERIAL Y MÉTODO
Descripción del área de estudio
El área de estudio se localiza en las cercanías del Aeropuerto Internacional de la Ciudad de México (en la zona centro-oriente), a una altitud de 2240 msnm. El tipo de vegetación corresponde a manchones dispersos de Eucaliptus sp, colorines (Erythrina coralloides) y pirules (Schinus molle) principalmente (Rzedowski 1988). Estos manchones están separados por avenidas y calles. Sceloporus grammicus es abundante a lo largo de estas «islas verdes». Cuando la actividad humana disminuye (poco tránsito vehicular y afluencia de personas mínima), entre las 900 y las 1330, y entre las 1630 y 1830, se les puede observar perchando sobre los troncos de los árboles antes mencionados, a una altura no mayor de 1.8 m, y a nivel del suelo dentro de jardineras ocupando estos sitios para asolearse.
Ecología térmica
El estudio se realizó de enero del 2001 a diciembre del mismo año. Se procedió a capturar el mayor número posible de lagartijas de la especie S. grammicus. Una vez capturado, a cada organismo se le registró sexo, hora de captura, temperatura corporal (Tc) (temperatura cloacal), así como la temperatura del aire (Ta) (bulbo a la sombra 3.0 cm por encima del sustrato ocupado por la lagartija) y la temperatura del sustrato (Ts) (bulbo a la sombra sobre el sustrato ocupado por la lagartija) utilizando un termómetro de lectura rápida (intervalo 0-50°C). Asimismo, se registró la posición del organismo con respecto a los rayos solares (a lo que posteriormente denominaremos condición: completamente expuesto al sol, expuesto a la sombra o día nublado). Todas las lagartijas que requirieron un esfuerzo mayor de captura (> 2 min.) fueron excluidas de los registros de temperatura. Solo se utilizó un dato de Tc, Ta y Ts por cada lagartija para tener una independencia estadística de los datos.
Estadísticos
Para determinar si se presentaron diferencias significativas entre la temperatura corporal de machos vs. hembras, hembras preñadas vs. hembras no preñadas y entre organismos utilizando diferente condición, se aplicó un análisis de covarianza (ANCOVA) tomando como covariable a la variable más correlacionada con la Tc , en este caso, la Ts. Para determinar si existió una correlación entre Ts y Ta con la Tc se aplicó un análisis de correlación de Pearson.
Tendencias termorreguladoras
Para comprobar las tendencias termorreguladoras o termoconformistas se aplicó el criterio de Huey y Slatkin (1976) quienes mencionan que una especie es termorreguladora cuando el valor de la pendiente de la regresión lineal de la Tc sobre la temperatura ambiental (Ta ó Ts) es cero o cercano a éste; cuando una especie es termoconformista el valor de la pendiente es uno o cercano a él. Con respecto a la forma de obtención de calor por parte de los animales, si la correlación entre Tc vs. Ta es mayor comparada a la correlación Tc vs. Ts, se asume que hay una tendencia de los organismos a ser heliotermos, si ocurre lo contrario en la correlación, la tendencia es a presentar una tigmotermia.
Condición reproductiva
Por último, para determinar la condición reproductiva de las hembras, en el laboratorio se realizó la disección de las mismas, considerando a las hembras no preñadas aquellas que presentaron folículos no vitelogénicos y las hembras preñadas aquellas que presentaron folículos vitelogénicos y embriones en el oviducto.
RESULTADOS
La Tc de estas lagartijas promedió 31.43 ± 0.1°C (intervalo 28.6-33.2°C). La Ta y Ts en la zona de estudio promediaron 20.02 ± 0.24°C (intervalo 14.6-24.8°C) y 20.67 ± 0.25°C (intervalo 15.6-28.2°C) respectivamente.
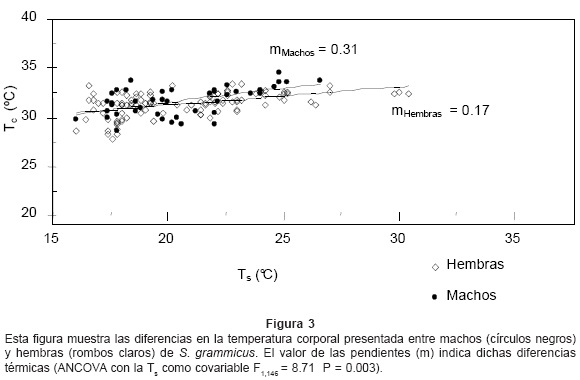
La Tc presentó una relación positiva y significativa con la Ta (Fig. 1, r = 0.451, P < 0.001; Tc= 27.529 + 0.195 Ta) y con la Ts (Fig. 2, r = 0.482, P < 0.001; Tc = 27.315 + 0.199 Ts) del microhábitat ocupado por cada lagartija. Por otro lado, la temperatura corporal para machos y hembras promedió 31.93 ± 0.17°C (rango 28.8 - 34.6), n = 55 y 31.26 ± 0.12°C (rango 28.6 - 33.4), n = 92, respectivamente, observándose una diferencia significativa en la temperatura corporal presentada por ambos sexos (Fig. 3, ANCOVA con la Ts como covariable F1,146 = 8.71, P = 0.003), siendo los machos los que dependieron en mayor medida de la temperatura del microhábitat (r = 0.53, P < 0.001; Tc = 25.185 + 0.31 Ts) con respecto a las hembras (r = 0.48, P < 0.001; Tc = 27.690 + 0.17 Ts). Por otra parte, la temperatura promedio para hembras preñadas y no preñadas fue de 30.42 ± 0.17°C (intervalo 28.6 - 32.6), n = 35 y 31.68 ± 0.14°C (intervalo 28.2 - 33.4), n = 57, respectivamente, encontrándose una diferencia estadísticamente significativa entre las hembras con ambas condiciones reproductivas (Fig. 4, ANCOVA con la Ts como covariable F1,91 = 18.81, P < 0.001). Asimismo se observó que las hembras preñadas dependieron en mayor grado de la temperatura del microclima (n = 57, r = 0.56, P < 0.001; Tc = 26.656 + 0.225 Ts) que las hembras no preñadas (n = 35, r = 0.3, P = 0.08; Tc = 27.845 + 0.083 Ts).



La temperatura de las lagartijas que ocupaban diferente condición (sol, sombra y nublado), promedió 31.7 ± 0.09°C (intervalo 29.2 - 33.8), n = 84; 31.8 ± 0.26°C (intervalo 29.2 -34.6), n = 37 y 29.6 ± 0.27°C (27.8 - 31.8), n = 26, respectivamente; observándose una diferencia significativa entre lagartijas que ocupaban sol y sombra con respecto a las que se encontraron en días nublados (ANCOVA con la Ts como covariable F2,145 = 34.64, P < 0.001, ver Fig. 5). Durante los días nublados la dependencia de los lacertilios hacia la temperatura del microhábitat fue mayor (r = 0.69, P < 0.001; Tc = 21.7497 + 0.4161 Ts), en comparación a los días soleados (r = 0.4, P < 0.001; Tc = 28.9 + 0.1340 Ts) ó cuando se encontraban en la sombra (r = 0.47, P < 0.001; Tc = 28.1173 + 0.1732 Ts).

DISCUSIÓN
Temperatura corporal
El promedio de la temperatura corporal de S. grammicus fue de 31.43°C ± 0.1°C, similar a la presentada en otras poblaciones pertenecientes al complejo grammicus (Lemos-Espinal y Ballinger 1995). Tal vez esta similitud en el promedio de la temperatura corporal se deba a una característica ancestral del grupo (Huey y Bennett, 1987; Garland et al., 1991; Harvey y Pagel, 1991) ya que los hábitats, las condiciones climáticas y la altitud en las zonas donde ocurren estos organismos difieren entre sí (ver cuadro 1). Otra posible explicación es que quizás se deba a que la temperatura corporal presentada por estos organismos es la óptima en la que los procesos fisiológicos se llevan a cabo adecuadamente (Van Damme et al., 1987), pues se ha observado en otra lagartija vivípara (Lacerta vivipara) un adecuado funcionamiento locomotor y digestivo cuando presenta temperaturas corporales cercanas a 32 °C (Patterson y Davies, 1978).
Tendencias termorreguladoras
La mayor parte de estos lacertilios se encontraron completamente expuestos al sol. Sin embargo, también estuvieron activos en la sombra y durante días nublados. Lo anterior sugiere que tanto la temperatura del aire como la del sustrato son ocupadas por los organismos para regular su temperatura corporal. Existen dos evidencias que pueden indicar una termorregulación activa. La primera es que el valor de ambas pendientes de las regresiones Tc vs. Ta y Tc vs. Ts, son de 0.19. Con base al criterio propuesto por Huey y Slatkin (1976), S. grammicus al igual que otras especies pertenecientes al género, presenta tendencias hacia dicha estrategia termorreguladora (Lemos-Espinal y Ballinger, 1995; Lemos-Espinal et al., 1993, 1997a y b; Smith y Ballinger, 1994a, y b, 1995; Smith et al., 1993; Andrews et al. 1997). El que una lagartija sea termorreguladora tiene ciertas implicaciones. Por un lado, al presentar su cuerpo altas temperaturas, habrá una mayor tendencia a la pérdida de agua por evaporación (Hertz, 1992). Por otra parte, generalmente buscará fuentes de radiación directa al sol, haciéndose conspicua a potenciales depredadores (Ballinger et al., 1970; Huey, 1974; Huey y Slatkin, 1976), entre otros posibles costos. Por otro lado, el acceso a una temperatura ambiental que permita a los organismos elevar su temperatura corporal a un rango óptimo, trae como posible ventaja que el animal asigne la cantidad de energía necesaria al crecimiento, reproducción y mantenimiento (Beuchat y Ellner, 1987; Sinervo y Adolph, 1989; Sinervo, 1990; Daut y Andrews, 1993), entre otros. La segunda evidencia que puede indicar una termorregulación activa es que tanto la tigmotermia como la heliotermia parecen desempeñar un papel importante en los esquemas termorreguladores de S. grammicus, debido a una correlación relativamente alta y significativa entre la Tc con la temperatura del microclima (Ta y Ts, ver resultados). Las observaciones realizadas en campo y lo mencionado anteriormente, pueden sugerir que estos organismos realizan movimientos de sol a sombra para mantener su temperatura corporal constante en las horas de luz solar, ganando calor por radiación directa del sol, y cuando su temperatura aumenta, buscan refugio a la sombra, en sustratos con temperaturas confortables que les permita mantener una temperatura corporal constante. Este esquema de obtención de calor utilizando ambas vías (tigmotermia y heliotermia) contrasta con los patrones presentados por otros lacertilios cuyas tendencias se cargan más hacia la tigmotermia (Lemos-Espinal et al., 1997b y c, 1998; Woolrich-Piña et al., 1999, 2003), o heliotermia (Carrascal y Díaz, 1989; Marquet et al., 1989).
La diferencia en la temperatura corporal presentada por las lagartijas ocupando diferente condición (sol, sombra y nublado) puede ser otra evidencia más de que estos lacertilios termorregulen activamente, ya que las Tc's fueron mayores en días soleados que en días nublados y, por otra parte, quizás empleen el mecanismo de cambiar de postura con respecto a los rayos del sol para regular su temperatura (Dreisig, 1984; Bauwens et al., 1996).
Diferencias térmicas inter e intrasexuales
La diferencia en la temperatura corporal presentada por ambos sexos de S. grammicus tal vez se deba al grado de territorialidad o a diferencias en el uso de microhábitats (Dias y Rocha, 2004; Kerr y Bull, 2004). Este mismo patrón ha sido observado en otros lacertilios (Smith et al., 1993), donde los machos pueden acceder a microhábitats con mayor disponibilidad de fuentes de calor. Sin embargo, en otras especies, las hembras presentan una temperatura corporal mayor a los machos (Daut y Andrews, 1993 y Gillis, 1991). Quizás lo anterior se deba a que las hembras requieren de microhábitats adecuados que suministren el calor necesario para incrementar la temperatura corporal con fines reproductivos (Schwarzkopf y Shine, 1991).
Una capacidad termorreguladora disminuida y una tendencia tigmotérmica por parte de las hembras preñadas en comparación a las no preñadas (pendientes 0.225 vs. 0.083, r = 0.56 vs. r = 0.3, respectivamente), tal vez aumente su probabilidad de supervivencia (Stewart, 1984), ya que al ocupar diferentes microhábitats o conductas termorreguladoras, posiblemente eviten el riesgo de ser depredadas y por esta razón presenten una temperatura corporal menor en comparación de las hembras no preñadas (Shine, 1980; Bauwens and Thoen, 1981; Braña, 1993). Esta tendencia hacia una termorregulación pasiva por parte de las hembras preñadas, tal vez pueda explicarse desde una perspectiva ecológica y otra fisiológica. Desde un punto de vista ecológico, las hembras preñadas son más vulnerables a la depredación debido a que su mayor masa corporal les impide escapar rápidamente en comparación con los machos (Huey, 1982). Por otro lado, desde el punto de vista fisiológico, la baja temperatura corporal de las hembras preñadas puede evitar una afección al desarrollo embrionario (Beuchat y Ellner, 1987; Smith y Ballinger, 1994b; Andrews et al., 1997). Sin embargo, una disminución en la temperatura corporal por parte de las hembras preñadas, puede afectar su crecimiento, reproducción y supervivencia a futuro (Beuchat y Ellner, 1987).
AGRADECIMIENTOS
Deseamos agradecer a los Drs. Vinicio Sosa Fernández y Gerardo C. Leynaud, así como a otro revisor anónimo los comentarios y sugerencias realizadas a la primera versión de este trabajo. La Dirección General de Vida Silvestre de la SEMARNAT nos concedió los permisos necesarios para la recolección de ejemplares dentro de la Delegación Venustiano Carranza. Un agradecimiento especial a los Drs. Patricia Dávila Aranda y Rafael Lira Saade de la FES Iztacala UNAM, quienes a través de la Unidad de Biología, Tecnología y Prototipos (UBIPRO), nos han apoyado y alentado para realizar éste y otros estudios.
LITERATURA CITADA
Adolph S. C. & W. P. Porter. 1993. Temperature, activity and lizard life-history. American Naturalist 142: 273-295. [ Links ]
Andrews R. M., F. R. Méndez de la Cruz, & M. Villagrán-Santa Cruz. 1997. Body temperatures of female Sceloporus grammicus: Thermal stress or impaired mobility? Copeia 1997: 108-115. [ Links ]
Anguilletta M. J. Jr., L. G. Montgomery & Y. L. Werner. 1999. Temperature preference in geckos: diel variation in juveniles and adults. Herpetologica 55: 212-222. [ Links ]
Anguilletta M. J. Jr., R. Scott Winters & A. E. Dunham. 2000. Thermal effects on the energetics of lizards embryos: Implications for hatchling phenotypes. Ecology 81: 2957-2968. [ Links ]
Ballinger R. E., K. R. Marion & O. J. Sexton. 1970. Thermal ecology of the lizard, Anolis limifrons, with comparative notes on three additional panamanian Anoles. Ecology 51: 246-254. [ Links ]
Bauwens D., P. E. Hertz & A. M. Castilla. 1996. Thermoregulation in a lacertid lizard: The relative contributions of distinct behavioral mechanisms. Ecology 77: 1818-1830. [ Links ]
Bauwens D. & C. Thoen. 1981. Escape tactics and vulnerability to predation associated with reproduction in the lizard Lacerta vivipara. Journal of Animal Ecology 50: 733-744. [ Links ]
Belliure J., L. M. Carrascal & J. A. Díaz. 1996. Covariation of thermal biology and foraging mode in two mediterranean lacertid lizard. Ecology 74: 1163-1173. [ Links ]
Benabib M. & J. D. Congdon. 1992. Metabolic and water-flux rates of free-ranging tropical lizards Sceloporus variabilis. Physiological Zoology 65: 788-802. [ Links ]
Beuchat C. A. 1986. Reproductive influences on thermoregulatory behavior of a live-bearing lizard. Copeia 1986: 971-979. [ Links ]
---------- 1988.Temperature effects during gestation in a viviparous lizard. Journal of Thermal Biology 13: 135-142. [ Links ]
Beuchat C. A. & S. Ellner. 1987. A quantitative test of life history theory: Thermoregulation by a viviparous lizard. Ecological Monographs 51: 45-68. [ Links ]
Bogert C. M. 1949a. Thermoregulation and critic body temperatures in Mexican lizards of the genus Sceloporus. Anales del Instituto de Biología UNAM 20: 415-426. [ Links ]
---------- 1949b. Thermoregulation in reptiles, a factor in evolution. Evolution 3: 195-211. [ Links ]
Braña F. 1993. Shift in body temperatures and escape behavior of female Podarcis muralis during pregnancy. Oikos 66: 216-222. [ Links ]
Brown R. P. 1996. Thermal biology of the gecko Tarentola boettgeri: comparisons among populations from different elevations within Gran Canaria. Herpetologica 52: 396-405. [ Links ]
Carrascal L. M. & J. A. Díaz. 1989. Thermal ecology and spatio-temporal distribution of the Mediterranean lizard Psammodromus algirus. Holarctic Ecology 12: 137-143. [ Links ]
Cowles R. B. & C. M. Bogert. 1944. A preliminary study of termal requirements of desert reptiles. Bulletin of the American Museum of Natural History 83: 261-296. [ Links ]
Daut E. F. & R. M. Andrews. 1993. The effect of pregnancy on thermoregulatory behavior of the viviparous lizard Chalcides ocellatus. Journal of Herpetology 27: 6-13. [ Links ]
Dias E. J. R. & C. F. D. Rocha. 2004. Thermal ecology, activity patterns, and microhabitat use by two sympatric whiptail lizards (Cnemidophorus abaetensis and Cnemidophorus ocellifer) from northeastern Brazil. Journal of Herpetology 38: 586-588. [ Links ]
Dreisig H. 1984. Control of body temperature in shuttling ectotherms. Journal of Thermal Biology 9: 229-233. [ Links ]
Dunham A. E., B. W. Grant & K. L. Overall. 1989. Interfaces between biophysical and physiological ecology and the population ecology of terrestrial vertebrate ecthoterms. Physiological Zoology 62: 335-355. [ Links ]
Dzialowski E. & M. P. O'Connor. 2001. Thermal time constant estimation in warming and cooling ectotherms Journal of Thermal Biology 26: 231-245. [ Links ]
Garland T. Jr., R. B. Huey & A. F. Bennett. 1991. Phylogeny and coadaptation of thermal physiology in lizards: A reanalysis. Evolution 45: 1969-1975. [ Links ]
Garrick L. D. 1974. Reproductive influences on behavioral thermoregulation in the lizard, Sceloporus cyanogenys. Physiological Behavioral 12: 85-91. [ Links ]
Gillis R. 1991. Thermal biology of two populations of red-chinned lizards (Sceloporus undulatus erytrocheilus) living in different habitats in southcentral Colorado. Journal of Herpetology 25: 18-23. [ Links ]
Grant B. W. & A. E. Dunham. 1988. Thermally imposed time constraints on the activity of the desert lizard Sceloporus merriami. Ecology 69: 167-176. [ Links ]
---------- 1990. Elevational covariation in environmental constraints and life histories of the desert lizard Sceloporus merriami. Ecology 71: 1765-1776. [ Links ]
Grenot C. J., L. Garcin, J. Dao, J. P. Hérold, B. Fahys & T. Pages. 2000. How does the European common lizard, Lacerta vivipara, survive the cold of winter? Comparative Biochemistry and Physiology Part A 127: 71-80. [ Links ]
Harvey P. H. & M. D. Pagel. 1991. The comparative method in evolutionary biology. Oxford University Press, New York, E.E.U.U. [ Links ]
Hertz P. E. 1981. Adaptation to altitude in two West Island anoles (Reptilia : Igunidae): Field thermal biology and physiological ecology. Journal of Zoology 195: 25-37. [ Links ]
---------- 1992. Evaluating thermal resource partitioning by sympatric lizards Anolis cooki and A. cristatellus: A field test using null hypoteses. Oecología 90 : 127-136. [ Links ]
Hertz P. E. & R. B. Huey. 1981. Compensation for altitudinal changes in the thermal environment by some Anolis lizard on Hispaniola. Ecology 62: 515-521. [ Links ]
Huey R. B. 1974. Behavioral thermoregulation in lizards: Importance of associated costs. Science 184: 1001-1003. [ Links ]
---------- 1982. Temperature, physiology, and the ecology of reptiles. Pp. 25-91. In C. Gans and F. H. Pough (Eds). Biology of reptilia. Vol. 12. Academic Press, London, UK. [ Links ]
Huey R. B. & A. F. Bennett. 1987. Phylogenetic studies of coadaptation: Preferred temperatures versus optimal performance temperatures of lizards. Evolution 41: 1098-1115. [ Links ]
Huey R. B. & E. R. Pianka. 1977. Seasonal variation in thermoregulatory behavior and body temperature of diurnal Kalahari lizards. Ecology 58: 1066-1075. [ Links ]
Huey R. B. & M. Slatkin. 1976. Costs and benefits of lizard thermoregulation. Quarterly Review of Biology 51: 363-384. [ Links ]
Kerr G. D. & C. M. Bull. 2004. Microhabitat use by the scincid lizard Tiliqua rugosa: Exploiting natural temperature gradients beneath plant canopies. Journal of Herpetology 38: 536-545. [ Links ]
Lemos-Espinal J. A. & R. E. Ballinger. 1995. Comparative thermal ecology of the high altitude lizard Sceloporus grammicus on the eastern slope of the Iztaccihuatl Volcano, Puebla, Mexico. Canadian Journal of Zoology 73: 2184-2191. [ Links ]
Lemos-Espinal J. A., R. E. Ballinger & J. M. Javelly-Gurría. 1993. Observations on the sensitivity to high temperatures in two lizard species (Ameiva undulata and Sceloporus horridus) from Zacatepec, Morelos, Mexico. Bulletin of the Maryland Herpetological Society 29: 24-29. [ Links ]
Lemos-Espinal J. A., R. E. Ballinger., S. Sanoja-Sarabia & Gl R. Smith. 1997a. Thermal ecology of the lizard Sceloporus mucronatus mucronatus in Sierra del Ajusco, Mexico. Southwestern Naturalist 42: 344-347. [ Links ]
Lemos-Espinal J. A., G. R. Smith & R. E. Ballinger. 1997b. Thermal ecology of the lizard, Sceloporus gadoviae, in an arid tropical scrub forest. Journal of Arid Environments 35: 311-319. [ Links ]
---------- 1997c. Temperature relationship of the lizard, Barisia imbricata, from Mexico. Amphibia-Reptilia 19: 95-99. [ Links ]
---------- 1998. Thermal ecology of the crevice-dwelling lizard, Xenosaurus newmanorum. Journal of Herpetology 32: 141-144. [ Links ]
Marquet P. A., J. C. Ortiz, F. Bosinoviæ & F. M. Jasiæ. 1989. Ecological aspects of thermoregulation at high altitudes: the case of Andean Liolaemus lizards in northern Chile. Oecologia 81: 16-20. [ Links ]
O'Connor M. P. 1999. Physiological and ecological implications of a simple model of heating and cooling in reptiles. Journal of Thermal Biology 24: 113-136. [ Links ]
Ortega-Rubio A., R. Rodríguez, L. Hernández & R. Barbault. 1984. Cycles journaliers d'Activité chez deux espèces sympatriques de Sceloporus (Iguanidae) S. grammicus et S. scalaris. Amphibia-Reptilia 5: 347-354. [ Links ]
Patterson J. W. & P. M. C. Davies. 1978. Preferred body temperatures: seasonal and sexual differences in the lizard Lacerta vivipara. Journal of Thermal Biology 3: 39-41. [ Links ]
Pough F. H., R. M. Andrews, J. E. Cadle, M. L. Crump, A. H. Savitzky & K. D. Wells. 2001. Herpetology. Segunda edición. Prentice Hall, New Jersey, E.E.U.U. [ Links ]
Rock J., R. M. Andrews & A. Cree. 2000. Effects of reproductive condition, season, and site on selected temperatures of a viviparous gecko. Physiological and Biochemical Zoology 73: 344-355. [ Links ]
Rzedowski J. 1988. Vegetación de México. Ed. Limusa. México D.F., México. [ Links ]
Schwarzkopf L. & R. Shine. 1991. Thermal biology of reproduction in viviparous skinks, Eulamprus tympanum: why do gravid females bask more? Oecologia 88: 562-569. [ Links ]
Shine R. 1980. «Costs» of reproduction in reptiles. Oecologia 46: 92-100. [ Links ]
Sinervo B. 1990. Evolution of thermal physiology and growth rate between populations of the western fence lizard (Sceloporus occidentalis). Oecologia 83: 228-237. [ Links ]
Sinervo B. & S. C. Adolph. 1989. Thermal sensitivity of growth rate in hatchling Sceloporus lizards: environmental, behavioral and genetic aspect. Oecologia 78: 411-419. [ Links ]
---------- 1994. Growth plasticity and thermal opportunity in Sceloporus lizard. Ecology 75: 776-790. [ Links ]
Smith G. R. & R. E. Ballinger. 1994a. Temperature relationships in the high-altitude viviparous lizard, Sceloporus jarrovi. American Midland Naturalist 131: 181-189. [ Links ]
---------- 1994b. Thermal ecology of Sceloporus virgatus from southeastern Arizona, with comparison to Urosaurus ornatus. Journal of Herpetology 28: 65-69. [ Links ]
---------- 1995. Temperature relationships of the tree lizard, Urosaurus ornatus, from desert and low elevation montane population in the southwestern USA. Journal of Herpetology 29: 126-129. [ Links ]
Smith G. R., R. E. Ballinger & J. D. Congdon. 1993. Thermal ecology of the high-altitude bunch grass lizard, Sceloporus scalaris. Candian Journal of Zoology 71: 2152-2155. [ Links ]
Stearns S. C. 1976. Life history tactics: A review of the ideas. Quarterly Review of Biology 51: 3-47. [ Links ]
---------- 1992. The evolution of life histories. Oxford University Press, New York, E.E.U.U. [ Links ]
Stevenson R. D. 1985a. The relative importance of behavioral and physiological adjustments controlling for body temperature in terrestrial ectotherms. American Naturalist 126: 362-386. [ Links ]
---------- 1985b. Body size and limits to the daily range of body temperature in terrestrial ectotherms. American Naturalist 125: 102-117. [ Links ]
Stewart J. R. 1984. Thermal biology of the live bearing lizard Gerrhonotus coerulus. Herpetologica 40: 349-355. [ Links ]
Tosini G. & R. Avery. 1996. Pregnancy decreases set point temperatures for behavioral thermoregulation in the wall lizard Podarcis muralis. Herpetological Journal 6: 94-96. [ Links ]
Van Damme R., D. Baywens & R.F. Verheyen. 1987. Thermoregulatory responses to environmental seasonality by the lizard Lacerta vivipara. Herpetologica 43: 405-415. [ Links ]
Vrcibradic D. & C. F. D. Rocha. 2004. Field body temperatures of pregnant and nonpregnant females of three species of viviparous skinks (Mabuya) from southeastern Brazil. Journal of Herpetology 38: 447-451. [ Links ]
Waldschmidt S. & C. R. Tracy. 1983. Interactions between a lizard and its thermal environment: implications for sprint performance and space utilization in the lizard Uta stansburiana. Ecology 64: 476-484. [ Links ]
Woolrich-Piña G. A., J. E. González-Espinoza, J. A. Lemos-Espinal & A. Ramírez-Bautista. 1999. Ecología térmica de una población de la lagartija Sceloporus gadoviae (Lacertilia:Phrynosomatidae) que habita en Zapotitlán de las Salinas, Puebla, México. Pp. 121. In: Memorias del XV Congreso Nacional de Zoología, realizado en Tepic, Nayarit. [ Links ]
Woolrich-Piña G. A., J. A. Lemos-Espinal, L. Oliver López, J. E. González-Espinoza & F. Correa Sánchez. 2003. Diferencias y similitudes en la termorregulación de dos lagartijas de pared, Sceloporus gadoviae (Phrynosomatidae) y Phyllodactylus bordai (Gekkonidae) que habitan en el Valle de Zapotitlán Salinas, Puebla, México. Pp. 8. In: Memorias del XVII Congreso Nacional de Zoología, realizado en Puebla, Puebla. [ Links ]
Zug Gl R., L. J. Vitt & J. P. Caldwell. 2001. Herpetology: An introductory biology on amphibians and reptiles. Segunda edición. Academic Press, San Diego, California, E.E.U.U. [ Links ]














