Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta zoológica mexicana
versión On-line ISSN 2448-8445versión impresa ISSN 0065-1737
Acta Zool. Mex vol.20 no.3 Xalapa dic. 2004
Ciclo reproductor de Uta stejnegeri Schmidt 1921 (Sauria: Phrynosomatidae) en dunas del Bolsón de Mapimí, Durango, México
Héctor Gadsden1, Fausto R. Méndez-de la Cruz2 y Rosalina Gil-Martínez1
1 Instituto de Ecología, A. C., Centro Regional Chihuahua. Km. 33.3 Carretera Chihuahua-Ojinaga, Cd. Aldama, 32900, Chihuahua. MÉXICO. gadsden@sequia.edu.mx.
2 Departamento de Zoología, Instituto de Biología, UNAM, Ciudad Universitaria Apdo. Postal 70 - 153, 04510, México, D. F. MÉXICO. faustor@ibiologia.unam.mx.
Recibido: 16 de febrero 2004
Aceptado: 25 de agosto 2004
RESUMEN
Se determinó el ciclo reproductor de Uta stejnegeri Schmidt 1921 (antes Uta stansburiana stejnegeri Schmidt 1921) utilizando datos obtenidos de individuos capturados en el campo en la Reserva de Biosfera de Mapimí, Durango, México. Durante 1990 se colectaron mensualmente muestras de esta especie en dunas de arena. Los machos alcanzaron la madurez sexual a los 45.0 mm de longitud hocico-cloaca (LHC), y las hembras alcanzaron la madurez sexual a los 40.0 mm LHC. El ciclo reproductor de ambos sexos fue sincrónico. La variación significativa en peso testicular fue determinada por ANCOVA y los machos alcanzaron su máximo peso testicular entre diciembre y febrero. Los testículos comenzaron a decrecer en julio, alcanzando su peso mínimo en septiembre. Para las hembras se registró el porcentaje mensual de folículos sin vitelo, folículos con vitelo, y de huevos en oviductos. Los primeros folículos agrandados y con vitelo se observaron a la mitad de enero en las hembras. Estas mostraron una presencia bimodal de huevos en oviductos entre febrero y mayo y en julio. La media del tamaño de puesta basada sobre el conteo de los huevos en los oviductos fue de 2.8 ± 1.1. El tamaño de puesta estuvo correlacionado positivamente con el tamaño del cuerpo de las hembras. La mayoría de la precipitación pluvial anual ocurre durante el verano, y se propone que la producción de crías está sincronizada con la mejor estación para promover el crecimiento y supervivencia de los jóvenes. Encontramos similitudes entre este ciclo reproductor y aquellos reportados previamente para U. stansburiana de los Estados Unidos.
Palabras Clave: Desierto Chihuahuense, Reserva de Biosfera de Mapimí, reproducción, Uta, dunas.
ABSTRACT
The reproductive cycle of the lizard Uta stejnegeri Schmidt 1921 (previously Uta stansburiana stejnegeri Schmidt 1921) was determined using data obtained from field caught individuals at the Biosphere Reserve of Mapimí, Durango, México. During 1990 monthly samples of this species were collected from sand dunes. Males reached sexual maturity at 45.0 mm snouth-vent length (SVL); females reached sexual maturity at 40.0 mm SVL. The reproductive cycles of both sexes were synchronous. Significant variation in testes mass was determinated by ANCOVA and males reached maximal testes mass between December-February; testes began to decrease in July, reaching minimum mass in September. The monthly percentage of non-vitellogenic follicles, vitellogenic follicles and oviductal eggs was recorded for females. Enlarged vitellogenic follicles first appeared during mid-January in females. These showed bimodal presence of eggs in oviducts between February and May and in July. Mean clutch size based on oviductal eggs counts was 2.8 ± 1.1. Clutch size was positively correlated with female body size. Most of the annual rainfall ocurrs during summer, and we suggest that offspring production is timed to the best season to promote juvenile growth and survivorship. We found similarities between this reproductive cycle and those previously reported for U. stansburiana from the United States.
Key Words: Chihuahuan Desert, Biosphere Reserve of Mapimí, reproduction, Uta, dunes.
INTRODUCCIÓN
Existen estudios de la biología reproductora de varias poblaciones de Uta stansburiana de los Estados Unidos (Tinkle 1961, Hahn 1964, Asplund & Lowe 1964, Cuellar 1966, Tinkle 1967, Nussbaum & Diller 1976, Fitch 1981, Nussbaum 1981, Worthington 1982, Fitch 1985). Sin embargo, no se conoce información sobre la reproducción en poblaciones de este complejo de lagartijas en el Desierto Chihuahuense en México. En el oeste de los Estados Unidos Nussbaum & Diller (1976) y Fitch (1981, 1985) han estudiado en U. stansburiana algunas tendencias reproductoras latitudinales como el número de nidadas. Estos autores detectaron que las hembras de esta especie que habitan poblaciones del norte tienen una nidada al año, mientras que las hembras de poblaciones meridionales con climas más cálidos tienen normalmente tres nidadas. De manera que es adecuado ampliar al Altiplano Mexicano los estudios de reproducción de este grupo de lagartijas para incrementar esta clase de información que contribuya a aclarar esas tendencias reproductoras latitudinales.
El ciclo reproductor de Uta stansburiana stejnegeri fue estudiado con mayor énfasis en las hembras en el oeste de Texas por Tinkle (1961). Este autor encontró hembras con folículos vitelogénicos y huevos en oviductos desde el inicio de la primavera hasta julio. En agosto los ovarios se tornaron quiescentes o al menos no mostraron evidencia de vitelogénesis. En el caso de los machos, el mayor tamaño testicular se observó en febrero y la regresión testicular se completó a mediados de agosto.
En el sureste de Arizona Uta stansburiana y Urosaurus ornatus son las únicas lagartijas de desierto que están activas durante cada mes del año (Asplund & Lowe 1964). En días cálidos durante el invierno, los individuos de ambas especies pueden ser observados en actividad y una verdadera hibernación es virtualmente inexistente en Uta. También se ha observado que U. stansburiana presenta su máximo desarrollo testicular en invierno (Asplund & Lowe 1964, Hahn 1964, Tinkle 1967). Sin embargo, son necesarios un mayor número de estudios de reproducción en otras poblaciones de estas especies, para contar con más información de este tipo para poner a prueba las predicciones en torno a las estrategias de su historia de vida (Tinkle 1969, Congdon et al. 1982, Stearns 1977, Stearns 1992).
El objetivo de este estudio fue determinar el ciclo reproductor de machos y hembras de Uta stejnegeri (antes U. stansburiana stejnegeri) en el centro del Desierto Chihuahuense y comparar algunas de sus características con las de los ciclos reproductores de otras poblaciones de U. stansburiana de los Estados Unidos.
MATERIALES Y MÉTODOS
Se estudió una población de Uta stejnegeri (ver Upton & Murphy 1997) en la zona de dunas de arena en la Reserva de la Biosfera de Mapimí en Chihuahua, México (26° 50'N, 103° 49'W) a 1250 m de altitud. La vegetación dominante en las dunas está compuesta por: Dalea scoparia, Acacia greggii, Yucca elata, Acacia constricta, Lycium berlandieri y Larrea tridentata (Montaña & Breimer 1988). La temperatura media anual es de 20.8°C y el promedio de la precipitación total anual es de 230 mm, con un promedio de precipitación total mensual de 23 mm, pero según Delhoume (1991) existe una fuerte irregularidad interanual y espacial de la distribución de la lluvia en el Desierto Chihuahuense (Fig. 1).
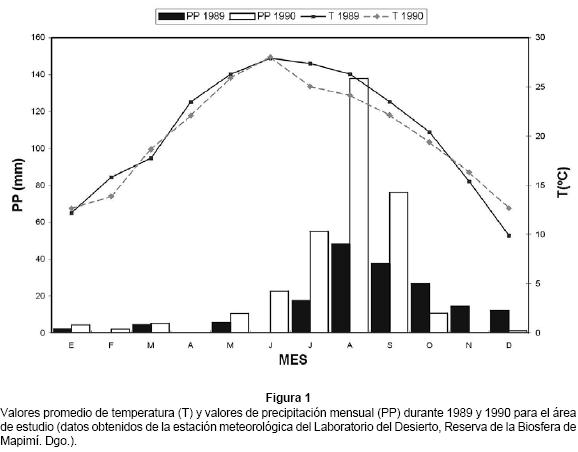
Para determinar el ciclo reproductor, se capturaron individuos adultos mensualmente durante 1990. Cada individuo se sacrificó en el laboratorio por hipotermia y se disecó dentro de las primeras 24 horas después de la captura. Antes de la disección se registraron las medidas estándar de la longitud hocico-cloaca (LHC) con una regla y el peso del cuerpo a 0.2 g con una balanza Pesola.
Para la comparación del dimorfismo sexual entre el tamaño del cuerpo (LHC) de ambos sexos, se adicionaron los datos de otros individuos de la misma especie capturados con anterioridad en la misma zona de estudio (Gadsden-Esparza et al. 1995), de manera que se utilizaron en total datos de 271 individuos adultos (157 hembras y 114 machos).
En los machos se registró el peso testicular y la condición de enrollamiento del epidídimo (Méndez de la Cruz et al. 1988). El tamaño del macho más pequeño que presentó testículos agrandados y epidídimos ensanchados y enrollados (típicamente asociados con producción de esperma) fue considerado el tamaño mínimo para alcanzar la madurez sexual (Goldberg & Lowe 1966, Vitt & Cooper 1985, Censky 1995).
Para determinar diferencias significativas en los cambios mensuales del peso testicular se aplicó un ANCOVA (Sokal & Rohlf 1981) seguido por una prueba de intervalos múltiples de Duncan (Bruning & Kitnz 1977). Se utilizó una P < 0.01 para indicar significancia. Se utilizó la media del peso testicular de ambos testículos para definir la temporada en que los machos adultos fueron reproductores, debido a que, de acuerdo con registros previos (Tinkle 1961, Tanner & Hopkin 1972, Estrada-Flores et al. 1990, Méndez-de la Cruz et al. 1994) existe una correlación directa entre el peso testicular y la condición de madurez reproductora del animal.
La actividad reproductora de las hembras se definió de acuerdo con Ramírez-Bautista et al. (1998) considerando el número de huevos en oviductos, largo y ancho de los huevos (al 0.1 mm más cercano con un calibrador vernier), número de folículos ováricos con vitelo y número de folículos ováricos sin vitelo. Se consideró el porcentaje mensual de hembras en cada categoría reproductora a lo largo del año. La LHC de la hembra más pequeña con presencia de folículos vitelogénicos o huevos en oviductos fue utilizada para estimar el tamaño corporal mínimo de madurez sexual (Vitt & Cooper 1985, Censky 1995).
El número de huevos por nido fue comparado con el tamaño del cuerpo de la hembra utilizando el coeficiente de correlación producto momento de Pearson. Se utilizó una P = 0.05 para indicar significancia. Se probó la correlación entre la LHC de las hembras con huevos en oviductos y con folículos vitelogénicos (hembras gestantes), en función de los meses del año en los que las hembras presentaron esas características reproductoras.
RESULTADOS
Los machos adultos fueron significativamente más grandes que las hembras adultas (t= 12.5, g.l.= 269, p<0.05). La media de LHC de las hembras (n= 157) fue de 44.9 ± 3.2 mm (intervalo: 41-54 mm), y la de los machos (n= 114 ) fue de 49.9 ± 3.2 mm (intervalo: 45-56 mm).
Vitt (1977) registró una media mayor de LHC (47.7 ± 1.2 mm) para hembras adultas de U. stansburiana stejnegeri en las muestras del suroeste de los Estados Unidos, que la obtenida para hembras de U. stejnegeri en este estudio. Sin embargo, habría que demostrar si esas diferencias son significativas.
El peso de los testículos de Uta stejnegeri varió considerablemente durante el año. Al inicio de la estación reproductora, de noviembre a enero, los testículos aumentaron significativamente de peso, en cambio en la estación no reproductora, de agosto a octubre, los testículos fueron relativamente menos pesados y transparentes. El macho más pequeño con testículos agrandados y epidídimos ensanchados y sumamente enrollados midió 45 mm de LHC, por consiguiente todos los machos = 45 mm (LHC) eran adultos. La figura 2 muestra la variación que ocurrió en el peso testicular de los individuos adultos durante el año; se observa que presentaron un periodo de actividad reproductora estacional que abarcó invierno y primavera. De diciembre a febrero se encontró la máxima actividad reproductora, los machos tuvieron el mayor peso testicular promedio, seguida de una disminución del peso gonadal entre abril y julio, y la reactivación gonadal ocurrió de octubre a enero (ANCOVA; F10,48= 6.13, P<0.0001) .

El ciclo reproductor de ambos sexos fue sincrónico y similar a los ciclos reproductores de otras especies de lagartijas, que también presentan en invierno su máximo desarrollo testicular.
La hembra más pequeña con huevos en oviductos se encontró en julio y midió 40 mm de LHC por lo que se consideró que de este tamaño o mayores eran hembras adultas reproductoras. La media de tamaño de los huevos elipsoidales y blanquecinos (n= 45) fue de 8.4 ± 2.0 mm de largo x 5.9 ± 0.8 mm de ancho.
La media de la longitud y el ancho de los huevos en U. stansburiana registrado por Vitt (1977) fue más grande en el suroeste de los Estados Unidos que el encontrado por nosotros en el Bolsón de Mapimí para U. stejnegeri, no obstante desconocemos si las diferencias detectadas son significativas. Así mismo, el tamaño de los huevos, y el tamaño y la frecuencia de la nidada, son adaptaciones que estarían sometidas a selección natural, de manera que varían tanto internamente en una población como entre poblaciones distintas (Tinkle 1969, Tinkle et al. 1970).
Las hembras presentaron dos picos de actividad reproductora con huevos en oviductos (Fig. 3): el primero de febrero a mayo y el segundo en julio. En febrero y mayo el 71 % (n= 7) y 50 % (n= 8) de las hembras presentaron huevos en oviductos. Sumando el número de huevos presentes en los dos oviductos, en febrero las hembras presentaron una media de 3.6 ± 0.5 huevos (3-4 huevos) y las hembras de mayo 1.2 ± 0.4 huevos (1-2 huevos). Posteriormente, de agosto a diciembre ninguna hembra tuvo folículos vitelogénicos y en enero se detectaron las primeras hembras (20 %) con presencia de folículos con vitelo.

De febrero a julio fue más frecuente encontrar hembras con tres y cuatro huevos en oviductos (37.5% (n= 6) y 31.25% (n= 5), respectivamente) que hembras con uno o dos huevos en oviductos (18.75% (n= 3) y 12.5% (n= 2), respectivamente). La variación observada en 16 puestas fue de 2.8 ± 1.1 huevos por nido (1-4 huevos por nido). El tamaño de la nidada de esta especie presentó una correlación positiva con la LHC (r= 0.62, g.l.=15, P=0.01) (Fig. 4), de modo que las hembras más grandes presentaron un mayor número de huevos en oviductos como se ha registrado en otras lagartijas.

Según Fitch (1985), el tamaño del cuerpo en U. stansburiana en las hembras no presenta una tendencia latitudinal definida. No obstante, en donde el tamaño del cuerpo es más grande que el usual, como en el sur de Arizona y noroeste de Utah, el tamaño de la nidada también es relativamente mayor.
Debido a la presencia de hembras con folículos vitelogénicos desde enero y con huevos en oviductos desde febrero, es probable que el cortejo y la cópula se hayan llevado a cabo a fines de otoño, y prolongado hasta la primavera.
La LHC de las hembras gestantes presentó una correlación negativa con los meses del ciclo reproductor (r=- 0.44, g.l.=29, P=0.02) (Fig. 5). De acuerdo con la curva de crecimiento de la LHC de las hembras de U. stansburiana obtenida en la misma zona de estudio (Gadsden et al. 1995), las hembras gestantes en febrero y marzo podrían llegar a tener dos o tres nidadas durante la época reproductora y las de junio y julio sólo una. Estas últimas estarían inmaduras para reproducirse al inicio del ciclo reproductor y alcanzarían a tener solamente una nidada al final de la estación reproductora, durante la cual obtendrían la madurez sexual.

Los individuos de la nueva generación de U. stejnegeri empiezan a eclosionar desde mayo y terminan durante octubre; coincidiendo con la época de mayor precipitación pluvial en verano, una temperatura media de 24°C (Fig.1) y la mayor diversidad de artrópodos disponibles para ser consumidos por esta especie de lagartija. Particularmente, la producción de los individuos jóvenes en esta época está sincronizada con la mejor estación del año para promover su crecimiento y supervivencia.
DISCUSIÓN
El dimorfismo sexual se ha detectado en otros estudios de U. stansburiana en el oeste de los Estados Unidos y en varias islas del Golfo de California (Parker & Pianka 1975, Nussbaum & Diller 1976, Dunham et al. 1978). En general esta tendencia hacia el dimorfismo está ampliamente extendida en lagartijas (Fitch 1981, Stamps 1983, Shine 1989). En la población de U. stejnegeri estudiada los machos adultos son más grande que las hembras adultas.
El ciclo reproductor de los machos de U. stejnegeri es comparable con los ciclos reproductores de otras especies de lagartijas, como Sceloporus undulatus (Atland 1941) y Uma paraphvgas (Gadsden et al. 1993) que también presentaron en invierno su máximo desarrollo testicular. A principios del verano, los testículos de U. stejnegeri, presentaron una reducción significativa de tamaño, y posteriormente mostraron en noviembre un crecimiento significativo. El crecimiento testicular máximo observado en esta especie del Bolsón de Mapimí durante el invierno, fue muy similar al registrado en otras poblaciones de U. stansburiana stejnegeri en Texas (Tinkle 1961, Hahn 1964) y en Arizona (Asplund & Lowe 1964). Siguiendo el criterio de Asplund & Lowe (1964), la similitud tan marcada entre el ciclo reproductor de la población estudiada de U. stejnegeri con respecto al de otras poblaciones de U. stansburiana en diversas localidades de los Estados Unidos, puede estar relacionada con una historia evolutiva macroclimática muy similar.
Es probable que el cortejo y la cópula en U. stejnegeri se hayan iniciado desde noviembre debido al incremento significativo del tamaño testicular de los machos en noviembre y diciembre. De acuerdo con Cuellar (1966) el esperma de U. stansburiana puede permanecer funcional en las hembras al menos 81 días en los receptáculos seminales; de tal forma que muchas hembras pueden depender del almacenamiento de esperma en los oviductos para la fertilización retardada. De esta forma es probable que aunque las hembras de U. stejnegeri no hayan presentado actividad folicular vitelogénica en esos meses, pudieron haber almacenado esperma funcional después de la cópula para la fertilización posterior en enero y febrero, cuando se observaron las primeras hembras con folículos vitelogénicos y con huevos en oviductos respectivamente.
El tamaño de la nidada de las hembras en el Bolsón de Mapimí presentó una correlación positiva con la LHC como ha sido encontrado en varios lacertilios. Así mismo, las hembras de mayor tamaño podrían llegar a tener dos o tres puestas durante la época reproductora, asociada con una estación de crecimiento más larga y un clima más cálido que en el norte de Oregon y noroeste de Utah, en donde Fitch (1985) registró que U. satnsburiana puede producir solamente una nidada anualmente.
Fitch (1985) encontró que el promedio de número de huevos por nidada para U. stansburiana fue de 3.5, variando de 2.8 a 4.3 en muestras de distintas localidades pero sin existir una tendencia geográfica definida. Por ejemplo, dos de las muestras de Uta stansburiana stejnegeri referidas por este autor presentaron un promedio de 3.1 (sur de Nuevo México) y 3.9 (oeste de Texas) huevos/nidada respectivamente, mientras que nosotros encontramos un promedio de 2.8 huevos/nidada, coincidiendo con lo registrado para dos muestras en la distribución norteña (sureste de Oregon y noroeste de Nevada) de U. stansburiana, que presentaron también un promedio de 2.8 huevos/nidada. Sin embargo, esta coincidencia en cuanto al promedio del número de huevos por nidada en esas poblaciones, puede deberse a la variabilidad interanual y espacial de la distribución de la lluvia y la temperatura detectada tanto en el Desierto Chihuahuense (desierto caliente) como en el Desierto de la Gran Cuenca (desierto frío) en donde se localizan estas lagartijas y que puede afectar las características reproductoras de las mismas (Whitford & Creusere 1977, Worthington 1982, Delhoume 1991, Cuellar 1993). Por ejemplo, en una población de Uta stansburiana stejnegeri localizada en el sur de Nuevo México, en el Desierto Chihuahuense, Worthington (1982) encontró un tamaño promedio de nidada de 2.5 huevos en un año seco y un promedio de 3.8 huevos por nidada en un año húmedo.
La actividad reproductora invernal de U. stejnegeri en el Bolsón de Mapimí, posiblemente favorece la mayor sobrevivencia de los individuos debido a la escasa actividad de algunos de sus principales depredadores en esta estación. Por ejemplo, Grenot et al. (1978) mencionan que el ave Geococcyx californianus es uno de los principales depredadores de lagartijas en esa misma área y presenta menor actividad en invierno. Así mismo, durante el invierno de 1990, la población estudiada de U. stejnegeri se alimentó principalmente de formícidos, coleópteros, isópteros y hemípteros (Palacios-Orona & Gadsden-Esparza 1995). Estos factores podrían incrementar el potencial reproductor de esta lagartija en invierno, cuando la mayor parte de otras especies de lacertilios potencialmente competidoras que habitan en el Bolsón de Mapimí, reducen su capacidad metabólica y fisiológica al estar hibernando. Esto último también fue propuesto por Gadsden et al. (1993) para los individuos jóvenes de la lagartija de arena Uma paraphygas en el mismo tipo de hábitat y área de estudio. Sin embargo, Asplund & Lowe (1964) encontraron en Arizona que U. stansburiana presenta una actividad invernal muy variable de un año a otro dependiendo de la severidad del clima, lo cual probablemente sea similar en U. stejnegeri.
AGRADECIMIENTOS
Damos las gracias a la familia Herrera del Ejido la Flor por su ayuda en el trabajo de campo. Asimismo, agradecemos a Orlando Cuellar por sus sugerencias al manuscrito. Y a las sugerencias tanto del Editor Asociado Gustavo Aguirre León como de los árbitros anónimos. También al CONACYT (1367-N9206) el haber apoyado este estudio. Esta es una contribución al programa MAB-UNESCO de Reservas de Biosfera.
LITERATURA CITADA
Asplund, K. K. & C.H. Lowe. 1964. Reproductive cycles of the iguanid lizards Urosaurus ornatus and Uta stansburiana in Southeastern Arizona. J. Morph. 115: 27-34. [ Links ]
Atland, P. D. 1941. Annual reproductive cycle of the male fence lizard. J. Elisha Mitchel Sci. Soc. 57: 73-83. [ Links ]
Bruning, J. L. & B. Kintz. 1977. Computational handbook of statistics. 2nd Ed. Scott Foresman and Co., Glenview, Illinois. [ Links ]
Censky, E. J. 1995. Reproduction in two Lesser Antillean populations of Ameiva plei (Teiidae). J. Herpetol. 29: 553-560. [ Links ]
Congdon, J. D., A. E. Dunham & D. W. Tinkle. 1982. Energy budgets and life history of reptiles. Pp. 233-271. In: C. Gans and H.F. Pough (Eds.). Biology of the Reptilia. Vol 13. Academic Press. London. [ Links ]
Cuellar, 0. 1966. Delayed fertilization in the lizard Uta stansburiana. Copeia 1966: 549-552. [ Links ]
----------. 1993. Lizard population ecology: a long term community study. Bull. Ecol. 24: 109-149. [ Links ]
Delhoume, J-P. 1991. Una zona árida del norte de México: limitaciones para el desarrollo de la ganadería extensiva. Trace 19: 59-65. [ Links ]
Dunham, A. E., D. W. Tinkle & J. W. Gibbons. 1978. Body size in island lizards: a cautionary tale. Ecology 59: 1230-1238. [ Links ]
Estrada-Flores, E., M. Villagran-Santa Cruz, F. R. Méndez-de la Cruz & G. Casas-Andreu. 1990. Gonadal changes throughout the reproductive cycle of the viviparous lizard Sceloporus mucronatus (Sauria: Iguanidae). Herpetologica 46: 43-50. [ Links ]
Fitch, H. S. 1981. Sexual size differences in reptiles. Univ. Kansas Mus. Nat. Hist., Misc. Pub. 70:1-72. [ Links ]
----------. 1985. Variation in clutch and litter size in new world reptiles. Univ. Kansas Mus. Nat. Hist., Misc. Pub. 76: 1-76. [ Links ]
Gadsden-Esparza, H., G. Aguirre-León, G. Guerra-Mayaudón & L. E. Palacios-Orona. 1995. Ecología de gremios parapátricos de lagartijas en dunas del Bolsón de Mapimí. Informe Técnico Final, CONACYT (1367-N9206). México. 82 pp. [ Links ]
Gadsden-Esparza, H., F. R. Méndez-de la Cruz, R. Gil-Martínez & G. Casas-Andreu. 1993. Patrón reproductivo de una lagartija (Uma paraphygas) en peligro de extinción. Bol. Soc. Herpetol. Mex. 2: 42-50. [ Links ]
Goldberg, S. R. & C. H. Lowe. 1966. The reproductive cycle of the western whiptail (Cnemidophorus tigris) in southern Arizona. J. Morphol. 118: 543-548. [ Links ]
Grenot, C., R. Barbault & M. E. Maury. 1978. Contribution à la connaissance de l'herpetocenose du Bolsón de Mapimí (Désert de Chihuahua, Mexique). C. R. Soc. Biogéogr. 476: 67-84. [ Links ]
Hahn, W. E. 1964. Seasonal changes in testicular and epididymal histology and spermatogenic rate in the lizard Uta stansburiana stejnegeri. J. Morph. 115: 447-460. [ Links ]
Méndez-de la Cruz, F. R., L. J. Guillette, Jr., M. Villagran-Santa Cruz & G. Casas-Andreu. 1988. Reproductive and fat body cycles of the viviparous lizard, Sceloporus mucronatus (Sauria: Iguanidae). J. Herpetol. 22: 1-12. [ Links ]
Méndez-de la Cruz, F. R., M. Villagrán-Santa Cruz & O. Cuellar. 1994. Geographic variation of spermatogenesis in the mexican viviparous lizard Sceloporus mucronatus. Biogeographica 70: 59-67. [ Links ]
Montaña, C. & R. Breimer. 1988. Major vegetation and environment units. Pp. 99-114. In: C. Montaña (Ed.). Estudio integrado de los recursos vegetación, suelo y agua en la Reserva de Biosfera de Mapimí. I Ambiente natural y humano. Publicación 23, Instituto de Ecología, A. C., México, D.F. [ Links ]
Nussbaum, R. A. 1981. Seasonal shifts in clutch size and egg size in the side-blotched lizard, Uta stansburiana Baird and Girard. Oecologia 49: 8-13. [ Links ]
Nussbaum, R. A. & L. V. Diller. 1976. The life history of the side-blotched lizard, Uta stansburiana Baird and Girard, in north-central Oregon. Northwest Science 50: 243-260. [ Links ]
Palacios-Orona, L. E. & H. Gadsden-Esparza. 1995. Patrones alimentarios de Uta stansburiana stejnegeri (Sauria: Iguanidae) en dunas del Bolsón de Mapimí en Chihuahua, México. Ecología Austral 5: 1-9. [ Links ]
Parker, W. E S. & R. Pianka. 1975. Comparative ecology of populations of the lizard Uta stansburiana. Copeia 1975: 615-632 . [ Links ]
Ramírez-Bautista, A., J. Barba-Torres & L. J. Vitt. 1998. Reproductive cycle and brood size of Eumeces lynxe from Pinal de Amoles, Queretaro, México. J. Herpetol. 22: 18-24. [ Links ]
Shine, R. 1989. Ecological causes for the evolution of sexual dimorphism: a review of the evidence. Quart. Rev. Biol. 64: 419-461. [ Links ]
Sokal, R. R. & F. J. Rohlf. 1981. Biometry, the principles and practice of statistics of biological research. 2nd Ed. W.H. Freeman and Co., San Francisco. 859 pp. [ Links ]
Stamps, J. A. 1983. Sexual selection, sexual dimorphism, and territoriality. Pp. 169-204. In: R.B. Huey, E.R. Pianka & T.W. Schoener (Eds.). Lizard Ecology Studies of a Model Organism, Harvard University Press, Cambridge. [ Links ]
Stearns, S. C. 1977. The evolution of life history traits. Ann. Rev. Ecol. Syst. 8: 145-172. [ Links ]
----------. 1992. The evolution of life histories. Oxford University Press. 249 pp. [ Links ]
Tanner, W. W. & J. M. Hopkin. 1972. Ecology of Sceloporus occidentalis longipes Baird and Uta stansburiana stansburiana Baird and Girard on Rainer Mesa, Nevada test site Nye County, Nevada. Brigham Young Univ. Sci. Bull. 7: 1-31. [ Links ]
Tinkle, D. W. 1961. Population structure and reproduction in the lizard Uta stansburiana stejnegeri. Am. Midl. Nat. 66: 206-234. [ Links ]
----------. 1967. The life and demography of the side-blotched lizard, Uta stansburiana. Misc. Publ. Mus. Zool. Univ. Michigan 132: 1-182. [ Links ]
---------- . 1969. The concept of reproductive effort and its relation the evolution of life history in lizards. Am. Nat. 103: 501-516. [ Links ]
Tinkle, D. W., H.M. Wilbur & S.G. Tilley. 1970. Evolutionary strategies in lizard reproduction. Evolution 24: 55-74. [ Links ]
Upton, D. E. & R. W. Murphy. 1997. Phylogeny of the side-blotched lizards (Phrynosomatidae: Uta) based on mtDNA sequences: support for a midpeninsular seaway in Baja California. Mol. Philogenet. Evol. 8: 104-113. [ Links ]
Vitt, L. J. 1977. Observations on clutch and egg size and evidence for multiple clutches in some lizards of southwestern United States. Herpetologica 33: 333-338. [ Links ]
Vitt, L. J. & W. E. Cooper, Jr. 1985. The relationship between reproduction and lipid cycling in the skink Eumeces laticeps with comments on brooding ecology. Herpetologica 41: 419-432. [ Links ]
Whitford, W. G. & M. F. Creusere. 1977. Seasonal and yearly fluctuations in Chihuahuan Desert lizard communities. Herpetologica 33: 54-65. [ Links ]
Worthington, R. D. 1982. Dry and wet year comparisons of clutch and adult body sizes of Uta stansburiana stejnegeri. J. Herpetol. 16: 332-334. [ Links ]














