Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta zoológica mexicana
versión On-line ISSN 2448-8445versión impresa ISSN 0065-1737
Acta Zool. Mex vol.20 no.3 Xalapa dic. 2004
Descripción de los estados inmaduros de tres especies de Anomala, Ancognatha y Ligyrus (Coleoptera: Melolonthidae: Rutelinae y Dynastinae) con observaciones de su biología
Concepción Ramírez-Salinas1, Miguel Ángel Morón2 y Adriana E. Castro-Ramírez1
1 Departamento de Agroecología, Área Sistemas de Producción Alternativos, El Colegio de la Frontera Sur (ECOSUR). Apartado Postal 63, 29200 San Cristóbal de Las Casas, Chiapas, MÉXICO.
2 Departamento de Entomología, Instituto de Ecología, A. C. Apartado Postal 63 Xalapa, Veracruz 91000, MÉXICO.
Recibido: 28 de mayo 2004
Aceptado: 13 de agosto 2004
RESUMEN
Se describen las larvas de tercer estadio de Anomala inconstans Burmeister, Ancongnatha sellata Arrow y Ligyrus (Ligyrodes) sallei Bates, con base en 35 larvas procedentes de suelo con cultivo de maíz, composta doméstica, hojarasca de bosque y estiércol de borrego en las montañas del norte de Chiapas, y de composta de pulpa de café en las montañas del centro de Veracruz, México. También se describen las pupas de A. sellata y L. (L.) sallei obtenidas durante el desarrollo de las larvas en cautiverio. Se incluyen ilustraciones de los caracteres diagnósticos y datos sobre el ciclo de vida, se comentan sus semejanzas con otras especies afines, y se anexa una clave para identificar algunas larvas de Melolonthidae comunes en los suelos de Los Altos de Chiapas, México.
Palabras Clave: Melolonthidae, larvas, pupas, suelos, saprófagos, Chiapas, Veracruz, México.
ABSTRACT
Third instar larvae of Anomala inconstans Burmeister, Ancongnatha sellata Arrow and Ligyrus (Ligyrodes) sallei Bates, are described using 35 specimens collected from soil with corn crops, domestic compost and forest leaf litter and sheep dung in the mountains of northern Chiapas, as well as compost from coffe fruit remains in the mountains of central Veracruz, Mexico. The pupae of A. sellata and L. (L.) sallei also are described using specimens reared in captivity. Drawings of the diagnostic structures, notes on the life cycles, comparative comments on related species, and a key to some common larvae in the soils from Los Altos de Chiapas, Mexico, are included.
Key Words: Melolonthidae, larvae, pupae, soils, saprophagous, Chiapas, Veracruz, Mexico.
INTRODUCCIÓN
El desconocimiento de las características morfológicas y de los hábitos de las larvas de los coleópteros Scarabaeoidea o Lamelicornios, conocidos popularmente como "gallina ciega", pone en riesgo a las especies benéficas cuando se trata de controlar a las larvas de las especies nocivas. Aún se conoce poco sobre la identidad de las larvas escarabeiformes presentes en las parcelas agrícolas y, erróneamente, muchos estudios se refieren a especies de Phyllophaga, cuando en realidad puede estar presente un complejo de géneros y especies con distintos hábitos de alimentación. Sólo se conoce el 1% de la diversidad de especies que habitan en los suelos cultivados de América Latina (Ramírez-Salinas et al. 2000). Las especies saprófagas estrictas se encuentran en suelos muy humificados o en suelos abonados con materia orgánica, sobre todo estiércol, como ocurre con la mayor parte de las especies de Cyclocephala Latreille, Ligyrus Burmeister, Cotinis Burmeister y Euphoria Burmeister; otras especies de los géneros Anomala Samouelle, Euetheola Bates y Dyscinetus Harold presentan larvas con hábitos rizófagos facultativos, que al parecer solo se alimentan de raíces en suelos con escasa materia orgánica y probablemente cuando están sometidas a presión de competencia inter o intraespecífica (Morón 1983).
Los adultos de Anomala inconstans Burmeister (Rutelinae: Anomalini) se han capturado de mayo a junio al ser atraídos por las luces eléctricas en numerosas localidades mexicanas, pero se desconocen sus hábitos de alimentación y sus larvas (Morón et al. 1997); King y Saunders (1984) mencionan que en América Central las larvas de ésta especie se alimentan con las raíces del maíz en América Central. Los adultos de Ancognatha sellata Arrow (Dynastinae: Cyclocephalini) se han citado esporádicamente para algunas localidades de Chiapas (Simojovel, Solistahuacan), Guatemala y El Salvador (Morón et al. 1997) pero no se tiene información sobre sus hábitos y estados inmaduros. Ligyrus (Ligyrodes) sallei Bates (Dynastinae: Pentodontini) tiene una amplia distribución en México, de hábitos saprófagos y con frecuencia es muy abundante en las muestras, tanto en ambientes agrícolas como en zonas forestadas (Morón et al. 1997), se han obtenido adultos a partir de larvas colectadas en suelos humificados o en composta, pero no se han descrito sus estadios inmaduros. Los objetivos del presente estudio consisten en describir por primera vez las larvas de tercer estadio de Anomala inconstans, Ancognatha sellata y Ligyrus (Ligyrodes) sallei, y las pupas de A. sellata y L. (L.) sallei principalmente con base en muestras de la región Altos de Chiapas; establecer comparaciones con otras especies afines; reunir la información disponible sobre su biología y hábitos; y ofrecer una clave dicotómica que ayude a la identificación de las larvas edafícolas rizófagas y saprófagas en las montañas de Chiapas.
MATERIAL Y MÉTODOS
Las larvas que se utilizaron para describir Anomala inconstans procedieron de parcelas agrícolas con maíz y descendencia de adultos criados en laboratorio. Se recolectaron adultos vivos en la primavera de 2001 y las larvas de tercer estadio en el año 2002, en Yalumá Villahermosa, municipio de Comitán, Chiapas. Para que ovipositaran los adultos se colocaron en recipientes de plástico parcialmente llenos con suelo, tapados con tela de organza. Cuando eclosionaron, las larvas se alimentaron con materia orgánica y plántulas de maíz hasta llegar al tercer estadio, la muestra obtenida en laboratorio se fijó en solución de Pampel y se conservó en alcohol etílico al 70 %.
Para obtener los inmaduros de Ancognatha sellata se muestrearon suelos con hojarasca de bosque y composta doméstica de la colonia Erasto Urbina, San Cristóbal de Las Casas. Las larvas se llevaron al laboratorio; la mitad de los ejemplares se fijaron en solución de Pampel y se conservaron en alcohol etílico al 70%; el resto se dejó crecer individualmente en recipientes de plástico (200 ml ) con suelo rico en materia orgánica en descomposición, semanalmente se añadieron 10 ml de agua, hasta obtener pupas y adultos.
Las larvas de Ligyrus (L.) sallei fueron recolectadas bajo estiércol de borrego y en composta en el Centro Ovino de Teopisca, Chiapas, o bajo composta formada con la pulpa del café en Coatepec y La Orduña, Veracruz, y se llevaron al laboratorio, donde se les trató en una forma similar a la antes mencionada, hasta obtener pupas y adultos.
Las observaciones, mediciones e ilustraciones de las larvas se hicieron con la ayuda de estereomicroscopios Leica® NZ- 14T y Carl Zeiss® Stemi SV6. Los caracteres y la terminología utilizada en las descripciones son los propuestos por Bõving (1942), Ritcher (1966), Morón (1986) y King (1996). Los ejemplares estudiados están depositados en las colecciones del proyecto "Diversificación en Sistemas de Cultivos" de ECOSUR, San Cristóbal de Las Casas Chiapas, y en la colección entomológica lEXA, Instituto de Ecología, Xalapa, Veracruz.
Anomala inconstans Burmeister, 1844 (Figs. 1-14)


Larva de tercer estadio. CABEZA. Anchura máxima de la cápsula cefálica: 4.08-4.5 mm. Superficie del cranium parda amarillenta, casi lisa. Frente con una seda frontal exterior y 2 sedas frontales posteriores a cada lado; 2 sedas frontales anteriores; 2 sedas en los ángulos anteriores de la frente; el resto de la superficie craneal con numerosas sedas dispersas, entre las que destacan 3-4 sedas dorsoepicraneales, 8-10 sedas epicraneales y 6-8 sedas basiantenales a cada lado (Fig. 1). Clípeo con 2 sedas centrales y 2 sedas laterales a cada lado. Labro ligeramente asimétrico, con 8 a 10 sedas posteriores, 2 sedas centrales y 3 sedas laterales a cada lado. La epifaringe (Fig. 2) tiene una anchura de 1.62-1.8 mm y una longitud de 1.3-1.4 mm; con epizygum alargado, irregular, pardo obscuro, haptomerum con una hilera transversal de 4 heli seguida de 7-9 heli mas cortos, irregularmente dispuestos; cada plegmata formada por 12-14 plegmatia cortos, levemente visibles; carece de proplegmatia, y clithra; laeophoba escasa; dexiophoba dispersa. Dexiotorma casi recta y delgada; laeotorma corta con pternotorma redondeada. Placa esclerosada estrecha y angulosa, cono sensorial prominente. Crepis estrecho pero bien definido. Pedium amplio. Cada acanthoparia con 9-14 sedas espiniformes recurvadas y cortas. Chaetoparia izquierda con 42-60 sedas gruesas y de 32-40 sedas delgadas. Chaetoparia derecha con 30-40 sedas gruesas y 31-40 sedas delgadas. El márgen interior de las paria sin grupos de microsensilas laterobasales. Ambas mandíbulas (Figs. 3-4) con un área estriduladora ventral. Áreas incisivas de ambas mandíbulas con una lámina cortante distal separada de un dientecillo incisivo proximal por una escotadura incisiva; márgenes internos sin dientes; área molar de la mandíbula izquierda con el lóbulo distal (M1) bien desarrollado; acia corta; brustia moderadamente setosa; área molar de la mandíbula derecha con 3 rebordes bien diferenciados; calx prominente y brustia levemente setosa. Maxilas (Figs. 5-6) con 1 uncus en la galea, 2 unci alineados en lacinia, y con hileras de 2-4 heli a cada lado. Área estriduladora maxilar formada con 5-6 dientecillos largos y afilados. Escleroma hipofaríngeo asimétrico (Fig. 7), con el lado derecho prominente y el izquierdo reducido. Último artejo antenal (Fig. 8) con un área sensorial ovalada en la superficie dorsal y dos áreas sensoriales en la superficie ventral.
TÓRAX. Pronoto con un escleroma lateral corto a cada lado, amarillo ámbar, con 3-5 sedas medianas y largas. Los estigmas respiratorios miden 0.38 mm de largo por 0.44-0.58 mm de ancho; placa respiratoria amarillo rojiza, uniformemente recurvada en forma de "C", la distancia entre los lóbulos de la placa respiratoria es menor que el diámetro dorsoventral de la bulla; la bulla es redondeada y poco prominente (Fig. 9). Proprescudo con 3-10 sedas cortas y largas distribuidas irregularmente, proescudo con 4-9 sedas cortas y largas de arreglo transversal, mesoprescudo con 7-15 sedas cortas y largas distribuidas irregularmente, mesoescudo sin sedas, mesoescutelo con 7-13 sedas cortas y largas tranversales, metaprescudo con 8-15 sedas cortas y largas tranversalmente dispuestas, metaescudo sin sedas, metaescutelo con 14-25 sedas cortas y largas transversales. Todas las uñas tarsales alargadas, con el ápice afilado, 1 seda basal interna y 1 seda preapical externa (Figs. 10-12) (11).
ABDOMEN. Estigmas de los segmentos 1°-8° semejantes en diámetro, 0.26-0.42 mm de largo por 0.38-0.5 mm de ancho; placa respiratoria amarillo rojiza, regularmente recurvada en forma de "C".
Dorsa de los segmentos abdominales 1°-6° con numerosas sedas espiniformes y algunas sedas largas distribuidas en sentido transversal; segmentos abdominales 7°-9° sin sedas espiniformes con 2 hileras transversas de sedas medianas y largas. Venter de los segmentos abdominales 1°-9° con hileras transversas de sedas medianas y largas. Raster (Fig. 13) con un par de palidia longitudinales, paralelas y ligeramente divergentes hacia el labio anal inferior, alcanzan una longitud de 1.1-1.35 mm y se encuentran separados en su parte superior por 0.2-0.25 mm y en la parte inferior por 0.35-0.45 mm; cada palidium está formado por 11-17 pali espiniformes cortos (Fig. 14); los pali de la parte superior miden de 0.08-0.1 mm de longitud y los pali de la parte inferior de 0.12-0.16 mm de longitud. Tegilla formadas con 62-77 sedas hamate cerca de la palidia. Labio anal ventral bien diferenciado con 31 a 45 sedas. Campus con 6-10 sedas largas. Barbula moderadamente setosa y amarillenta. Abertura anal transversal, ligeramente recurvada. La longitud dorsal aproximada del cuerpo, en promedio es de 3.2 cm. El cuerpo de la larva se mantiene encorvado y es de color blanco cremoso.
Material examinado: una larva de tercer estadio obtenida en laboratorio el 16-XI-2001, a partir de adultos recolectados en México: Estado de Chiapas, municipio Comitán, comunidad Yalumá Villahermosa (Llano Grande), 21-V-2001, hospedero roble (Quercus sp.) J. Rivelín Sánchez-Gómez. Cuatro larvas de tercer estadio recolectadas en la misma comunidad en suelo de parcela con maíz durante el 26 y 27-IX-2002.
Comentarios taxonómicos. La larva de tercer estadio de A. inconstans se diferencia de otras especies de Anomala en Los Altos de Chiapas por presentar 2 sedas frontales posteriores y 1 seda laterofrontal a cada lado; el márgen interior de las paria sin grupos de microsensilas laterobasales; las palidia ligeramente divergentes hacia el labio anal inferior, la longitud de los pali se incrementa ligeramente hacia el extremo posterior (0.08-0.1 mm a 0.12-0.16 mm). Por su parte, las larvas de A. sticticoptera Blanchard de San Cristóbal de Las Casas tienen 1 seda frontal posterior a cada lado y carecen de sedas laterofrontales; el márgen interior de las paria con grupos de 20-24 microsensilas laterobasales; las palidia casi paralelas y los pali son más pequeños y tienen longitud uniforme (0.08 a 0.1 mm). De acuerdo con la descripción de Micó et al. (2003) basada en larvas de Los Tuxtlas, Veracruz, A. sticticoptera presenta de 1 a 3 sedas frontales posteriores y 1 seda laterofrontal a cada lado; el márgen interior de las paria con grupos de 25-45 microsensilas laterobasales y los palidia casi paralelos, formados por 13-14 pali cortos y agudos. Esta variación en las larvas de A. sticticoptera puede corresponder a diferencias poblacionales, que también son evidentes en la pigmentación, puntuación y talla de los adultos.
Ancognatha sellata Arrow, 1911 (Figs. 15-26)
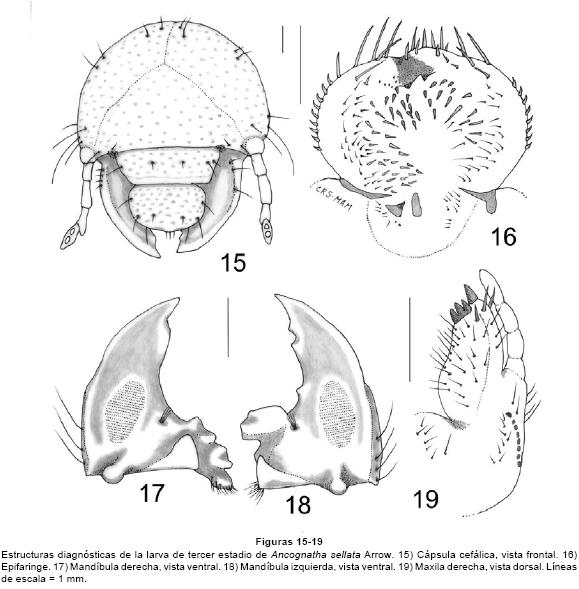
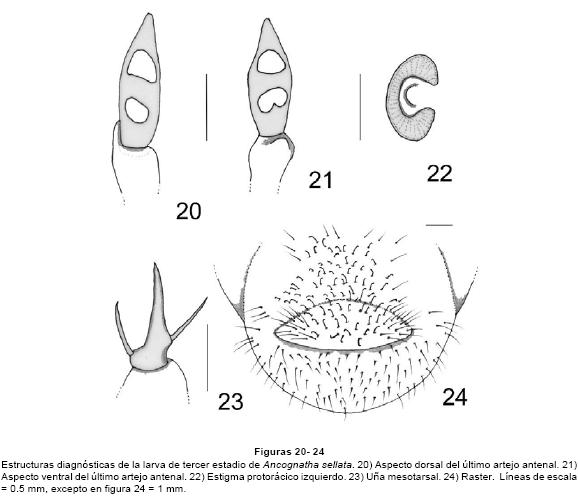


Larva de tercer estadio. CABEZA. Anchura máxima de la cápsula cefálica: 5.46-6.0 mm. Superficie del cranium punteada de color pardo rojizo. Frente con 2 sedas en los ángulos anteriores, 2 sedas dorso-epicraneales, 2 sedas epicraneales, y 3 sedas paraocelares a cada lado; carece de sedas frontales anteriores, posteriores y exteriores (Fig. 15). Ocelos pequeños, poco conspicuos. Clípeo con 2 sedas centrales y 2 sedas laterales a cada lado. Labro ovalado, ligeramente asimétrico con 2 sedas anteriores y 2 sedas laterales a cada lado, carece de sedas posteriores. La epifaringe (Fig. 16) tiene una anchura de 2.55-2.65mm y una longitud de 1.75-1.85 mm; proceso haptomeral prominente y bidentado; carece de plegmatia, proplegmatia, haptolachus y dexiophoba. Acanthoparia con 6-10 sedas espiniformes cortas. Corypha con 7-8 sedas medianas. Acroparia con 5-7 sedas. Dexiotorma delgada, con el extremo mesial aguzado. Laeotorma corta y aguzada, con pternotorma redondeada y pronunciada. Placa esclerosada grande y angulosa, cono sensorial ancho y prominente. Laeophoba dispersa. Crepis fino pero bien definido. Pedium amplio. Chaetoparia izquierda con 39-40 sedas gruesas y 20-23 sedas delgadas. Chaetoparia derecha con 22-25 sedas gruesas y 15-22 sedas delgadas. Ambas mandíbulas con área estriduladora ventral, con 5 sedas dorso molares. Mandíbula derecha (Fig. 17) con 1 diente en el área incisiva y un lóbulo redondeado amplio después de la escotadura postincisiva, calx prominente, brustia escasa. Mandíbula izquierda (Fig. 18) con 2 dientes en el área incisiva y un diente después de la escotadura postincisiva, con un lóbulo molar distal prominente y anguloso, acia corta, brustia escasa. Maxilas con un uncus en la galea y tres unci bien definidos en la lacinia; con un área estriduladora maxilar formado por 7-9 dientecillos redondeados o truncados, y un proceso anterior redondeado (Fig. 19). Escleroma hipofaríngeo asimétrico, muy esclerosado con el lado derecho prominente (Fig. 20). Último artejo antenal con dos áreas sensoriales ovaladas a ligeramente asimétricas dorsales y dos áreas sensoriales ventrales (Figs. 21-22).
TÓRAX. Pronoto con un escleroma lateral alargado a cada lado, amarillo ámbar, con 3 sedas medianas o largas. Proprescudo con 4-5 sedas cortas y largas; proescudo con 6-10 sedas cortas y largas; mesoprescudo con 4-7 sedas cortas y largas; mesoescudo sin sedas; mesoescutelo con 6-7 sedas cortas y largas; metaprescudo con 7-8 sedas cortas y largas; metaescudo sin sedas; metaescutelo con 4-7 sedas cortas y medianas. Los estigmas respiratorios miden 0.38 mm de largo por 0.67 mm de ancho. Placa respiratoria amarilla, uniformemente recurvada en forma de "C" (Fig. 23), la distancia entre los lóbulos de la placa respiratoria es mayor o igual que el diámetro dorso-ventral de la bulla, la bulla es redondeada, poco prominente. Uñas tarsales semejantes en los tres pares de patas (Fig. 24), alargadas con el ápice afilado, con 1 seda basal interna y 1 seda prebasal externa.
ABDOMEN. Estigmas abdominales de los segmentos 1°-8° casi semejantes en diámetro; 0.3-5 mm de largo por 0.5-0.66 mm de ancho; placa respiratoria amarillo rojiza, regularmente recurvada en forma de "C", la distancia entre los lóbulos de la placa respiratoria es menor o igual que el diámetro dorso-ventral de la bulla; bulla redondeada, poco prominente. Dorsa de los segmentos abdominales 1°-6° con numerosas sedas espiniformes y algunas sedas largas distribuidas transversalmente; segmentos abdominales 7°-9° sin sedas espiniformes, con sedas medianas y largas situadas transversalmente. Venter de los segmentos abdominales del 1°al 9° con 7-20 sedas cortas y largas en hileras transversales. Raster (Fig. 25) sin palidia, teges formado por 54-60 sedas hamate. Labio anal ventral con 20-26 sedas hamate flanqueadas por sedas largas y delgadas. Abertura anal transversal, ligeramente recurvada. Longitud total dorsal aproximada del cuerpo: 5.5-6.5 cm. El cuerpo de la larva es de color blanco cremoso.
Pupa. CABEZA. Glabra, fuertemente inclinada hacia abajo; piezas bucales claramente diferenciadas; frente con la superficie irregular, clípeo convexo fusionado con el labro; canthus ocular aparente; ojos hundidos; tecae antenales engrosadas, claramente visibles. TÓRAX. Pronoto convexo; meso y metanoto bien diferenciados; tecae elitrales ligeramente más cortas que las tecae alares. ABDOMEN. Segmentos abdominales bien diferenciados, con 5 pares de órganos dioneiformes bien definidos y esclerosados entre el dorso de los segmentos 1°-6° (Fig. 26). Estigmas del 1er segmento con el peritrema ancho y esclerosado, oculto por la tecae alares; estigmas de los segmentos 2°-4° con los peritremas anchos, esclerosados y muy prominentes; estigmas de los segmentos 5° y 6° reducidos, sin peritremas; estigmas de los segmentos 7° y 8° sin peritrema, reducidos y rodeados por arrugas. Los dos últimos segmentos abdominales son más pequeños y estrechos, carecen de urogomphi. Longitud corporal: 2.6 cm, color pardo ambarino.
Material examinado: cinco larvas de tercer estadio recolectadas en MÉXICO: Estado de Chiapas, municipio de San Cristóbal de Las Casas, Colonia Erasto Urbina, el 3 y 23-II-2002, y 18-IV-2002, C. Ramírez-Salinas. Dos larvas de tercer estadio, dos prepupas y una pupa recolectadas en el mismo sitio pero el 3-XI-1997. Una larva de tercer estadio con los mismos datos excepto 6-V-2001. En el laboratorio se obtuvo una pupa el 7-III-2002.
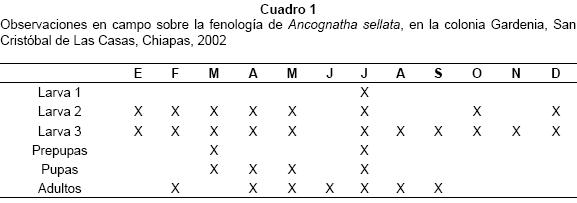
Biología. ADULTOS. De hábitos nocturnos, son atraídos por las luces eléctricas y vuelan entre las 18:30 y 20:00 hrs. En San Cristóbal de Las Casas, están activos desde principios de abril hasta septiembre y ocasionalmente en febrero. También se han registrado en Tenejapa y San Juan Cancuc. En la reserva de la Biosfera "El Triunfo" en Chiapas se registraron ocho ejemplares de A. sellata distribuidos entre junio y febrero (Morón-Ríos y Morón, 2001). En el laboratorio se observó un adulto que permaneció vivo durante 48 días sin alimentarse. LARVA. Se alimenta con la materia orgánica del suelo, degrada la hojarasca del bosque, y desechos de cocina dispuestos para obtener abono orgánico (composta doméstica). Las excretas de las larvas son ovaladas, con 0.4 a 0.5 mm de longitud y 0.2 a 0.3 mm de ancho. Es importante mencionar que las larvas de esta especie se observaron durante todos los meses del año y, debido a que la actividad de los adultos es prolongada, se podría pensar que el período de oviposición también es amplio, sin embargo no fue posible observar huevos en ningún mes (Cuadro 1). PUPA. La exuvia de la larva de tercer estadio se abre a lo largo de toda la línea media dorsal, desde la cabeza hasta la parte terminal del abdomen y permanece rodeando a la pupa dentro de la celda definida en el substrato. En marzo y julio se observaron prepupas, y en marzo, abril, mayo y julio se observaron las pupas (Cuadro 1). El estadio pupal tiene una duración de 47 a 52 días bajo condiciones de laboratorio. Es posible que anualmente existan varias generaciones sobrepuestas, pero es necesario realizar más observaciones para conocer la duración del ciclo vital y los meses de oviposición.
Comentarios taxonómicos. Ritcher (1966) describió con detalle la larva de Ancognatha manca LeConte, especie distribuida en las montañas del suroeste de los Estados Unidos y el noroeste y occidente de México (Morón et al. 1997). La larva de A. sellata presenta 3-4 sedas paraocelares largas y A. manca tiene dos; el proceso haptomeral de A. sellata es bidentado, y en A. manca es redondeado; la placa esclerosada de la epifaringe es más grande y aguda en P. sellata; el primer lóbulo molar es menos prominente y las áreas estriduladoras mandibulares son más estrechas en A. manca; el teges de A. sellata muestra 54-60 sedas hamate y el labio anal inferior tiene 20-26 sedas hamate, mientras que A. manca presenta 36-42 sedas hamate en el teges y 40 sedas hamate en el labio anal inferior.
Ligyrus (Ligyrodes) sallei Bates, 1888 (Figs. 27- 39)


Larva de tercer estadio. CABEZA. Anchura máxima de la cápsula cefálica: 5.52-6.30 mm, superficie del cranium pardo rojizo con abundantes puntos amplios y profundos. Frente con 2-3 sedas en los ángulos anteriores, 1- 2 sedas dorso-epicraneales, 2-3 sedas epicraneales, y 5-7 sedas paraocelares a cada lado. Carece de sedas frontales anteriores, posteriores y exteriores. Ocelos bien definidos (Fig. 27). Clípeo con puntos esparcidos, 2 sedas centrales y 1 seda lateral a cada lado. Labro ligeramente asimétrico, toscamente rugoso, con 4 sedas posteriores, 2 sedas anteriores y 3 sedas laterales a cada lado. La epifaringe (Fig. 28) tiene una anchura de 2.1-2.25 mm y una longitud de 1.6-1.85 mm, carece de plegmatia, proplegmatia, clithra, dexiophobay haptolachus; haptomerum prominente y ligeramente bidentado. Pedium muy amplio. Acanthoparia con 9-12 sedas espiniformes. Corypha con 3-5 sedas. Acroparia con 4-5 sedas. Dexiotorma larga, con el extremo mesial aguzado y ligeramente angulado. Laeotorma larga y estrecha con pternotorma ancha y redondeada. Placa esclerosada grande, semitriangular. Cono sensorial alargado, con tres fosetas. Chaetoparia izquierda con 73-83 sedas gruesas. Chaetoparia derecha con 51-54 sedas gruesas. Gymnoparia estrecha. Ambas mandíbulas con área estriduladora ventral, la mandíbula derecha (Fig. 29) con dos dentículos posteriores a la escotadura incisiva, margen interno con un dentículo corto y ancho; área molar con tres lóbulos redondeados, acia corta y brustia escasa. Mandíbula izquierda (Fig. 30) con un dentículo posterior a la escotadura incisiva, margen interno con una proyección dentiforme ligeramente bilocada o truncada; área molar con el primer lóbulo ancho y prominente, acia corta y brustia multisetosa. Maxilas (Fig. 31) con un uncus en la galea y tres unci bien definidos en la lacinia, dispuestos en forma oblicua; área estriduladora maxilar formada por 6-9 dientecillos truncados o redondeados, y un proceso anterior ancho y redondeado. Escleroma hipofaríngeo asimétrico, muy esclerosado, con el lado derecho prominente (Fig. 32). Último artejo antenal (Fig. 33) con 2-3 áreas sensoriales ovaladas dorsales y 3-4 áreas sensoriales ventrales.
TÓRAX. Pronoto con un escleroma lateral alargado a cada lado, amarillo, con 1-4 sedas cortas o largas. Proprescudo con 4 sedas largas transversales; proescudo con 4 sedas largas transversales; mesoprescudo con 11-17 sedas cortas y largas distribuidas irregularmente; mesoescudo sin sedas; mesoescutelo con 3-4 sedas cortas y largas transversales; metaprescudo con 5-14 sedas cortas y largas distribuidas irregularmente; metaescudo sin sedas; metaescutelo con 2-4 sedas cortas y largas transversales. Los estigmas respiratorios miden 0.55 mm de largo por 0.75 mm de ancho; placa respiratoria amarilla rojiza, uniformemente recurvada en forma de "C" la distancia entre los lóbulos de la placa respiratoria es menor que el diámetro dorsoventral de la bulla; bulla redondeada, poco prominente (Fig. 35). Uñas tarsales de los dos primeros pares de patas similares, con una proyección apical aguzada, una seda basal interna y una seda preapical externa (Figs. 36-37). Uñas metatarsales con la proyección apical más corta y con las sedas interna y externa situadas casi a la misma distancia de la base (Fig. 38).
ABDOMEN. Los estigmas abdominales de los segmentos 1°-8° con diámetros similares, 0.4-0.6 mm de largo por 0.62-0.82 mm de ancho; placa respiratoria amarillo rojiza, regularmente recurvada en forma de "C", la distancia entre los lóbulos de la placa respiratoria es menor que el diámetro dorso-ventral de la bulla; bulla redondeada, poco prominente. Dorsa de los segmentos abdominales 1°-6° con numerosas sedas espiniformes y algunas sedas largas distribuídas transversalmente; segmentos abdominales del 7°-9° con pocas sedas espiniformes y algunas sedas largas situadas irregularmente. Venter de los segmentos abdominales de 1-9 con sedas medianas o largas en hileras transversales. Raster (Fig. 39) con una septula muy larga, que se extiende sobre todo el labio anal inferior. Palidia polisticos, formados por 3-4 hileras irregulares de 17-21 pali cortos cada una, las cuales invaden el labio anal inferior. Abertura anal transversal, moderadamente recurvada. Longitud total dorsal aproximada del cuerpo: 50-71 mm; la larva es robusta y de color blanco-cremoso.
Pupa. CABEZA. Glabra, fuertemente inclinada hacia abajo; frente con depresiones irregulares; clípeo convexo; labro poco notable; piezas bucales claramente diferenciadas; ojos hundidos; tecae antenales engrosadas, claramente visibles. TÓRAX. Pronoto convexo, con pliegues finos oblicuos. Meso y metanoto bien diferenciados. Tecae elitrales ligeramente más cortas que las tecae alares. Protibias ligeramente más largas que los tarsos respectivos. Mesotibias tan largas como los mesotarsos. Metatibias un poco más largas de los tarsos respectivos. ABDOMEN. Primeros seis segmentos claramente más anchos que los segmentos distales, con cinco pares de órganos dioneiformes bien definidos y esclerosados entre los segmentos 1°-5° (Fig. 40). Estigma del primer segmento no visible, cubierto por las alas; estigmas de los segmentos 2°-4° con peritremas esclerosados, muy prominentes; estigmas de los segmentos 5°-7° cerrados, reducidos y rodeados por arrugas finas; el 8° estigma poco prominente, rodeado de arrugas finas. Último terguito abdominal sin urogomphi. Último esternito abdominal con una ámpula genital trilobulada. Longitud corporal: 2.4-3.2 cm.
Material examinado: cuatro larvas de tercer estadio recolectadas en MÉXICO: Estado de Chiapas, municipio Teopisca. Centro Ovino (UNACH) el 1-VI-2001, M. López-Anaya; dos de ellas fueron encontradas en estiércol de borrego y dos en composta. De larvas provenientes del mismo lugar se obtuvo una pupa en laboratorio el 7-VIII-2001. Veintisiete larvas de tercer estadio recolectadas en MÉXICO: Estado de Veracruz, municipio Coatepec, el 25-IV-1995, bajo composta de pulpa de café, E. Aranda; de ellas se obtuvieron en laboratorio 3 prepupas, 13 pupas y 5 adultos el 12-VI-1995. Ocho larvas de tercer estadio, 2 prepupas y 1 adulto recolectados en MÉXICO: Estado de Veracruz, municipio Coatepec, La Orduña, el 18-VII-1995, bajo composta de pulpa de café, E. Aranda.
Biología. Las larvas de L. (Ligyrodes) sallei pueden ser muy abundantes en suelos humificados, acumulaciones de restos vegetales o estiércol en proceso de degradación. La pupación ocurre principalmente entre junio y agosto. La exuvia de la larva de tercer estadio se abre por la línea media dorsal del cuerpo, desde la cabeza hasta la parte terminal del abdomen y queda rodeando laxamente a la pupa dentro de la celda definida en el substrato. Aún cuando no se ha confirmado la duración del ciclo vital, tomando en cuenta las fechas en que se encuentran las larvas completamente desarrolladas y las pupas, así como el período de vuelo de los adultos, es muy probable que el ciclo se complete en un año.
Comentarios taxonómicos. Ritcher (1966) describió con detalle la larva de tercer estadio de Ligyus (Ligyrodes) relictus Casey, especie ampliamente distribuída en el medio oeste y noreste de los Estados Unidos (Ratcliffe 1991). La larva de L. sallei es muy parecida, pero puede distinguirse porque carece de sedas frontales exteriores, solo tiene una seda en los ángulos frontales anteriores y muestra 1-2 sedas dorsoepicraneales a cada lado, en vez de las 3-5 sedas que se observan en L. relictus; el proceso haptomeral de L. sallei es bidentado y en L. relictus está entero; el abdomen de L. sallei tiene abundantes sedas espiniformes en los dorsa de los segmentos 1-6 mientras que en L.relictus este tipo de sedas esta presente en los dorsa de los segmentos 1-7; L. sallei tiene 3-4 hileras irregulares de pali en el raster y L. relictus muestra 5-7 hileras irregulares de pali.
| Clave para separar algunas de las larvas de tercer estadio de Melolonthidae comunes en los suelos de la región Altos de Chiapas, México. | |||||||
|---|---|---|---|---|---|---|---|
| 1 | Labio anal inferior claramente hendido; abertura anal con forma de "Y" o "V". Mandíbulas sin área estriduladora ventral........................................................................................................................................... 2 | ||||||
| 1' | Labio anal inferior entero, sin hendidura sagital; abertura anal recta o ligeramente recurvada. Mandíbulas con área estriduladora ventral ....................................................................................................................... 10 | ||||||
| 2 | Haptomerum con un helus. Raster sin palidia, con teges formado por numerosas sedas hamate ........................................................................................................................................Hoplia spp. | ||||||
| 2' | Haptomerum con 1 a 3 hileras transversales de 3 a 12 heli. Raster con palidia longitudinales u oblicuos.............3 | ||||||
| 3 | Raster con palidia oblicuos, cerca del márgen basal del labio anal inferior. Labro simétrico, con un reborde transversal prominente y recurvado ..................................................................................Diplotaxis spp. | ||||||
| 3' | Raster con palidia longitudinales y septula en la línea media. Labro simétrico o asimétrico, sin reborde transversal prominente.......................................................................................................................................4 | ||||||
| 4 | Uñas tarsales de las patas metatorácicas con forma y longitud similar a las uñas pro- y mesotorácicas. Haptomerum con una hilera transversal de 4 heli. Labro simétrico ................................... Macrodactylus spp. | ||||||
| 4' | Uñas tarsales de las patas metatorácicas con longitud claramente menor a las uñas pro- y mesotorácicas. Haptomerum con 1 a 3 hileras transversales de 6 a 12 heli. Labro asimétrico ............Phyllophaga spp........... 5 | ||||||
| 5 | Epifaringe con proplegmatia ............................................................................................................... 6 | ||||||
| 5' | Epifaringe sin proplegmatia................................................................................................................. 7 | ||||||
| 6 | Palidia casi paralelos, cada palidium formado por 14-21 pali cortos. Anchura de la cápsula cefálica 4.5-5.1 mm....................................................................................................P. (Phyllophaga) ravida (Blanch.) | ||||||
| 6' | Extremos posteriores de las palidia ligeramente convergentes, cada palidium formado por 8-15 pali cortos. Anchura de la cápsula cefálica 3.8-4.1 mm...............................................P. (Chlaenobia) tumulosa (Bates) | ||||||
| 7 | Superficie de la frente casi lisa ........................................................................................................... 8 | ||||||
| 7' | Superficie de la frente finamente rugosa............................................................................................... 9 | ||||||
| 8 | Palidia ligeramente recurvadas, convergentes en ambos extremos, cada palidium formado por 15-27 pali cortos. Anchura de la cápsula cefálica 4.1-4.8 mm................................................ P. (Phytalus) obsoleta (Blanch.) | ||||||
| 8' | Palidia casi paralelas, cada palidium formado por 23-30 pali cortos. Anchura de la cápsula cefálica 5.6-6.2 mm............................................................................................ P. (Phyllophaga) menetriesi (Blanch.) | ||||||
| 9 | Palidia muy recurvadas, cercanamente convergentes en ambos extremos, delimitando una septula ovalada; cada palidium formado por 19-25 pali cortos. Anchura de la cápsula cefálica 4.9-5.2 mm........................................................................................P. (Phyllophaga) testaceipennis (Blanch.) | ||||||
| 9' | Ambos extremos de las palidia ligeramente convergentes, que limitan los lados de una septula alargada; cada palidium formado por 11-18 pali cortos. Anchura de la cápsula cefálica 6.1-6.7 mm..................................................................................................P. (Phyllophaga) tenuipilis (Bates) | ||||||
| 10 | Labro simétrico, con el borde anterior claramente trilobado. Epifaringe con clithra. Segundo artejo antenal mas corto que el primero. Raster con palidia monostico, cada palidium formado por 11-16 pali espiniformes. Anchura de la cápsula cefálica 3.0-3.6 mm ........................................................................ Euphoria basalis (G. et P.) | ||||||
| 10' | Labro asimétrico, con el borde anterior redondeado, prominente o ligeramente bilobado. Epifaringe sin clithra. Segundo artejo antenal claramente mas largo que el primero. Palidia presente o ausente. Anchura de la cápsula cefálica 3.9-6.0 mm........................................................................................................................ 11 | ||||||
| 11 | Raster sin palidia ni septula, solo con tegilla. Anchura de la cápsula cefálica 5.4-6.0 mm...............................................................................................................Ancognatha sellata Arrow | ||||||
| 11' | Raster con palidia y septula de forma y longitud variable ........................................................................12 | ||||||
| 12 | Cada palidium formado por 2-3 hileras irregulares de pali (polistico). Lacinia maxilar con 3 unci. Ultimo artejo antenal con 2 o 3 áreas sensoriales dorsales. Cápsula cefálica con 5.5-5.8 mm de anchura, parda rojiza, punteada-rugosa, con un ocelo en cada lado .............................................................. Ligyrus sallei Bates | ||||||
| 12' | Cada palidium formado por una hilera regular de 11 a 17 pali (monostico). Lacinia maxilar con 2 unci. Ultimo artejo antenal con un área sensorial dorsal. Cápsula cefálica amarillenta, casi lisa, sin ocelos ................................ 13 | ||||||
| 13 | Cabeza con 2 sedas frontales posteriores y 1 seda laterofrontal a cada lado. Los pali del extremo anterior son ligeramente mas cortos (0.08-0.1mm) que los del extremo posterior (0.12-0.16 mm). Epifaringe con el márgen interior de las paria sin grupos de microsensilas laterobasales. Anchura de la cápsula cefálica 4.0-4.5 mm..............................................................................................................Anomala inconstans Burm. | ||||||
| 13' | Cabeza con 1 seda frontal posterior a cada lado, sin sedas laterofrontales. Los pali tienen longitud uniforme (0.08-0.10 mm). Epifaringe con el márgen interno de las paria con grupos de 20-24 microsensilas laterobasales. Anchura de la cápsula cefálica 3.9-4.5 mm ................................................... Anomala sticticoptera Blanch. | ||||||
AGRADECIMIENTOS
Se reconoce el apoyo de Jesús Revelín Sánchez Gómez, Pedro Ramírez López, Cutberto Pacheco Flores y Miguel Ángel López Anaya para obtener las muestras estudiadas en este trabajo, con el apoyo económico del CONACYT (proyecto 35067-B). También se agradece a Eduardo Aranda por la donación de las muestras de larvas de L. sallei colectadas en Veracruz.
LITERATURA CITADA
Böving, A. 1942. A classification of larvae and adults of the genus Phyllophaga (Coleoptera: Scarabaeidae). Mem. Entomol. Soc. Wash., No.2: 1-95. [ Links ]
King, A. B. S. 1996. Clave para la identificación de larvas y adultos de Phyllophaga spp. en América Central. Pp. 44-49. In: P. J. Shannon y M. Carballo (Eds.) Biología y Control de Phyllophaga spp. CATIE, Serie Técnica. Informe Técnico 277, Turrialba, Costa Rica. 132 pp. [ Links ]
King, A. B. S. & J. L. Saunders. 1984. Las plagas invertebradas de cultivos anuales alimenticios en América Central. TDRI-ODA, CATIE, Londres. [ Links ]
Micó, E., M. A. Morón & E. Galante. 2003. New larval descriptions and biology of some new world Anomalini beetles (Scarabeidae: Rutelinae). Ann. Ent. Soc. Amer., 96(5): 597-614. [ Links ]
Morón, M. A. 1983. Introducción a la biosistemática y ecología de los coleópteros Melolonthidae edafícolas de México. In: Memorias II Mesa Redonda Sobre Plagas del Suelo. C1-C14. [ Links ]
----------. 1986. El género Phyllophaga en México. Morfología, distribución y sistemática supraespecífica (Insecta: Coleoptera). Pub.19. Instituto de Ecología. México. 344 pp. [ Links ]
Morón, M. A., B. C. Ratcliffe & C. Deloya. 1997. Atlas de los escarabajos de México. Vol. I. CONABIO y Sociedad Mexicana de Entomología, México. 280 pp. [ Links ]
Morón-Ríos, A. & M. A. Morón, 2001. La fauna de Coleoptera Melolonthidae de la Reserva de la Biosfera "El Triunfo", Chiapas, México. Acta Zool. Mex. (n.s.) 84: 1-25. [ Links ]
Ramírez- Salinas, C., M. A. Morón & A. E. Castro-Ramírez. 2000. Descripción de los estados inmaduros de seis especies de Phyllophaga (Coleoptera: Melolonthinae) de la región Altos de Chiapas, México. Folia Entomol. Mex., 109: 73-106. [ Links ]
Ratcliffe, B. C. 1991. The scarab beetles of Nebraska. Bull. Univ. Nebraska St. Mus., 12: 1-330. [ Links ]
Ritcher, P. O. 1966. White grubs and their allies: a study of North American scarabaeoid larvae. Studies in Entomology No. 4. Oregon State University Press, Corvallis. [ Links ]














