Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta zoológica mexicana
versión On-line ISSN 2448-8445versión impresa ISSN 0065-1737
Acta Zool. Mex vol.20 no.2 Xalapa ago. 2004
Patrón de distribución y listado de especies de las lombrices de tierra (Annelida, Oligochaeta) en Colombia
Alexander Feijoo M.1, Heimar Quintero V.2, Carlos Fragoso3 y Ana G. Moreno4
1 Universidad Tecnológica de Pereira, Facultad de Ciencias Ambientales, vereda La Julita, A. A. 097, Pereira, COLOMBIA. E-mail: afeijoo@ambiental.utp.edu.co.
2 Universidad Nacional de Colombia, Palmira, A. A. 237, COLOMBIA.
3 Instituto de Ecología A. C., A. P. 63, CP 91000, Xalapa, Veracruz, MÉXICO.
4 Departamento de Zoología y Antropología Física, Facultad de Biología, Universidad Complutense, 28040, Madrid, ESPAÑA.
Recibido: 25 de noviembre 2002
Aceptado: 25 de marzo 2004
RESUMEN
Este artículo es el resultado de un esfuerzo colectivo para construir los patrones de distribución de las lombrices de tierra de Colombia a partir del análisis de la información sobre las colectas realizadas entre 1872 y 2003. La información abarca desde registros esporádicos con información taxonómica de las especies hasta estudios sistemáticos de especies en algunas cuencas hidrográficas y en suelos de sabanas, que destacan la alta diversidad en los sistemas de alta montaña de la cordillera de los Andes. El mayor porcentaje (93.2%) de las colectas se ha realizado en la región Andina. La oligoquetofauna colombiana determinada está compuesta por 113 especies situadas en nueve familias, 30 géneros y 6 subgéneros, de las cuales 90 son nativas y 23 exóticas. La mayoría de las especies son endémicas y pertenecen a la familia Glossoscolecidae. Andiodrilus, con 25 especies, fue el género de la familia mejor representado, mientras que Martiodrilus, con 19 especies, ocupó la mayor diversidad de ambientes, desde selvas y pastizales hasta el páramo. Sólo dos especies de esta familia fueron cosmopolitas (Pontoscolex corethrurusy Onychochaeta elegans), las cuales se encontraron en ambientes antropócoros. El resto de las especies de las otras familias fueron euritópicas, excepto Tumak hammeni y Dichogaster medellina.
Palabras Clave: Lombrices de tierra, suelos, cordillera de los Andes, Glossoscolecidae, agroecosistemas, nativas, exóticas.
ABSTRACT
The checklist of earthworm species of Colombia and the patterns of distribution are presented. Data was obtained from collections made from 1872 to 2002. The information come from sporadic taxonomic registers and from some systematic studies conducted in hydrographic basins and savanna regions; both highlight the high diversity of the Andes mountainous areas. Most collections (93.2%) were carried out in the Andean region. The Colombian Oligochaeta comprises 113 species placed in nine families, 30 genera and six subgenera, of which 90 are native and 23 exotic. Most of the species are endemic of the Glossoscolecidae family. Andiodrilus is represented by the greatest number of species (25), while Martiodrilus with 19 species shows the highest habitat diversity, including forests, pastures and even the páramo. Only two species of this family were cosmopolitan (P. corethrurus and O. elegans) currently inhabiting anthropic environments. The species of the other families, excepting Tumak hamenni and Dichogaster medellina, were eurytopic.
Key Words: earthworms, soils, Cordillera of the Andes, Glossoscolecidae, agroecosystems, natives, exotics.
INTRODUCCIÓN
Colombia se ha clasificado como el segundo país en el mundo en megadiversidad, siendo su biota la herencia de procesos evolutivos y de especiación del Terciario y el Cuaternario. Esta rica flora y fauna se concentra principalmente en el área del piedemonte y en las estribaciones inferiores de las cordilleras (Van Der Hammen 1997, Hernández 1992). Esta diversidad, sin embargo, se transforma por la interacción de la vida animal y vegetal con las sociedades humanas, ya que las actividades de la población colombiana se han concentrado en valles y mesetas interandinas y en las laderas de las cordilleras.
Los inventarios recientes de esta diversidad reconocen a la compleja región Andina como el principal centro de diversificación de aves, reptiles, arácnidos y plantas (Rangel & Aguilar 1994) y la consideran como una de las más diversas del neotrópico (Andrade et al. 1992, Hernández 1992, Instituto Alexander Von Humboldt 1998, Hofstede 2002). Sin embargo esta apreciación se podría atenuar en la medida en que aumente el conocimiento de las formas de vida en las selvas húmedas tropicales por debajo de los 1000 m y en los ecosistemas de agua dulce (Andrade et al. 1992).
Las primeras colectas de oligoquetos terrestres ocurrieron durante las exploraciones de viajeros europeos por regiones colombianas en las últimas décadas del siglo XIX. Estos ejemplares fueron descritos por algunos de los taxónomos de lombrices de aquella época (Cognetti 1902, 1906, Michaelsen 1910, 1913, 1918). No se registran más investigaciones sobre estos animales durante cerca de cinco décadas hasta el último tercio del siglo XX (Righi 1995, Zicsi 1997, 1998, 2000, Zicsi & Feijoo 1994), cuando además aparecen los primeros estudios con un enfoque local de carácter sistemático y con un énfasis en ecología (Feijoo 1993, 2001, Decaens 1998, Jiménez 1999, Jiménez & Thomas 2001).
Este estudio se propuso como objetivo elaborar el listado de las lombrices de tierra de Colombia y delinear sus patrones de distribución geográfica, con el fin de continuar documentando la alta diversidad Andina y Amazónica de la fauna de Colombia.
MATERIAL Y MÉTODOS
Área de estudio
Situada en el noroccidente de América del Sur e incluyendo el archipiélago de San Andrés y Providencia, Colombia cuenta con 1,141,748 km2 de superficie dentro de los 12° 90' 40" N y 4° 13' 30" S, y los 66° 50' 40" O (en el río Negro Guainía) y los 70° 01' 23" O (Punta Manglares). El país se divide en dos regiones, la transandina compuesta por tres cordilleras, los valles interandinos y las fajas litorales Caribe y Pacífica, y la región cisandina que abarca las llanuras de Orinoquía y Amazonía (Hernández 1992) (Fig. 1).
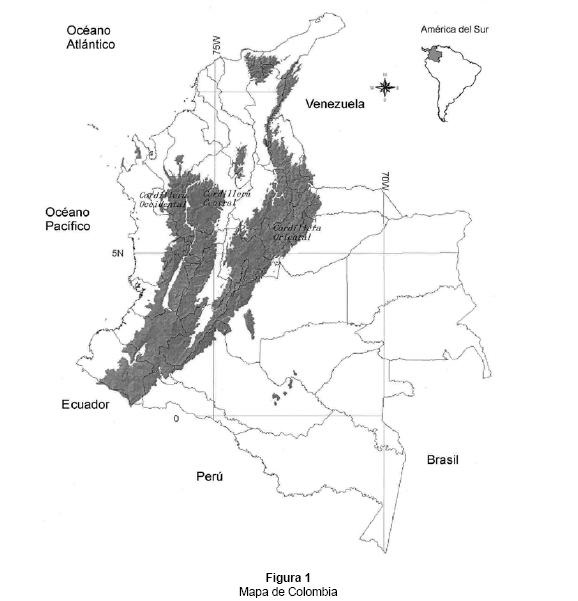
El listado de especies y su distribución en las regiones de Colombia (Caribe, Pacífico, Andina, Orinoquía y Amazonía), en los diferentes tipos de suelos y pisos altitudinales se obtuvieron de los trabajos de Michaelsen (1900, 1910, 1913, 1918), Ayala et al. (1972), Fajardo & Prince (1976), ames (1990), Chamorro (1981, 1986), Zicsi (1988a, b, c, 1989, 1992, 1993, 1997, 1998 y 2000), Zicsi & Feijoo (2002), Zicsi et al. (2002), Righi (1984, 1995), Righi & García (1989), Righi & Van Der Hammen (1995) y Jiménez et al. (1995, 1999). Adicionalmente se revisó el material de las colectas realizadas por A. Feijoo entre 1986 - 2002.
Análisis de la distribución de las lombrices de tierra de Colombia
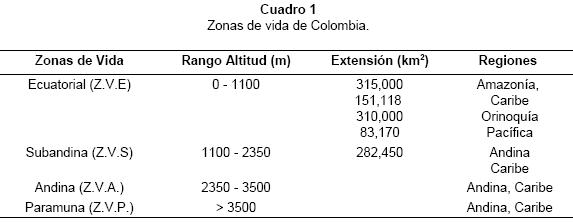
La distribución de las especies se analizó según la clasificación de las zonas de vida de Colombia (Cuatrecasas 1958, Rangel & Aguilar 1994), que toma en cuenta los cambios en el tipo de vegetación y de la temperatura a lo largo del gradiente altitudinal (Cuadro 1).
El listado de especies y su distribución en las regiones de Colombia (Caribe, Pacífico, Andina, Orinoquía y Amazonía), en los diferentes tipos de suelos y pisos altitudinales se obtuvieron de los trabajos de Michaelsen (1900, 1910, 1913, 1918), Ayala et al. (1972), Fajardo & Prince (1976), James (1990), Chamorro (1981, 1986), Zicsi (1988a, b, c, 1989, 1992, 1993, 1997, 1998 y 2000), Zicsi & Feijoo (2002), Zicsi et al. (2002), Righi (1984, 1995), Righi & García (1989), Righi & Van Der Hammen (1995) y Jiménez et al. (1995, 1999). Adicionalmente se revisó el material de las colectas realizadas por A. Feijoo entre 1986 - 2002.
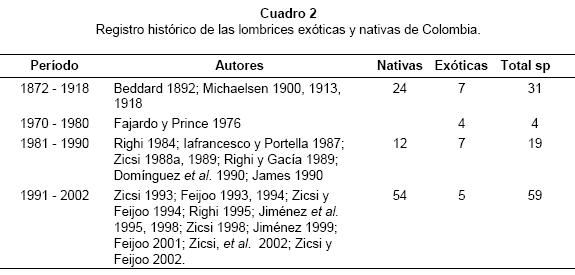
Para elaborar el listado de los registros históricos de las lombrices nativas o exóticas (Cuadro 2) se tuvo en cuenta la primera mención de la especie y se obviaron las que se consideran sinónimos (Righi 1984, Zicsi 1988a, 1993), los cambios de nombre (Righi 1995) o la inclusión en un nuevo género o subgénero (Zicsi 1997, Zicsi et al. 2002).
RESULTADOS
Registro histórico de los estudios de lombrices en Colombia
En el período comprendido entre 1872 y 1918 se describieron 24 especies nativas y se dieron a conocer 7 nuevos registros de exóticas recolectadas en Bogotá, Palmira y en algunas localidades de los departamentos de Antioquia, Santander y Tolima (Cuadro 2). El auge se debió al interés de los naturalistas europeos continentales por la fauna Suramericana, tales como los Profesores Otto Burger y O. Fuhrmann quienes colectaron lombrices en algunos estados de Colombia entre 1896 y 1897 y las depositaron en el Museo de Historia Natural de Berlín, material que más tarde describirá Michaelsen entre 1900 y 1918 (Cuadro 2). Las investigaciones de este período fueron sobre la sistemática de especies. Entre 1970 y 1980, Fajardo y Prince (1976) dieron a conocer por primera vez en Colombia información ecológica de cuatro especies cosmopolitas. Entre 1981 y 1990 se intensificaron los estudios sobre la oligoquetofauna colombiana y se registraron 12 especies nativas y 7 exóticas (Cuadro 2), encontradas en el Departamento del Magdalena: Sierra Nevada de Santa Marta, transecto Buritaca - La Cumbre (Righi 1984), Cundinamarca (Galvis, 1984) y Huila (Iafrancesco & Portella 1987). Entre 1991 y 2003 se registraron 54 especies nativas y cinco exóticas (Cuadro 2), siendo este período el de mayor crecimiento en el conocimiento de las lombrices del país, con estudios sobre sistemática, ecología, distribución geográfica, estudio de las interacciones con otros organismos y el suelo (Zicsi 1993, Feijoo 1993, 1994, Zicsi & Feijoo 1994, Jiménez et al. 1995, Righi 1995, Zicsi 1998, Decaens 1998, Feijoo & Knapp 1998, Feijoo et al. 1999, Jiménez 1999, Jiménez et al. 2000, Feijoo 2001, Zicsi & Feijoo 2002, Zicsi et al. 2002, Feijoo & Quintero 2002).
La curva temporal de los estudios relacionados con comunidades de lombrices está en crecimiento, hecho que se refleja en los registros: 27.4% para el período entre 1872 y 1918, 3.5 entre 1970 y 1980, 16.8 entre 1981 y 1990 y 52.2% entre 1991 y 2002.
La oligoquetofauna colombiana determinada en la actualidad esta compuesta por 113 especies situadas en nueve familias, 30 géneros y 6 subgéneros, de las cuales 90 son nativas y 23 exóticas. Como un indicador de la diversidad potencial de especies de Colombia se puede considerar las especies pendientes de descripción (12 especies de Jiménez y Moreno; 53 de Zicsi y Feijoo y algunas de Feijoo 2001).
Patrones de diversidad
El mayor porcentaje de colectas se han realizado en la región Andina, la cual está comprendida por tres cordilleras (Occidental, Central y Oriental), desde el departamento de Nariño en el sur de Colombia hasta los departamentos de Antioquia y Santander en el nor-occidente y oriente respectivamente (Anexo 1), con alturas que oscilan entre 50 y 3,500 m, y distancia entre colectas, tomando como eje central a Bogotá, entre 10 y 1,500 km. Si se tiene en cuenta que el número de especies por área es de cerca de 20 por cada 100,000 km2 (Fragoso 2001), en Colombia la estimación arrojaría 230. Sin embargo, estas cifras se consideraron para ambientes de zonas templadas con menor heterogeneidad y biodiversidad del paisaje.
El 93.2% de los registros de especies se hizo en la región Andina, 24 de los cuales pertenecen a la zona de vida ecuatorial, 43 a la zona de vida subandina y 19 a la zona de vida paramuna; predominando en la zona de vida ecuatorial las especies cosmopolitas y en la zona subandina las endémicas (Anexo 1). Los restantes registros se situaron en Orinoquía (cinco especies, 4%) y en la zona de vida ecuatorial de la Costa Pacífica (dos, 2%).
Familia Glossoscolecidae
La mayoría de las especies que ocupan la región Andina son endémicas de la familia Glossoscolecidae (16 géneros de 39 en la familia), la cual se distribuye desde México y el Caribe (Fragoso et al. 1995) hasta las riberas del río Sama en la frontera entre Perú y Chile, y las riberas del Valle del río Juramento Salado en el norte de Argentina y Paraguay (Righi 1972, 1984).
En la familia Glossoscolecidae se observaron ejemplos de especies nativas peregrinas. Siguiendo los criterios de Terborgh y Winter (1982) y de Michaelsen (1900), los glososcolecidos Martiodrilus agricola, Martiodrilus (Botaria) euzonus, M. (B) bicolor, M. (Cordilleroscolex) Magnus, M. (Martiodrilus) heterostichon y Maipure ecuadoriensis se ajustarían a la categoría de peregrinas (Feijoo 1993, 1994, Feijoo & Quintero 1998, 2002) debido a que se distribuyen a lo largo de la Cordillera de los Andes en Colombia y Ecuador. Estas especies se restringen a ciertos ambientes como selvas primarias o secundarias, cultivos multiestrata con sombra y cobertura superficial o en páramos; por lo que parecen ser especies que se han dispersado a lo largo de una vasta región, ocupando ambientes con características similares. Así mismo, se observó que en Colombia pocas especies de esta familia son cosmopolitas y que sólo Pontoscolex corethrurus y Onychochaeta elegans moran en ambientes antropocoros. La primera es una especie pantropical, que habita en suelos cultivados y pastizales por debajo de los 1800 m.s.n.m., mientras que la segunda se encuentra en suelos muy alterados por la extracción minera, en pastizales en Santa Fe de Antioquia y en ambientes con relictos de selva en el Tolima por debajo de los 1300 m.s.n.m. (Righi 1995, Feijoo datos no publicados).
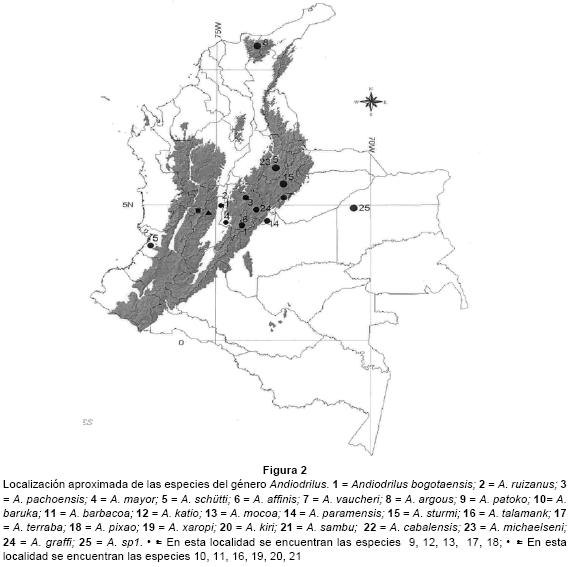
Andiodrilus fue el género de la familia representado por más especies (25). Con excepción de A. cabalensis que mora en bromelias, todas son habitantes del suelo de las regiones montañosas y presentan alta endemicidad. A. schütti, A. bogotaensis, A. pachoensis y A. argous son las especies con mayor distribución geográfica (Fig. 2). La primera coloniza suelos cultivados y pastizales en algunas localidades de las Cordilleras Central y Oriental, mientras que las otras se han adaptado a un amplio rango de variaciones altitudinales (Anexo 1). La única especie registrada para los Llanos Orientales fue Andiodrilus sp1, la cual habita en bosques de galería, sabanas nativas y pastizales mejorados de Brachiaria sp (Jiménez et al. 1995, 2001).
El segundo género en importancia fue Glossodrilus (16 especies), que es el de mayor número de especies de la familia (68). En general las especies de este género son de tamaño pequeño (25 - 45 mm y 1 - 2 mm de diámetro), despigmentadas, presentan gran endemicidad en pequeñas áreas y su distribución altitudinal es restringida (Fig. 3). La mayoría de las especies está distribuida en los Andes y moran donde la vegetación presenta diversos estratos, aunque también en pastizales (G. griseus y G. lacteus); Glossodrilus sp1 es la única especie en suelos de sabana, bosques de galería y pastizales de los Llanos Orientales (Jiménez et al. 1995).
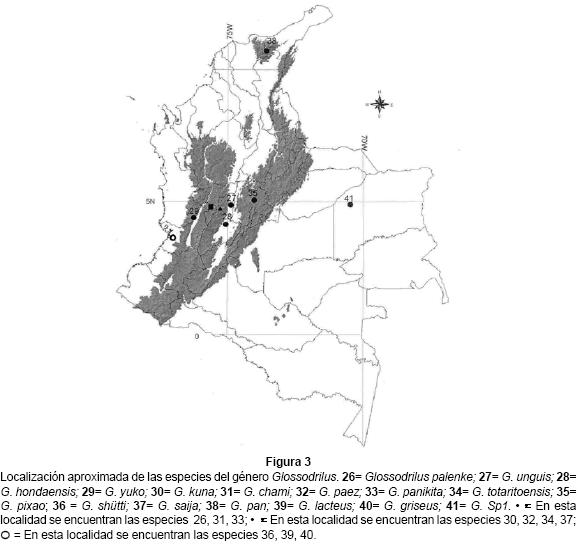
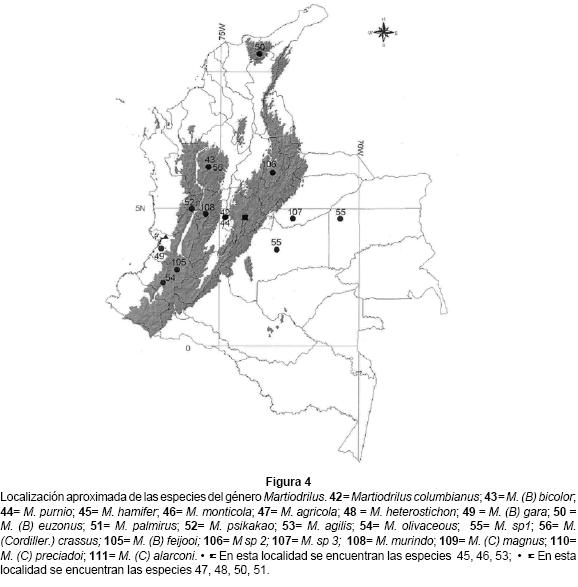
Martiodrilus, con 22 especies, ocupa la mayor diversidad de ambientes y gradientes altitudinales, desde selvas y pastizales en el páramo (M. agricola y M. (B.) euzonus) hasta sistemas de cultivo (M. sp 1 y M. (M) heterostichon) (Fig. 4). Tres especies (M. (C) columbianus, M. olivaceous y M. psikakao) son de gran tamaño y se han encontrado por encima de los 1600 m. de altitud en selvas o páramos de la cordillera Central; otras especies de gran tamaño (50 - 120 cm), aún no determinadas, se colectaron en los departamentos del Valle, Caldas, Caquetá, Putumayo y Nariño a orillas de los cursos bajos de los ríos (50 y 300 m.s.n.m.), o por encima de los 2500 m.s.n.m.
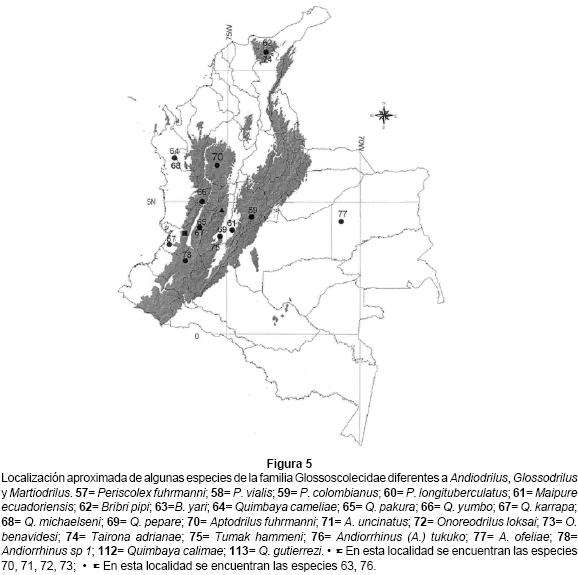
Quimbaya (ocho especies), Periscolex (cuatro), Aptodrilus (dos), Onoreodrilus (dos), Bribri (dos), y Tairona (una) son géneros con alto endemismo; habitan las selvas de la Cordillera de los Andes y con algunas excepciones (Aptodrilus fuhrmanni y A. uncinatus) presentan elevadas biomasas en pastizales de Pennisetum clandestinum. Las especies de Periscolex, difíciles de encontrar por su pequeño tamaño, son habitantes de la hojarasca y de los troncos en descomposición (Fig. 5).
Distribución de otras familias
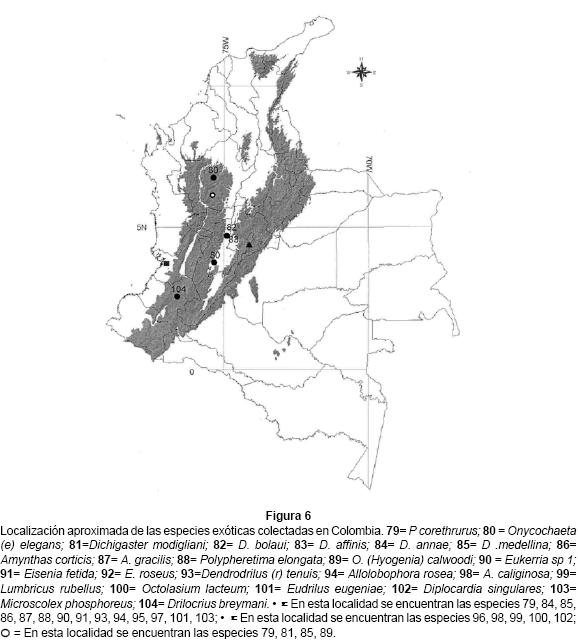
La única especie de Tumakidae, T. hammeni, es endémica y sólo se colectó en ambientes de selva, mientras que Dichogaster medellina es la única endémica de la familia Octochaetidae. Las restantes especies son euritópicas que llegaron a Colombia transportadas por el hombre desde Norte América, Europa, Asia o Africa (Sims 1980). Por ejemplo, los Lumbricidae (nueve géneros) se han adaptado, en su mayoría, a suelos cultivados y pastizales por encima de los 2,000 m.s.n.m.; los Megascolecidae (dos géneros) se hallan por debajo de los 2,200, excepto Amynthas corticis que se encuentra en diversos pisos térmicos desde el pacífico (50 m.s.n.m) hasta la cima de la cordillera de los Andes (Fig. 6). En la familia Octochaetidae (un género) se destaca D. annae que se distribuye desde los 100 hasta los 2,500 m, mientras que D. medellina sólo se halló desde los 2,200 hasta los 2,800 m de altitud; así mismo, las especies no identificadas de Ocnerodrilidae (una especie) y Acanthodrilidae (una especie) moran en el fango o en suelos húmedos y se caracterizan por su pequeño tamaño (20 - 40 mm). Una especie de la familia Eudrilidae, Eudrilus eugeniae, vive entre los 800 y los 1,100 m.s.n.m. en las riberas de los ríos del valle del Cauca. La familia Almidae con una especie (Drilocrius breymanni) es el primer registro para Colombia y mora en el fango o en suelos muy húmedos (Anexo 1).
Interacciones de las lombrices con el uso de la tierra y el paisaje
La zona de vida andina ofrece condiciones favorables (temperatura uniforme, elevada humedad relativa y disponibilidad de alimento) para la elevada diversidad de organismos en la pedobiocenosis. Olas de colonización humana propiciaron la fragmentación de las selvas y fueron conectando las áreas descubiertas desde los 2,000 m hasta los páramos, hasta dejar reducida la cobertura vegetal a un solo estrato, el superficial. En este paisaje son conspicuas las especies de la asociación lachemilleton, especialmente Lachemilla orbiculata y L. aphanoides, en extensos prados de tipo cespitoso que cumplen varias funciones importantes en la cobertura del suelo, pero ofrecen un perfil reducido para la vida de los oligoquetos. Por otro lado, esto también ha posibilitado que la diversidad y densidad de las lombrices sea importante.
Los sistemas montañosos Andinos e Interandinos y las selvas húmedas tropicales se caracterizan por la fragilidad frente a la degradación antropogénica. Las presiones que amenazan la diversidad de lombrices en Colombia están relacionadas con las actividades agrícolas y ganaderas y con la construcción de carreteras y viviendas. Por ejemplo, en cultivos en surco continuo por debajo de los 2,000 m de altitud (caña de azúcar, maíz, fríjol) o en pastizales (Brachiaria humidicola, B. mutica, Paspalum notatum, P. conjugatum, Cynodon plectostachyus o C. dactylon), las únicas especies de lombrices presentes son las exóticas P. corethrurus y P. elongata. Sin embargo, algunos sistemas de cultivo tradicionales - cafetales y cacaotales con sombrío - o pastizales asociados con leguminosas son ambientes propicios para la conservación de la diversidad, recolonización y multiplicación natural de las especies. Estos cultivos se han convertido en refugios que se vuelve imperativo investigar para evaluar la validez de los modelos relacionados con la transformación del paisaje.
Por encima de los 2,000 m de altitud, en pastizales (P. clandestinum, Calamagrostis efusa), cultivos de papa, cebolla junca y de algunos cereales como trigo y cebada la diversidad varía entre 4 y 9 especies con mezclas de nativas (A. fuhrmanni, A. uncinatus, M. ecuadoriensis, M. (B.) euzonus, M. agricola, Andiodrilus schuetti, Onoreodrilus benavidesi, Glossodrilus griseus, G. lacteus) y exóticas (A. corticis, Dendrodrilus rubidus rubidus, D. rubidus tenuis, Octolasion tyrtaeum) (Fig. 7).
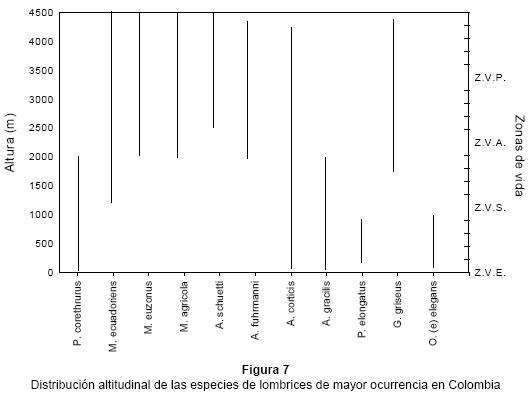
Todavía no son claros los factores del paisaje que han permitido la colonización, evolución, distribución y establecimiento de las lombrices a lo largo de la cordillera de los Andes. Feijoo (2001) analizó la relación entre algunos parámetros del suelo y la abundancia y la biomasa de lombrices, y encontró que el contenido elevado de carbono coincidió con una actividad alta y bajos valores con poblaciones reducidas. En muchos casos resulta difícil delimitar los rangos de adaptación al carbono para especies endémicas tales como O. loksai, O. benavidesi, M. ecuadoriensis, M. (B.) euzonus, A. schuetti, G. griseus, A. fuhrmanni y A. uncinatus, ya que estas especies se encontraron en sitios con valores de C desde 3 hasta 24%, mientras que entre las peregrinas P. corethrurus, A. gracilis, A. corticis, E eugeniae, O. tyrtaeum, A. rosea y E. tetraedra, el rango es más restringido (entre 2.4 y 5.9%) (Feijoo 1993). Este último patrón puede explicarse si se considera que las especies exóticas invaden los ambientes depauperados en carbono, el cual a su vez fue en parte la causa de la desaparición de las especies endémicas. La pérdida de Carbono ocurre generalmente en los ambientes perturbados, en donde la tala de la estructura aérea de la vegetación, incrementa la intensidad lumínica, acelera la descomposición de la hojarasca y disminuye la humedad en el piso selvático. Algunas especies de mayor plasticidad ambiental tales como M. agrícola, M. ecuadoriensis, A. fuhrmanni y G. griseus, se sobreponen sin embargo a esta alteración; su persistencia en estos ambientes podría deberse a que se benefician de la disminución de la competencia por espacio y alimento y de la presión de los depredadores y a que posiblemente sean muy eficaces para establecer interacciones con organismos y microorganismos. En relación con el pH el patrón de adaptación fue variable y en muchas ocasiones fluctuó de acuerdo con la especie. Por ejemplo, las endémicas A. fuhrmanni, M. ecuadoriensis, O. benavidesi, A. schuetti y G. griseus, por un lado, y M. (B.) euzonus y O. loksai por el otro, se encontraron en suelos con pH entre 2.9 y 4 y menor de 2.9 respectivamente. Para las exóticas el rango del pH fue menos amplio (4.4 - 7.2) (Feijoo 1993). Estos datos sugieren que la asociación entre el pH y la presencia de una especie no es alta, y que habría que darles más peso a otros factores como la alteración del hábitat. En general se puede decir que en los medios no perturbados en donde el C tiende a ser alto y el pH bajo moran las endémicas, mientras en los sitios alterados colonizados por cosmopolitas, el carbono es menor y se eleva el pH. La granulometría fue amplia tanto para las endémicas M. ecuadoriensis, O. benavidesi, A. schuetti y A. fuhrmanni (8 - 38%, 6 - 25%, 6 - 24% y 6 -19% de arcillas respectivamente), como para las exóticas P. corethrurus y P. elongata que se encontraron entre 12 y 35% de arcilla.
Por otro lado, Feijoo (2001) también encontró que la mayor abundancia de lombrices se observó, en la mayoría de los casos, en pastizales colonizados por especies exóticas. Después de la tala y quema de la vegetación original (Selva Andina, Subandina, Páramos y Selvas Húmedas), se establecen cultivos transitorios para dar paso al pastizal. Probablemente estas prácticas han incidido en la distribución de las lombrices exóticas, pues el enriquecimiento con los excrementos del ganado de los cespedones de P. clandestinum, ha sido probablemente la causa de la dispersión de A. corticis a los sitios de siembra.
DISCUSIÓN
Diversidad y distribución geográfica
La mayoría de las especies de lombrices encontradas en Colombia (88 spp) están incluidas en la familia Glossoscolecidae, de las cuales 86 son nativas y dos son exóticas (P. corethrurus y O. (e) elegans). Las especies de esta familia predominan en la región Andina colombiana, ecuatoriana, peruana y venezolana. Los géneros comunes son Martiodrilus y Aptodrilus para Colombia, Ecuador y Perú, Andiodrilus, Glossodrilus, Onoreodrilus, Aptodrilus, Holoscolex y Periscolex para Ecuador y Colombia y Andiodrilus, Andiorrhinus, Glossodrilus y Onychochaeta para Venezuela y Colombia. Solamente Colombia y Ecuador tienen especies comunes tales como M. (M) heterostichon, M. agricola, M. (B) euzonus, M. (B) bicolor, M. (C) magnus y M. ecuadoriensis, que coexisten con especies exóticas en agroecosistemas alterados. Debido a que un mayor número de glándulas calcíferas (como en el caso de Martiodrilus: 8 pares) y la holandria con dos pares de ductos simples masculinos independientes se consideran caracteres ancestrales, se propuso como probable centro de origen de la familia Glossoscolecidae a la región comprendida entre Mérida (Venezuela) y las cordilleras Occidental y Oriental en Colombia, en donde se encuentran géneros con estas características. A partir de aquí la familia se dispersó hacia el occidente y al norte hasta Costa Rica y al sur a través de los ríos Orinoco y Amazonas y en pequeño número hasta las riberas del río Paraguay (Righi 1984). Con relación a los géneros derivados, el mismo autor sugiere que Quimbaya se formó por la elongación de algunos de los tubos de las glándulas calcíferas en la unión con el vaso sanguíneo axial, mientras que Perolofius surgió por la reducción de los tubos calcíferos y por la desaparición de los órganos genitales anteriores (Righi 1984). A partir de estos cambios morfológicos se pudieron desencadenar una serie de eventos evolutivos que permitieron la conformación y diversificación de los géneros actuales en las regiones selváticas y su adaptación a pequeños relictos que conservaron la diversidad actual. En Colombia, varios estudios indican que de una cuenca hidrográfica a otra, hay varias especies diferentes. Por ejemplo Feijoo (1993) en el inventario de dos cuencas (Amaime y Nima) próximas, diferenció 10 y 13 especies nativas por cuenca respectivamente, mientras que Righi (1995) en dos transectos en el Parque de los Nevados y el Parque Nacional Tatamá, describió 30 especies y una nueva familia (Tumakidae). Posteriormente, Feijoo (2001) diferenció 10 especies en la cuenca del río Cabuyal, Cauca.
El patrón de distribución de la oligoquetofauna de Colombia se caracterizó por la presencia de especies que se podrían aglutinar en cinco grupos:
- Las especies nativas que habitan ambientes restringidos de las selvas Andinas, húmedas tropicales o de las sabanas nativas de los Llanos Orientales, por ejemplo M. palmirus, O. loksai, O. benavidesi y M. columbianus.
- Las especies nativas con amplia distribución, las cuales viven en ambientes que van desde selvas hasta sistemas de cultivo multiestratificados y pastizales, tales como Andiodrilus ruizanus, A. uncinatus, G. griseus, G. lacteus y Martiodrilus sp n 1.
- Las especies exóticas introducidas de Europa o Norte América que habitan en suelos por encima de los 1,500 m de altitud, como por ejemplo Dendrodrilus (r) tenuis, Dendrobaena octaedra, Allolobophora rosea y O. tyrtaeum.
- Las especies exóticas introducidas de Asia y Africa que invaden suelos con abundante cobertura superficial y que ocurren en ambientes desde 50 hasta 3900 m.s.n.m, tales como A. corticis, A. gracilis, E. eugeniae y D. annae.
- Las especies exóticas con origen en el Neotrópico que invaden sistemas de cultivo con alta degradación y que se encuentran por debajo de los 1800 m de altitud, por ejemplo O. elegans y P. corethrurus.
A nivel local, las especies con distribución amplia en las cuencas de los ríos Amaime y Nima (departamento del Valle), en la cuenca del río Cabuyal (Cauca), en el transecto parque de los Nevados - Cordillera Central (Tolima y Risaralda), y en el transecto Tatamá - Cordillera Occidental (Chocó, Risaralda y Valle) fueron M. ecuadoriensis, M. agricola, P. corethrurus, A. gracilis, y A. corticis. Por el amplio rango de distribución y por la capacidad para adaptarse a diversos ambientes, se consideraron como especies con alto uso potencial en actividades agrícolas y ambientales.
Por otro lado, la distribución de las lombrices está asociada con factores que operan en diferentes escalas de tiempo y espacio: el tipo de vegetación (ambientes de selva, relictos secundarios y pastizales introducidos), suelos (Andosoles, Inceptisoles, Ultisoles, Oxisoles y Vertisoles) y el régimen climático en diferentes gradientes altitudinales, favorecen las altas tasas de endemismo y contribuyen a que exista una elevada diversidad del hábitat (alfa), entre hábitats (beta) y geográfica (gama). La alta diversidad de lombrices se debe a que las especies se encuentran en hábitats geográficamente aislados por las cordilleras, ríos o cambios en el tipo de vegetación, por cambios en los suelos y por el micro-relieve que frecuentemente limitan el movimiento de las especies; en cada sitio, sin embargo las especies ocupan condiciones ecológicas similares. Los sitios que ocupan las especies endémicas se caracterizan por una alta acidez de los suelos, una baja actividad microbial, una baja temperatura y una baja capacidad de intercambio catiónico; por tales razones, podemos especular que estas especies probablemente han desarrollado el sistema digestivo endosimbiótico facultativo o de rumen externo para modificar la materia orgánica a través del establecimiento de relaciones mutualísticas con microorganismos y raíces, lo que les habría permitido explotar los recursos orgánicos del mantillo y del suelo (Barois & Martin 1989, Lavelle et al. 1995).
El patrón de las comunidades de lombrices de la región Andina coincidió con el señalado por Fragoso et al. (1999) para otras comunidades: "cuando la selva natural y las sabanas son convertidas en agroecosistemas, éstas cambian en abundancia, biomasa, número de especies, categorías ecológicas y composición de especies".
La existencia de centros de endemismo y/o diversidad de especies en la región amazónica está bien fundamentado (Prance 1973, Huston 1994), aún cuando se ha cuestionado la validez de la teoría de los refugios como explicación de los patrones de endemismo y diversidad de especies en el trópico (Huston 1994). Así los altos niveles de endemismo y alta diversidad de especies (diversidad geográfica) no requieren la existencia histórica de refugios, y se puede explicar por procesos corrientes. De hecho en algunas situaciones, altos niveles de heterogeneidad topográfica están asociados con el endemismo y la diversidad de especies (Huston 1994). Por tanto, en la región Andina el elevado endemismo de lombrices, podría estar correlacionado con la irregularidad del paisaje, la presencia frecuente de corrientes de aguas y con el cambio de la vegetación, así como con las variaciones de altitud, precipitación y temperatura. El estudio de las lombrices de tierra de la región Andina y del piedemonte tropical seguramente nos aportará interesantes datos sobre la relación entre el levantamiento del sistema de montañas y la evolución de estos organismos (Righi & Van der Hammen 1995).
Finalmente y con objeto de estudiar la diversidad de lombrices, proponemos como agenda de trabajo dividir a Colombia y los países vecinos en las siguientes regiones: i) el piedemonte de las cordilleras, ii) los Llanos Orientales, iii) el Chocó Biogeográfico desde Panamá hasta Ecuador y iv) la cordillera de los Andes en Ecuador, Colombia y Venezuela.
Impacto de la perturbación e importancia como bioindicadores
Al sustituir la selva andina, subandina o la sabana nativa por pastizales, se modifican las comunidades de lombrices y algunas especies se benefician con el cambio. Por ejemplo en la región Andina las endógeas Andiodrilus schuetti, A. bogotaensis, A. fuhrmanni, A. uncinatus, G. griseus y G. lacteus son abundantes y coexisten con exóticas, mientras que en Carimagua, varias especies nuevas de Martiodrilus, Andiodrilus y Glossodrilus se mantienen en los pastizales derivados de las sabanas. Otros grupos de especies epígeas (Onoreodrilus benavidesi, O. loksai, M. palmirus y D. medellina) son frágiles y desaparecen con la modificación del paisaje.
A pesar del carácter preliminar de los hallazgos, se pueden reconocer dos formas de utilizar a las lombrices como indicadoras. La primera se relaciona con la fertilidad natural del suelo, ya que para garantizar el funcionamiento de los ecosistemas y los servicios ambientales del mismo, el sistema debe incluir entre otros grupos funcionales a los productores primarios (vegetación cultivada, arvenses, arbustos y árboles), a los fragmentadores (diplópodos) y por lo menos dos de las tres categorías ecológicas de lombrices: i) las epigeas que modifican la circulación de los nutrimentos de la materia orgánica, ii) las endogeas que consumen partículas minerales y que modifican la estructura del suelo con su actividad cavadora y producción de heces al interior y exterior del suelo y iii) las anécicas o endoanécicas que conjugan las dos estrategias anteriores. El segundo enfoque, tiene relación con el uso de las lombrices como bioindicadores de señales tempranas de trayectorias de degradación, o de recuperación de los medios de cultivo. Se requiere de una mayor investigación futura sobre estos dos aspectos, y en particular de las interacciones entre especies de diferentes niveles tróficos, para en el futuro poder utilizar rutinariamente a las lombrices como indicadoras de la calidad / salud del suelo.
Es evidente que el uso de las lombrices como indicadoras de la calidad del suelo requiere de la interacción de varias disciplinas. Sobre todo cuando se trate de inculcar este conocimiento, mediante metodologías amigables de muestreo, al trabajo comunitario con los agricultores. Esta estrategia posibilitará un mejor monitoreo de la importancia de los recursos naturales a nivel del paisaje (preferentemente en ensayos de largo plazo y en escalas espaciales amplias), tales como el grado de desarrollo de la capa arable, la calidad del agua superficial y subterránea, las emisiones de gases como CO2, CH4 y óxidos de nitrógeno, entre otros.
Conclusiones
No obstante el carácter no sistemático de los muestreos y los territorios que aún faltan por explorar, uno de los hechos sobresalientes en este estudio fue la alta diversidad local y regional. Estos resultados refuerzan el papel de la cordillera de Los Andes en la conformación de la rica diversidad del Neotrópico.
Las 113 especies registradas constituyen un inventario parcial, que deberá continuar creciendo con las investigaciones futuras. Para lograr esto sin embargo, será necesario mantener el interés de los investigadores y unir esfuerzos para formular propuestas robustas de investigación sistemática sobre los oligoquetos de las regiones biogoegráficas colombianas. En particular el número de especies deberá incrementarse significativamente cuando se logren estudiar las lombrices de tierra por debajo de los 1000 m, principalmente en selvas húmedas tropicales.
El dominio de la familia Glossoscolecidae (78% de las 113 especies encontradas, y casi todas nativas), señala que futuros proyectos deberán concentrarse justamente en esta familia. El potencial de utilizar a las lombrices nativas como bioindicadores de la calidad del suelo, hace necesario que las investigaciones futuras también incluyan la evaluación del impacto de diferentes sistemas de producción agropecuarios sobre las poblaciones de lombrices terrestres.
Si bien en Colombia ha ocurrido un incremento de los estudios faunísticos y ecológicos sobre las lombrices de tierra, todavía falta mucho por hacer; sobre todo si se pretende comprender el papel que desempeña esta biodiversidad de especies en el funcionamiento de los ecosistemas naturales y agroecosistemas derivados.
AGRADECIMIENTOS
El primer autor agradece a María Constanza Zúñiga, Manuel A. Trujillo, Edwin B. Knapp, Alberto Escobar y Mario Mejía G. por sus valiosas contribuciones y apoyo durante el trabajo, y a la Universidad Nacional de Colombia, Sede Palmira, al Centro Internacional de Agricultura Tropical, CIAT y a la Corporación Autónoma Regional del Valle del Cauca (CVC) y al Proyecto PIP CYTED XII.3 por la financiación de dos estancias de investigación del primer autor en México y España, respectivamente.
LITERATURA CITADA
Andrade, G. I., R. Gómez & J. P. Ruiz. 1992. Biodiversidad, conservación y uso de recursos naturales - Colombia en el contexto Internacional. Bogotá. CEREC - FESCOL. 126 p. [ Links ]
Ayala, S. C., B. Morris, B. Rooney, A. Stuart & B. Woodhull. 1972. A colony of giant Andean earthworms. Bioscience, 22 (5): 229 - 301. [ Links ]
Barois, I. & A. Martin, A. 1989. Interactions entre les vers de terre et la microflore du sol pour l'explotaton de la matiere organique du sol. Pp. 16 -25. In: P. Lavelle (Ed.) Processus biologiques et fertilite du sol dans les savanes humides de Cote D'Ivoire. Programme TSBF Cote D'Ivoire (IUBS/MAB-UNESCO) repor dávances No. 2. [ Links ]
Beddard, F. E. 1892. The earthworms of the Vienna Museum. Ann. Mag. Nat. Hist., 6 (9): 113 -134. [ Links ]
Cognetti De Martiis, L. 1902. Gli oligocheti della regione neotropicale II. Mem. Accad. Torino, 56: 147 - 262. [ Links ]
----------. 1906. Viaggio del Dr. A. Borelli nel Chaco boliviano e nella Republica Argentina. Boll. Mus. Torino, 17: 1 - 11. [ Links ]
Chamorro, B. 1981. Correlación entre la población de lombrices de tierra y sus características físico - químicas de tres suelos seleccionados de la Sabana de Bogotá. Tesis Mg. Sci. Bogotá, Univ. Nac. Colombia, Instituto Colombiano Agropecuario. [ Links ]
----------. 1986. Actividad de las lombrices de tierra en el Páramo de Chisacá (Cundinamarca - Colombia). Suelos Ecuatoriales, 16 (1): 95 - 101. [ Links ]
Cuatrecasas, J. 1958. Aspectos de la vegetación natural de Colombia. Rev. Acad. Colombiana de Cienc. Exactas Físico - Químicas y Naturales, 10 (40): 221 - 268. [ Links ]
Deçaens, T. 1998. Role fonctionnel et résponses aux pratiques agricoles des vers de terre et autres ingénieurs écologiques dans les savanes colombiennes. Thése de doctorat, Univ. Pierre et Marie Curie (Paris VI). 374 p. [ Links ]
Dominguez, C., L. A. Oviedo & R. C. Sandoval. 1990. Estudio de las poblaciones de lombrices de tierra (Annelida, Oligochaeta) del piso térmico cálido en el Departamento del Tolima. Tesis post grado, Univ. del Tolima. Ibagué. 195 p. [ Links ]
Fajardo, G. & C. Prince. 1976. Ciclo biológico y algunos aspectos ecológicos de las lombrices de tierra en dos suelos de la sabana de Bogotá. Tesis Biólogo. Bogotá, Univ. Nac. Colombia, 77 p. [ Links ]
Feijoo, M. A. 1993. Inventario de las lombrices de tierra (Annelida, Oligochaeta) de una región del departamento del Valle. Palmira. Univ. Nac. Colombia. Trabajo de Grado. 186 p. [ Links ]
----------. 1994. Relaciones espacio temporales de algunas lombrices de tierra con uso potencial en agricultura. Suelos Ecuatoriales, 24: 99-102. [ Links ]
----------. 2001. Impacto del uso de la tierra en áreas de laderas sobre comunidades de macrofauna del suelo (Caldono, Cauca, Colombia). Palmira. Univ. Nac. Colombia. Tesis de Doctorado. 216 p. [ Links ]
Feijoo, M. A. & B. E. Knapp. 1998. El papel de los macroinvertebrados como indicadores de fertilidad y perturbación de suelos de laderas. Suelos Ecuatoriales, 28: 254-259. [ Links ]
Feijoo, M. A., B. E. Knapp, P. Lavelle & A. G. Moreno. 1999. Quantifying soil macrofauna in a Colombian watershed. Pedobiologia, 43: 513-517. [ Links ]
Feijoo, M. A. & H. Quintero. 1998. Glossoscolecidae de una región de los Andes del departamento del Valle, Colombia. Suelos Ecuatoriales, 28:248-253. [ Links ]
----------. 2002. Las lombrices de tierra: recursos de uso potencial en la fertilidad del suelo en Colombia. Rev. Scientia et Techne, 7 (18): 117-122. [ Links ]
Fragoso, C. 2001. Las lombrices de tierra de México (Annelida, Oligochaeta). Diversidad, Ecología y manejo. Acta Zool. Mex. (n.s.), 1: 131-171. [ Links ]
Fragoso, C., S. James & S. Borges. 1955. Native earthworms of the North Neotropical region: Current status and controversies. Pp. 67 - 115. In: Hendrix P.F. (Ed.). Earthworm ecology and biogeography in North America. Boca Ratón, Florida. Lewis Publishers. [ Links ]
Fragoso, C., P. Lavelle, E. Blanchart, B. Senapati, J. Jiménez, M. Martínez, T. Decaens, & J. Tondoh. 1999. Earthworm communities of tropical agroecosystems: origin, structure and influence of management practices. Pp. 27-55. In: Lavelle, P., Brussaard, L. and Hendrix, P. (Eds). Earthworm management in tropical agroecosystems. Wallinford, CABI International. [ Links ]
Galvis, V. 1984. Anatomía externa e interna de la lombriz de tierra Andiodrilus bogotaensis (Mich., 1900), (Glossoscolecidae, Oligochaeta). Tesis de Grado. Univ. Javeriana, Fac. Cienc., Bogotá, Colombia. [ Links ]
Hernández, C. A. 1992. Caracterización geográfica de Colombia. Pp. 45-53. In: Halffter, G. (Ed). La diversidad biológica de iberoamérica I. Acta Zool. Mex. Vol. especial. Instituto de Ecología, A. C. Xalapa, México.
Hofstede, R. 2002. Los páramos Andinos; su diversidad, sus habitantes, sus problemas y sus perspectivas. Un breve diagnóstico regional del estado de conservación de los páramos. www.páramo.org./regional.pdf. 25 p. [ Links ]
Huston, M. A. 1994. Biological diversity: The coexistence of species on changing landscapes. Cambridge University Press. 681 p. [ Links ]
Iafrancesco, V. G. & A. E. Portella. 1987. Contribución a los estudios de Anélidos glossoscolecidos de Colombia; morfología y anatomía de Martiodrilus crassus. Univ. Javeriana. Fac. Ciencias, Bogotá. p. 66-83. [ Links ]
Instituto Alexander Von Humboldt. 1998. I.A.V.H Programa de Inventario de la diversidad. Grupo de Exploraciones y Monitoreo Ambiental (GEMA). 24 p. [ Links ]
James, S. W. 1990. Martiodrilus olivaceous y M. panamensis, new earthworms from Colombia and Panamá (Oligochaeta: Glossoscolecidae). Zool. Scripta, 19 (3): 305 - 308. [ Links ]
Jiménez, J. 1999. Estructura de las comunidades y dinámica de las poblaciones de lombrices en las sabanas naturales y perturbadas de Carimagua (Colombia). Univ. Complutense de Madrid. Tesis de Doctorado. 311 p. [ Links ]
Jiménez, J. J., G. G. Brown, T. Decaëns, A. Feijoo & P. Lavelle. 2000. Differences in the timing of diapause and patterns of aestivation in some tropical earthworms. Pedobiologia, 44(6): 677-694. [ Links ]
Jiménez, J., A. G. Moreno, T. Decaens, J. P. Rossi & P. Lavelle. 1995. The earthworms community of Carimagua (eastern plains, Colombia): taxonomy and ecology of species. Looking forward to a sustainable way of land management?. EC Final report. 32p. [ Links ]
Jiménez, J., A. G. Moreno, T. Decaens, P. Lavelle, M. Fisher & J. R. Thomas. 1998. Earthworm communities in native savannas and man-made pastures of the easter plains of Colombia. Biol. Fertil. Soil, 28: 101-110. [ Links ]
Jiménez, J. J., A. G. Moreno & P. Lavelle. 2001. Reproductive strategies of three native earthworm species from the savannas of Carimagua (Colombia). Jiménez, J. J. and Thomas, R. (Eds.). Pp. 79 - 86. In: Soil macroinvertebrate communities in the Neotropical savannas of Colombia. Cali, Centro Internacional de Agricultura Tropical (CIAT). [ Links ]
Jiménez, J. J. & R. Thomas. 2001. Soil macroinvertebrate communities in the Neotropical savannas of Colombia. Cali, Centro Internacional de Agricultura Tropical (CIAT). [ Links ]
Lavelle, P., C. Lattaud, D. Trigo. & I. Barois. 1995. Mutualism and biodiversity in soils. Plant and Soil, 170: 23-33. [ Links ]
Michaelsen, W. 1900. Die terricolen Fauna columbiens. Naturgesch, 66: 231 - 266. [ Links ]
----------. 1910. Oligochaeten von verschiedenen Gebieten. Mitt. Mus. Hamb., 27: 47 - 169. [ Links ]
----------. 1913. Die oligochaten Columbias. In: Fuhrmann O. et Mayor E. "voyage D'exploration scientifique en Columbie. Ed. Mem. Soc. neuchat. Scinat., 5: 202 - 252. [ Links ]
----------. 1918. Die lumbriciden, mit besonderer Berucksichtigung der bisher als familie Glossoscolecidae zusammengefaBten unterfamilien. Zool. Jb. Syst., 41: 1 - 398. [ Links ]
Prance, G.T. 1973. Phytogeography support for the theory of pleistocene forest refuges in the Amazon Basin, based on evidence of distribution pattern in Caryocaraceae, Chrisobalanaceae, Dichapetalaceae, and Lecythidaceae. Acta Amazonica, 3, 5 -28. [ Links ]
Rangel, J. O. & M. Aguilar. 1994. Una aproximación sobre la diversidad climática en las regiones naturales de Colombia. Pp. 25-76. In: Rangel, J. O. Colombia diversidad biótica I. Bogotá, Ed. Guadalupe ltda. [ Links ]
Righi, G. 1972. Bionomic consideration upon the Glossoscolecidae (Oligochatea). Pedobiologia, 12: 254 - 260. [ Links ]
----------. 1984. On some earthworms (Oligochaeta, Glossoscolecidae) from the Sierra Nevada de Santa Marta (Colombia). Pp. 455 - 468. In: Hamman, T. Van der & Ruiz, P. M. (Ed.). Studies on Tropical Andean Ecosystems, 2. J. Cramer, Berlin. [ Links ]
----------. 1995. Colombian earthworms. Pp. 485-607. In: T. van der Hammen & A.G. dos Santos (Eds). Studies on tropical Andean Ecosystems/Estudios de Ecosistemas Tropandinos 4. Cramer. Berlin. [ Links ]
Righi, G. & R. H. Garcia. 1989. Duas espécies de Oligochaeta da Colombia. Rev. Bras. Biol., 49 (2): 415 - 420. [ Links ]
Righi, G. & T. Van Der Hammen. 1995. Distribución de especies de lombrices en las dos vertientes de la cordillera Central (transecto Parque de Los Nevados, Colombia). Pp. 445-483. In: T. van der Hammen & A. G. dos Santos (Eds). Studies on tropical Andean Ecosystems/Estudios de Ecosistemas Tropandinos 4. Cramer. Berlin. [ Links ]
Sims, R. W. 1980. A classification and the distribution of earthworms, suborder Lumbricina (Haplotaxida: Oligochaeta). Zoology series, 39 (2): 103 - 124. [ Links ]
Terborgh, J. & B. Winter. 1982. Evolutionary circumstances of species with small ranges. p. 587-600. Columbia Univ. Press, N.Y. [ Links ]
Van Der Hammen, T. 1997. Prólogo. In: Rangel, J.O. (Ed.). Colombia diversidad biótica I. Santafé de Bogotá, Ed. Guadalupe Ltda. 442 p. [ Links ]
Zicsi, A. 1988a. Neue Andiodrilus - Arten aus Kolumbien (Oligochaeta: Glossoscolecidae). Regemwurmer aus Sudamerika 5. Rev. Suisse Zool., 95 (3): 715 - 722. [ Links ]
----------. 1988b. Beitrage zur Kenntnis einiger Martiodrilus -Arten aus Ekuador (Oligochaeta: Glossoscolecidae) Regenwurmer aus Sudamerika 6. Rev. Suisse Zool., 95 (4): 953 - 959. [ Links ]
----------. 1988c. Weitere neue und bekannte Martiodrilus - Arten aus Ekuador und Kolumbien (Oligochaeta: Glossoscolecidae). Regenwurmer aus Sudamerika, 7. Acta Zool. Hung., 34 (4): 435 - 446. [ Links ]
----------. 1989. Uber zwei Periscolex - Arten aus dem Anden - Gebiet Kolumbiens und Ekuadors (Oligochaeta: Glossoscolecidae) (Regenwurmer aus Sudamerika 10). Rev. Suisse Zool., 96 (1): 19 - 24. [ Links ]
----------. 1992. Uber weitere neue und bekannte Arten der Gattung Periscolex (Oligochaeta: Glossoscolecidae) Regenwurmer aus Sudamerika 16. Rev. Suisse Zool., 99: 211 - 217. [ Links ]
----------. 1993. Revision der Gattung Andiodrilus Michaelsen, 1900 (Oligochaeta, Glossoscolecidae) Regenwurmer aus Sudamerika 17. Acta Zool. Hung., 39 (1-4): 311-342. [ Links ]
----------. 1997. Revision der gattung Aptodrilus Cognetti 1904 (Oligochaeta: Glossoscolecidae). Opusc. Zool. Budapest, 29 - 30.
----------. 1998. Revision weitere Martiodrilus arten (Oligochaeta: Glossoscolecidae) regenwurmer aus Sudamerika, 30. Opusc. Zool. Budapest, 31: 149 - 164. [ Links ]
----------. 2000. Revision der untergattung Martiodrilus (Martiodrilus, 1936) (Oligocahaeta: Glossoscolecidae) regenwurmer aus Sudamerika, 29. Opusc. Zool. Budapest, 32: 139 - 167. [ Links ]
Zisci, A., C. Csudzi & M. A. Feijoo. 2002. Neu und becante Reiesenregenwürmer aus Kolumbien, Ecuador und Peru (Oligochaeta: Glossoscolecida). Regenwürmer aus Sudamérica 35. Rev. Suisse Zool., 109: (4): 785 - 796. [ Links ]
Zicsi, A. & M. A. Feijoo. 1994. Regenwurmer aus der Zentral Kordillere Kolumbiens (Oligochaeta, Glossoscolecidae) Regenwurmer aus Sudamerika 21. Mit. Hamb. Zool. Mus., 23 (2): 55 - 62. [ Links ]
----------. 2002. Neue Quimbaya- und andere Regenwurmarten aus Kolumbien und Ecuador (Oligochaeta: Glossoscolecidae) Regenwürmer aus Sudamérica 36. Ber. Nat.-med. Verein Innsbruck, 89: 111 - 121. [ Links ]














