Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta zoológica mexicana
versión On-line ISSN 2448-8445versión impresa ISSN 0065-1737
Acta Zool. Mex no.89 Xalapa ago. 2003
Artículo
Ecología de la anidación de Crocodylus acutus (Reptilia: Crocodylidae) en la desembocadura del río Cuitzmala, Jalisco, México
Gustavo Casas-Andreu
Instituto de Biología, Universidad Nacional Autónoma de México Apartado Postal 70-153, 04510 México, D.F. MÉXICO. gcasas@servidor.unam.mx
Recibido: 8 de noviembre 2001
Aceptado: 21 de noviembre 2002
Resumen
Se estudió la ecología de la anidación del Cocodrilo Americano (Crocodylus acutus) en la desembocadura del Río Cuitzmala en la costa de Jalisco, México, en las temporadas de 1990 a 1993. La temporada de anidación es durante los meses de abril y mayo. Al analizar los datos compilados por otros autores y los de este estudio, se observa una tendencia latitudinal en el inicio de la anidación, siendo más temprana a bajas latitudes y más tardía a altas latitudes. Este mismo patrón puede ser aplicado a C. acutus de las vertientes del Golfo de México y el Caribe. La temporada de anidación en el área de estudio se presenta durante los meses más secos del año y es cuando la oscilación térmica diaria promedio de mínimas y máximas varía entre 15°C y 38°C en enero y entre 14°C y 35°C previo al inicio de la anidación en marzo; la fase de luna nueva parece coincidir con la excavación de los primeros nidos. Aparentemente existe fidelidad de las hembras por el nido. La hembra más pequeña midió 225 cm de longitud total, mientras que las más grandes midieron 305 cm. Los nidos fueron hoyos excavados en el substrato, orientados en su mayoría al sur, con suelos de pH cercanos a la neutralidad y con textura arenosa, areno-limosos y areno-limo-arcillosos y con una humedad entre 0.48 y 25.58%. Existe menor porcentaje de humedad y temperaturas más bajas en los nidos arenosos que en los nidos con un porcentaje mayor de limos y arcillas, que son significativamente más húmedos y con temperaturas mayores. La cobertura de la vegetación sobre los nidos estaba entre cero y 30%. El número de huevos por nido fluctuó entre nueve y 54 (promedio 27.9 ± 13.2). La viabilidad de los huevos promedió 80.7 ± 21.0. Existe una tendencia a que las hembras más grandes presenten huevos con mayor longitud y peso, con alta natalidad y viabilidad. El promedio de días de incubación fue de 83. Hay una tendencia a que los huevos con mayor longitud y peso, muestren una alta natalidad y viabilidad en las hembras más grandes, así como que los nacimientos ocurran a principios o durante la temporada de lluvias.
Palabras clave: Crocodylus acutus, ecología reproductora, ecología de la anidación, Jalisco, México.
Abstract
The nesting ecology of the American crocodile (Crocodylus acutus) was studied in the region of the Cuitzmala river mouth in Jalisco State, Mexico, from 1990 to 1993. Nesting occurred from mid-April to May, during the annual dry season, coinciding with high daily temperature variations. The initiation of nesting also appeared to be related to the presence of a new moon. Compared to other sites along the Pacific coast of the Americas, C. acutus in Jalisco nests late in the year, and timing of nesting appears to be related to latitude. Populations of C. acutus along the Gulf of Mexico and Caribbean show a similar latitudinal pattern. Females exhibit a tendency to nest fidelity. Total length of the smallest nesting female was estimated to be 225 cm, and largest was 305 cm. Nests were holes excavated in sand, sand-lime, or sand-lime-clay soils and percent of soil moisture ranged from 0.48% to 25.58%, with pH close to neutrality. Nests in sandy soils tended to have lower soil moisture levels and higher temperatures. Most nests faced south, and vegetation cover ranged from 0% to 30%. Clutch size ranged from nine to 54 (mean 27.9 ± 13.2). Overall egg viability was 80.7 ± 21.0%. It was found that larger females tend to have larger and heavier eggs, higher egg viability and natality. Hatching takes place during the annual rainy season.
Key Words: Crocodylus acutus, reproductive ecology, nesting ecology, Jalisco, Mexico.
Introducción
El conocimiento de los diferentes aspectos de la biología de una especie es fundamental para el entendimiento de su posición en el ambiente, sus relaciones intra e interespecíficas, así como su adecuado manejo y en su caso aprovechamiento. Los cocodrilos forman parte de esta intrincada maraña, ocupando los lugares más altos en la cadena de alimentación; no obstante, su conocimiento se ha incrementado apenas en los últimos veinticinco años.
Los nuevos aportes a la ecología reproductora de estos animales, también han seguido esta misma secuencia, sin embargo, y como bien lo señalan Thorbjarnarson y Hernández (1993), la mayoría de los estudios se han realizado solamente en algunas especies, sobre todo en Alligator mississippiensis (Joanen 1969, Lance 1989, Vliet 1989), Crocodylus niloticus (Cott 1961, Hutton 1984, Kofron 1989, 1990) y Crocodylus porosus (Webb et al. 1977, 1983, Messel & Vorlicek 1989) y se han producido síntesis interesantes para el grupo (Ferguson 1985), por mencionar algunos. Existen otras especies en las que se ha producido cierta información sobre la reproducción, no obstante, la necesidad de una mayor cantidad de estudios es de importancia vital, para la implantación de programas más efectivos en su conservación.
Aun cuando existe información sobre la reproducción de Crocodylus acutus (Ogden, 1978, Alvarez del Toro 1974, Medem 1981, 1983, Kushlan & Mazzotti 1989, Thorbjarnarson 1988, 1989, Casas & Méndez 1992), una especie considerada como vulnerable por la Unión Mundial para la Conservación, son pocos los estudios que se han abocado al estudio sistemático de su reproducción en la vertiente del Pacífico de América y en particular de México. En relación con lo anterior, Mazzotti (1989), dice que para asegurar la sobrevivencia de una especie en peligro de extinción, es importante tener un conocimiento sólido de los factores que afectan el éxito reproductivo de la población (que se define como el reclutamiento a la población reproductora), por lo que entre otros factores, estudió aquellos que afectan el éxito en anidación de C. acutus en Florida.
Desde el año de 1988 se iniciaron los estudios de una población de C. acutus de la desembocadura del Río Cuitzmala en la Costa de Jalisco, México, encontrándose que su población es significativa para una área relativamente pequeña (1000 ha) (Casas & Méndez 1992). De Luna (1996) determinó para esta área, entre 1992 y 1993, una población de al menos 356 individuos, ó 26.2 cocodrilos por kilómetro; finalmente, Thorbjarnarson (1999) señala que la población total estimada en fechas recientes para esta región, puede variar entre 500 y 600 individuos y que el número de nidos conocido se ha incrementado desde diez a fines de la década de los ochenta, hasta 30 en 1998, aun cuando no se presentan evidencias sobre esto último.
Por lo anterior, se propuso la realización de este estudio, considerando que si la población muestra un tamaño adecuado, los parámetros de anidación permitirán determinar que la misma se está reproduciendo en forma exitosa
Los objetivos fueron describir la anidación, correlacionarla con algunos factores del ambiente y buscar similitudes o diferencias con los patrones descritos para C. acutus en áreas previamente estudiadas, dado que la costa de Jalisco, México, se encuentra alejada de las mismas.
Materiales y métodos
En el año de 1989 se realizaron prospecciones en la zona de estudio, buscando identificar áreas de anidación conocidas por los habitantes de la localidad y determinar algunas características de las mismas. En 1990 se inició el estudio sistemático de los lugares de anidación, prolongándose hasta 1993. A principios del mes de abril de cada año, se iniciaron recorridos por toda la zona, detectando la actividad preliminar que desarrollan las primeras hembras y que denotan el inicio de la anidación, por las huellas dejadas por ellas (rastros del cuerpo) durante noches sucesivas entre la orilla del agua y el sitio de anidación, pudiéndose observar excavaciones en diferentes lugares, pero sin oviposición.
Las temperaturas máximas y mínimas del ambiente y datos climáticos (Fig. 1) fueron obtenidas por cortesía de la Estación Meteorológica de la Fundación Ecológica de Cuixmala que se encuentra dentro del área de estudio. Las fases lunares se obtuvieron de los Calendarios Gráficos de Mareas (Anónimo, 1990-1993).

Cuando se encontró el nido, se midió la distancia en metros, desde el mismo al árbol y al arbusto más cercano y se calculó la altura de la vegetación por el método de triangulación con un tránsito de bolsillo (Pocket & Esser Company). Posteriormente la distancia, en metros a la orilla del espejo del agua y también por triangulación la altitud del mismo. Los nidos se excavaron con cuidado para determinar el tamaño de la nidada (número de huevos), el diámetro mayor y menor de cada huevo, ambos con un vernier (0.1 mm de precisión) y se pesaron con una balanza Ohaus de triple barra (0.1 g de precisión). La viabilidad (fertilidad) de los huevos se determinó por la presencia de la banda opaca en los mismos (Ferguson 1985).
A catorce nidos a lo largo del área de anidación se les tomó una muestra de suelo para analizar su porcentaje de arena, limo, arcilla (Bouyoucos 1936), pH y humedad relativa; la cobertura (sombra proyectada por la vegetación alrededor de las 12 horas del día) se midió en un diámetro de dos metros de circunferencia a partir del centro del nido. Para determinar la humedad de los nidos se tomaron muestras de suelo del mismo, se colocaron en bolsas de plástico y el mismo día se llevaron al laboratorio; se sometieron a desecación muestras de 10 g cada una en un horno a 105° C, hasta que el peso fue constante. El contenido de humedad (PH) se determinó mediante la fórmula: Peso Fresco - Peso Seco en horno (PS)= Contenido de Humedad (CH), y el porcentaje de humedad (PH) mediante la fórmula: PH= CH x 100/PS.
Con una brújula se determinó la orientación-exposición de 22 nidos; finalmente se registró la profundidad del nido al huevo más cercano a la superficie del suelo, la profundidad total y la anchura del mismo.
Durante 10 días del mes de mayo de 1992 y 1993, se seleccionaron tres nidos para el registro de temperatura (Fig. 2), uno con suelo arenoso (nido no. 1), otro medianamente arenoso (nido no. 3) y finalmente uno poco arenoso (nido no. 9). En esos nidos se registró, con un termómetro de máxima y mínima, columna de mercurio, marca Taylor (precisión de 0.5°C) la temperatura máxima y mínima de la cámara de incubación, mediante un tubo de PVC, en que el termómetro tocaba los huevos del centro de la misma y con un tapón de látex en el extremo superficial, por el que se extraía el termómetro. La temperatura máxima y mínima se registró diariamente a las 7:00 a.m.

Cuando existía, se tomó longitud de la huella de la pata trasera dejada por la hembra en el nido. Debido a la timidez de los cocodrilos en la zona y de las dificultades para su captura, fue necesario estimar el tamaño de las hembras. Para ello, se tomaron los datos de longitud total y longitud de la pata posterior en 30 C. acutus, mantenidos en cautiverio en la Escuela Tecnológica en la Ciudad de Cihuatlán, Jalisco, 40 km al sureste de la localidad de trabajo, desde crías recién nacidas, hasta individuos de cuatro metros de longitud total, con los que se calculó el coeficiente de correlación y se obtuvo la ecuación de la recta. El primero fue altamente significativo (r2= 0.93, p< 0.01, N= 30) y la ecuación de la recta se determinó como Y=-0.4078+13.2929(X). Los resultados se presentan como promedio ± desviación estándar.
Descripción del Área de estudio. La región del estudio se encuentra en la costa del Estado de Jalisco, México, sobre la vertiente del Pacífico, situada aproximadamente a los 19° 23' N y 105° 00' W. Es una llanura de inundación con una superficie aproximada de 1000 hectáreas (Fig. 2), en la que se encuentran seis pequeñas lagunas, tres de ellas artificiales y una serie de canales que se forman a partir de la desembocadura del Río Cuitzmala y que son una serie de ramales a lo largo de seis km y que varían en anchura entre 3 y 6 m y profundidades desde 2.8 m en la boca del río, hasta 60 cm en las partes más bajas, los que permanecen con agua durante todo el año. En algunas porciones el terreno es ondulado y con pendientes algunas veces de poco más de 45°.
La zona tiene una temperatura media anual de 25°C (Fig. 1), con una mínima media aproximada de 21.6°C en los meses de febrero y marzo y una máxima media entre 27 y 28°C, en los meses de julio a septiembre, con una precipitación media anual de 795 mm, concentrada principalmente en el verano (García 1988).
La vegetación circundante a estos cuerpos la constituyen, principalmente, los carrizos (Phragmites australis) y en las zonas con variaciones en la salinidad del agua se encuentra el mangle rojo (Rhizophora mangle). La vegetación del canal principal, que se origina directamente del Río Cuitzmala, está formada por el bambú (Bambusa vulgaris), vegetación que fue introducida en esta área, hace varios años. En algunos sitios se puede observar también mangle blanco (Laguncularia racemosa), en terrenos inundables se puede encontrar la manzanilla (Hippomane mancinella) y entre los árboles más altos, aunque escasos, se encuentra la higuera (Ficus goldmanii). En ciertas áreas es abundante el tule (Typha latifolia). Finalmente, la vegetación acuática más sobresaliente está integrada por el pato (Pistia stratiotes), la hoja de sol (Nymphaea ampla) y el lirio acuático (Eichhornia crassipes).
Estos cuerpos de agua tienen influencia marina y la salinidad varía entre cero y 28 partes por mil, aunque la mayor parte del año se conserva casi dulce.
Resultados
Temporada de anidación. En la costa de Jalisco, considerando desde la puesta de los huevos hasta el nacimiento de los cocodrilos, es durante los meses de abril y mayo para la oviposición y de junio a agosto para los nacimientos.
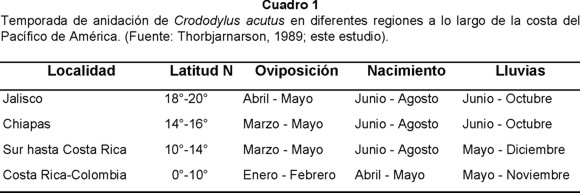
En el Cuadro 1 se presentan los períodos de oviposición y nacimientos dentro de la temporada de anidación, en donde se pueden observar las diferentes fechas para la costa de Jalisco y otras localidades de México, Centro y Sudamérica.
Inicio de la temporada de anidación y factores ambientales. Las hembras inician las visitas a las zonas de anidación potencial aproximadamente cuatro semanas antes de que se depositen los huevos, lo cual ocurre en la región a mediados del mes de marzo. Durante estas visitas, la hembra sale con frecuencia y remueve el suelo, haciendo varias excavaciones en el lugar, hasta que en un momento dado pone los huevos.
La temporada de anidación en el área de estudio se presenta durante los meses más secos del año (Fig. 1), en los que ocasionalmente puede haber escasa precipitación. Estos meses corresponden a la primavera en el hemisferio norte y es cuando la oscilación térmica diaria promedio de mínimas y máximas varía entre 15°C y 38°C (oscilación de 23°C) en enero y entre 14°C y 35°C (oscilación de 21°C) previo al inicio de la anidación en marzo (Cuadro 2).

Otro factor que parece mostrar cierta relación con el período de anidación es el de las fases lunares, y particularmente la fase de luna nueva parece coincidir con la excavación de los primeros nidos en el mes de abril, dato que coincidió durante las cuatro temporadas estudiadas (Cuadro 2).
Sitios de anidación en la zona y fidelidad por el sitio. Los sitios de anidación se encontraron dispersos a lo largo de toda la zona de estudio, en la que se localizaron un total de 28 nidos (Fig. 2), 26 en el área de trabajo y dos (nidos 27 y 28) adyacentes a la misma. Se observó una mayor concentración hacia el centro del área, alrededor del nido 11, posiblemente por que es una área más aislada y protegida, con menor accesibilidad para el hombre.
Se registró la actividad en los nidos entre los años de 1989 y 1993 (Cuadro 3); de 28 nidos se encontró que en siete la anidación fue continua en cada una de las cinco temporadas; tres nidos fueron abandonados después de una temporada de registro, debido a que hubo disturbio humano en la vegetación y el suelo del lugar y no se utilizaron posteriormente; ocho nidos presentaron anidación en una sola temporada y no fueron utilizados posteriormente por las hembras. En el año de 1993, se descubrieron diez nidos que no se habían observado anteriormente y fueron determinados como de actividad incierta en temporadas anteriores (Cuadro 3).

Tamaño de las hembras anidadoras y tamaño a la madurez sexual. El tamaño de las hembras anidadoras se estimó a partir de la longitud de las huellas de la pata posterior, dejadas por las hembras en el sitio de anidación (ver materiales y métodos). La hembra más pequeña midió 225 cm de longitud total, mientras que las más grandes midieron 305 cm, con una media de 290 ± 24 cm (N = 9). La mayoría de las hembras anidadoras (89%) midieron entre 292 y 305 cm de longitud total.
Características de los sitios de anidación. Los nidos se encuentran entre la vegetación de la orilla en lugares abiertos por la misma hembra, y consisten en hoyos excavados al ras del suelo, sin ningún indicio de montículo o acumulación de material vegetal sobre el mismo. Encontrar los nidos de esta especie presenta ciertas dificultades, por lo que se hizo necesario caracterizarlos, para lo cual se analizaron nueve variables físicas y de la vegetación en un mínimo de diez y un máximo de 28 nidos, dependiendo de la variable, las que se describen a continuación.
Características físicas. Se determinó que en la orientación-exposición de los nidos, el 54.5% estaban expuestos hacia el sur (Cuadro 4), aunque también hubo otras exposiciones, excepto hacia el oeste, probablemente por que esta orientación hace frente a los huracanes que se presentan en el área.

La distancia de los nidos a la orilla del agua fue muy variable (Cuadro 5), entre 1.5 y 49.5 m, con una media de 9.2 m. De 27 nidos, la mayoría (78%) se encontraron a distancias entre 1.5 y 9.0 m. En relación con la altura desde el nivel del agua, los nidos estuvieron entre 0.20 y 4.0 m, con una media de 2.1 m.
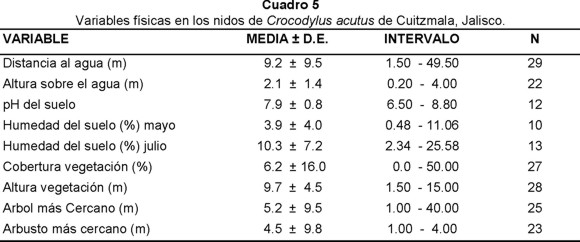
El pH del suelo de la mayoría de los nidos (11), varió de neutro a ligeramente básico (Cuadro 5), con una media de 7.9 y un intervalo entre 6.5 y 8.8.
Por la textura del suelo, los 14 nidos analizados contenían diferentes porcentajes de arena, limo y arcilla, por lo que se pudieron determinar tres tipos de nidos: arenosos (80-100% arena, N=7), areno-limosos (60-79.9% arena, 40-20.1% limo, N=5) y areno-limo-arcillosos (con cualquier combinación de arena y limo, pero con un mínimo de 20 a 30% de arcilla, N=4). Los nidos arenosos (con mas del 30% de arena, fueron los que menor porcentaje de humedad contenían (media 7.3%, mínimo de 4.38 y máximo de 10. 92%), mientras que los que contenían mayor cantidad de limo y arcilla (Cuadro 6), tendieron a mantener un pH neutro o ligeramente ácido (7.1-6.5) y un porcentaje de humedad mayor (media 18.8%, mínimo de 15.45 y máximo de 25.6%). Los porcentajes de humedad entre estos dos tipos de nidos fueron significativamente diferentes (t= 7.1, g.l. 12, p< 0.001).

La humedad del suelo de los 14 nidos estudiados, en mayo que es el mes más seco, osciló entre 0.48 y 11.6%, mientras que en julio, un mes húmedo en que nacen muchos cocodrilos, varió entre 2.34 y 25.6%.
Características de la vegetación. En el Cuadro 5 se presentan resultados sobre las características de la vegetación en los alrededores de los nidos. La mayoría de los nidos se observaron cercanos a un árbol. De 25 nidos, 22 (88%), se situaban entre uno y seis m del árbol más cercano; 21 (84%) estaban entre uno y tres m del arbusto más cercano. La altura de la vegetación alrededor de la mayoría de los nidos (76%) tenía entre cinco y 12 m de altura.
El porcentaje de cobertura de la vegetación sobre los nidos (Cuadro 5) varió entre cero y 50%, aunque sobre la mayoría (20 de 25) se encontraba entre cero y 30%.
Características de los nidos y huevos. Entre los años de 1989 y 1993 se muestrearon 26 nidos en total, aunque en algunos nidos no se registraron todos lo datos presentados. Los nidos presentaron una depresión ligera en la superficie que se denominó cama, variando en diámetro entre 0.89 y 2.00 m. La profundidad de la cámara de huevos y del nido en sí, fue una excavación diagonal hacia atrás (con respecto al cuerpo de la hembra), con una profundidad total entre 17 y 68 cm (promedio 39.7 ± 14). La profundidad a la primera capa de huevos tuvo a un intervalo entre 12 y 38 cm (promedio 22.2 ± 7.4). El diámetro del nido varío entre 25 y 76 cm (promedio 39 ± 14.2).
El número de huevos por nido fluctuó entre nueve y 54 (promedio 27.9 ± 13.2); en 14 nidos (434 huevos), el largo de los huevos o diámetro mayor tuvo un promedio de 74.6 ± 4.2 mm, aunque variando ampliamente entre 61.8 y 73.1 mm; el ancho o diámetro menor promedió 45.5 ± 2.0 mm, con un intervalo entre 36.9 y 49.8 mm; el promedio del peso de los huevos fue de 93.1±10.0 g, aunque con gran variación, entre 63 y 139.5 g. Un solo huevo excepcionalmente grande y que tenía dos yemas, midió 117.8 de largo por 92.7 mm de ancho y pesó 139.5 g.
Relaciones entre los nidos y algunas variables ecológicas. Del estudio de diferentes variables en los nidos de C. acutus (Cuadro 6) en la costa de Jalisco, encontramos lo siguiente: al relacionar la textura del substrato, el pH, la humedad, las temperaturas y la cobertura vegetal en siete nidos, se observa que existe menor porcentaje de humedad y temperaturas más bajas en los nidos arenosos que en los nidos con un porcentaje mayor de limos y arcillas, que son significativamente más húmedos y con temperaturas mayores.
Viabilidad. Se determinó la viabilidad de los huevos en 16 nidos por observación de la banda opaca, como se ha realizado en otras especies de reptiles. La viabilidad varió entre el 36 y el 100%, con un promedio de 81 ± 21%; aunque en 14 nidos (87.5%) fue siempre mayor al 82%.
La viabilidad más alta (90-100%) se presentó en los nidos con mayor proporción de arena, es decir los más cercanos a la playa. No obstante lo anterior, en esta región las hembras tienen acceso a sitios de anidación altos y bien drenados.
Viabilidad de los huevos, incubación y natalidad. La natalidad observada en ocho nidos, varió entre cero y 100%, aunque en cinco nidos (63%) estuvo por arriba del 82%.
Para determinar el período de incubación y el periodo de nacimiento, en el año de 1990 se revisaron seis nidos; el periodo de incubación varió entre 80 y 90 días, con un promedio de 83. Los nacimientos se presentan en el período lluvioso del año, entre fines de junio y mediados de agosto (Fig. 1) y la hora de los nacimientos, registrada en tres nidos, fue entre las ocho y las 12 de la mañana.
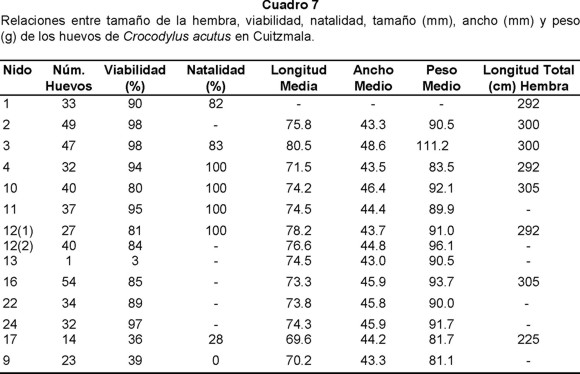
En algunos nidos fue posible obtener relaciones entre la viabilidad, natalidad, tamaño y peso de los huevos y longitud total de las hembras, aunque no en todos los casos se tienen los datos completos (Cuadro 7). Se puede observar una tendencia a que las hembras más grandes depositen huevos de mayor longitud y peso, y a presentar alta natalidad y viabilidad, excepto por una hembra que ovipositó solamente diez huevos. Una hembra pequeña puso sólo 14 huevos y mostró baja viabilidad, así como bajas dimensiones y pesos de los huevos.
Cuidado materno. En la región del Río Cuitzmala se observó que las hembras de C. acutus, permanecen en los alrededores del nido durante la incubación de los huevos, sin embargo, no se detectó la protección del nido, ni el cuidado de las crías después del nacimiento, por lo menos no en forma activa.
Depredación. Durante este trabajo no se registró la depredación en ninguno de los nidos estudiados, aunque es posible que exista.
Discusión
La temporada de anidación en la desembocadura del Río Cuitzmala, se inicia posteriormente en comparación con otras regiones de la costa del Pacifico de América. Thorbjarnarson (1989), mostró que la temporada de reproducción se iniciaba en diferentes fechas dependiendo de la localidad. Al retomar los datos del autor anterior y los de este estudio (Cuadro 1), el inicio de la temporada de anidación tiende a ser latitudinal, más tempranamente en bajas latitudes y más tardía en altas latitudes. De acuerdo con la información antes señalada, se puede establecer que los nacimientos pueden ocurrir a principios o durante la temporada de lluvias.
Thorbjarnarson (1989) indica que en C. acutus existe variación importante entre el tiempo de la puesta de huevos y el patrón de precipitación. Cott (1961), propone para Crocodylus niloticus que la oviposición en la época seca del año reduce la probabilidad de la inundación de nidos, permitiendo la emergencia de los recién nacidos en la época lluviosa, con incrementos en la superficie del hábitat y disponibilidad de alimento; en el caso de C. acutus de la vertiente del Pacífico, parece haber coincidencia con la propuesta mencionada.
Al analizar la información existente, se puede observar que también hacia la región del Golfo de México y el Caribe, el patrón reproductor de C. acutus, parece mostrar esta tendencia latitudinal. Thorbjarnarson (1989), señala que en Haití (18°-20° N) la oviposición es en enero y febrero con los nacimientos en abril y mayo; Alonso & Rodríguez (1998) mencionan que esta especie oviposita de fines de febrero a fines de marzo en Cuba, con los nacimientos en mayo o junio; en Florida (24°- 26° N) la oviposición es en abril y mayo, con los nacimientos en julio y agosto (Kushlan 1988), mostrando por lo tanto, la tendencia latitudinal antes señalada. Inclusive, Thorbjarnarson (1989) observa que en el sur de Florida, existe un patrón de precipitación similar al del Caribe, pero que la temporada de oviposición de C. acutus en esta región se puede retrasar por las bajas temperaturas del invierno y la primavera. Adicionalmente, Alonso & Rodríguez (1998), observan que la temporada de oviposición en Cuba se puede retrasar hasta 15 días si previamente existen frentes fríos.
Posiblemente esta tendencia latitudinal indique que la temporada de reproducción y en particular la de anidación estaría gobernada mas bien por la temperatura que por las lluvias. De hecho, en Jalisco la oscilación térmica más grande se presenta en febrero y marzo (Cuadro 2), los meses mas fríos del año (Fig. 1).
Thorbjarnarson & Hernández (1993) determinaron que en Crocodylus intermedius existe fidelidad de las hembras por su sitio de anidación y Graham et al. (1976) la citan para C. niloticus, Alvarez del Toro (1974) y Ogden (1978) lo especulan para C. acutus, no obstante, Kushlan & Mazzotti (1989) la demuestran para esta especie en Florida, utilizando datos de telemetría.
Debido a la timidez de C. acutus en Cuitzmala, las hembras sólo fueron avistadas desde lejos, por lo que el registro de huellas del mismo tamaño en algunos de los nidos de actividad continua, permite suponer que una misma hembra acudió al mismo nido cada año, lo que parece confirmar, una vez más, las observaciones de autores anteriores sobre la fidelidad por el sitio de anidación en esta especie.
De acuerdo con los resultados obtenidos en este estudio en relación con la fidelidad por el sitio de anidación, parece ser que una parte de la población de hembras regresa a los mismos sitios de anidación en años subsecuentes y otras hembras parecen tener plasticidad para cambiar a otros lugares, lo cual podría representar una posibilidad más en la adaptación de las hembras para anidar, y tener tanto la posibilidad de buscar lugares de anidación con alta probabilidad de nacimiento como la de explorar nuevas áreas que también favorezcan la natalidad, teniendo así un patrón conservador y un patrón oportunista para la anidación.
Poco se ha mencionado sobre el disturbio en las áreas de anidación en cocodrilos, no obstante, Kushlan (1988), al igual que lo observado en este trabajo (Cuadro 3), señala que el disturbio humano puede afectar los lugares de anidación de C. acutus, y de hecho, señala que en Florida el área geográfica de anidación se ha reducido debido a los desarrollos humanos, misma que los cocodrilos han compensado con la anidación en áreas artificiales en otros lugares. Posiblemente en la costa de Jalisco se están dando condiciones similares, debido al disturbio asociado con el desarrollo de áreas turísticas en la región.
Los resultados de este estudio muestran un patrón de anidación en el periodo más seco del año (abril-mayo), aparentemente estimulado por las grandes oscilaciones diarias de temperatura (21 a 23°C) en los meses previos, similar al patrón encontrado por Kofron (1990) para C. niloticus de Zimbabwe.
No existe información previa sobre el efecto de las fases lunares en el período de anidación de cocodrilos, aunque parece haber correlación entre la fase de luna nueva y las salidas de las hembras a anidar y una explicación preliminar sería que esta estrategia, dada la obscuridad de esos días, les permite evitar que sean observadas por depredadores potenciales de nidos.
Alvarez del Toro (1974) indica no haber observado hembras anidadoras menores a 280 cm; Ogden (1978) encontró como tamaño mínimo para las hembras reproductoras los 225 cm; en Florida, Mazzotti (1983) también encuentra que el tamaño mínimo de anidación es de 225 cm; Varona (en Thorbjarnarson, 1989) registra que en Cuba los tamaños mínimos a la reproducción varían entre 270 y 300 cm; Thorbjarnarson (1989), señala que las hembras de esta especie inician la anidación a tamaños entre 220 y 230 cm. El tamaño mínimo de anidación encontrado para Jalisco, como lo registran otros autores citados, es de 225 cm de longitud total. Por los registros en poblaciones de otras localidades, parece ser que la edad mínima para la reproducción a estos tamaños corresponde a los diez años (Thorbjarnarson 1989).
No existe información sobre la orientación-exposición de los nidos en cocodrilos, pero una explicación posible, de acuerdo con los resultados, es que si más del 50% están expuestos hacia el sur y ninguno hacia el oeste, esa orientación podría conferirles cierta protección contra huracanes generados en el Pacífico y que pudiesen entrar en el área durante la temporada de incubación, afectando negativamente el éxito en el desarrollo y la viabilidad de los huevos en el nido.
En comparación con los nidos registrados por Thorbjarnarson (1988), los de Jalisco estaban más cerca del agua, en términos generales. La altura desde el nivel del agua (entre 0.2 y 4.0 m) con una media de 2.1 m, difiere de los datos de Haití (Thorbjarnarson 1988), los cuales muestran una media menor (1.2 m). La discrepancia, posiblemente se debe a que el tipo de terreno es diferente, ya que en Jalisco el terreno es ondulado y con pendientes importantes.
El pH del suelo en la gran mayoría de los nidos de la localidad estudiada, varió de neutro a ligeramente básico, difiriendo con los valores registrados por el autor antes mencionado para Haití (media 6.2, intervalo 5.2-7.1) posiblemente debido al origen del suelo, por lo que las características físicas y biológicas de los mismos pueden variar dependiendo de la localidad.
En forma similar a lo encontrado por Kofron (1989) en Crocodylus niloticus de Zimbabwe, la textura del suelo en los nidos de Jalisco fue de tres tipos: arenosos, areno-limosos y areno-limo-arcillosos. Lutz & Dunbar-Cooper (1984) definen, por su textura, solamente dos tipos de nidos en Florida; en esta localidad los nidos arenosos fueron los que contenían menor humedad, mientras que los de mayor contenido de limo y arcilla tendieron a mantener un pH neutro o ligeramente ácido, en forma similar a lo encontrado en este estudio. La humedad del suelo fue menor en mayo que es el mes más seco, y mayor en julio que es un mes húmedo en el que nacen muchos cocodrilos, y los valores máximos obtenidos se ubican muy por arriba de los citados por Thorbjarnarson (1988), aunque dentro de los mencionados por Lutz & Dunbar-Cooper (1984).
Los nidos de C. acutus son difíciles de encontrar debido, en parte, a que están ampliamente rodeados por vegetación. Kofron (1989), registró la mayoría de los nidos de C. niloticus en áreas expuestas a la luz solar, pero a no más de uno o dos metros de la vegetación. En forma similar, en Cuitzmala la mayoría de los nidos se observaron cercanos a árboles y arbustos. La altura de la vegetación se observa hasta cerca de 12 m alrededor de la mayoría de los nidos, lo que parece mantenerlos aislados, aunque la cobertura de la vegetación sobre los mismos fue menor al 30%. Es posible que los nidos estén protegidos por la vegetación circundante, aunque sobre ellos exista poca cobertura vegetal, permitiéndoles una adecuada insolación.
Por cuanto a las características de los nidos estudiados, así como las dimensiones y pesos de los huevos, éstos se encontraron dentro de los valores mencionados por otros autores para la especie y solamente es destacable que siempre se observaron hoyos excavados en el suelo y sin ningún indicio de montículo o acumulación de material vegetal
Cerca del 50% de los nidos estudiados se encontraron por debajo del promedio en cuanto al número de huevos por nido registrado por Kushlan & Mazzotti (1989) en Florida, aunque fue superior al citado por Thorbjarnarson (1988) en Haití. Los huevos fueron muy variables en dimensiones pero se muestran entre los intervalos mencionados para esta especie por Thorbjarnarson (1989). Es factible que esta variación en el número de huevos, dependa de las condiciones de las hembras en cada población.
Aunque solamente se pudo relacionar el tamaño de la hembra con el número de huevos en siete hembras con sus nidos, la tendencia fue a haber una correlación significativa (r2= 0.683, p<0.05), es decir, el número de huevos es mayor cuando la longitud total de la hembra es mayor, aunque es posible que la correlación se encuentre afectada por la presencia de un solo nido con una hembra más pequeña. Esta correlación se ajusta con los datos para las diferentes especies de cocodrilos (Thorbjarnarson 1996).
Por otro lado al relacionar la textura del substrato, el pH, la humedad, las temperaturas y la cobertura vegetal, se observó la existencia de menor porcentaje de humedad y temperaturas más bajas en los nidos arenosos que en los nidos con un porcentaje mayor de limos y arcillas, siendo significativamente más húmedos y con temperaturas mayores, en forma similar a lo registrado por Kushlan (1988) en Florida para esta especie. Lo interesante de las observaciones anteriores se encuentra en que se ha demostrado experimentalmente en C. acutus (Aguilar et al. 1998), como en otras especies, que la temperatura de incubación determina el sexo, por lo que es importante investigar si ésta pudiera estar determinándolo en condiciones naturales.
En Chiapas el periodo de incubación fluctuó entre 75 y 80 días (Alvarez del Toro 1974), es decir, ligeramente menor que el encontrado para Cuitzmala (80 a 90 días, con un promedio de 83); en este sentido, se podría suponer que los nidos de Chiapas estuvieron sujetos a una mayor temperatura durante la incubación. No obstante lo anterior, los resultados se encuentran dentro del intervalo (80-90 días) de otras poblaciones de la especie (Thorbjarnarson 1989).
La mortalidad embrionaria en los nidos de cocodrilos, se puede deber a diferentes factores: la viabilidad de los huevos, la inundación, desecación y depredación de nidos (Kushlan 1988, Mazzotti et al. 1988). En la costa de Jalisco la viabilidad en huevos tuvo un promedio de 81% ± 21, aunque en la mayoría de ellos fue siempre mayor al 82%. En términos generales, se puede considerar, que la viabilidad en los nidos de esta población fue ligeramente baja en función de lo citado por Kushlan & Mazzotti (1989) y Thorbjarnarson (1988), quienes encuentran viabilidades de alrededor de 90% en esta especie, mismas que se estiman adecuadas para poblaciones saludables; la baja viabilidad en tan sólo dos nidos (36 y 41%), posiblemente se debió a que en un caso el nido fue puesto muy cerca del nivel del agua y el otro en una área con suelo altamente limo-arcilloso, en los cuales la humedad debe haber sido muy alta, reduciendo la capacidad de difusión del oxígeno (Lutz & Dunbar-Cooper 1984).
La viabilidad más alta se presentó en los nidos con mayor proporción de arena, es decir, los más cercanos a la playa. No obstante, en esta región, las hembras tienen acceso a sitios de anidación altos y bien drenados, por lo cual, de acuerdo con Thorbjarnarson (1989) la probabilidad de mortalidad de huevos por inundación es muy baja. Por otro lado, las inundaciones en la costa de Jalisco se pueden presentar a partir del mes de agosto que es el periodo de tormentas tropicales y huracanes (Fig.1), generalmente cuando ya nacieron los cocodrilos.
Por cuanto a las relaciones entre la viabilidad, natalidad, tamaño y peso de los huevos y longitud total de las hembras, se detectó una tendencia a que los huevos puestos por las hembras más grandes fueran los de mayor longitud y peso y mostraran una alta viabilidad y natalidad (no obstante, en Cuitzmala se encontraron varios nidos con menos de 15 huevos cada uno, de los que no se tuvieron datos sobre las hembras que los ovipositaron). En Alligator mississippiensis se ha documentado la existencia de una relación entre la edad materna, el tamaño de la puesta y la calidad de los huevos, lo que ha llevado a pensar que las hembras de edad media son las reproductoras más exitosas en términos de cantidad, tamaño y calidad de los huevos producidos, mientras que las hembras viejas pueden ser exitosas, aunque el tamaño de su puesta es menor y el número de embriones malformados es mayor; de la misma manera las hembras más jóvenes de esta especie tienen puestas más pequeñas y cualitativamente inferiores (Ferguson 1985).
Al igual que en otros estudios (Alvarez del Toro 1974, Ogden 1978, Kushlan & Mazzotti 1989, Thorbjarnarson 1988, 1989), se observó que las hembras permanecen en los alrededores del nido, pero sin cuidados maternos activos; no obstante, en esta área, y a diferencia de lo observado por Alvarez del Toro (1974) en Chiapas, las hembras no proporcionan ningún tipo de protección al nido. En adición, conviene señalar que aun cuando la concentración de recién nacidos en ciertas zonas del área de estudio es muy notoria después del periodo de nacimientos (De Luna 1996), nunca se observó la presencia de hembras ni la protección a los recién nacidos.
No obstante que se conocen los depredadores de los nidos de C. acutus (Alvarez del Toro 1974, Kushlan & Mazzotti 1989, Thorbjarnarson 1989) y de la existencia de la mayoría de ellos en la zona de trabajo, no se registró la depredación en ninguno de los nidos estudiados, posiblemente por que la población de los depredadores no es muy grande.
Agradecimientos
Un trabajo como el que se presenta, requiere de la colaboración de muchas personas e instituciones; particularmente deseo agradecer a la Estación Biológica de Chamela del propio Instituto de Biología, UNAM por las facilidades y apoyo en la logística para el estudio, a la Fundación Ecológica de Cuixmala y al Hotel Careyes, la primera por haberme proporcionado apoyo logístico y a ambas por el acceso al área de trabajo. En los trabajos de campo recibí la colaboración decidida de Xóchitl Aguilar Miguel, Fausto R. Méndez de la Cruz, Octavio de Luna Cuevas, Gabriel Barrios Quiroz, Horacio Saracho Vensamoye y Andrés García Aguayo, por lo cual se les agradece cumplidamente. Dos revisores anónimos hicieron críticas y sugerencias que enriquecieron el trabajo.
Literatura citada
Aguilar, M.X.,J. Herrera, H. Merchant L. & G. Casas A. 1998. Efecto de la temperatura de incubación sobre la actividad esteroidogénica en Crocodylus acutus y C. moreletii. Rev. Soc. Mex. Hist. Nat. 48: 95-103. [ Links ]
Alonso, T.A. & R. Rodriguez S. 1998. Observations on the nesting behavior of Crocodylus acutus. Croc. Spec. Group Newsletter 17 (1): 11-13. [ Links ]
Alvarez del Toro, M. 1974. Los Crocodylia de México. Instituto Mexicano de Recursos Naturales Renovables. México. 70 p. [ Links ]
Anónimo. 1990-1993. Calendario gráfico de mareas. Océano Pacífico. Instituto de Geofísica. Universidad Nacional Autónoma de México. México. [ Links ]
Bouyoucos, G.J. 1936. Directions for making mechanical analyses of soils. Soil Sci. 32: 225-228. [ Links ]
Casas, A.G. & F.R. Méndez de la Cruz. 1992. Observaciones sobre la ecología de Crocodylus acutus en el Río Cuitzmala, Jalisco, México. Rev. Soc. Mexicana, Hist. Nat. 43: 71-80. [ Links ]
Cott, H.B. 1961. Scientific results of an inquiry into the ecology and economic status of the Nile Crocodile (Crocodylus niloticus) in Uganda and northern Rhodesia. Trans. Zool. Soc. London 29: 211-356. [ Links ]
De Luna, C. O. 1996. Fluctuación anual de la densidad de una población de Crocodylus acutus en Cuitzmala, Jalisco, México. Bol. Soc. Herpetol. Mex. 7 (1): 15-16 [ Links ]
Ferguson, M.W.J. 1985. Reproductive biology and embryology of the Crocodilians, 329-491 pp. In: C. Gans, F. Billet & P.F.A. Maderson (eds.) Biology of the Reptilia, Vol. 14, Development A. Wiley, Nueva York. [ Links ]
García, E. 1988. Modificaciones al sistema de clasificación climática de Köppen. Para adaptarlo a las condiciones de la República Mexicana. Offset Larios, S.A. México. 221 p. [ Links ]
Hutton, J. M. 1984. The population ecology of the Nile Crocodile, Crocodylus niloticus Laurenti, 1768, at Ngezi, Zimbabwe. Ph. D. dissertation, University of Zimbabwe, Harare. 502 p. [ Links ]
Joanen, T. 1969. Nesting ecology of alligators in Louisiana. Proc. Ann Conf. S.E. Assoc. Game Fish Comm. 29: 407-415. [ Links ]
Kofron, C.P. 1989. Nesting ecology of the Nile Crocodile (Crocodylus niloticus). Afr. J. Ecol. 27:335-341. [ Links ]
----------. 1990. The reproductive cycle of the Nile Crocodile (Crocodylus niloticus). Jour. Zool. (London) 221: 477-488. [ Links ]
Kushlan, J.A. 1988. Conservation and management of the American Crocodile. Environ. Managemen, 12 (6): 777-790. [ Links ]
Kushlan, J.A. & F.J. Mazzotti. 1989. Population ecology of the American Crocodile. Jour. Herp. 23 (1): 7-21. [ Links ]
Lance, V. A. 1989. Reproductive cycle of the American Alligator. Amer. Zool. 29: 999-1018. [ Links ]
Lutz, P. L. & A. Dunbar-Cooper. 1984. The nest environmental of the American Crocodile (Crocodylus acutus). Copeia 194(1): 153-161. [ Links ]
Mazzotti, F.J. 1983. The ecology of Crocodylus acutus in Florida. Ph. D. dissertation. Pennsylvania State University. University Park, Pennsylvania. 161 pp. [ Links ]
----------. 1989. Factors affecting the nesting success of the American Crocodile, Crocodylus acutus, in Florida Bay. Bull. Mar. Sci. 44 (1): 220-228. [ Links ]
Mazzotti, F.J., Kushlan, J.A. & A.Dunbar-Cooper. 1988. Dessication and cryptic nest flooding as probable causes of egg mortality in the American Crocodile, Crocodylus acutus, in Everglades National Park, Florida. Florida Sci. 51 (2): 65-72. [ Links ]
Medem, F. 1981. Los Crocodylia de Sur America. Vol. 1 Los Crocodylia de Colombia. Carrera7a Ltd., Bogotá, Colombia. 354 pp. [ Links ]
----------. 1983. Los Crocodylia de Sur America. Vol. 2. Carrera7a Ltd., Bogotá, Colombia [ Links ]
Messel, H. & G.C. Vorlicek, 1989. Ecology of Crocodylus porosus in northern Australia.164-183 pp. In: Crocodiles: Their Ecology, Management and Conservation. Special Pub. Croc. Spec. Group. IUCN-The World Conservation Union Publ. N.S., Gland, Suiza. [ Links ]
Ogden, J.C. 1978. Status and nesting biology of the American Crocodile, Crocodylus acutus (Reptilia, Crocodylidae) in Florida. Jour. Herp. 12 (2): 183-196. [ Links ]
Thorbjarnarson, J. 1988. Status and ecology of the American Crocodile in Haiti. Bull. Florida State Mus. 33 (1): 1-86. [ Links ]
----------. 1989. Ecology of the American Crocodile (Crocodylus acutus). 228- 259 pp. In: Crocodiles: their Ecology, Management and Conservation. Special Pub. Croc. Spec. Group. IUCN- The World Conservation Union Publ. N. S., Gland., Switzerland. [ Links ]
----------. 1996. Reproductive characteristics of the order Crocodylia. Herpetologica 52 (1): 8-24. [ Links ]
----------. 1999. Cocodrilos en la Reserva de la Biosfera de Chamela-Cuixmala, Jalisco. Bol. Inf., Soc. Est. Cons. Cocodrilos México, A.C. 2 (enero-abril) 1999: 6. [ Links ]
Thorbjarnarson, J. & G. Hernández. 1993. Reproductive ecology of the Orinoco Crocodile (Crocodylus intermedius) in Venezuela. I. Nesting ecology and egg and clutch relationship. Jour. Herp. 27 (4): 363-370. [ Links ]
Vliet, K. 1989. Social displays of the American Alligator (Alligator mississippiensis). Amer. Zool. 29: 1019-1031. [ Links ]
Webb, G.J.W., H. Messel & W. Magnusson. 1977. The nesting of Crocodylus porosus in Arnhem Land, Northern Australia. Copeia 1977: 238-249. [ Links ]
Webb, G.J.W., G.C. Sack, R. Buckworth, & C. Manolis. 1983. An examination of Crocodylus porosus nests in two Northern Australia freshwater swamps, with an analisis of embryo mortality. Aust. Wildl. Res. 10: 571-605. [ Links ]














