Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta zoológica mexicana
versión On-line ISSN 2448-8445versión impresa ISSN 0065-1737
Acta Zool. Mex no.88 Xalapa abr. 2003
Artículo
Estudio comparativo de los testículos, epidídimos, glándulas sexuales accesorias y espermatozoides en tres especies de lagomorfos (Romerolagus diazi, Lepus californicus y Oryctolagus cuniculus)
Demetrio Ambriz García, José Luis Contreras Montiel, Omar Hernández Pérez, Efraín Mercado Pichardo, Fernando A. Cervantes Reza* y Adolfo Rosado García
Universidad Autónoma Metropolitana-Iztapalapa. Departamento de Biología de la Reproducción. Av. San Rafael Atlixco 186 Col Vicentina. Iztapalapa, México, D.F. CP 09340 MÉXICO. e-mail deme@xanum.uam.mx
*Departamento de Zoología, Instituto de Biología, UNAM, Apdo. Postal 70-153, Coyoacán 04510, México, D.F. MÉXICO.
Recibido: 7 de enero 2002
Aceptado: 30 de agosto 2002
Resumen
Se hizo un estudio comparativo del aparato reproductor masculino entre tres especies de lagomorfos: el conejo zacatuche (Romerolagus diazi), la liebre cola negra (Lepus californicus) y el conejo doméstico (Oryctolagus cuniculus). Se extrajo el aparato reproductor de los especímenes sacrificados y los testículos, epidídimos y glándulas sexuales accesorias fueron aislados, liberados del tejido conectivo y pesados. Los espermatozoides de la cola del epidídimo fueron obtenidos por retroperfusión, contados, fijados y medidos, utilizando técnicas fotográficas. La masa testicular no estuvo relacionada con la masa corporal y, considerada como porcentaje en relación a la masa corporal, fue más de dos veces mayor en L. californicus y R. diazi que en O. cuniculus. La masa epididimaria, expresada como porcentaje de la masa corporal, fue más grande en R. diazi que en L. californicus y en O. cuniculus. Hubo más espermatozoides, en la cola del epidídimo, de L. californicus que en R. diazi o en O. cuniculus. El largo y ancho de la cabeza espermática de R. diazi, superaron a los de O. cuniculus y L. californicus. La longitud total y el largo de la cola espermática, fueron similares en O. cuniculus y R. diazi, mientras que los espermatozoides de L. californicus fueron menores.
Los datos que se presentan en este estudio, son los primeros cuantitativos de testículos, epidídimos, glándulas sexuales accesorias y espermatozoides, de especies de lagomorfos silvestres de Norteamérica.
Palabras clave: Romerolagus diazi, Lepus californicus, Oryctolagus cuniculus, espermatozoides, epidídimo, glándulas sexuales accesorias, testículos, lagomorfos, reproducción.
Abstract
A comparative study of the male reproductive organs and spermatozoa from three lagomorphs species, the volcano rabbit or Zacatuche (Romerolagus diazi), the black-tailed hare (Lepus californicus) and the domestic rabbit (Oryctolagus cuniculus), was conducted. The animals were euthanased and their reproductive organs excised. Testes, epididymes and accessory sexual glands were isolated, removed of any of connective and other tissues and weighed. Caudal spermatozoa were obtained from the epididymal tail, counted, fixed and measured. The testicular mass was not related to body mass, but when considered as a percentage of body mass, the values for L. californicus and R. diazi were twice as large as that determined for O. cuniculus. The epididymal mass, when expressed as a percentage of the body mass, was highest in R. diazi and smallest in O. cuniculus. Spermatozoa counts from the epididymal tail were larger in L. californicus than in R. diazi or O. cuniculus. Lengths and widths of the spermatozoa head from R. diazi were larger than from O. cuniculus and L. californicus. Total length and tail length of caudal spermatozoa from O. cuniculus and R. diazi were found to be similar but larger than those recorded from L. californicus. This is the first such quantitative and comparative study of wild lagomorphs species from North America.
Key Words: Romerolagus diazi, Lepus californicus, Oryctolagus cuniculus, spermatozoa epididymes, testes, accessory sexual glands, lagomorphs, reproduction.
Introducción
El orden Lagomorfa comprende alrededor de 80 especies, clasificadas en dos grandes familias: Leporidae (liebres y conejos) y Ochotonidae (pikas). Los lagomorfos son pequeños mamíferos que, en las cadenas ecológicas, constituyen la fuente principal de alimento para muchos depredadores y contribuyen a la regulación de poblaciones de plantas y la diseminación de semillas. Además, forman parte de la dieta de muchos habitantes en el medio rural (Cervantes & González 1996).
México es el país del continente americano, con mayor número de especies de lagomorfos: 10 de conejos (nueve del género Sylvilagus y 1 de Romerolagus ) y cinco de liebres del género Lepus. Ocho de estas especies son endémicas y tienen una distribución restringida. A pesar de que algunas especies, como Lepus californicus, son consideradas perniciosas debido al impacto de sus poblaciones sobre la agricultura y la producción animal (Best 1996, Cervantes & González 1996), otras especies son poco comunes y están amenazadas o en peligro de extinción.
En la lista roja de la Unión Internacional para Conservación de la Naturaleza (IUCN) están registradas ocho especies de lagomorfos mexicanos, tres de ellas ( R. diazi, S. graysoni y L. flavigularis ) en peligro de extinción y una ( S. insonus ) críticamente en peligro (Cervantes 1993). Por esta razón, el estudio de los lagomorfos mexicanos, entre ellos el de sus características reproductivas, debería ser una prioridad.
Romerolagus diazi (teporingo, conejo de los volcanes o zacatuche) es endémico y relicto de México (Hibbard 1963, Barrera 1966, Thornback & Jenkings 1984, Hoth et al. 1987, Velázquez 1994), es además un conejo atípico, con número cromosómico y periodo de gestación similar al de las especies del género Lepus (López-Forment & Cervantes 1981, Velázquez et al. 1993, 1996). R. diazi tiene un hábitat restringido al bosque de pino asociado al zacatón, por arriba de los 3,000 msnm, en cuatro volcanes al sur de la ciudad de México, cuya extensión es menor a 250 km 2 (Velázquez 1994). El hecho de que su biología reproductiva sea poco conocida, restringe la posibilidad de plantear un programa de conservación adecuado, a pesar de los esfuerzos que se han llevado a cabo para su reproducción en cautiverio (Granados 1981, Cervantes 1982, Lindsay 1982, Matsuzaki et al. 1982, Hoth & Granados 1987).
Lepus californicus es la más común de las liebres que habitan en nuestro país, se distribuye en Baja California y en la zona norte y centro del país. La cuenca de México parece ser el límite sur de su distribución. L. californicus habita principalmente en regiones áridas y zonas de pastizales donde la cubierta vegetal se ha reducido. Sus poblaciones son abundantes, debido a que también puede habitar en campos de cultivo. Se permite su cacería y permanece sin riesgo (Haskell & Reynolds 1947, Cervantes 1993). A pesar de esta amplia distribución, su biología reproductiva ha sido muy poco estudiada.
Oryctolagus cuniculus tiene su distribución natural en Europa, aunque por su domesticación se le puede encontrar en casi cualquier parte de mundo. La raza de O. cuniculus domesticado más difundida es la Nueva Zelanda blanco (Boyd & Myhill 1987, Bencheikh 1995, Trout & Smith 1995) ya que es utilizada como animal de consumo y de laboratorio. Su reproducción, junto con otros aspectos de su biología, han sido ampliamente estudiados y con frecuencia sirve como referencia para comparar los de otros lagomorfos, existiendo un vacío de información en torno a las semejanzas y diferencias en relación con los lagomorfos mexicanos.
El objetivo del presente trabajo fue estudiar algunas estructuras anatómicas del aparato reproductor masculino (testículos, epidídimos y glándulas accesorias) de dos especies de lagomorfos mexicanos ( R. diazi y L. californicus ) y la especie europea ( O. cuniculus ), comparando además, la morfometría de sus espermatozoides.
Material y métodos
Se utilizaron 11 conejos Nueva Zelanda blanco ( O. cuniculus ) adultos, de fertilidad comprobada y sexualmente activos. Los animales provenían del bioterio de la Universidad Autónoma Metropolitana-Iztapalapa, donde permanecieron alojados a temperatura ambiente promedio de 26ºC, con ciclos de 12 hrs luz y 12 hrs oscuridad; alimentados con "pellets" (Conejina, Purina, México, D.F) y agua ad libitum. Para la obtención de los órganos reproductores, los ejemplares fueron sacrificados por sobredosis de pentobarbital sódico (Anestesal®, Bayer, México, D.F.) administrado por vía intraperitoneal. Se disecaron los testículos con sus epidídimos y conductos deferentes, y las glándulas sexuales accesorias.
Cinco R. diazi machos, adultos, fueron capturados entre febrero y julio (sexualmente activos), en el volcán El Pelado en la región de Parres, Delegación de Tlalpan, México D.F. (permiso DOO 750-2618/97, SEMARNAP). Los animales fueron llevados al laboratorio, donde se sacrificaron siguiendo el mismo procedimiento que se aplicó a los ejemplares de O. cuniculus y se obtuvieron los mismo órganos y glándulas.
Ocho especímenes de L. californicus fueron obtenidos a través de cacería en el mes de junio (sexualmente activos), en la zona desértica del norte de Durango. Sus testículos con epidídimos, fueron extraídos in situ, congelados en nitrógeno líquido y transportados al laboratorio.
Los testículos con epidídimos (frescos de O. cuniculus y R. diazi y descongelados de L. californicus ) fueron perfundidos a través de la arteria espermática con 1 ml de medio de Brackett-Oliphant (Brackett & Oliphant 1975, Baker et al. 1986) suplementado con 0.3% de albúmina sérica bovina (Sigma Co., St Louis, MO, EUA). Se disecaron los testículos, los epidídimos y las glándulas sexuales accesorias, y se pesaron por separado.
Las regiones de los epidídimos fueron delimitadas por dobles ligaduras y cortando entre ellas para separar cabeza, cuerpo y cola con el conducto deferente. Posteriormente se pesaron. Los espermatozoides contenidos en la cola del epidídimo fueron recuperados por retro-perfusión con 1 ml de medio de Brackett-Oliphant, a través del conducto deferente. Los espermatozoides fueron lavados y su número evaluado, siguiendo los métodos de la Organización Mundial de la Salud (WHO, 1987).
Una alícuota de la solución con espermatozoides fue fijada con una mezcla de glutaraldehído/paraformaldehído (Baker et al. 1986) y usada para hacer un frotis en un portaobjetos teñido con eosina/nigrosina (Adelman & Cahill 1989). Los frotis fueron observados y fotografiados con un aumento final de 2400X, utilizando un microscopio Zeiss (Axiophot) con contraste de fases. Los espermatozoides se midieron en las fotografías. Para reducir el error en las mediciones, éstas fueron realizadas por dos personas entrenadas, en cuatro laminillas independientes para cada especie. Cada persona midió tres veces 50 células espermáticas, comparando los resultados en cada laminilla. Bajo estas condiciones el error intra-observador fue menor de 2% y el error inter-observador, menor del 5%. En total 200 espermatozoides fueron medidos, por triplicado, para cada una de las especies.
Los datos obtenidos fueron comparados con la prueba t de Student y por ANDEVA de una vía. Para determinar diferencias, se utilizó la prueba de Tukey, todo ello con el programa estadístico de computadora Sigmastat® (Jandel Corporation).
Resultados
1. Características de los testículos, epidídimos y glándulas sexuales accesorias
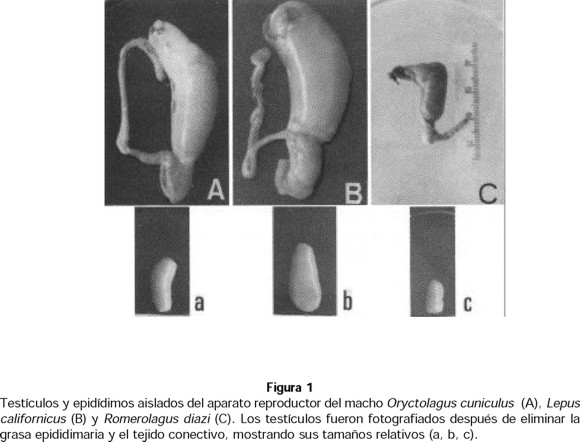
El promedio (± desviación estándar) de la masa corporal en R. diazi fue 486 ± 90 g (Tabla 1). Es posible que estos animales tuvieran alrededor de cinco meses de edad a considerar por los datos publicados por Matsuzaki et al. (1982, 1996) sobre el crecimiento de R. diazi nacidos en cautiverio. El promedio de masa corporal para las ocho liebres de cola negra fue 2250 ± 320 g y para el conejo doméstico de 3520 ± 250 g. Todos los especímenes mostraron los testículos escrotados (Fig. 1).
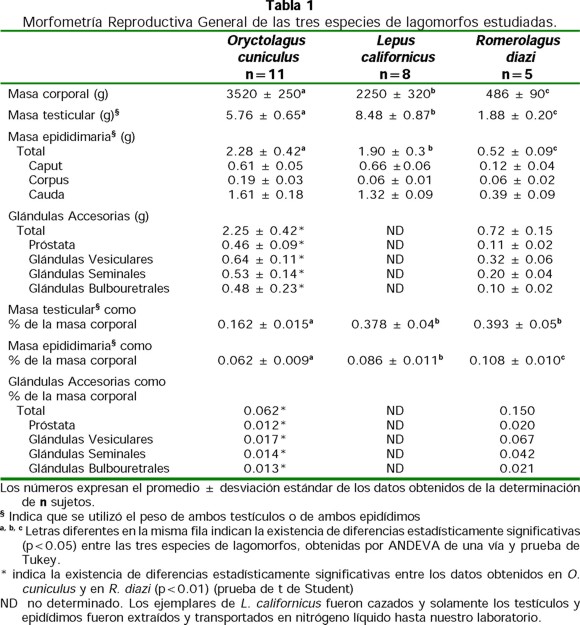
La masa testicular no tuvo relación directa con la masa corporal (Tabla 1), sino que fue significativamente mayor en Lepus (8.48 ± 0.87 g) que en Oryctolagus (5.76 ± 0.65 g) y en Romerolagus (1.88 ± 0.20 g). Cuando la masa testicular se expresó como porcentaje de la masa corporal, fue dos veces más en L. californicus (0.378 ± 0.04%) y en R. diazi (0.393 ± 0.05%) que en O. cuniculus (0.162 ± 0.015%).
La masa epididimaria relativa (masa epididimaria expresada como porcentaje de la masa corporal) fue significativamente mayor (ANDEVA usando valores con transformación arcoseno) en R. diazi (0.108 ± 0.010%) que en L. californicus (0.086 ± 0.011%) y en O. cuniculus (0.062 ± 0.009%).
Las características anatómicas macroscópicas de las glándulas sexuales accesorias fueron similares en Romerolagus y en Oryctolagus. El peso relativo de todas las glándulas accesorias fue significativamente mayor (prueba usando valores con transformación arcoseno) en R. diazi que en O. cuniculus. Esta diferencia fue particularmente importante en el caso de las vesículas seminales y de las glándulas vesiculares, las cuales fueron tres y cuatro veces mayores, respectivamente, en R. diazi que en O. cuniculus.
2. Número espermático
El número total de espermatozoides recuperados de la cola del epidídimo (Tabla 2), fue más de dos veces mayor en Lepus californicus (521 ± 139 x10 6) que en O. cuniculus (165 ± 42 x10 6) o en R. diazi (155 ± 49 x10 6). Por otro lado, el número total de espermatozoides recuperados de la cola del epidídimo, expresados por gramo de testículo, mostró no ser significativamente diferente entre L. californicus y R. diazi, pero fue más grande en estas especies que en O. cuniculus.

3. Características de los espermatozoides
La forma espermática de las tres especies es similar en muchos aspectos (Fig. 2 A, B y C). En el plano frontal la cabeza del espermatozoide de O. cuniculus y de L. californicus es visiblemente elipsoidal, mientras que la forma de la cabeza en R. diazi es ovoide, con la parte más ancha cerca de la porción apical. La unión entre la cabeza y la pieza media, parece ser especialmente lábil en R. diazi, puesto que es posible observar numerosas cabezas aisladas (Fig. 3 C). El acrosoma es claramente visible en O. cuniculus y en R. diazi, pero no en L. californicus. En las tres especies, el acrosoma cubre solo un 40% de la mitad anterior de la cabeza, pero es significativamente mayor (60%) en R. diazi (Tabla 2). R. diazi es también la especie que muestra más espermatozoides con gotas citoplásmicas (8% comparada con 3 y 4% para L. californicus y O. cuniculus ). Fuera de ello no existen anormalidades morfológicas importantes en ninguna de las tres especies.


4. Tamaño espermático
Se encontró que las dimensiones del espermatozoide de L. californicus fueron menores (Tabla 2). La longitud (8.63 ± 0.30 µm) y el ancho (5.88 ± 0.25 µm) de la cabeza del espermatozoide de R. diazi, fueron significativamente mayores (p<0.01) que las mismas dimensiones en O. cuniculus y en L. californicus. La longitud total de la cola fue semejante en O. cuniculus y R. diazi (47.00 ± 3.3 y 46.07 ± 2.19 µm), mientras que en el espermatozoide de L. californicus fue significativamente menor (41.45 ± 3.06 : µm).
Discusión
La masa corporal de R. diazi, aquí encontrada (486 ± 90 g), fue mayor a la reportada por Cervantes et al. en 1990 (418 g, con límites entre 387 y 480 g, n=31), pero similar a la reportada por Lindsay (1982) y Matsuzaki et al. (1982, 1996). La masa de L. califonicus (2250 ± 320 g) fue similar a la de esta especie en el sur de Arizona durante la estación reproductiva (en promedio 2475 g con límites entre 1980 y 3375 g; Best 1996), y a la de las liebres en California (2000-2950g; Best 1996) y mayor que el promedio de la masa corporal de L. californicus en Washington (1770 g en promedio, con límites entre 1510 y 1880 g; Best 1996). La masa corporal del conejo doméstico (3520 ± 250 g) fue parecida a la reportada por Bencheikh (1995) de entre 3470 y 3850 g.
No se encontraron diferencias en el tamaño testicular relativo entre R. diazi y L. californicus (0.393% y 0.378%, respectivamente), pero el de éstos fue significativamente mayor que para O. cuniculus (0.162%).
Dado que una de las funciones principales de la cola del epidídimo es el almacenamiento de espermatozoides, podemos decir que esta capacidad es el doble en L. californicus que en R. diazi o en O. cuniculus. Sin embargo, si se considera por gramo de masa húmeda, no existen diferencias entre L. californicus y R. diazi, mientras que esta capacidad de almacenamiento en O. cuniculus es significativamente menor.
Cohen (1983) indicó que muchas de las células espermáticas producidas tanto en especies animales como en humanos, presentan anormalidades morfológicas. Sin embargo, en este estudio no fueron observadas ni aún en L. californicus, que es la especie con mayor número de espermatozoides en la cola del epidídimo. La frecuencia de gota citoplásmica, en los espermatozoides recuperados de la cola del epidídimo del R. diazi, fue mayor que en los de L. californicus y O. cuniculus, indicando que la maduración de los espermatozoides epididimarios en Romerolagus, ocurre más tardíamente que en las otras dos especies. Esto podría también estar relacionado con la presencia de espermatozoides decapitados.
El conocimiento acerca de la evolución de los espermatozoides de vertebrados es muy reducido (Roldán et al. 1992). Se ha sugerido, sin embargo, que la forma ovalada de la cabeza espermática, es más primitiva que la elipsoidal (Bacceti 1986, Cetica et al. 1993, 1998). Desde este punto de vista es interesante mencionar que la forma de la cabeza, oval en R. diazi y elipsoidal en O. cuniculus y L. californicus, apoya la idea de que Romerolagus, es más antiguo que otras especies de conejos y liebres (Barrera 1966, Corbet 1983, Velázquez et al. 1993).
Se ha indicado que en los mamíferos, particularmente en euterios, existe una relación inversa entre la longitud total del espermatozoide y el tamaño corporal (Cummins & Woodall 1985). Esta relación negativa entre el tamaño espermático y la masa corporal no parece existir en los lagomorfos. Esto podría ubicar a los lagomorfos en la misma categoría que los artiodáctilos, carnívoros y primates, en los cuales esta relación inversa no se cumple (Cummins & Woodall 1985).
Entre los euterios existen pocas especies que posean espermatozoides con cabeza grande, acrosoma pequeño y cola corta (Fawcett 1970, 1975, Cetica et al. 1993, Cummins & Woodall 1985). Sin embargo esto parece ser característico de los espermatozoides de lepóridos. El largo y el ancho de la cabeza espermática en Priodontes maximus (armadillo gigante) y Chetophractus villosus (armadillo peludo) (Cetica et al. 1993) y en Suncus murinus (musaraña asiática), son los mayores entre los euterios estudiados (Cummins & Woodall 1985). Sin embargo, la longitud relativa de las cabezas de los espermatozoides de R. diazi (15.9%) y L. californicus (16.8%), no parece ser diferente de la longitud relativa de la cabeza de P. maximus (17%) y C. villosus (16.5%). Esta elevada relación cabeza/longitud espermática total en los lepóridos es debida, fundamentalmente, a la pequeña longitud de la cola.
La longitud espermática total de las tres especies de lagomorfos estudiados particularmente la de L. californicus, es menor que la de otros euterios. De los resultados del presente estudio, los de Cummins y Woodall (1985), y los de Roldán et al. (1992), es evidente que sólo el orden artiodáctila tiene espermatozoides más pequeños que los lagomorfos (50.8 contra 53.4 µm).
Finalmente, los datos que se presentan en este trabajo, son los primeros cuantitativos obtenidos de testículos, epidídimos, glándulas sexuales y espermatozoides, de especies de lagomorfos silvestres de Norteamérica.
Agradecimientos
Este trabajo fue apoyado en parte por CONACyT 400200-5-321N y 400262-3-519M y por FOMES 98-35-27.
Literatura citada
Adelman, M. & E. Cahill. 1989. Atlas of sperm morphology. Pp. 99-100. American Society of Clinical Pathologists. Chicago, U.S.A. [ Links ]
Bacceti, B. 1986. Evolutionary trends in sperm structure. Comp. Bioch. and Physiol. 85A:29-36. [ Links ]
Baker, W. G., F. T. Murray, L. S. Jefferson, J. Li, & C. W. Bardin. 1986. Perfusion of sex organs and testes. Pp. 215-222 en (Spring-Mills and Hafez. E.S.E. eds). Male accesory sex glands. Elsevier/North Holland, Boston, U.S.A. [ Links ]
Barrera, A. 1966. Redefinición de Cediopsylla jordan y Hoplopsyllus. Nuevas especies, comentarios sobre el concepto de relicto y un caso de evolución convergente. Rev. Soc. Mex. Hist. Nat. 27:67-83. [ Links ]
Bencheik, N. 1995. Effet de la fréquence la semence sur les caractéristiques du sperme et des spermatozoides récoltés chez le lapin. Ann. Zootech. 44: 263-279. [ Links ]
Best, T.L. 1996. Lepus californicus. Mammal. Sp. 530:1-10. [ Links ]
Boyd, I.L, & D. G. Myhill. 1987. Seasonal changes in condition and fecundity in the wild European rabbit Oryctolagus cuniculus. J. Zool. (London) 212:223-233. [ Links ]
Brackett, B. & G. Oliphant. 1975. Capacitation of rabbit spermatozoa in vitro. Biol. Reprod. 12:260-272. [ Links ]
Cervantes, F.A. 1993. Conejos y liebres silvestres de México. Ciencia y Desarrollo 115:58-59. [ Links ]
----------. 1982. Observaciones sobre la reproducción del zacatuche o teporingo Romerolagus diazi Mammalia: Lagomorpha. Doñana Acta Vert. 9:416-420. [ Links ]
Cervantes, F.A. & F.X. González. 1996. Los conejos y liebres silvestres de México. Pp. 17-25 en Ecología y conservación del conejo zacatuche y su habitat (A. Velázquez, F.J. Romero y J.L. Paniagua, eds) Fondo de Cultura Económica, México. [ Links ]
Cervantes, F. A., C. Lorenzo, & R. S. Hoffman. 1990 Romerolagus diazi. Mammal. Sp. 360:1-7. [ Links ]
Cetica, P.D., J. Sassaroli, M. S. Merani & A. Solari, 1993. Comparative spermatology in Dassipodidae: Priodontes maximus, Chaetophractus villosus and Dasypus hybridus. Biocell 18:89-103. [ Links ]
Cohen, J. 1983. Selection among spermatozoa. Pp. 33-37 en The Sperm Cell. Martinus Nijhoff, (J. Andre, ed). The Hague. Netherlands. [ Links ]
Corbet, G. B. 1983. A review of classification in the family Leporidae. Acta Zool. Fen. 174:11-15. [ Links ]
Cummins, J. M. & P. F. Woodall. 1985. On mammalian sperm dimensions. J. Rep. Fert. 75:153-175. [ Links ]
Fawcett, D. W. 1970. A comparative view of sperm ultrastructure. Biol. Rep. 2(Suppl 2), 90-127. [ Links ]
----------. 1975. The mammalian spermatozoa. Dev. Biol. 44:394-436. [ Links ]
Granados, H. 1981. Basic information on the volcano rabbit. Pp. 940-948 en Proceedings of the World Lagomoph Conference. University of Guelph. Ontario, Canada. [ Links ]
Haskell, H. S. & H. G. Reynolds. 1947. Growth, developmental food requirements and breeding activity of the California jack rabbit. J. Mammal. 28:129-136. [ Links ]
Hibbard, C. W. 1963. The origin of the P3 pattern of Sylvilagus, Captolagus, Oryctolagus and Lepus. J. Mammal. 44:1-15. [ Links ]
Hoth, J. & H. Granados. 1987. A preliminary report on the breeding of the volcano rabbit Romerolagus diazi at the Chapultepec Zoo, México City. Int. Zoo Year Book 26:261-265. [ Links ]
Hoth, J., A. Velázquez, F. J. Romero, L. León, M. Aranda, & D. J. Bell. 1987. The volcano rabbit a shrinking distribution and a threatened habitat. Oryx 21:85-91. [ Links ]
Lindsay, N. B. 1982. A second report on the management and breeding of the volcano rabbit Romerolagus diazi at the Jersey Wildlife Preservation Trust. Jersey Wild. Pres. Trust 19:46-51. [ Links ]
López-Forment, W. & F. Cervantes-Reza. 1981. Preliminary observations on the ecology of Romerolagus diazi in México. Pp. 949-955 en Proceedings of the World Lagomorph Conference. University of Guelph. Ontario, Canada. [ Links ]
Matsuzaki, T., M. Kamiya H. Susuki, T. Nomura, & A. Velázquez. 1996. Reproducción en el laboratorio del conejo zacatuche. Pp. 51-66 en Ecología y conservación del conejo zacatuche y su habitat (A. Velázquez, F.J. Romero, y J.L. Paniagua, eds). Fondo de Cultura Económica, México. [ Links ]
Matsuzaki, T., M. Saito, & M. Kamiya. 1982. Breeding and rearing of the volcano rabbit Romerolagus diazi in captivity. Exp. Anim. 31:185-188. [ Links ]
Roldán, E. R. S., M. Gomendio, & A. D. Vitullo. 1992. The evolution of eutherian spermatozoa and underlying selective forces: Female selection and sperm competition. Biol. Rev. 67:551-593. [ Links ]
Thornback, J. & M. Jenkings. 1984. The IUCN mammal red data book Part 1. International Union for Conservation of Nature and Natural Resources. Gland, Switzerland, l-516 Pp. [ Links ]
Trout, R. C. & G. C Smith. 1995. The reproductive productivity of the wild rabbit Oryctolagus cuniculus in southern England on sites with different soils. J. Zool. (London) 237:411-422. [ Links ]
Velázquez, A. 1994. Distribution and population size of Romerolagus diazi on El Pelado volcano, México. J. Mammal. 75:743-749. [ Links ]
Velázquez, A., F. A. Cervantes, & C. Galindo-Real. 1993. The volcano rabbit Romerolagus diazi a peculiar lagomorph. Lutra 36:62-70 [ Links ]
Velázquez, A., F. J. Romero, & L. León. 1996. Fragmentación del habitat del conejo zacatuche. Pp. 73-86 en Ecología y conservación del conejo zacatuche y su habitat. (A.Velázquez, F.J. Romero, y J.L. Paniagua, eds). Fondo de Cultura Económica, México. [ Links ]
World Health Organization. 1987. WHO manual for the examination of human semen and semen-cervical-mucus interaction. Cambridge: Cambridge University Press. 26 pp. [ Links ]














