Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Acta zoológica mexicana
versão On-line ISSN 2448-8445versão impressa ISSN 0065-1737
Acta Zool. Mex no.87 Xalapa Dez. 2002
Artículo
Filogenia y biogeografía de Cubadrilus (Oligochaeta: Octochaetidae), un género nuevo de lombriz de tierra de Cuba
Carlos Rodríguez Aragonés1 y Carlos Fragoso2
1 Depto. de Biología Animal y Humana, Fac. de Biología. Universidad de la Habana. Calle 25 No. 455. 10400, La Habana, CUBA. E-mail: crodri@fbio.uh.cu
2 Departamento Biología de Suelos. Instituto de Ecología, A.C. Km. 2.5 Carr. Antigua a Coatepec No. 351, Congregación El Haya, CP 91070 Apdo.Postal 63. Xalapa, Veracruz. MÉXICO. E-mail: fragosoc@ecologia.edu.mx
Recibido: 11 de enero 2001
Aceptado: 26 de junio 2002
Resumen
La descripción de tres especies nuevas de lombrices de tierra de Cuba hizo necesario separar en un género nuevo (Cubadrilus gen. nov.) todas las especies cubanas asignadas al género Zapatadrilus. Los resultados de un análisis filogenético de parsimonia (PAUP, V. 3.1.1) de las especies de los géneros Cubadrilus, Zapatadrilus, Trigaster, Borgesia y Neotrigaster apoyan totalmente esta separación y señalan como sinapomorfías de Cubadrilus gen. nov. a los conductos espermatecales largos y pegados al septo anterior, divertículos espermatecales semianillados y presencia en el esófago de una invaginación bífida ventral. Con este nuevo arreglo Cubadrilus aparece como un taxon intermedio entre las lombrices de México, representadas por Zapatadrilus, y las de las restantes Antillas mayores. Dada la historia geológica de Cuba, se propone que los ancestros de Cubadrilus invadieron Cuba dispersándose del sur de Norteamérica a mediados del terciario
Palabras clave: Zapatadrilus, análisis filogenético, parsimonia, México, Caribe.
Abstract
The finding of three new Cuban earthworm species, made it neccesary to describe Cubadrilus gen.nov. in order to include these species and former Cuban Zapatadrilus species. A parsimony phylogenetic analysis (PAUP, v. 3.1.1.) of the genera Cubadrilus, Zapatadrilus, Trigaster, Borgesia and Neotrigaster supported this arrangement, and pointed out the following synapomorphies of Cubadrilus gen. nov: spermathecal duct elongated and joined to anterior septum, half-ring shaped spermathecal diverticula and ventral bifid oesophagous invaginations. The new genus Cubadrilus is considered an intermediate taxon between the mexican Zapatadrilus and the other genera of the Greater Antilles. On the basis of recent interpretations of the geologic history of Cuba, it is proposed that the ancestors of Cubadrilus dispersed from Southern North America during the tertiary.
Key Words: Zapatadrilus, phylogenetic analysis, parsimony, Mexico, Caribbean.
Introducción
El antiguo género Trigaster descrito por Benham en 1886 (Benham 1890) agrupa en la actualidad a 20 especies que al parecer son poco comunes y que se restringen en su mayoría a ecosistemas sin perturbaciones. La carencia de datos en varias de sus especies y posiblemente la falta de nuevos registros han limitado el establecimiento de relaciones filogenéticas más coherentes entre sus miembros. No obstante, James (1991) al describir varias especies de Puerto Rico con tipo Trigaster y utilizando métodos cladísticos, decidió mantener sólo algunas especies en Trigaster (s.e.) y pasar el resto a otros géneros nuevos (Borgesia, Neotrigaster y Zapatadrilus). Los resultados del análisis filogenético mostraron coincidencias entre las afinidades y las distribuciones geográficas en estos grupos; así, Trigaster (tres mollejas, metandria y setas lumbricinas) queda restringido a Puerto Rico, Islas Vírgenes y Cuba, Neotrigaster (tres mollejas, holandria y setas lumbricinas) y Borgesia (tres mollejas, metandria y más de ocho setas por segmento) son exclusivas de Puerto Rico; mientras que Zapatadrilus (dos mollejas, holandria y setas lumbricinas) se distribuye en México y Cuba. Este género incluye cinco especies de México (Z. toltecus Eisen, Z. reddeli Gates, Z. albidus Gates, Z. vallesensis Gates y Z. ticus Righi) y cuatro de Cuba. Las especies de este último país son Trigaster cavernicola Gates y tres especies de la región oriental del país (Z. taina Rodríguez y Fragoso, Z. morenoae Rodríguez y Fragoso y Z. siboney Rodríguez y Fragoso), las que Rodríguez y Fragoso (1995) ubicaron provisionalmente en Zapatadrilus por tener dos mollejas, aún cuando la metandria en todas ellas sugería una diferenciación importante.
En este artículo se describen tres especies más nativas de Cuba, cuya morfología común con el resto de los Zapatadrilus cubanos determinó la designación de un género nuevo.
Materiales y métodos
Los ejemplares se colectaron en la Sierra del Rosario, Pinar del Río en noviembre de 1986 y febrero de 1997; en la Sierra de Cubitas, Camagüey, en agosto de 1996, y en la Sierra Maestra, Santiago de Cuba en noviembre de 1985, abril de 1996 y diciembre de 1997. Los animales se extrajeron manualmente en muestreos cualitativos y se conservaron en formalina al 4% (10% de la solución comercial). Se encuentran depositados en la colección del laboratorio de fauna del suelo de la Facultad de Biología, Universidad de La Habana (FBUH).
Análisis filogenético de las especies de Trigaster (s.l.)
Con el objetivo fundamental de analizar siete especies de Cuba no tratadas en el análisis filogenético que realizó James (1991) del antiguo género Trigaster (sensu Benham) y establecer las relaciones filogenéticas entre las especies cubanas y el resto de las especies afines, se realizó un análisis filogenético de las 23 especies mediante el programa de sistemática filogenética usando parsimonia (PAUP), versión 3.1.1 (Swofford 1993).
Se emplearon los mismos caracteres morfológicos usados por James (1991), pero se recodificaron, dándole la condición de multiestado a varios de ellos (Cuadro 1) y se adicionaron cinco caracteres más (del 25 al 29): 1. Origen del intestino: comienzo en el XVII (0), en o antes del XVI (1), en el XVIII (2), en o después del XIX (3). 2. Número de mollejas: dos (0), tres (1). 3. Localización de la primera molleja: en V (0), en VI (1). 4. Tiflosol: no (0), si (1). 5. Tipo de tiflosol: lamelar (0), bífido (1). 6. Localización del último par de corazones: en XIII (0), en XII (1). 7. Corazones: lateroesofágicos (0), laterales o esofágicos (1). 8. Vaso ventral: completo (0), interrumpido (1). 9. Localización de los poros masculinos: en XVIII (0), en XIX (1). 10. Próstatas: tubulares (0), racimosas (1). 11. Setas peniales: si (0), no (1). 12. Setas copulatorias: no (0), si (1). 13. Testículos: holándricos (0), metándricos (1). 14. Localización del primer par de espermatecas: en VIII (0), en VII (1), en VI (2). 15. Prostomio: Prolóbico (0), Epilóbico (1), Tanilóbico (2). 16. Número de segmentos del clitelo: 7 ó menos (0), entre 7 y 20 (1), 20 ó más (2). 17. Vesículas seminales: en IX y XII (0), en XI y XII (1), en XII (2). 18. Nefridios en segmentos anteriores: densos (0), no densos (1). 19. Espacios setales: cercanos (0), amplios (1). 20. Distribución de las setas: regulares (0), irregulares (1). 21. Número de setas por segmento: 8 (0), más de 8 (1). 22. Setas: constante en número (0), cambiante (1). 23. Vaso deferente: no muscular (0), muscular (1). 24. Nefridios medios: estomados (0), astomados (1). 25. Sacos testiculares: no (0), si (1). 26. Conducto espermatecal: corto (0), largo y sinuoso (1). 27. Divertículos espermatecales: en forma semianillada (0), esféricos, de 1 a 3 (1), variables en forma (2), ausentes (3). 28. Esófago: no modificado (0), escasamente modificado (1), muy modificado (2), con glándulas calcíferas (3). 29. Conducto prostático: simple, fino (0), muscular, grueso (1).
Como grupo externo se seleccionó a Eutrigaster (Eutrigaster) pobozsnyae Csuzdi y a Eutrigaster (Graffia) rodriguezi Csuzdi (Csuzdi 1994) por su condición meronefridial con meganefridios medios abiertos y doble molleja.
Se empleó la búsqueda heurística, intercambio de ramas (Branch Swapping), reconección de árboles por bisecciones (Tree Bisection Reconnection, TBR) y el sistema de optimización ACCTRAN. Los caracteres 1, 4, 6-8, 11-12, 14-16, 18-19, 24-27, 29 se trataron como no ordenados y no polarizados, el resto fueron ordenados y polarizados siguiendo los criterios establecidos en la evolución de Oligochaeta (Brinkhurst 1981, Jamieson 1988); en este caso, los caracteres codificados con 0, representan el estado plesiomórfico.
Resultados
Cubadrilus gen. nov.
Diagnosis: Holándrico o metándrico; vesículas seminales en IX y XII o solo en XII; terminalia masculina de tipo acantodrilina con poros masculinos en XVIII o XIX; próstatas tubulares o racimosas; espermatecas pareadas, conductos espermatecales adheridos al septo que precede al segmento de origen de la espermateca, estrechos, sinuosos, más largos que el diámetro de la ampolla, divertículos (1-3) en forma semianillada o esférico-digitiformes, localizados entre el conducto y la ampolla; dos mollejas en V y VI; esófago formando una invaginación bífida ventral de tejido lamelar entre el XI y el XIII; sistema excretor meronefridial, con nefridios sin vesículas; corazones lateroesofágicos en posición variable entre los segmentos X y XIII; vaso ventral completo.
Distribución: Cuba (Fig. 1) (Clave para su identificación en el Apéndice 1)
Especie tipo: Trigaster cavernicola Gates, 1962
Especies: T. cavernicola Gates, 1962; Zapatadrilus taina Rodríguez y Fragoso, 1995; Z. morenoae Rodríguez y Fragoso, 1995; Z. siboney Rodríguez y Fragoso, 1995; C. barroi sp. nov.; C. righii sp. nov.; C. cubitasensis sp. nov.
Etimología: Se refiere a la combinación del nombre del país donde se colectó la especie tipo, más la terminación "drilus"que significa gusano, lombriz
Cubadrilus cavernicolus (Gates, 1962), comb. nov.
Trigaster cavernicola Gates, 1962: 1-3
Zapatadrilus cavernicolus James, 1991
L: 143 mm, d: 5 mm. Pigmentada. Primer poro dorsal en 8/9. Poros espermatecales en VIII y IX, ecuatoriales a nivel de ab. Poros masculinos en XVIII. Con marcas genitales. Con 12 nefridios por segmento postclitelar. Holándrica. Glándulas prostáticas tubulares. Espermateca con un divertículo esferoidal.
Distribución: Sancti Spíritus, Yaguajay, Punta Caguanes, Cueva de Colón (Gates 1962).
Cubadrilus taina (Rodríguez y Fragoso, 1995), comb. nov.
Zapatadrilus taina Rodríguez y Fragoso, 1995: 23-26, figs. 1, 2
L: 335-463 mm, d: 7-8 mm. Sin pigmentación. Primer poro dorsal en 11/12. Poros espermatecales en 7/8 y 8/9 a nivel de ab. Poros masculinos en XVIII. Sin marcas genitales. De 46 a 48 nefridios por segmento a nivel del XXX. Metándrica. Glándulas prostáticas racimosas. Espermateca con divertículo semianillado entre ampolla y conducto, con hasta 18 cámaras seminales.
Distribución: Granma, Manzanillo, Yara (FBUH 131-134).
Cubadrilus morenoae (Rodríguez y Fragoso, 1995), comb. nov.
Zapatadrilus morenoae Rodríguez y Fragoso, 1995: 26-29, figs. 1, 3
L: 200-285 mm, d: 7-8 mm. Sin pigmentación. Primer poro dorsal en 10/11. Poros espermatecales en VIII y IX, ecuatoriales, laterales a b. Poros masculinos en XVIII. Con marcas genitales. De 24 a 34 nefridios por segmento a nivel del XXX. Metándrica. Próstatas tubulares. Espermateca con divertículo semianillado entre ampolla y conducto, con numerosas y diminutas cámaras seminales.
Distribución: Las Tunas, Ciudad de Las Tunas (FBUH 135-139).
Cubadrilus siboney (Rodríguez y Fragoso, 1995), comb. nov.
Zapatadrilus siboney Rodríguez y Fragoso, 1995: 29-32, figs. 1, 4

L: 98-100 mm, d: 3.5 mm. Sin pigmentación. Primer poro dorsal en 10/11. Poros espermatecales en VIII y IX, ecuatoriales, laterales a b. Poros masculinos en XVIII. Con marcas genitales. Con 18 nefridios por segmento a nivel del XXX. Metándrica. Próstatas tubulares. Espermateca con un divertículo en forma de abanico.
Distribución: Las Tunas, Ciudad de Las Tunas (FBUH 141-142).
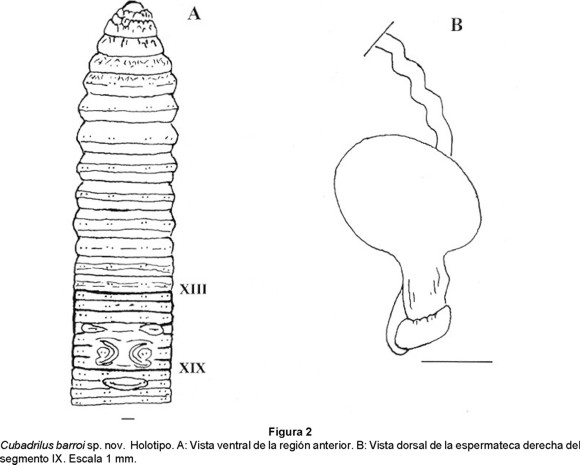
Cubadrilus barroi sp. nov. (Figs. 2 a y b)
Material: 3 adultos colectados en bosques pluvisilvas y semideciduos de la Sierra Maestra, en los picos Cuba, noviembre de 1985 y Turquino, abril de 1990, y en Altos del Naranjo, diciembre de 1996, Santiago de Cuba, Cuba, col. Alejandro Barro.
Holotipo: Ejemplar de 270 mm de longitud, 9.3 mm de diámetro postclitelar y 496 segmentos. Depositado en la colección de la Facultad de Biología de la Universidad de La Habana (FBUH 238).
Paratipos: 2 adultos depositados en la misma colección (FBUH 53, 149). Los tres ejemplares fueron disecados.
Anatomía externa: Longitud de 270 a 620 mm, diámetro postclitelar de 9.3 a 11.0 mm. Número de segmentos: 496 - 1032. Cuerpo en forma cilíndrica en sección transversal. Pigmentación ausente, coloración (conservados) gris - pardo grisáceo. Prostomio prolóbico. Anillación doble o triple a partir del segmento IX. Setas lumbricinas, 8 por segmento, cercanamente pareadas, diminutas, comienzan en el segmento II. Fórmula setal (aa:ab:bc:cd) X: 5:1:5.2:1; XXX: 10.6:1:8.3:1. No se observan setas sexuales. Primer poro dorsal en 10/11 (Holotipo) u 11/12. No se observan poros nefridiales. Clitelo de color pardo - verde aceituna, extendiéndose del segmento XIII al XIX (7 segmentos), anular, liso. Poros espermatecales intersegmentarios en 7/8 y 8/9 a nivel de las setas b. Poros femeninos, un par en XIV, medios a las setas a. Poros masculinos poco visibles en XVIII. Dos pares de poros prostáticos, el primero en XVII y el segundo en XIX a nivel de las setas ab; los surcos seminales rectos o ligeramente cóncavos externamente. Marcas genitales sólo visibles en el holotipo, constituidas por un par de papilas elípticas dispuestas ventralmente en XVI entre las setas a y c, áreas tumescentes ventrales entre los surcos seminales y en el área circundante de las setas ab del XVIII; también se presenta una papila medioventral, transversal y elíptica en XXI entre las setas b.
Anatomía interna: Septos 5/6-10/11 musculares formando embudos imbricados. Dos mollejas en V y VI. La estructura del esófago es compleja entre los segmentos XI y XIII, presentándose una invaginación bífida ventralmente, rellena de lamelas y con un vaso sanguíneo que corre longitudinalmente en el extremo de cada una de sus ramas. Comienzo del intestino en XVII. Vaso dorsal simple que corre a todo lo largo, con vaso ventral, pero sin subneural. Corazones lateroesofágicos en XII y XIII, laterales en X y XI. El vaso supraesofágico se observa en IX-XIII; del VI al IX existe un par de vasos laterales por segmento. Sistema excretor meronefridial; con 50-54 nefridios no estomados por segmento a nivel del XXX; en la parte posterior meganefridios medios abiertos. Metándrica, testículos encerrados en un saco testicular formado por los septos 10/11 y 11/12, embudos seminales iridiscentes. Vasos deferentes intraparietales. Vesículas seminales, un par en XII, pequeñas, de aspecto racimoso. Dos pares de glándulas prostáticas en XVII y XIX, aplanadas, racimosas - compactas, con el conducto prostático muscular, grueso. No se observan ovarios. Espermatecas grandes, voluminosas, un par en VIII y el otro en IX; ampolla ovoide B piriforme. En la unión de la ampolla y el conducto existe un divertículo semianillado a cuadrangular que ocupa sólo la cara anterior, sin cámaras. La ampolla y el divertículo están fijos a la cara posterior del septo que le antecede; el conducto espermatecal es intraseptal, largo, estrecho y sinuoso.
Etimología: La especie está dedicada al Licenciado Alejandro Barro, profesor del Departamento de Biología Animal y Humana de la Facultad de Biología de la Universidad de La Habana, Cuba, colector del holotipo de la especie.
Sistemática: Por la metandria, C. barroi se relaciona con C. taina, C. morenoae y C. siboney; sin embargo, por la presencia de próstatas racimosas y poros espermatecales intersegmentarios se separa de C. morenoae y C. siboney (próstatas tubulares y poros espermatecales ecuatoriales), mientras que de C. taina se distingue por las marcas genitales (presentes en barroi vs ausentes en taina) y las espermatecas (ampolla piriforme con divertículo sin cámaras vs ampolla esférica con divertículo con multiples cámaras)
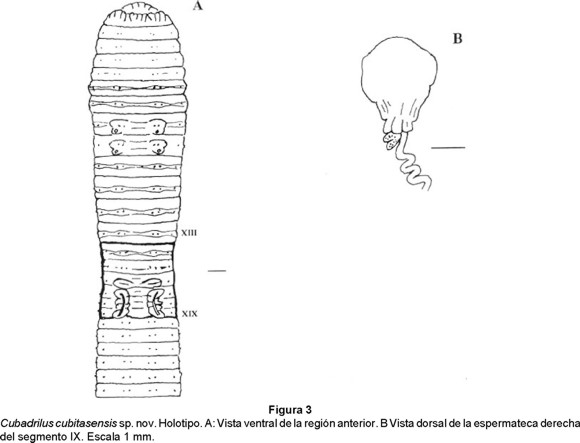
Cubadrilus cubitasensis sp. nov. (Figs. 3 a y b)
Material: 3 adultos y 5 preclitelados colectados en un bosque semideciduo micrófilo en el Hoyo de Bonet, Sierra de Cubitas, Camagüey, Cuba, agosto de 1996, col. Pablo Espinosa.
Holotipo: Ejemplar clitelado de 230 mm de longitud, 6.7 mm de diámetro postclitelar y 373 segmentos. Depositado en la colección de la Facultad de Biología de la Universidad de La Habana (FBUH 221).
Paratipos: 2 adultos y 5 preclitelados depositados en la misma colección (FBUH 220, 222 B 224). Disecados el holotipo y 3 paratipos.
Anatomía externa: Longitud de 195 a 260 mm, diámetro postclitelar de 4.7 a 6.7 mm. Número de segmentos: 307 - 381. Cuerpo en forma cilíndrica en sección transversal. Pigmentacion ausente, coloración (conservados) gris, ligeramente más oscura dorsalmente. Prostomio prolóbico - epilóbico. Anillación doble en los segmentos VI-XIII (XIV). Setas lumbricinas, 8 por segmento, conspicuas, cercanamente pareadas, comienzan en el segmento II y forman hileras regulares. Fórmula setal (aa:ab:bc:cd) X: 2.4:1:2.6:1.6; XXX: 3.4:1:2.6:1.6. No se observan setas sexuales. Primer poro dorsal en 10/11 (4). No se observan poros nefridiales. Clitelo gris con tonalidades amarillo - ocre, extendiéndose del segmento 1/2XIII al 1/2XX (8 segmentos), en forma de silla de montar. Poros espermatecales ecuatoriales en VIII y IX, lateroposteriores a b, entre bc, asociados a tumescencias tegumentarias. Los poros femeninos no se observan; los masculinos, poco visibles en XVIII, en los surcos seminales. Dos pares de poros prostáticos, el primero en XVII y el segundo en XIX a nivel de las setas b. Surcos seminales anchos, profundos, aproximadamente rectos. Marcas genitales pareadas en XVI, XVII, XVIII y XIX, formadas por gruesas papilas transversales entre las setas a y c.
Anatomía interna: Septos 6/7-10/11 musculares, formando embudos imbricados, glándulas septales pareadas en IX. Dos mollejas en V y VI. Esófago con numerosos plegamientos perpendiculares al lúmen, los dos pliegues más ventrales son más prominentes entre los segmentos XI y XIII. Comienzo del intestino en XV. Tiflosol presente a partir del XXXII, lamelar, escasamente desarrollado. Vasos dorsal simple visible a todo lo largo, vaso ventral presente y subneural ausente. Corazones lateroesofágicos en XII y XIII (son los de mayor tamaño), los del IX-XI, laterales. El vaso supraesofágico se extiende en XII-XIII. Sistema excretor meronefridial, con 22 - 24 nefridios por segmento a nivel del segmento XXX. En los primeros 8 segmentos existen densos ramilletes de nefridios, pareados a los lados; en la parte posterior, meganefridios medios abiertos. Holándrica, embudos seminales iridiscentes. Vasos deferentes intraparietales. Vesículas seminales en XII, acinosas. Dos pares de glándulas prostáticas en XVII y XIX, racimosas, aplanadas y redondeadas, conducto escasamente muscular, estrecho, más largo o de igual tamaño que el diámetro de la parte glandular. No se observaron ovarios. Dos pares de espermatecas grandes, el primero en VIII y el segundo en IX. La forma de la ampolla es aproximadamente esférica o piriforme, con varios pliegues en la región basal. Conducto largo, sinuoso, estrecho y pegado a la superficie de la fase posterior del septo del segmento de origen de la espermateca. Entre la ampolla y el conducto existe uno o dos divertículos digitiformes, pequeños.
Etimología: Se refiere al nombre del macizo montañoso donde se colectó la especie.
Sistemática: Por la holandría, C. cubitasensis se acerca a C. cavernicolus de la cual se distingue por el tipo de próstata (racimosas vs tubulares), el número de meronefridios por segmento (22-24 vs 12) y la localización del primer poro dorsal (10/11 vs 8/9).
Cubadrilus righii sp. nov. (Figs. 4 a y b)
Material: 1 adulto y 1 juvenil colectados en bosques Siempreverdes, Loma El Salón, noviembre de 1986 y en La Muralla, febrero de 1997, respectivamente, Sierra del Rosario, Pinar del Rio, Cuba, col. Angela González.
Holotipo: Ejemplar de 170 mm de longitud, 6.7 mm de diámetro postclitelar y 405 segmentos. Depositado en la colección de la Facultad de Biología de la Universidad de La Habana, Cuba (FBUH 074).
Paratipo: 1 juvenil depositado en la misma colección (FBUH 230).
Disecados el holotipo y el paratipo.
Anatomía externa: Longitud de 130-170 mm, diámetro postclitelar de 6.7-7.4 mm. Número de segmentos: 319-405. Cuerpo en forma cilíndrica en sección transversal. Pigmentación escasa, coloración (conservados) gris - pardo, ligeramente más oscura en la región dorsal. Prostomio prolóbico. Anillación doble en los segmentos preclitelares. Setas lumbricinas, 8 por segmento, cercanamente pareadas, conspicuas, formando hileras regulares, comienzan en el segmento II. Fórmula setal (aa:ab:bc:cd) X: 2.8:1:2.6:1.2; XXX: 4:1:2.8:2. No se observan setas sexuales. Primer poro dorsal en 10/11 (2). No se observan poros nefridiales.
Clitelo de color crema, más claro que la superficie dorsal del resto del cuerpo, en XIII-XX, 1/2XXI (9 segmentos), con forma de silla de montar. Poros espermatecales laterales a b, en el ecuador de los segmentos VIII y IX. Poros masculinos poco visibles en los surcos seminales, a mitad del XIX; dos pares de poros prostáticos, el primero en XVIII y el segundo en XX, a nivel de las setas b. Surcos seminales rectos. Marcas genitales pareadas en XVIII, XIX, XX y XXII, formadas por gruesas papilas a nivel de las setas bc y dejando un profundo surco transversal y ventral entre el par de cada segmento (en el holotipo).
Anatomía interna: Septos 5/6-11/12 musculares, formando embudos imbricados. Dos mollejas en V y VI. Esófago con numerosos y grandes pliegues perpendiculares al lúmen, los dos medioventrales más pronunciados, del segmento XI al XIV - XV. Comienzo del intestino en XXI. Tiflosol simple, lamelar, a partir del XXXV o XXXVI. Vaso dorsal simple visible a todo lo largo, vaso ventral presente y subneural ausente. Corazones lateroesofágicos en XI - XIII. Vaso supraesofágico en IX-XIII, vasos laterales del V al IX. Sistema excretor meronefridial, a nivel del segmento XXX se presentan de 16 a 18 nefridios por segmento. Relacionados con la faringe existen densos ramilletes de nefridios. Holándrica. Vasos deferentes intraparietales. Vesículas seminales, un par en XII. Dos pares de glándulas prostáticas compactas - racimosas en XVIII y XX; el conducto prostático es muscular, mucho más corto que la parte glandular. Ovarios, un par en el XIII, en forma de abanicos. Dos pares de espermatecas grandes en VIII y IX. La forma de la ampolla es aproximadamente esférica, con varios pliegues en la región basal de la misma. Se presentan 3 pequeños divertículos digitiformes o esféricos en la unión del conducto con la ampolla. En cada uno de los segmentos VIII y IX, la ampolla está adherida a la cara posterior del septo anterior y el conducto espermatecal es largo, sinuoso, estrecho y superficial al septo.
Sistemática: C. righii se distingue claramente por ser la única especie en el género con poros masculinos en XIX y poros prostáticos en XVIII y XX; así como por el comienzo del intestino en XXI (el resto de las especies, por delante de XIX).
Etimología: Esta especie está dedicada al finado Dr. Gilberto Righi, en reconocimiento a su trayectoria, y enorme y valiosa contribución al estudio de las lombrices de tierra de América Central y del Sur.
Discusión
Filogenia de Trigaster (s.l.)
El análisis filogenético produjo 183 árboles igualmente parsimoniosos (AIP) con Longitud (L) = 80, índice de Consistencia (IC) = 0.45, índice de Homoplasía (IH) = 0.55, índice de Retención (IR) = 0.69 e índice de Reescalamiento (RE) = 0.31. Después de aplicar pesaje sucesivo, los resultados se estabilizaron en 21 AIP con IC = 0.64, IH = 0.35, IR = 0.85 y RE = 0.55.
El consenso estricto de los 21 árboles (Fig. 5) muestra en primera instancia que las cinco especies mexicanas de Zapatadrilus forman un grupo parafilético (en el sentido de no incluir a todas las especies con el mismo ancestro); mientras que las 18 especies antillanas restantes conforman uno monofilético, distinguido por las siguientes sinapomorfías: aumento del número de segmentos clitelares, vesículas seminales en XI y XII o en XII, y la adquisición de próstatas racimosas (16, 17, 10, en el cladograma respectivamente).
A su vez, el clado antillano está formado por dos grupos también monofiléticos con caracteres de mayor exclusividad. Uno de ellos se define por la sinapomorfía de tener tres mollejas (2) y está constituido por especies de los géneros Trigaster, Borgesia y Neotrigaster, de Puerto Rico, Islas Vírgenes y Cuba, los cuales se separan entre sí por las siguientes apomorfías: vaso ventral interumpido en alguna porción de los segmentos anteriores del cuerpo y metandría (8,13) (Trigaster); corazones esofagicos, distribución de las setas irregularmente en alguna porción del cuerpo, más de ocho setas por segmento y metandría (7, 13, 20, 21) (Borgesia); y tiflosol bífido dorsal y vesículas seminales en XI y XII (5,17) (Neotrigaster). Los dos últimos géneros comparten también la localización de las espermatecas a partir de los segmentos VI ó VII y el vaso deferente y el conducto prostático con cubiertas musculares (14, 23, 29).
El segundo clado aparece como grupo hermano del anterior y se separa por tener las siguientes sinapomorfías: espermatecas con conductos largos, estrechos y sinuosos adheridos a la fase posterior del septo que le precede, divertículos en forma semianillada o esférico-digitiformes en número menor de tres, ubicados entre la ampolla y el conducto, y esófago modificado que forma una invaginación bífida ventral (26, 27, 28). A este grupo pertenecen las siete especies cubanas que integran el género nuevo Cubadrilus.
James (1991) señala que la similitud más importante entre todas las especies de Zapatadrilus es la presencia de dos mollejas, una simplesiomorfía atendiendo a la hipótesis de que tres mollejas es una condición derivada; se considera por tanto a Zapatadrilus como un representante del estado ancestral de Trigaster (s.l.). Sin embargo, en el cladograma presentado por James (1991), Z. cavernicolus apareció claramente separado del resto de las especies de Zapatadrilus y de acuerdo con el autor, debía definirse otro género para incluirla. El hallazgo y descripción de las tres especies nuevas cubanas y de otras tres previamente descritas como Zapatadrilus (Rodríguez & Fragoso 1995) así como la formación del grupo monofilético que las contiene en el árbol obtenido (Fig. 5), permitió definir el género Cubadrilus. Los caracteres sinapomórficos presentados por las especies cubanas justifican también la creación del nuevo taxón.
La figura 6 muestra la homogeneidad estructural que caracteriza a las espermatecas de las especies de Cubadrilus y la notable diferenciación respecto a la de los géneros afines. Asimismo, el surgimiento de una invaginación de tejido lamelar en el esófago es un aspecto de interés en la evolución del grupo y al parecer está en estrecha relación con el desarrollo de glándulas calcíferas, un órgano importante en la fisiología de las lombrices de tierra en el ambiente terrestre.

Las diferencias entre las especies de Cubadrilus se muestran en el cuadro 2. La presencia de especies metándricas en Cuba (C. taina, C. morenoae, C. siboney, C. barroi y T. setaearmatus), en Puerto Rico e Islas Vírgenes (Trigaster spp. y Borgesia spp.) y otras sin describir en México (Arteaga 1992, Fragoso 1993) indica que la pérdida del par anterior de testículos ha ocurrido varias veces independientemente en la evolución del grupo.
Las especies de Borgesia muestran evidencia del paso reciente de la holandria a la metandria, presentándose embudos espermáticos vestigiales en el segmento X, pero no testículos. El género pudo haber derivado de un tronco holándrico con tres mollejas, que también dió lugar a Neotrigaster (James 1991) y posiblemente a Trigaster. El surgimiento de la metandria entre las especies cubanas también debió ocurrir a partir de un ancestro holándrico, pero con dos mollejas.
El cladograma presentado en este artículo (Fig. 5) para ilustrar la filogenia de Trigaster (s.l.) difiere únicamente del propuesto por James (1991) en la separación de C. cavernicolus del género Zapatadrilus donde se incluía anteriormente; así como en la integración de dicha especie con las seis restantes (C. taina, C. morenoae, C. siboney, C. cubitasensis, C. barroi y C. righii) en el género nuevo Cubadrilus.
Distribución y biogeografía
Las 23 especies americanas con meronefridios y dos o tres mollejas (caracteres del antiguo género Trigaster) se distribuyen en México (Zapatadrilus, cinco especies), Cuba (Cubadrilus, siete especies; Trigaster, una especie) y Puerto Rico e Islas Vírgenes (Trigaster, Borgesia, Neotrigaster, 10 especies). La distribución geográfica del grupo en Cuba (Fig. 1) muestra su amplia dispersión en el territorio, dada fundamentalmente por las especies con dos mollejas. Sólo una especie con tres mollejas, T. setarmatus, se colectó en Camagüey.
Las nuevas condiciones mostradas por los géneros antillanos (tres mollejas, pérdida de las vesículas seminales del segmento IX, alteración del número de setas, engrosamiento muscular de los vasos deferentes y conductos prostáticos, modificación del esófago, próstatas racimosas) con relación a la mayor simplicidad morfológica de las formas continentales de Zapatadrilus, ponen de manifiesto que las Antillas Mayores han constituido un centro importante en la evolución y diversificación de las especies de Trigaster (s.l.), al exhibir una notable variabilidad morfológica. Cubadrilus presenta, desde el punto de vista morfológico y evolutivo, formas intermedias entre las antiguas especies de Zapatadrilus y las de Trigaster, Borgesia y Neotrigaster, con caracteres más recientes. El aislamiento geográfico de los territorios insulares favoreció el proceso de radiación, especiación y la subsecuente adquisición de las apomorfías mostradas por estos géneros.
La distribución actual de los géneros con dos mollejas (México y Cuba) y con tres mollejas (Puerto Rico, Islas Vírgenes y Cuba centro - oriental) sugiere que probablemente los ancestros de las especies actuales con dos mollejas, colonizaron la porción occidental del paleoarchipiélago que conformaría la isla de Cuba en la actualidad e invadieron el resto del territorio de Oeste a Este, conforme las islas se fueron uniendo entre el Mioceno y el Pleistoceno (Iturralde-Vinent 1988).
Por otra parte, los ancestros de las especies de tres mollejas debieron establecerse primariamente en las tierras que conformaron Gaarlandia (MacPhee & Iturralde-Vinent 1994; Iturralde-Vinent & MacPhee 1999) y dieron lugar a las especies actuales de tres mollejas de Puerto Rico e Islas Vírgenes. La restringida distribución y diversificación en estos territorios así lo sugieren. El hallazgo de una especie con tres mollejas en el este de Cuba pudiera ser reflejo de la conexión geográfica que existió entre esta parte de la isla y el resto de Gaarlandia.
La ausencia de registros de especies de Trigaster (s.l.) en La Española puede explicarse, según Fragoso et al. (1995), por la destrucción de los ambientes naturales o debido a un desplazamiento competitivo por las especies de Eutrigaster y del género ocnerodrilido endogeo Temanonegia. Fragoso et al. (1999), tomando como base la cantidad de especies encontradas en Puerto Rico (18) y extrapolando a la superficie de La Española (7 veces mayor), predicen que esta última isla debería tener cerca de 130 especies nativas (en lugar de las 13 registradas hasta el momento) lo que indicaría que aún falta por encontrar un 90% de especies nativas. En consecuencia en el presente trabajo se prefiere atribuir la falta de registros de Trigaster (s.l.) en La Española a la insuficiencia de muestreos que no han permitido detectar su presencia. No se debe descartar, sin embargo, el efecto de la historia paleogeográfica de la isla sobre este patrón (según Rosen, 1985, la Española se ubico en el pasado más al sur de su posición actual).
Considerando el conocimiento actual de la distribución de las lombrices de tierra en el área del Caribe, Fragoso et al. (1995) propusieron modificar la interpretación convencional de la geología y biogeografía de la región. Los autores indicaron que en contraste con los modelos geológicos de Coney (1982) y Burke et al. (1984), las Proto-Antillas formaron un itsmo en algún punto, uno conectado al Norte y otro al Sur de los continentes, aunque no necesariamente a la vez. Para que las formas ancestrales del antiguo Zapatadrilus y otros géneros como Zapotecia o Protozapotecia de México invadieran a las Proto-Antillas tuvo que haber continuidad para alcanzar Puerto Rico e Islas Vírgenes durante el Cretáceo, hace unos 65 m. a. (Rosen 1975). Sin embargo, la interpretación sobre la dispersión de las lombrices de tierra referida anteriormente no se corresponde con la distribución de anfibios y reptiles de las Indias Occidentales (Hedges et al. 1992, Hedges 1996), ni tampoco con los principios de Iturralde-Vinent (1982) quien plantea que, después del Eoceno Superior, la fauna cubana tuvo una evolución independiente de la fauna continental.
De acuerdo a recientes pruebas paleogeográficas y paleoceanográficas aportadas por Iturralde-Vinent y MacPhee (1999), las Proto - Antillas que formaron un arco volcánico en el Cretáceo, no tuvieron continuidad geográfica, ni temporal con las Antillas de hoy en día, pues desaparecieron producto de drásticos eventos tectónicos que ocurrieron en el Eoceno Medio - Tardío; por esta razón, la historia geográfica de las presentes Antillas comenzó con un nuevo régimen tectónico instituido a finales del Eoceno.
Por otra parte, y atendiendo a la teoría vicariante propuesta por Rosen (1975, 1985) cabe esperar que las afinidades de ciertos grupos monofiléticos entre el sureste de México y Cuba, deben ser más fuertes que entre Cuba y el Norte de México. Consecuentemente la fauna de lombrices de tierra del Sureste de México, como por ejemplo Balanteodrilus, Ramiellona, Lavellodrilus, etc., debería ser muy parecida a la oligoquetofauna cubana y de otras islas de las Antillas Mayores, lo que sin embargo no ocurre así. El mismo Rosen (1975) observó un patrón de distribución similar para los peces del género Fundulus.
En consecuencia la presencia en Cuba y otras islas del Caribe de los géneros Protozapotecia y Zapotecia (presentes en el Norte y centro de México, pero ausentes al Sur y Sureste de este país y del Norte de América Central) podría deberse a eventos de dispersión más que a eventos vicariantes.
Una interpretación más aceptable sobre la distribución de las lombrices en el área parece tener mayor sustento en la reconstrucción paleogeográfica propuesta por Donnelly (1985, 1988) quien señala que a mediados del Terciario (posiblemente durante el Oligoceno) el archipiélago de las Antillas se encontraba relativamente cerca de la Florida, lo que pudo haber permitido la entrada de algunos elementos nórdicos a las islas caribeñas. Por supuesto, ello presupone aceptar una dispersión por mar o por aire sobre el plumaje y patas de las aves migratorias. Como las lombrices son altamente sensibles a la salinidad y las corrientes marinas del Golfo fluyen en un sentido opuesto al Caribe, la segunda vía de dispersión parece tener mayor lógica. La ausencia de registros en el sureste de los Estados Unidos de los géneros Zapatadrilus, Eutrigaster y Protozapotecia, no apoya esta hipótesis, aunque la última glaciación podría haber causado la extinción masiva de estos géneros en esta región. También es posible que la dispersión haya ocurrido del norte de México. Un muestreo sistemático del norte de Tamaulipas y sur de Texas, Lousiana y la Florida será importante para aclarar esta situación.
Agradecimientos
Carlos Rodríguez agradece al Proyecto CYTED PIP XII.3 del Subprograma Diversidad Biológica y al CONACYT, el apoyo para realizar varias estancias de investigación en el Depto. Biología de Suelos del Instituto de Ecología A.C., durante las cuales se llevó a cabo gran parte de este manuscrito. Los autores agradecen a A. Moreno, P. Omodeo y un revisor anónimo sus atinadas sugerencias a la primera versión del artículo, así como a A. Angeles y M. Cruz su ayuda en la edición de las figuras.
Literatura citada
Arteaga, C. 1992. Sistemática y Ecología de las lombrices de tierra (Annelida: Oligochaeta) de la cuenca del río Pánuco. Tesis de Licenciatura. Facultad de Ciencias Biológicas, Universidad del Noreste, Tampico, México, 64 pp. [ Links ]
Benham, B. 1890. The Genera Trigaster and Benhamia. Annals 8 Magazine of Nat. Hist. 6 (Serie 6):414-416. [ Links ]
Brinkhurst, R. O. 1981. Evolution in the Annelida. Can. J. Zool. 60:1043-1059. [ Links ]
Burke, K., C. Cooper, J.F. Dewey, P. Mann & J.L. Pindell. 1984. Caribbean tectonic and relative plate motions. Geol. Soc. Am. Mem. 162:31-63. [ Links ]
Coney, P.J. 1982. Plate tectonic constraints on the biogeography of middle America and the Caribbean Region. Ann. Missouri Bot. Gard. 69 (3):437-443. [ Links ]
Csuzdi, C. 1994. Neue Eutrigaster-Arten aus Kuba und ihre zoogeographischen Beziehungen (Oligochaeta: Octochaetidae). Mitt. Hamb. Zool. Mus. Inst. 89 (2):63-70. [ Links ]
Donnelly, T. W. 1985. Mesozoic and Cenozoic Plate Evolution of the Caribbean Region. Pp. 89-121 In: F.G. Stehli and D. Webb (Eds.): The Great American Biotic Interchange. Plenum Press, New York. [ Links ]
----------. 1988. Geological constraints on Caribbean biogeography. Pp. 15-37 In: J. K. Liebherr (ed.): Zoogeography of Caribbean Insects.Cornell Univ. Press. [ Links ]
Fragoso, C. 1993. Les peuplements de vers de terre dans l=est et sud=est du Mexique. Ph. D. Thesis. Univ. Paris 6. Paris, France, 225 pp. [ Links ]
Fragoso, C., S.W. James & S. Borges. 1995. Native earthworms of the North Neotropical region: Current status and controversies. Pp. 67-115. In: P.F. Hendrix (ed.): Earthworm Ecology and Biogeography in North America. Lewis Publishers, Boca Raton. [ Links ]
Fragoso, C., J. Kanyonyo, A. Moreno, B. Senapati, E. Blanchart & C. Rodríguez. 1999. A Survey of Tropical Earthworms: Taxonomy, Biogeography and Environmental Plasticity. Pp.1-26. In: P. Lavelle, L. Brussaard, y P. Hendrix, P. (Eds.): Earthworm Management in Tropical Agroecosystems.. CAB International. Oxford, UK. [ Links ]
Gates, G.E. 1962. On a new species of the earthworm genus Trigaster Benham, 1886 (Octochaetidae). Breviora. 178:1-4. [ Links ]
Hedges, S.B. 1996. The origen of West Indian anphibians and reptiles. Pp. 95-128. In: R. Powell and W. Henderson (Eds.): Contributions to the west indian Herpetology: a tribute to Albert Schwartz. Society for the Study of Anphibians and Reptiles. Ithaca, New York. [ Links ]
Hedges, S. B., C. A. Hass & L. R. Maxson. 1992. Caribbean biogeography: molecular evidence for dispersal in West Indian terrestrial vertebrates. Proc. Natl. Acad. Sci. (USA) 89:1909-1913. [ Links ]
Iturralde-Vinent, M.A. 1982. Aspectos geológicos de la biogeografía de Cuba. Rev. Cien. de la Tierra y el Espacio. 5:85-101. [ Links ]
----------. 1988. Naturaleza geológica de Cuba. Científico B Técnica, Ciudad de La Habana, 146 pp. [ Links ]
Iturralde-Vinent, M.A. & R.D.E. MacPhee. 1999. Paleogeography of the Caribbean Region: Implications for Cenozoic Biogeography. Bull. Amer. Mus. Nat. Hist. 238:1-95. [ Links ]
James, W.S. 1991. New species of earthworms from Puerto Rico with a redefinition of the genus Trigaster. Trans. Am. Micros. Soc. 110(4):337-353. [ Links ]
Jamienson, B. G.M. 1988. On the phylogeny and higher classification of the Oligochaeta. Cladistics 4:367-400. [ Links ]
MacPhee, R. D. E. & M. A. Iturralde-Vinent 1994. First Tertiary land mammal from Greater Antilles: an early Miocene sloth (Xenarthra, Megalonichidae) from Cuba. Amer. Mus. Novit. 3094:1-13. [ Links ]
Rodríguez, C. & C. Fragoso 1995. Especies nuevas de Zapatadrilus James, 1991 (Oligochaetaa: Megascolecidae) de Cuba. Acta Zool. Mex. (n.s.) 64:21-33. [ Links ]
Rosen, D. E. 1975. A vicariance model of Caribbean biogeography. Syst. Zool. 24:431-464. [ Links ]
----------. 1985. Geological hierarchies and biogeographical congruence in the Caribbean. Ann. Mo. Bot. Gard. 72:636-659. [ Links ]
Swofford, T. R. E. 1993. PAUP: Phylogenetic Analysis Using Parsimony. Version 3.1. Computer program Illinois Natural History Survey, Champaingn, Illinois, 257 pp. [ Links ]














