Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta zoológica mexicana
On-line version ISSN 2448-8445Print version ISSN 0065-1737
Acta Zool. Mex n.87 Xalapa Dec. 2002
Artículo
Aportes a la biología del escarabajo sudarericano Sulcophanaeus leander (Waterhouse, 1891) (Coleoptera: Scarabaeidae)
Jorge Ari Noriega Alvarado
Laboratorio de Zoología y Ecología Animal, Universidad de Los Andes, Bogotá, COLOMBIA. E-mail: jnorieg@hotmail.com
Recibido: 26 de noviembre 2001
Aceptado: 10 de junio 2002
Resumen
En una zona de bosque húmedo tropical de la Amazonía Colombiana se llevó a cabo un estudio sobre el escarabajo suramericano Sulcophanaeus leander, mediante muestreos con trampas de caída y observaciones ad libitum. El escarabajo presenta hábitos alimenticios estrictamente coprófagos y su presencia está restringida a las playas, donde es el único escarabajo estercolero que se encuentra presente con mayor frecuencia. Utiliza excremento de mamíferos y reptiles, y su actividad de vuelo presenta dos picos de actividad: uno al amanecer y otro al atardecer. La actividad de remoción de arena y excremento fue visible en la noche, al comienzo de la mañana y al final de la tarde. Bajo las muestras de excremento, los escarabajos construyen galerías alimenticias poco curvadas de una longitud aproximada de medio metro. Se presentan algunos datos de la distribución geográfica de la especie.
Palabras clave: Amazonía Colombiana, coprófagos, historia natural, playas, Scarabaeidae, Sulcophanaeus leander.
Abstract
In a zone of tropical rain forest of the Colombian amazonic region a study on the south american beetle Sulcophaneus leander was carried out, using pitfall sampling methods and ad libitum observations of the captured specimens. The beetle presents strictly coprophagic feeding habits and its presence is restricted to river beaches, being the only species found there in abundance; it uses dung from different animals (mammals and reptiles) and its flight activity shows two peaks along the day: one at dawn and one at dusk. The sand and dung remotion activity was visible through the night, early in the morning and the late evening. The construction of poorly curved alimentary galleries was observed below the excrement samples, reaching an approximate length of half a meter. The present study gives some information of the geographical distribution of this species, based on collections from different localities.
Key Words: Amazonía Colombiana, beaches, dung beetles, natural history, Scarabaeidae, Sulcophanaeus leander.
Introducción
En las regiones tropicales, el gremio de coleópteros coprófagos perteneciente a la familia Scarabaeidae, tiene una gran importancia en los ecosistemas, al utilizar excrementos de mamíferos omnívoros y herbívoros, como fuente principal de alimento (Howden & Young 1981, Halffter & Halffter 1989, Gill 1991). Las larvas y los adultos de estos escarabajos toman los nutrientes necesarios de las heces, siendo importante para las hembras adultas, ya que realizan la ovoposición al interior de las masas de estiércol (Halffter & Edmonds 1982, Cambefort & Hanski 1991).
Aunque de este grupo de escarabajos se conocen con cierta profundidad diversos aspectos ecológicos como son su contribución al reciclaje de nutrientes, el control de parásitos y enfermedades, la capacidad de dispersión de semillas y su utilización como bioindicadores (Halffter & Matthews 1966, Waterhouse 1974, Hanski 1989, Estrada & Coates-Estrada 1991, Favila & Halffter 1997), es muy poco lo que se ha estudiado acerca de la historia natural en algunos géneros tropicales como es el caso de Sulcophanaeus.
De los pocos trabajos realizados en el género Sulcophanaeus cabe resaltar el estudio efectuado por Morelli, Vainer & Canziani (1997), con la especie S. menelas (Laporte 1840), en donde logran dilucidar algunos de los componentes más importantes sobre su ecología, tipo de nidificación y ciclo de vida. Pero para el resto de especies, de este género, es casi desconocida su historia natural.
Este es el caso de S. leander (Waterhouse 1891), un escarabajo suramericano perteneciente a la tribu Phanaeini de la subfamilia Scarabaeinae s. str. (Edmonds 1972). Ambos sexos presentan procesos cefálicos corniformes bien desarrollados, siendo el del macho bastante largo, curvo y terminado en punta y el de la hembra fuertemente bifurcado (Edmonds 1972). La principal fuente alimenticia de los Phaneini, son las heces de animales y la carroña, sin embargo la biología y ecología de S. leander se desconoce. Tampoco se tiene certeza sobre su rango de distribución, debido a los pocos ejemplares existentes en las colecciones entomológicas (Edmonds 1972).
Este trabajo presenta algunas observaciones sobre la biología y ecología de S. leander con relación a su hábitat, el empleo del recurso alimenticio, el vuelo, la actividad diaria, las galerías subterráneas y algunos registros de su presencia en localidades Colombianas.
Material y métodos
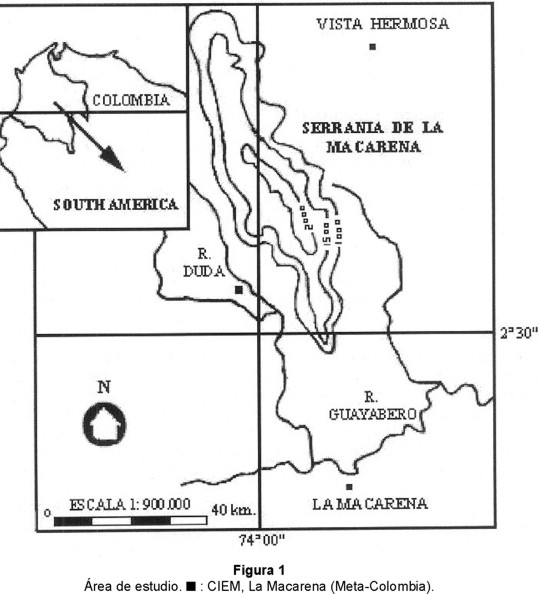
Área de estudio: El presente estudio se realizó en el campamento de Puerto Marimba del Centro de Investigaciones Ecológicas de La Macarena (CIEM) localizado en: 2°40' N y 74°10' W. Se ubica en la margen derecha del Río Duda, a 13 km del Río Guayabero, en el borde oriental del Parque Nacional Natural Tinigua, departamento del Meta, Colombia (Fig. 1). A una altura de 350 msnm, predomina una vegetación de bosque húmedo tropical de tierras bajas (Hirabuki 1990).
La región se caracteriza por un ciclo monomodal de lluvias. El período seco abarca de diciembre a marzo y el resto del año (de abril a noviembre) es lluvioso (>100 mm por mes). Los registros de los últimos 20 años, obtenidos por el Instituto de Hidrología y Meteorología de Estudios Medio Ambientales (IDEAM), indican que el promedio anual de lluvias para la zona es de 2400 mm, registrándose en enero los mínimos valores mensuales (0 mm) y los mayores en mayo (530 mm). La temperatura promedio anual para la zona es de 25 °C.
Este trabajo se realizó en los tres hábitats descritos por Hirabuki (1990) para la zona de estudio:
- Bosque Maduro de Tierra Firme: se caracteriza por tener un dosel continuo con árboles de 25 a 30 m de altura y árboles emergentes que alcanzan los 35 m. Este tipo de bosque presenta la más alta diversidad de especies vegetales (Barbosa & Hirabuki 1992).
- Bosque Anegadizo: localizado en un terreno plano que se inunda parcialmente en la época de lluvias. Presenta un dosel discontinuo, dominado por Ficus spp., Inga spp. y Cecropia sp., con un sotobosque cubierto principalmente por Heliconia spp.
- Playas: están ubicadas en las márgenes del río Duda, siendo su número y tamaño variable a lo largo del año, en relación con la estacionalidad pluviométrica. En los meses con mayor pluviosidad, el río aumenta su caudal y en pocos días cubre rápidamente las playas por completo, mientras que en la época de sequía estas quedan al descubierto, sin secarse el río por completo. En los meses de sequía, las temperaturas en las playas llegan a los 50-55 °C, que junto con la ausencia de precipitación, hacen de este hábitat un ambiente árido, de tipo desértico (Mcginnies 1979). Asociado a las playas se encuentra el bosque ripario, que presenta etapas tempranas de sucesión, estructurado principalmente por gramíneas (Tessaria integrifolia Ruiz & Pavon) y árboles jóvenes de Cecropia sp. (Fig. 2).

Muestreo y análisis de los datos: Dentro del estudio faunístico de la comunidad de escarabajos coprófagos en la zona, se realizaron muestreos de junio a julio de 1994, de diciembre a enero de 1996 y en enero de 1998, el primero de ellos correspondiente a la época de lluvias y los dos restantes a la época de sequía. En los tres muestreos se estudiaron los hábitats descritos anteriormente, utilizando trampas de caída tipo "pitfall", con cebo (Escobar 1994). Para el muestreo en la época lluviosa se colocaron dos transectos en cada hábitat, con diez trampas separadas 25 m entre si y 500 m de distancia entre los transectos. En cada transecto, se colocaron trampas intercaladas cebadas con excremento humano, pescado en descomposición y calamar en descomposición, por espacio de 48 horas cada 10 días, para cada uno de los meses de muestreo.
Para los dos muestreos en época de sequía se repitió la metodología anterior, pero se utilizaron un total de quince trampas por transecto.
Como complemento a lo anterior, se realizaron 142 horas de observación ad libitum sobre muestras de excremento humano y carroña, colocadas en playas tanto en el día como en la noche, para las dos épocas.
Para examinar las galerías subterráneas de los escarabajos, se realizaron excavaciones directamente debajo de los sitios en donde se observo que algún individuo se enterraba; se efectuaron cortes longitudinales en la arena, a una profundidad de 1 m utilizando palas manuales.
A su vez, se colocaron trampas de tipo bote, las cuales consisten en un tubo de 20 cm de diámetro por 60 cm de profundidad, el cual se encuentra partido en dos. Este se llena de arena y se entierra totalmente, dejando su borde a ras con la superficie de la playa. Posteriormente se puede abrir para revisar su contenido; estas trampas permiten a los individuos de S. leander realizar galerías dentro y así poder ser estudiada la estructura de las mismas.
Resultados
Hábitat
En los hábitats muestreados (bosque maduro y bosque inundable) no fue registrada la presencia de ningún individuo de S. leander, ni por observación, ni por colecta en trampas de caída. Solo en la época seca pudo registrarse la presencia de S. leander en las playas, tanto por observaciones directas en muestras de excremento humano colocadas a diferentes horas del día, como por medio de los muestreos con trampas de caída. En la época lluviosa no se registro su presencia en ninguno de los hábitats existentes en la zona, por lo que su existencia no solo se encuentra restringida a las playas, sino a la época de sequía.
La colecta de ejemplares en la línea de trampas desde el borde de la playa hasta el interior del bosque, a lo largo del gradiente de sucesión en la playa, demuestra que S. leander solo entra hasta la zona anterior de los árboles maduros de T. integrifolia (Fig. 2 zona B), ya que solo se encontraron individuos en esta zona. Observaciones directas sobre cebos colocados en las áreas más cercanas al bosque confirmaron la ausencia de esta especie para esta zona y no se observó en ningún caso la llegada o aproximación de ningún individuo.
Igualmente todas las colectas ocasionales de esta especie en años anteriores, fueron realizadas en playas: cuatro en galerías y tres más sobre excremento (Noriega, obs. pers.), siendo S. leander la única especie de escarabajo coprófago encontrada comúnmente en las playas, a excepción de algunos individuos de Gromphas aeruginosa (Perty 1830).
Excremento utilizado
A lo largo de los recorridos en las playas, se colectaron ejemplares de S. leander: cuatro sobre excremento de capybara (Hydrochaeris hydrochaeris [L.]), dos en excremento de cocodrilo (Crocodylus intermedius [Graves]), dos en tapir (Tapirus terrestris [L.]) y un ejemplar en excremento de cebú (Bos indicus [L.]). En las playas, también puede encontrarse excremento de algunos otros animales como el de aves y felinos que podrían ser utilizados potencialmente por S. leander, pero estos, a lo largo de los recorridos diarios, fueron muy escasos.
Sulcophaneus leander mostró hábitos estrictamente coprófagos, prefiriendo el cebo de heces humanas a los demás ofertados, ya que no se registro la presencia de ningún individuo en las trampas cebadas con calamar y pescado en descomposición, el 100% de los individuos colectados fueron en excremento.
Localización de la fuente de alimento
Tanto las hembras como los machos vuelan sobre la arena a una altura entre 30 y 50 cm, describiendo un vuelo en zigzag a lo largo de la playa hasta llegar al excremento, sobre el que realizan elipses largas que van reduciendo su diámetro, hasta descender de manera abrupta. En la mayoría de los casos (76 de 82 individuos observados), el descenso se presenta a una distancia del excremento de 8 a 25 cm. En los restantes casos, los escarabajos descendieron directamente sobre la muestra. En cualquiera de las dos situaciones, después de aterrizar, el escarabajo se desplaza caminando hasta el borde del excremento, lugar en donde se entierra escarbando principalmente con sus patas anteriores y ayudándose con el clípeo.
Actividad diaria
El vuelo se restringe a dos picos de actividad a lo largo del día. Se hicieron 123 observaciones sobre la actividad de vuelo tanto directa, como por capturas en trampas de caída, únicamente entre las 5:40 y las 6:30 y entre las 18:00 y las 18:40 (Fig. 3). Estos datos concuerdan con las horas de captura en otras localidades diferentes a La Macarena, donde el autor ha encontrado individuos de S. leander. La actividad de remoción de arena sobre las muestras directas de excremento que puede observarse externamente, parece ser más frecuente en las horas de la noche (19:00 a 22:30), mientras la diurna se presenta entre las 7:00 y las 9:00 y de 16:00 a 18:00, coincidiendo con las horas de menor temperatura en la superficie de la arena.

Descripción de las galerías alimenticias
Se observaron cinco galerías subterráneas, al final de las cuales se encontraron nueve individuos, el número de individuos por galería oscila entre 1 a 3. Las galerías se localizan exactamente debajo de la fuente alimenticia, algo desplazadas hacia el borde del excremento por donde ingresan los individuos. Presentan una profundidad entre 40 y 60 cm, con pocas curvas y ángulos de 45 a 60 grados respecto a la superficie de la playa. El diámetro oscila entre los 2.5 y 3.5 cm, constante a todo lo largo de la galería.
En dos de las galerías con menor profundidad, se observó la presencia de un solo individuo y no se presentó almacenamiento de excremento en el interior, debido principalmente a ser muy recientes. En las tres restantes, en donde tanto la profundidad como el tiempo de elaboración de la galería fue mayor, se encontró en dos de ellas la presencia de un macho y una hembra por galería alimenticia y en otra ocasión se encontraron dos machos y una hembra. En estos tres últimos casos se encontró una importante cantidad de excremento almacenado en forma de salchicha que oscilaba entre los 5 a 7 cm3, ubicándose por encima y por debajo de los especímenes encontrados (Fig. 4).

De igual manera que en estudios anteriores (Noriega 1996), se encontró almacenamiento de excremento de capybara (H. hydrochaeris) en dos galerías examinadas.
Distribución geográfica.
A partir de las colectas realizadas por el autor y de la revisión de las colecciones de la Universidad de Los Andes, la Universidad Pedagógica Nacional, del Instituto de Ciencias de la Universidad Nacional, del Instituto Alexander von Humboldt, de la Pontificia Universidad Javeriana, las colecciones particulares de Alejandro Lopera, Luis Carlos Locarno y la del autor; se observó que para Colombia el rango de distribución es limitado, concentrándose en la parte Oriental, correspondiente a la provincia biogeográfica de la Orinoquía (Hernández et al. 1992).
Las localidades donde se han encontrado especímenes de S. leander son: META: SERRANÍA DE LA MACARENA, CIEM - 350 msnm; 94 km de Villavicencio PUERTO LÓPEZ, Finca Mozambique - 185 msnm; 187 km de Villavicencio PUERTO GAITÁN - 207 msnm; 250 km de Villavicencio SAN PEDRO DE ARIMENA - 250 msnm; VICHADA: 350 km de Puerto Carreño GUAYABITO - 166 msnm; 170 km de Puerto Carreño STA. RITA - 200 msnm ; CASANARE: 20 km de San Pedro de Arimena EL COPEY - 250 msnm; 150 km de Yopal EL AMPARO - 150 msnm; ARAUCA: 120 km de Arauca MOCHUELO, Caserío Indígena - 100 msnm (Fig. 5).

A la distribución registrada para Colombia hay que sumar la confirmación de S. leander en las sabanas venezolanas (Blanco 1988), especialmente abundante para la localidad de San Fernando, en el estado de Apure - 260 msnm (Arnaund, com. pers.).
Discusión y conclusiones
Hábitat
Edmonds (1972) sugiere que S. leander es una especie posiblemente restringida a Venezuela, probable habitante de sabanas y que podría esperarse que fuera coprófaga, si en realidad ocupara este tipo de hábitat. Los resultados y observaciones de este trabajo confirman su distribución tanto en Venezuela como en Colombia, en ecosistemas como lo son las playas de río y las sabanas de la Orinoquía, lo que estaría señalando una posible restricción a un determinado substrato, similar a lo descrito por Matthews (1966) para S. carnifex (L).
Sulcophanaeus leander se encuentra presente en las playas de río y ausente de los bosques inundables y de los de tierra firme, llegando solamente a la zona de pastos de la sucesión, sin entrar mas allá de esta franja.
Como se mencionó anteriormente, en los meses más lluviosos del año (mayo y junio), el aumento en el caudal del río conlleva la inundación de las playas, ocasionando que este hábitat desaparezca por completo. Sin embargo se desconoce que sucede con S. leander en esta temporada y para ello a modo de especulación proponemos una serie de posibles explicaciones.
Una posible hipótesis, hace mención a la coordinación del ciclo biológico con la aparición y desaparición de las playas, representado en una existencia anual de tipo semelpara como en algunos escarabeidos y otros coleópteros (Moutia 1940, Hardy & Andrews 1974, Scholtz & Caveney 1988), en este caso sería necesario estudiar el ciclo completo de desarrollo.
Si existiera una concordancia entre el ciclo de desarrollo y la época de sequía, es de esperar el encontrar modificaciones especiales en la construcción del nido, que permitieran su protección contra la inundación (Edmonds, com. pers.), ya que la alta humedad en las cámaras de cría, durante la época de lluvias, representaría un fuerte inconveniente. Es muy probable que el grosor de la bola-nido sea mayor que el de ciertas especies asociadas a ambientes áridos (e.j. Euoniticellus intermedius, Rougon & Rougon 1980 y 1982).
Una segunda hipótesis, hace referencia a que en la época de nidificación, el escarabajo entre al bosque en busca de un excremento de mejor calidad y un suelo más apto, aunque esto implique una mayor competencia. Aún así, sería necesario explicar no solo la migración de las crías de regreso a las playas, sino la ausencia de los adultos en trampas en estas épocas.
Sulcophanaeus leander es el único escarabajo estercolero catalogado como común para las playas, mientras que para los otros hábitats el número de especies reportadas es de 61 (Noriega 2002 en prensa). En las playas, además de S. leander, solo se capturaron cinco individuos de G. aeruginosa. Esta especie no fue observada en actividad sobre el excremento y no se presento en las trampas de caída, solo fue encontrada en una de las trampas de bote.
Excremento utilizado.
Sulcophanaeus leander muestra hábitos estrictamente coprófagos, ya que en ningún caso se reportó su presencia en trampas con carroña, aunque se desconoce si pudiese llegar a tener hábitos necrófagos en casos de estrés alimenticio.
Actividad diaria.
La restricción en la actividad a unas pocas horas en el día, puede responder a estrategias de tipo antidepredatorio contra aves, especialmente búhos y lechuzas (Woodruff 1973). Lo anterior es muy probable ya que se observó el ataque a un individuo de S. leander, por parte de Tyrannus melancholicus (Perlepsch), al ser liberado a las 9:00, hora posterior a la de su actividad típica. También hay que considerar las relaciones de termorregulación con el ambiente, características de estas formas de vida (Crawford 1981). Un comportamiento semejante fue evidenciado para dos especies de escarabaeidos pertenecientes al género Leptohoplia (Howden & Hardy 1971) que ocupan hábitats similares. Matthews (1976), expone que esta restricción a una determinada hora, puede obedecer al efecto que sobre los simbiontes tiene una alta radiación solar (temperaturas tomadas a medio día llegan a alcanzar los 50 °C, en la superficie de la arena). Al restringir la actividad a estas horas, se asegura la presencia de los simbiontes para un adecuado aprovechamiento del recurso y de esta forma se evita a su vez el efecto que tiene la desecación del excremento (Crawford 1979).
Galerías alimenticias.
La presencia de un almacenamiento de excremento en forma tubular, por encima de los individuos, concuerda con lo esperado para la especie (Edmonds com. pers.), permitiendo creer que se ajusta al patrón II de los Coprini-Phanaeina según Halffter y Edmonds (1982), lo cual sería necesario corroborar, observando la totalidad del proceso de construcción de las galerías y el papel que el macho desempeña. La inexistencia de cámaras de cría puede atribuirse al poco tiempo de elaboración de las galerías y ser probablemente un proceso que se realice después de finalizar el almacenamiento necesario, presentándose un comportamiento muy similar al estudiado para S. carnifex (Klemperer 1983).
Es importante anotar que la nidificación no solo depende de la historia evolutiva de las especies (Halffter & Edmonds 1982, Cabrera & Gandolfo 1996), sino del tipo de suelo y de las estrategias asociadas a este comportamiento (Doube et al. 1988). En suelos de tipo arenoso, como lo es el de las playas, se presentan una serie de inconvenientes, en especial la alta tasa de desecación (Barkhouse & Ridsdill-Smith 1986), lo cual se ha evidenciado en varias especies de Phanaeus (Fincher 1973). Siendo una fuerte presión el tipo de suelo, puede ser más probable que exista una necesidad por parte de los individuos de entrar al bosque para la nidificación, sin embargo la humedad relativa a unos pocos centímetros de la superficie varía considerablemente, siendo tal vez un factor poco relevante.
Distribución geográfica
Con respecto a su distribución geográfica, la restricción observada debe atribuirse a la falta de colectas exhaustivas en la zona, en especial en ciertos departamentos como Vichada, Guainía y Guaviare. Debido a la alta homogeneidad de la zona, su distribución puede abarcar la totalidad de los llanos orientales, incluyendo no solo el Meta y Casanare, sino los departamentos de Arauca, Vichada, Guaviare, Vaupes y Guainía, ingresando de esta manera a las sabanas Venezolanas. La presencia histórica de esta especie en las márgenes del río Duda puede explicarse como una posible migración, playas arriba, desde las sabanas del departamento del Meta y Guaviare, por el río Guayabero, utilizando las márgenes del río como hábitat sustituto. Sería necesario comprobar esta hipótesis realizando muestreos a lo largo de las márgenes del río, en época de sequía, esperando encontrar a S. leander a lo largo de su curso.
Otros aspectos asociados
La coloración presentada por S. leander (verde cobrizo metálico), no responde plenamente a una vida en un ambiente árido como lo son las sabanas y aun más las playas, donde se esperaría un color oscuro que permitiera una eficiencia en los procesos de termorregulación, por lo que el color además de obedecer a una característica morfo-fisiológica de la cutícula (Crowson 1981) puede presentar algún tipo de ventaja adaptativa a otros aspectos ecológicos como inpalatabilidad (Arrow 1951), termorregulación (Cloudsley-Thompson 1979), o reconocimiento sexual (Vulinec 1997), o simplemente ser un recuerdo evolutivo, ya que es una coloración típica del grupo.
De igual forma se ha propuesto que la presencia de cuernos con relación al tamaño corporal puede afectar el comportamiento reproductivo (Rasmussen 1994) y en especial ser una limitante para una adecuada locomoción en el interior de túneles subterráneos (Emlen 1994). La presencia de un proceso cefálico corniforme muy desarrollado en las hembras es una condición poco común entre los Phanaeina y otros escarabajos estercoleros (Edmonds 1972). Si las hembras de S. leander están perdiendo en parte su capacidad de desplazamiento, el cuerno debe estar desempeñando una importante función. Sería interesante observar si se presentan luchas entre las hembras o incluso entre las hembras y los machos, por acceso a la fuente alimenticia como se registra para otras especies (Otronen 1988).
Finalmente la similitud en ciertos aspectos que presenta S. leander con S. carnifex, como la posible restricción a un sustrato; la convergencia en la utilización de heces de tapir y la presencia en sabanas encontrada para S. columbi MacLeay (B. Malkin, en Edmonds 1972), permiten pensar que además de la gran afinidad de tipo morfológico descrita por Edmonds (1972) para el grupo faunus, este estaría caracterizado por más aspectos en común.
Siendo los escarabajos estercoleros importantes componentes en el reciclaje de desechos orgánicos en las comunidades (Halffter & Matthews 1966) y al ser S. leander el coprófago mejor representado en las playas, es evidente que esta especie juega un importante papel al interior de este ecosistema, mas aún si tenemos en cuenta que es un interesante ejemplo para el estudio de los procesos de adaptación exitosa a ambientes hostiles, como lo son las playas y de los procesos de migración y colonización de las mismas.
Agradecimientos
A Iván Jiménez y a Daniel Cadena por su ayuda y colaboración en campo, así como a Juan Cristóbal Calle por la elaboración de los dibujos. A Edwald Roessler, Emilio Realpe, Guillermo Rueda y Angélica Rodríguez por la lectura del manuscrito. Un fuerte agradecimiento a Carlos Arturo Mejía por su apoyo en la investigación. A Pedro Reyes (Instituto de Ecología, Xalapa México) por sus importantes anotaciones y comentarios al texto. Muy especialmente a W.D. Edmonds (California State Polytechnic University, Pomona, Cal.), tanto por la identificación taxonómica de los ejemplares, como por sus valiosas y pertinentes revisiones a este manuscrito, las cuales incrementaron significativamente la calidad del mismo. Finalmente quiero agradecer las valiosas sugerencias que recibí de los revisores anónimos y del comité editorial de la revista, al trabajo final.
Literatura citada
Arrow, G.J. 1951. Horned beetles: A study of the fantastic in nature. W. Junk, Publishers, The Hague. Netherland. 180 pp. [ Links ]
Barbosa, C. & Y. Hirabuki. 1992. Notas sobre la vegetación en la margen derecha del Río Duda Macarena (Meta, Colombia). Field Studies of new World Monkeys, La Macarena, Colombia. 7: 15-18. [ Links ]
Barkhouse, J. & Ridsdill-Smith, T.J. 1986. Effect of soil moisture on brood ball production by Onthophagus binodis Thurnberg and Euoniticellus intermedius (Reiche) (Coleoptera: Scarabaeinae). J. Aust. Entomol. Soc. 25: 75-78. [ Links ]
Blanco, J. 1998. Catalogo de los Scarabaeidae (Coleoptera) coprófagos y necrófagos del Estado Táchira, Venezuela. Parte II. Revista Científica UNET. 2: 39-48. [ Links ]
Cabrera, G.W. & Gandolfo, D. 1996. Nidification of Thirteen Common Argentine Dung Beetles (Scarabaeidae: Scarabaeinae). Ann. Entomol. Soc. Am. 89(4): 581-588. [ Links ]
Cambefort, Y., & I. Hanski. 1991. Dung beetle population biology. Pp. 5-22 In: I. Hanski y Y. Cambefort (eds). Dung Beetle Ecology. Princeton Univesity Press, Princeton, NJ. U.S.A. [ Links ]
Cloudsley-Thompson, J.L. 1979. Adaptive functions of the colours of desert animals. J. Arid Environ. 2: 95-104. [ Links ]
Crawford, Clifford S. 1979. Desert detritivores: a review of live history patterns an trophic roles. J. Arid Environ. 2: 31-42. [ Links ]
----------. 1981. Biology of Desert Invertebrates. Springer, New York. 314 pp. [ Links ]
Crowson, R.A. 1981. The biology of the Coleoptera. Academic Press, New York, N.Y. 802 pp. [ Links ]
Doube, B.M., Giller, P.S. & Moola F. 1988. Dung burial strategies in some South African coprine and onotine dung beetles (Scarabaeidae: Scarabaeinae). Ecol. Entomol. 13: 251-261. [ Links ]
Edmonds, W.D. 1972. Comparative skeletal morphology, systematics and evolution of the phanaeine dung beetles (Coleoptera: Scarabaeidae). Univ. Kansas Sci. Bull. 49: 11-143. [ Links ]
Emlen, D.J. 1994. Alternative reproductive behaviors select for male dimorphism in the horned beetle Onthophagus acuminatus (Coleoptera: Scarabaeidae). Thesis, Princeton University, New Jersey. 35 pp. [ Links ]
Escobar, F. 1994. Excrementos, coprófagos y deforestación en bosques de montaña al sur occidente de Colombia. Trabajo de Grado, Biología-Entomología, Universidad del Valle. [ Links ]
Estrada, A. & R. Coates-Estrada. 1991. Howler monkey (Alouatta palliata), dung beetles (Scarabaeidae) and seed dispersal: ecological interactions in the tropical rain forest of Los Tuxtlas, Mexico. J. Trop. Ecol. 7: 475-490. [ Links ]
Favila, M.E. & G. Halffter. 1997. The use of indicator groups for measuring biodiversity as related to community structure and function. Acta Zool. Mex. (n.s.). 72: 1-15. [ Links ]
Fincher, G.T. 1973. Nidification and reproduction of Phanaeus spp. in three textural classes of soil (Coleóptera: Scarabaeidae). Coleopt. Bull. 27 (1): 33-37. [ Links ]
Gill, B.D. 1991. Dung beetles in tropical american forests. Pp. 211-230. In: I. Hanski y Y. Cambefort (eds). Dung Beetle Ecology. Princeton Univesity Press, Princeton, NJ. USA. [ Links ]
Halffter, G. & W.D. Edmonds. 1982. The nesting behavior of dung beetles (Scarabaeinae): an ecological and evolutive approach. Instituto de Ecología, Publicación No. 10, México, D.F. 176 pp. [ Links ]
Halffter, G. & V. Halffter. 1989. Behavioral evolution of the non-rolling roller beetles (Coleoptera: Scarabaeidae; Scarabaeinae). Acta Zool. Mex. (n.s.). 32: 1-53. [ Links ]
Halffter, G. & E.G. Matthews. 1966. The natural history of dung beetles of the subfamily Scarabaeinae (Coleoptera, Scarabaeidae). Folia Entomol. Mex. 12-14: 1-312. [ Links ]
Hanski, I. 1989. The Dung Beetles. Pp. 489-511. In: H. Lieth, y J.A. Weger (eds). Ecosystems of the world 14b: Tropical Rain Forests Ecosystems. Elsevier, Amsterdam. [ Links ]
Hardy, A.R. & F.G. Andrews. 1974. Observations on Megasoma with behavioral notes on some lamellicorn beetles associated with sand dunes (Coleoptera: Scarabaeidae, Lucanidae). Pan- Pacif. Entomol. 50: 124-128. [ Links ]
Hernández, J., A. Hurtado, R. Ortiz & T. Walschburger. 1992. Unidades biogeográficas de Colombia. Pp. 105-152. In: Halffter, G. La Diversidad biologica de Iberoamerica. Acta Zoológica Mexicana (n.s.). Volumen especial. México. [ Links ]
Hirabuki. Y. 1990. Vegetation and Land form structure in the study area of La Macarena. A Physionomic investigation. Field Studies of new World Monkeys, La Macarena, Colombia. 3: 35-55. [ Links ]
Howden, H.F & A.R. Hardy. 1971. Generic placement and adult behavior of the genus Leptohoplia Saylor (Coleoptera: Scarabaeidae). Proc. Entomol. Soc. Wash. 73: 337-341. [ Links ]
Howden, H.F. & O.P. Young. 1981. Panamanian Scarabaeinae: taxonomy, distribution and habits (Coleoptera: Scarabaeidae). Contrib. Amer. Entomol. Inst.. 18: 1-204. [ Links ]
Klemperer, H.G. 1983. Brood ball construction by the non-brooding Coprini Sulcophanaeus carnifex and Dichotomius torulosus (Coleoptera, Scarabaeidae). Ecol. Entomol. 8: 61-68. [ Links ]
Matthews, E.G. 1966. A taxonomic and zoogeographic survey of the Scarabaeinae of the Antilles (Coleóptera: Scarabaeidae). Mem. Amer. Ent. Soc. 21. 1-134. [ Links ]
----------. 1976. Insect ecology. Univ. Queensland Press, St Lucia. 226 pp. [ Links ]
Mcginnies, W.G. 1979. Arid-land ecosystems - common features throughout the world. Pp. 299-216. In: Goodall D.W., Perry R.A., Howes KMW (eds). Arid-land ecosystems: structure, functioning and management. Vol. 1, Cambridge University Press, Cambridge. [ Links ]
Morelli, E., P. Vainer & C. Canziani. 1997. Nidificación, ciclo de vida y estados preimaginales de Sulcophanaeus menelas (Laporte, 1840) (Coleoptera: Scarabaeidae). Elytron. 10:11-22. [ Links ]
Moutia, L.A. 1940. The search for parasites of white grubs (Melolonthids) in Zanzibar, Algeria, Morocco and France. Bull. Entomol. Res. 31: 193-208. [ Links ]
Noriega, J.A. 1996. Reporte de utilización de excremento de capybara (Hydrochaeris hydrochaeris), por un escarabajo coprófago (Coleoptera: Scarabaeidae). Informe de campo, Universidad de Los Andes, Bogotá, Colombia. (Sin publicar). [ Links ]
----------. 2002. A preliminary inventory of the scarab guild species (Coleoptera. Scarabaeidae) collected at the CIEM, Tinigua National Park, Colombia. Field Studies of New World Monkeys La Macarena Colombia. (En prensa)
Otronen, M. 1988. Intra- and intersexual interactions at breeding burrows in the horned beetle, Coprophanaeus ensifer. Anim. Behav. 36: 741-748. [ Links ]
Rasmussen, J.L. 1994. The influence of horn and body size on the reproductive behavior of the horned rainbow scarab beetle Phanaeus difformis (Coleoptera: Scarabaeidae). J. Insect Behav. 7: 67-82. [ Links ]
Rougon, D. & Rougon, C. 1980. Le cleptoparasitisme en zone sahélienne: Phénomène adaptatif d'insectes Coléoptères coprophages Scarabaeidae aux climats arides et semi-arides. C.R. Acad. Sci. Paris D. 291: 417-419. [ Links ]
Mcginnies, W.G. 1979. Arid-land ecosystems - common features throughout the world. Pp. 299-216. In: Goodall D.W., Perry R.A., Howes KMW (eds). Arid-land ecosystems: structure, functioning and management. Vol. 1, Cambridge University Press, Cambridge. [ Links ]
----------. 1982. Le comportement nidificateur d'Onitis alexis Klug en region sahélienne (Col. Scarabaeidae Onitini). Bull. Sc. Entomol. Fr. 87: 15-19. [ Links ]
Scholtz, C.H. & S. Caveney. 1988. Adaptations in trogid carrion beetles to extremely arid conditions. J. Arid Environ. 15: 179-191. [ Links ]
Vulinec, K. 1997. Iridiscent dung beetles: a different angle. Fla. Entomol. 80(2): 132-141. [ Links ]
Waterhouse, C.O. 1891. New Scarabaeidae in the British Museum: 5th contribution. Ann. Mag. Nat. Hist. 6(8): 53-60. [ Links ]
Waterhouse, D.F. 1974. The biological control of dung. Sci. Amer. 230: 101-109. [ Links ]
Woodruff, R.E. 1973. The Scarab Beetles of Florida (Coleoptera: Scarabaeidae). Part I. The Laparosticti (Subfamilies: Scarabaeinae, Aphodiinae, Hybosorinae, Ochodaeinae, Geotrupinae, Acanthocerinae). Fla. Dept. Agr. & Consumer Serv. 8: 1-220. [ Links ]














