Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta zoológica mexicana
versión On-line ISSN 2448-8445versión impresa ISSN 0065-1737
Acta Zool. Mex no.87 Xalapa dic. 2002
Artículo
Interacción entre trogidos (Coleoptera: Trogidae) y tortugas marinas (Reptilia: Cheloniidae) en el PacÃfico Mexicano
María C. Rosano-Hernández y Cuauhtémoc Deloya1
1Instituto de Ecología, A.C., Departamento de Entomología. Km 2.5 carretera antigua a Coatepec, Xalapa, Veracruz, C.P. 91000, MEXICO. mrosano@imp.mx deloyac@ecologia.edu.mx
Recibido: 22 de mayo 2001
Aceptado: 17 de mayo 2002
Resumen
Desde 1987 a 2000 se ha reportado gran mortalidad (>70%) de tortugas marinas del género Lepidochelys en la playa La Escobilla, en Oaxaca, México. Aunque la causa de tal mortalidad se debe a factores diversos, algunos autores la atribuyen mayormente a la depredación de embriones y crías que hace un escarabajo de la familia Trogidae. La revisión taxonómica confirmó que el escarabajo presente en La Escobilla es Omorgus suberosus Fabricius. Este escarabajo habita también otras playas de anidación de tortugas marinas del Pacífico, pero no del Atlántico. El presente trabajo, basado en la revisión y síntesis de la literatura publicada sobre el tema, describe la interacción Omorgus-tortugas marinas (Lepidochelys) y cuestiona el papel depredador de O. suberosus. No se encontró evidencia suficiente de que Omorgus sea un depredador especialista en embriones de tortugas marinas; por el contrario, parece ser un necrófago-saprófago facultativo muy eficiente en la remoción de materiales orgánicos en playas de anidación de tortugas marinas.
Palabras clave: Omorgus, Lepidochelys, tortugas, escarabajos, PacÃfico.
Abstract
From 1987 to 2000, great embryo and hatchling mortality (>70%) of sea turtles (Lepidochelys) has been reported in the nesting beach La Escobilla, Oaxaca, México. The embryo death in this beach was attributed by some authors mainly to the egg predation by a beetle belonging to the family Trogidae. Taxonomic examination confirmed that the beetle at La Escobilla was Omorgus suberosus Fabricius. This species has been also reported in some other nesting beaches of the Pacific, but in none of the Atlantic Ocean. The present paper, based on the literature published about both Omorgus and marine turtles (Lepidochelys), describes the interaction between Omorgus and sea turtles, and discusses the predatory role of Omorgus suberosus. Based in our research, there was insufficient evidence to point O. suberosus as a predator especialist in turtle eggs; the beetle seems to be a highly efficient and facultative necrophagous-saprophagous organism.
Key Words: Omorgus, Lepidochelys, turtles, beetles, Pacifico.
Introducción
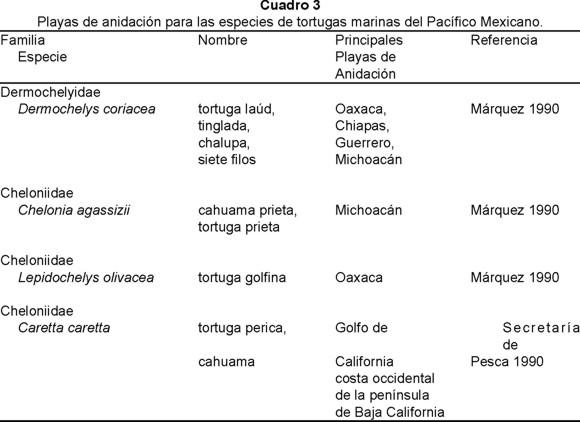
Las tortugas golfinas (Lepidochelys olivacea Eschscholtz 1829) y otras seis especies de tortugas que anidan en México (Dermochelys coriacea Vandelli 1761; Caretta caretta Linnaeus 1758; Chelonia agassizii Bocourt 1868; Chelonia mydas Linnaeus 1766; Eretmochelys imbricata Linnaeus 1766 y Lepidochelys kempii Garman 1880) han sido protegidas legalmente a la fecha, desde 1966-1967 (Secretaría de Pesca 1990). Dado su estado actual de conservación, recientemente se ratificó el peligro de extinción en el que se encuentran todas las especies de tortugas de las Américas (Epperly & Frazier 2000).
Particularmente en la playa La Escobilla (Fig. 1), Oaxaca, México, se ha encontrado una mortalidad de embriones y crías de tortugas golfinas, superior al 70% (López & Aragón 1994). Aunque la causa ha estado relacionada con la densidad de tortugas desovantes en la playa y el saqueo por humanos y perros (Ruiz & Hernández 1988, Rosano et al. 1996), otros autores la han atribuido casi en su totalidad al papel "depredador" de miles de escarabajos de una especie presentes en ésa playa.

La especie de escarabajo, perteneciente a la familia Trogidae, ha sido registrado en la literatura desde 1987 con diferentes nombres: "Trox omorgus subespecies Fabricius" y "Trox suberosus subespecies Fabricius" (López & Aragón 1994) y Omorgus suberosus Fabricius (López & Harfush 2000).
Con la finalidad de disminuir la "depredación de tortugas" por estos trógidos, se ha intentado controlar su número en la playa a través de la recolección directa con atrayentes azucarados y cebos (López & Aragón 1994, López 2000). Utilizando este método, en cinco meses de la temporada de anidación 1999-2000 en La Escobilla, López (2000) recolectó más de siete millones de escarabajos Omorgus suberosus en la playa.
Sin embargo, aparte de los trógidos, hay otros coleópteros en La Escobilla. Observaciones diurnas y nocturnas en esta playa hechas por Rosano et al. (1997), mostraron que hay en total siete especies de escarabajos morfológicamente diferentes entre sí, pertenecientes a cuatro familias de Coleoptera: Trogidae (una o dos especies); Heteroceridae (2); Histeridae (1) y Tenebrionidae (2). Estas especies conforman una coleopterofauna aparentemente única para La Escobilla, cuyo papel ecológico no ha sido investigado. Uno de los siete coleópteros, Omorgus suberosus parece ser una especie necrófaga o saprófaga activa y muy eficiente en la limpieza de la playa, que distaría del papel depredador atribuido por otros autores.
Los objetivos del presente ensayo son: revisar las características de la interacción del escarabajo Omorgus suberosus con las tortugas marinas, discutir el papel ecológico de este escarabajo en las playas de anidación de Lepidochelys olivacea del Pacífico e incluir claves para la determinación de las especies de Omorgus y tortugas marinas en la costa del Pacífico Mexicano.
Metodología
Este trabajo se basó en la literatura publicada por Allgower (1979); López & Aragón (1994), Ruiz & Hernández (1988), López (2000), López & Harfush (2000), Rosano-Hernández et al. (1996) y Rosano et al. (1997) sobre la relación de O. suberosus y L. olivacea en la costa del Pacífico.
Resultados y discusión
La familia Trogidae está ampliamente distribuida en el mundo y particularmente en América está representada por 88 especies incluidas en tres géneros: Polynoncus Burmeister, Trox y Omorgus Erichson, los cuales se encuentran en los Hemisferios norte y sur (Scholtz 1990). En México se han registrado 9 especies de Trox y 18 especies de Omorgus (Deloya 2000). Los miembros de la familia Trogidae son telio-necrófagos, debido a que larvas y adultos se desarrollan en los últimos restos de los cadáveres de vertebrados o en los nidos de aves (huesos, cartílagos, pelo, plumas, tendones) y en las madrigueras de los mamíferos (Morón & Deloya 1991).
Omorgus tiene amplia distribución geográfica en el Continente Americano, desde Canadá hasta Argentina (Scholtz 1990). Habita ambientes diversos: bosques tropicales caducifolios y subperennifolios, bosques espinoso-matorral xerófilo, manglares, acahuales y comunidades perturbadas, ubicados entre el nivel del mar y los 2,400 m de altitud (Deloya 2000). El género ha sido encontrado en Costa Rica y en las Galápagos; en Costa Rica, se encontró en la parte más seca de la Provincia de Guanacaste (Araya 1999). En las Galápagos, aunque se recolectó por primera vez en 1906, en Puerto Villamil, Isabela, se encontró también en todas las islas grandes: Santiago, San Cristóbal, Floreana, Española y Santa Cruz (Allgower 1979).
Omorgus suberosus Fabricius 1775
Systema entomologiae, p. 31
Taxonomía. El género Trox fue descrito por Fabricius 1775, quién designó a la especie tipo como Trox suberosus Fabricius. Omorgus fue descrito por Erichson en 1847, quién designó a Trox suberosus como la especie tipo del género. Esta especie fue considerada hasta 1962 como Trox suberosus. Basado en la taxonomía de los estados inmaduros, Baker (1968) revalidó el carácter genérico de Omorgus. Por lo tanto, el nombre específico válido de la especie asociada con los nidos de tortugas golfinas es Omorgus suberosus Fabricius.
Zoogeografía. O. suberosus (Fig. 2) ha sido encontrado en las Islas Vírgenes (Johnson 1996); en playas de las Islas Galápagos en Ecuador (Márquez et al. 1976); en Ostional, Costa Rica (Araya 1999) y en La Escobilla en México (López & Aragón 1994). La especie tiene una distribución ecológica amplia que va desde los desiertos interiores hasta las playas, en casi cualquier tipo de comunidad vegetal establecida entre el nivel del mar y los 2,400 m de altitud. En México, es la especie más ampliamente distribuida en 20 estados (Deloya 2000). La presencia de O. suberosus en playas ha estado asociada con los sitios de anidación de tortugas marinas del género Lepidochelys (Allgower 1979, Araya 1999, López & Aragón 1994, Ruiz & Hernández 1988, López 2000, López & Harfush 2000, Rosano-Hernández et al. 1996, Rosano et al. 1997).

Morfología. Las larvas son largas, blancas-grisáceas, con la cabeza café y mandíbulas grandes. Su longitud varía entre 8 a 23 mm (Allgower 1979). Los adultos tienen forma alargada oval, robusta, muy convexa dorsalmente y casi plana por la región ventral; tegumento negro brillante a gris pardo; longitud de 11.5 a 15.0 mm; ancho 6.5 a 8.0 mm. Antena con diez artejos, los últimos tres formando una maza de forma rosetada con aspecto tomentoso; abdomen con cinco esternitos visibles; pigidio cubierto por élitros; élitros con hileras de tubérculos; clípeo cubriendo las piezas; ojos no visibles dorsalmente; dimorfismo sexual no aparente (Scholtz 1990, Deloya 2000).
Ciclo De Vida. Lago et al. (1979) mencionan que el ciclo de vida dura un año, aunque los detalles del mismo son prácticamente desconocidos. Allgower (1979) ha mencionado tres estadios larvarios. Por otro lado, O. suberosus ha sido atraído -al inicio de la época de lluvias- con diferentes tipos de luz (mercurial, amarilla, ultravioleta) y con trampas temporales y permanentes (NTP-80: Morón & Terrón 1984) cebadas con pescado, pulpo o calamar.
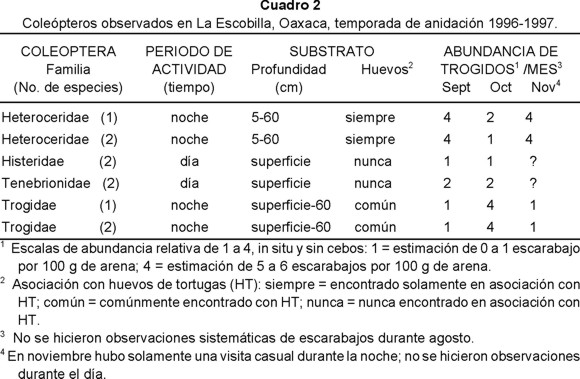
Distribución y Abundancia. Omorgus suberosus ha sido observado y capturado dentro de una región muy definida de la playa La Escobilla (Cuadro 1). No hay reportes de colectas hechas en otras playas de México. En La Escobilla abundan en la región de máxima anidación de tortugas golfinas, entre los 0.7 a 6.9 km (Rosano et al. 1997). Prefieren el suelo húmedo (López & Harfush 2000), arriba del nivel máximo de agua (High Water Mark, HWM) en la región supralitoral (Rosano et al. 1997). El número de escarabajos en el suelo disminuyó desde la superficie hasta los 60 cm de profundidad (Rosano et al. 1997) y fue particularmente abundante a mediados de octubre (Cuadro 2).

Hábitat. Omorgus suberosus ha sido encontrado en nidos con huevos de tortugas golfinas (N=5), dentro de huevos podridos y alrededor de huevos con embriones vivos y cascarones aparentemente intactos. Nunca ha sido hallado en el suelo de agujeros recién hechos por las tortugas, sin huevos (N=20) (Rosano et al. 1997).
Actividad. En la playa La Escobilla O. suberosus fue nocturno, visible únicamente en la noche y en la madrugada (Rosano et al. 1997). Los escarabajos se observaron caminando activamente sobre el suelo superficial, o se encontraron inmóviles sobre material orgánico de origen animal (huevos de tortugas rotos, cadáveres de tortugas, materia fecal de aves).
Depredadores. En La Escobilla, López & Aragón (1994) mencionan que los cangrejos de la playa (posiblemente de la Familia Ocypodidae Ortmann 1894), son depredadores de Omorgus. Los zopilotes Cathartes aura Linnaeus (1758) y Coragyps atratus Bechstein (1793) presentes en la playa, ingieren gran cantidad de escarabajos (Rosano-Hernández et al. 1996), los cuales son defecados casi intactos por estas aves.
Interacción con otros escarabajos. En la arena de La Escobilla, O. suberosus formó parte de una fauna de coleópteros no descrita anteriormente. Los siete escarabajos que componen esta fauna, aunque presentes en la zona de anidación y dependientes de la densidad de tortugas anidantes, mostraron estar separados espacial y temporalmente durante el período de observación (Cuadro 2). No es claro cómo se reparten los recursos disponibles (Rosano et al. 1997).
Hábitos Alimentarios. Como otros coleópteros, O. suberosus posee un aparato bucal masticador que le es apropiado durante todo su ciclo de vida para explotar materiales duros o resecos. Aunque haya sido observado en huevos de tortugas, no hay certeza que O. suberosus sea un especialista en ellos. Sería interesante investigar la selección que hace O. suberosus de los recursos disponibles en la playa, dentro y fuera de la temporada de anidación de tortugas marinas. Es posible que algunos de los escarabajos de La Escobilla sean detritófagos, necrófagos (Rosano et al. 1997) o saprófagos facultativos, esto es, que la condición dependa del tipo y disponibilidad de recursos.
Papel Ecológico. El papel depredador de O. suberosus (López et al. 1994; López 2000) sobre tortugas marinas le fue asignado a las larvas y a los escarabajos adultos sin haber experimentos rigurosamente controlados. Allgower (1979), quién realizó algunas observaciones y experimentos controlados tanto in situ como ex situ con huevos de tortugas blancas Chelonia mydas, en Bahía Barahoña, al sur de la Isla Isabela (Galápagos), encontró que la tasa de mortalidad atribuible a Trox (Omorgus) suberosus fue de 18.9% en los nidos analizados (N=47). Esta es mucho menor al 70% de mortalidad reportado en La Escobilla por López & Aragón (1994). Asimismo, la autora reportó que durante sus experimentos los tres estadios de las larvas y adultos de Omorgus infectaron todo tipo de huevos: aquellos con embriones normales y vivos; con embriones muertos y aquellos de menor tamaño que contuvieron sólo albúmina. Sin embargo, los escarabajos nunca fueron encontrados en nidos recién hechos o en aquellos donde el período de incubación fue menor a 28 días. Tampoco se encontró que los escarabajos se alimentaran de embriones vivos o crías de tortugas marinas. Por lo tanto, O. suberosus durante todo su ciclo de vida, no parece ser un depredador obligado de huevos de tortugas marinas. En la mayor parte de su rango de distribución no existen tortugas marinas o reportes de que sea un saprófago-limpiador de materia orgánica en playas.
Origen de O. suberosus en La Escobilla. Aunque no hay evidencia histórica del ingreso de O. suberosus, López & Aragón (1994) afirman que los escarabajos de esta especie entraron a La Escobilla "por medio de la madera utilizada en la construcción del campamento o arrastrada por el Río Cozoaltepec y depositada en la playa. Una vez ahí, encontraron alimento nutritivo (cascarones y huevos de las tortugas), por lo que se reprodujeron y dispersaron en toda la playa". Omorgus parece que ha sido un habitante natural en la historia de La Escobilla, donde ha aprovechado tanto el hábitat de anidación como la protección de las tortugas. En la playa de Isabela (Galápagos), Omorgus no pudo ser encontrado fuera de la zona de anidación, lo cual indicó que el ciclo de vida de O. suberosus ocurre de manera totalmente subterránea en la arena de la playa (Allgower 1979).

LAS TORTUGAS MARINAS DEL PACÍFICO MEXICANO
Cuatro de las siete especies de tortugas marinas que llegan a México anidan en el Pacífico, desde Baja California, al norte, hasta el sur de Chiapas (Márquez et al. 1976). Con base en el número anual de anidaciones, las principales playas de anidación del Pacífico se localizan en los Estados de Sinaloa, Nayarit, Colima, Jalisco, Guerrero y Oaxaca (Cuadro 3).

Comentarios acerca de las tortugas marinas Lepidochelys del Pacífico.
Las tortugas marinas son reptiles pulmonados, longevos y migratorios, de maduración sexual tardía. Aunque la mayor parte de su vida la pasan en el mar, durante su ciclo de vida visitan una amplia variedad de hábitats oceánicos y costeros; sólo en la época reproductiva se acercan a la playa para desovar (GETM 1995).
Las tortugas Lepidochelys (Fig. 3) presentan un comportamiento de anidación singular. Cientos y a veces, miles de individuos emergen a lo largo de una porción pequeña de playa (<10 km). El fenómeno, conocido como "la arribada", sucede durante dos o tres días de cada mes alrededor del cuarto menguante, hasta el final del otoño (Márquez 1990). El fenómeno es dependiente de una multicausalidad de factores y a la fecha, impredecible con exactitud.

En el sitio elegido para anidar, la hembra limpia la superficie y excava una cámara o hueco de entre 36 a 80 cm de profundidad (Casas-Andreu 1978, Márquez 1990) donde depositará los huevos que se incubarán por aproximadamente 60 días. Durante la excavación, la hembra extrae suelo, plantas y otros materiales presentes, incluyendo huevos de otras tortugas. El número de huevos desovados por hembras Lepidochelys es variable, entre 25 y 155. En La Escobilla el 68.27% de las tortugas golfinas desovan en promedio103.81 huevos (N = 304 hembras) (Casas-Andreu 1978), cuyo tamaño promedio es de 39.1 a 40.6 mm (N = 7 nidos, con 757 huevos) y la masa del huevo promedio, entre 30.1 a 38.2 g (Márquez 1990).
El desarrollo embrionario en las tortugas marinas ha sido descrito con detalle por Miller (1985), período crítico para la sobrevivencia de las tortugas marinas, el cual está fuertemente correlacionado con la temperatura y la humedad en el microambiente del suelo, entre otros factores.
Completado el desarrollo embrionario, las tortugas eclosionan del huevo, ascienden a la superficie, emergen del nido y migran al mar. El proceso es similar en todas las tortugas marinas (Miller 1985, 1997). El ascenso dura entre 3 y 7 días y las crías emergen principalmente durante la noche, cuando la temperatura es menor a los 28°C (Márquez 1990). Las crías se orientan al mar utilizando estímulos esencialmente visuales (Lohmann et al. 1997), y durante el recorrido al mar están expuestas a gran variedad de depredadores (perros, cangrejos, zopilotes, cerdos, etc.).
La Interacción Omorgus-lepidochelys
Los reportes a la fecha sobre la interacción entre Omorgus y tortugas marinas están referidos a dos géneros de una familia de tortugas marinas: Chelonia y Lepidochelys (Cheloniidae) que anidan en la costa del Pacífico: L. olivacea en La Escobilla (López & Aragón 1994) y en las Galápagos (Márquez 1990); L. kempii en la playa de Ostional (Costa Rica) (Araya 1999) y Chelonia mydas en las Galápagos. En otros sitios de anidación, sea masiva o no, de tortugas del género Lepidochelys tanto en el Pacífico (por ejemplo, Playa Nancite en Costa Rica y Orissa, India), como en el Atlántico (Rancho Nuevo, Tamaulipas o Isla Aguada, Campeche, estos dos últimos en México) se han reportado escarabajos Omorgus o de otro género.
Según los reportes examinados, el contacto escarabajos-tortugas ocurre en el nido y es estrictamente depredador: las larvas y adultos de O. suberosus atacan indiscriminadamente a los embriones y crías, mediante la destrucción de los huevos de las tortugas (Allgower 1979, Márquez 1990, López & Aragón 1994, López 2000). Aunque estos autores mencionaron que el ataque a los huevos de tortugas por larvas y adultos de O. suberosus se inicia con la perforación e ingesta del cascarón y en el caso de Chelonia mydas, después de 35 a 40 días de incubación, de un período total de 45 a 55 días (Allgower 1979), no indicaron el estado fisiológico de los embriones en los huevos perforados.
Otro tipo de contacto menos investigado, sería aquel en el que Omorgus seleccionará los huevos con tortugas agonizantes o muertas. Los huevos atacados pudieron tener embriones muertos o letalmente dañados (agonizantes), cuyo olor fue atractivo para Omorgus y otros insectos (dípteros) presentes en la playa. Como la muerte no ocurre al mismo tiempo en todos los órganos, sino progresivamente y de manera jerarquizada (Marín s/a), hubiera sido conveniente definir el estado fisiológico embrionario, definiendo los criterios de salud y daño embrionario, este último letal y no letal, en los huevos donde Omorgus fue observado. La atracción selectiva de artrópodos hacia los restos animales, por ejemplo, las tortugas marinas (Fretey & Babin 1998) ya ha sido documentada en la literatura (Carvalho et al. 2000, Stækeby 2000).
El proceso de ataque y colonización en los huevos de las tortugas marinas de La Escobilla sugiere el desarrollo de una sucesión faunística común en los cadáveres; en ella estarían involucrados organismos heterótrofos de diversos taxa: hongos, bacterias, protozoarios, artrópodos y aves. El papel de cada taxa -necrófago, omnívoro, parásito, depredador o simplemente incidental (Kali 2001), así como su aparición en secuencias más o menos conocidas, sería predecible. Esta es la manera como opera actualmente la entomología forense. Los ordenes Diptera y Coleoptera -observados en La Escobilla y en otros sitios de anidación de tortugas marinas (Márquez 1990, Andrade et al. 1992)- usualmente aparecen en las etapas tempranas de la descomposición de cadáveres animales (Fretey & Babin 1998, Carvalho et al. 2000, Stækeby 2000). Los trógidos al ser telionecrófagos (Morón & Deloya 1991), aparecerían al final de la sucesión de aquellos insectos que invaden tanto cadáveres (Young 2000), como nidos de aves y mamíferos (Jameson 2000).
La cantidad de materia orgánica depositada en La Escobilla que sustentaría una trama trófica de descomponedores y recicladores se estimó para una temporada de anidación, utilizando la cantidad de materia orgánica que introduce un nido de tortuga marina y el número de nidos durante una temporada de anidación. En la playa de anidación Melbourne en la Florida, Bouchard & Bjorndal (1999) estimaron que cada nido de tortuga cahuama Caretta caretta introdujo en promedio, 688 g de materia orgánica. Durante la temporada de anidación 1992-1993 en La Escobilla ocurrieron 10 arribadas más otras anidaciones entre las arribadas (López & Aragón 1994). Si en cada arribada pueden anidar entre 30,000 y 200,000 tortugas (Márquez 1990) y cada nido introdujo 688 g de materia orgánica al suelo, hubieron en teoría, entre 20.6 a 137.6 toneladas de materiales orgánicos después de cada arribada, disponibles para los heterótrofos presentes en la playa.
Los microorganismos, moscas y larvas, perros, zopilotes y los escarabajos (Omorgus y sus larvas, entre otras familias), son heterótrofos que conforman una trama trófica básicamente aerobia, en la que los recursos son eficazmente repartidos y el carbono eficientemente reciclado. Mientras esta trama funcione, no habría riesgo de acumulación en el suelo de substancias tóxicas (por ejemplo, H2S) para otros los embriones de tortugas en incubación, quienes son también heterótrofos aerobios. De ahí que el diseñar e implementar medidas de control para los escarabajos (u otros organismos), sin antes conocer cuáles son sus papeles ecológicos es altamente riesgoso. Ciertas actividades podrían causar efectos desastrosos en el delicado equilibrio de la playa y consecuentemente, en el reclutamiento de las crías y en el futuro de la población de golfinas de La Escobilla.
Una pregunta aún sin contestar es porque La Escobilla posee una fauna de artrópodos tan singular. Aunque los estudios realizados no son concluyentes, permiten hipotetizar que 1) La Escobilla presenta nichos ecológicos apropiados para Omorgus y los otros escarabajos; 2) ésta coleopterofauna parece ser parte de la historia de La Escobilla (y quizá, de otros sitios donde anidan las tortugas Lepidochelys) y que no llegaron de otro lado como lo sugieren otros autores. La existencia de Omorgus en otros sitios de anidación de tortugas marinas en Ostional, Costa Rica y las Galápagos, Ecuador, apoyaría esta hipótesis; sin embargo, habría que documentar la presencia de coleopterofauna de otros sitios de anidación. 3) si Omorgus (y los otros escarabajos) hubieran sido introducidos y Omorgus hubiera adquirido una capacidad depredadora especializada en huevos de tortugas marinas, su existencia estaría letalmente ligada a la de su presa: ambas poblaciones, depredador y presa tenderían a desaparecer y el efecto ya habría sido notado en los nuevos reclutas. Sin embargo, eso no ha ocurrido, ya que por lo menos hasta 1996, la población de golfinas de La Escobilla tenía una sobresaliente tendencia a la recuperación (Peñaflores et al. 1996).
Conclusiones
La pregunta si O. suberosus es un depredador de tortugas marinas, la respuesta sería que no lo es. Los estudios revisados no proporcionaron evidencia rigurosa de que este escarabajo sea especialista en huevos de tortugas marinas. Omorgus suberosus tiene un amplio rango de distribución geográfica, altitudinal, tolerancia ecológica y espectro alimentario muy diverso. Más bien se plantea que es un gran improvisador con mucho éxito de adaptación ecológica, particularmente en los sitios de anidación de Lepidochelys. El trógido en cuestión es un necrófago-saprófago facultativo muy eficiente en la remoción de carbono orgánico dentro de la temporada de anidación. Se precisa por lo tanto, obtener registros sobre la presencia de escarabajos en playas de anidación de otras tortugas marinas, particularmente del género Chelonia y mayor investigación sobre el nicho ecológico de O. suberosus. Es importante conocer el reparto que hace de los recursos disponibles en la playa, ya que parece actuar simultáneamente como saprófago, telionecrófago o depredador oportunista. La realización de experimentos con O. suberosus y embriones de tortugas en diferente estado de afectación fisiológica, serían de particular interés para conocer las preferencias alimenticias de O. suberosus. La Escobilla (México), Ostional y Nancite (Costa Rica) en el Pacífico y Orissa (India) son algunos de los santuarios de tortugas marinas del género Lepidochelys donde debe, en primer término, ser dirigida la atención. Es necesario enfatizar la importancia de realizar experimentos controlados, los cuales darán certidumbre sobre el papel ecológico del escarabajo en las playas de anidación. Mientras no se conozca éste, la instrumentación de medidas de control para los escarabajos podría afectar el equilibrio ecológico de la playa y consecuentemente la población de golfinas anidadoras y los nuevos reclutas.
Agradecimientos
Al Biól. Vicente Guzmán (INP-SEMARNAT, Ciudad del Carmen, Campeche) por facilitar información bibliográfica sobre la biología de las tortugas marinas. A los Drs. Miguel Angel Morón y Gustavo Aguirre (Instituto de Ecología, A.C.) por los comentarios y sugerencias hechos al trabajo.
Literatura citada
Allgower, K. 1979. Effect of the scarab beetle Trox suberosus on the hatching success of the East Pacific Green Turtle Chelonia mydas Agassizi in the Galapagos Islands. Inf. an. Estac. Ci. Ch. Darwin, Santa Cruz: 152-154. [ Links ]
Andrade M.,R., Flores L., R., Fragoso R., S., López S., C., Sarti M., L., Torres M., L. & Vázquez B., L. 1992. Efecto de las larvas de díptero sobre el huevo y las crías de tortuga marina en el playón de Mexiquillo, Michoacán. Mem. VI Encuentro Interuniversitario sobre Tortugas Marinas en México. Facultad de Ciencias, UNAM, México, D.F. Publ. Soc. Herpetol. Méx. No. 1 (1992) pp. 27-37. [ Links ]
Araya M., E. 1999. Biología de Omorgus suberosus Fabricius (Scarabaeidae). In: Biología de los Omorgus (Scarabaeidae) en Finca Jenny. Area de Conservación Guanacaste (Costa Rica). URL:http://www.acguanacaste.ac.cr/1999/investigcion/proyectos_parataxonomos/elda_aray.../omorgus_suberosus.htm. 12 febrero, 2001. [ Links ]
Baker, C.W. 1968. Larval taxonomy of the Troginae in North America with notes on biologies and life histories (Coleoptera: Scarabaeidae). Smithsonian Institute Press, Washington, D.C., 79 p. [ Links ]
Bouchard, S.S. & K.A. Björndal. 1999. Sea turtles as biological transporters of nutrients and energy from marine to terrestrial ecosystems. Ecology, 81(8): 2305-2312. [ Links ]
Carvalho, L.M.L., Thyssen, P.J., Linhares, A.X. & Palhares, F.A.B. 2000. A checklist of Arthropods associated with pig carrion and human corpses in Southeastern Brazil. Memórias do Instituto Oswaldo Cruz On-Line 95(1):135-138. [ Links ]
Casas-Andreu, G. 1978. Análisis de la anidación de las tortugas marinas del género Lepidochelys en México. An. Centro Cienc. Del Mar y Limnol. Univ. Nal. Autón. México 5(1):141-158. [ Links ]
Deloya, C. 2000. Distribución de la familia Trogidae en México (Coleóptera Lamellicornia). Acta Zool. Méx. (n.s.) 81:63-76 [ Links ]
Epperly, S. & J. Frazier, 2000. Resolutions of the Members of the 20th Annual Symposium on Sea Turtle Biology and Conservation. Marine Turtle Newsletter 88:22-26. [ Links ]
Fabricius J.C. 1775. Systema entomologiae, 31 pp. [ Links ]
Fretey, J. & R. Babin. 1998. Arthropod succession in Leatheback Turtle carrion and implications for determination of the postmortem interval. Marine Turtle Newsletter 79:4-7. [ Links ]
GETM, 1995. Estrategia Mundial para la Conservación de las Tortugas Marinas. UICN, Estados Unidos, 24 pp. [ Links ]
Jameson, M.L. 2000. Trogidae MacLeay, 1819, Skin or Hide Beetle Family. http://www.museum.unl.edu/research/entomology/guide/_Trogidae_.htm, 12 febrero 2001, 3 p. [ Links ]
Johnson, N.F. 1996. The beetles of the Virgin Islands. Taxon Name ID 1895. Trox suberosus (Coleoptera:Trogidae). http://iris.biosci.ihio-state.edu/vi_beetles/family.html, 31 enero 1997. [ Links ]
Kali, 2001. Ecological roles of arthropods associated with a corpse. http://kali.usask.ca/bio364/essay97/SA97206.html, 18/01/2001. [ Links ]
Lago, P., R.L. Post, & C. Y., Oseto 1979. The phytophagous Scarabaeidae and Troginae (Coleoptera) of North Dakota. North Dakota Insects Publ. 12: 1-131. [ Links ]
Lohmann, K.J., Witherington, B.E., Lohmann, C.M.F. & M. Salmon 1997. Orientation, navigation and natal beach homing in sea turtles. Cap. 5., pp. 107-137. In: The Biology of Sea Turltes. Lutz, P.L. & Musick, J.A. (Editores). CRC Press, Boca Raton. [ Links ]
López R., E.M. 2000. The study and control of a beetle (Omorgus suberosus Fabricius) that destroys the eggs of Olive Ridley sea turtles (Lepidochelys olivacea) at La Escobilla, Oaxaca, Mexico. 20th Sea turtle Symposium, 29 February through 4 March, 2000. Orlando, FL. A B S T R A C T 2 9 2 , 1 p . U R L : http://www.seaturtle.org/tortuga2000/engprogram/abstracts/271.shtml. [ Links ]
López R., E.M. & L. Aragón R. 1994. Programa de Investigación y Conservación de las Tortugas Marinas. Informe final de las actividades realizadas durante la temporada de anidación 1992-93 de la tortuga Golfina (Lepidochelys olivacea) en la Playa La Escobilla, Tonameca, Pochutla, Oaxaca. Universidad Autónoma "Benito Juárez" de Oaxaca-Secretaría Académica, 57 pp. [ Links ]
López R., E.M. & M. Harfush. 2000. Determination of the percentage of Olive Ridley (Lepidochelys olivacea) in situ nests that are affected by beetles at Escobilla Beach (Mexico). 20th Sea Turtle Symposium, 29 February through 4 March, 2000, Orlando, FL. Abstract 271, 1p. URL:http://www.seaturtle.org/tortuga2000/engprogram/abstracts/271.shtml. [ Links ]
Marín R., E. Sin año (s/a). La fauna y flora de los cadáveres. B. Costa-Amic Editor, México, 118 pp. [ Links ]
Márquez M.,R. 1990. FAO species catalogue. Vol 11: Sea turtles of the world. An annotated and illustrated catalogue of sea turtle species known to date. FAO Fisheries Synopsis no. 125, Vol. 11. Rome, FAO. 1990. 81 pp. [ Links ]
Márquez M.,R., A. Villanueva O., & C. Peñaflores S. 1976. Sinopsis de datos biológicos sobre la tortuga golfina Lepidochelys olivacea (Eschscholtz, 1829) en México. INP Sinopsis Pesca no.2. Instituto Nacional de la Pesca, México, febrero 1976, 61 pp. [ Links ]
Miller, J.D. 1985. Embryology of marine turtles. pp. 270-328. In: Biology of Reproduction, Vol. 14, Development. A. Gans (Editor). John Wiley & Sons, [ Links ]
----------. 1997. Reproduction in sea turtles. Cap. 3., pp. 51-81. In: The Biology of Sea Turltes. Lutz, P.L. & Musick, J.A. (Editores). CRC Press, Boca Raton. [ Links ]
Morón, M.A. & C. Deloya. 1991. Los coleópteros Lamelicornios de la reserva de la biosfera "La Michilía", Durango,México. Folia Entomol. Mex. 81:209-283. [ Links ]
Morón, M.A. & R.A. Terrón. 1984. Distribución altitudinal y estacional de los insectos necrófilos en la Sierra Norte de Hidalgo, México. Acta Zool. Mex. (n.s.) 3: 1-47. [ Links ]
Peñaflores S., C., J. Vasconcelos P., & E. Albavera P. 1996. Anidación de tortugas marinas en la playa de La Escobilla, Oaxaca. Res.. Mem.1er Encuentro Regional sobre Investigación y Desarrollo Costero: Guerrero, Oaxaca y Chiapas, México pg.3. [ Links ]
Rosano-Hernández, M.C., T. Argueta-Valadez & J. Frazier. 1996. Factores que pueden afectar la sobrevivencia de embriones de tortuga golfina Lepidochelys olivacea en la playa La Escobilla, Tonameca, Oaxaca: observaciones en el campo. Res. Mem.1er Encuentro Regional sobre Investigación y Desarrollo Costero: Guerrero, Oaxaca y Chiapas, México. pg. 4. [ Links ]
Rosano H., M.C., T. Argueta-Valadez & J. Frazier. 1997. Return of the beetles: Observations at La Escobilla. In: Proc. Seventeenth Ann. Sea Turtle Symp. Orlando FL. U.S.A. Dep. Commer. NOAA Tech Memo. NMFS-SEFSC-415.294 pp; 1998, p.257-260. [ Links ]
Ruiz, G. & M.B. Hernández. 1988. Programa de Investigación y Conservación de Tortugas Marinas en las costas de Oaxaca, México.Especial atención: Tortuga golfina, Lepidochelys olivacea. Reporte Técnico, Temporada 1987. UABJO-Asociación Mexicana Pro-Conservación de la Naturaleza-SEP, 70 pp. [ Links ]
Scholtz, C.H. 1990. Revision of the Trogidae of South America (Coleoptera: Scarabaeoidea). J. Nat. Hist., 24: 1391-1456. [ Links ]
Secretaría de Pesca 1990. XXV años de investigación, conservación y protección de la tortuga marina. Instituto Nacional de la Pesca, Secretaría de Pesca, pp. 28-31. [ Links ]
Stækeby, M. 2000. The ultimate guide to forensic entomology. Estimating time of death with forensic entomology. URL:http://www.uio.no/morstake/forens_ent/orensic_entomol_pmi.html, 14 Mar 2000. [ Links ]
Vaurie, P. 1955. Revision of the genus Trox in North America. Bull. Mus. Nat. Hist. 115(5): 257-396. [ Links ]
Young, M. 2000.Familia Trogidae. URL: http://entomology.wisc.edu/?young/scarab/trogidae/trogidae.html, 12 febrero 2001. [ Links ]














