Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Acta zoológica mexicana
versão On-line ISSN 2448-8445versão impressa ISSN 0065-1737
Acta Zool. Mex no.86 Xalapa Ago. 2002
Artículo
Efecto de diferentes factores sobre la cría de Callosobruchus maculatus (Coleoptera: Bruchidae) para la producción de Catolaccus spp. (Hymenoptera: Pteromalidae)
Esteban Rodríguez Leyva,1 Victoria Gómez Tovar,1 Nina M. Bárcenas Ortega,2 y Jorge L. Leyva Vázquez1
1 Instituto de Fitosanidad, 2 Instituto de Recursos Genéticos y Productividad, Colegio de Postgraduados en Ciencias Agrícolas, 56230 Montecillo, Texcoco, Edo. de Méx., MÉXICO. E-mail: esteban@colpos.colpos.mx
Recibido: 6 de diciembre 2000
Aceptado: 13 de noviembre 2001
Resumen
En el presente trabajo se describe cómo mantener un pie de cría de Callosobruchus maculatus (Fabricius), y cómo producir larvas de este brúquido para usarlas como hospederas facticias de Catolaccus grandis (Burks) y C. hunteri Crawford, parasitoides del picudo del algodonero (Anthonomus grandis Boheman) y del picudo del chile (A. eugenii Cano), respectivamente. Estos picudos son dos de las principales plagas de dichos cultivos en el continente Americano. Con el propósito de mejorar la metodología de producción del brúquido se evaluaron algunos factores como cantidad y tamaño de garbanzo, tipo de recipiente de cría, y número de orificios para ventilación. De 14 tratamientos que resultaron de la combinación de los factores en estudio, se determinó que a 25 ± 2 ºC la mejor combinación para la producción de larvas de C. maculatus fue: recipientes de 4 L con un orificio de 50 cm2 para la ventilación y 1 kg de garbanzo quebrado grande. Después de 25 ó 30 días del establecimiento de dichos recipientes fue posible recolectar larvas de C. maculatus en dos o tres ocasiones. Se recomienda que estas recolecciones no se extiendan más de una semana porque la calidad y cantidad de las larvas disminuye.
Palabras clave: Control biológico por aumento, cría masiva, hospedero facticio, Anthonomus grandis, A. eugenii.
Abstract
This work describes how to maintain a stock of cowpea weevil, Callosobruchus maculatus (F.), and how to produce larvae for use as factitious hosts for Catolaccus grandis (Burks) and C. hunteri Crawford, parasitoids of boll weevil and pepper weevil, respectively. The weevils are two of the main pest of these crops in the American continent. This methodology was developed to rear the parasitoids in the laboratory, and to improve production of cowpea weevil larvae. We evaluated factors such as quantity and size of broken chick pea, type of rearing container and number of ventilation holes. It was determinated that the best treatment among 14 combinations of factors tested at 25 ± 2 ºC, was a 4 L rearing container with 1 kg of coarsely broken chick pea and one ventilation hole of 50 cm2. After 25 or 30 days, it was possible to harvest larvae on 2 or 3 times from each container, and it is recommended that harvesting does not extend for more than one week. After 7 d the chick pea from the container should be discarded because the quantity and quality of larvae diminishes.
Key Words: Augmentative biological control, mass rearing, factitious host, Anthonomus grandis, A. eugenii.
Introducción
Catolaccus grandis (Burks) es un ectoparasitoide específico del picudo del algodonero, Anthonomus grandis Boheman (Coleoptera: Curculionidae), y se le considera un agente de control biológico ideal para combatir a esta plaga mediante liberaciones inundativas (Summy et al. 1992; Morales-Ramos et al.1995). Por otro lado, C. hunteri Crawford es un ectoparasitoide generalista (Cross & Chesnut 1971) que ataca al picudo del chile (Anthonomus eugenii Cano), tiene un potencial reproductivo superior a éste, y debería considerársele como un agente de control biológico apto para evaluarse contra esta plaga (Rodríguez-Leyva et al. 2000).
Cate (1987) implementó una metodología exitosa para la producción de C. grandis sobre el hospedero natural. Con la intención de disminuir el costo de producción de C. grandis Rojas y colaboradores (1996) desarrollaron una dieta merídica para reproducirlo in vitro. Sin embargo, la dieta artificial no elimina completamente la necesidad del hospedero natural (Rojas et al. 1998).
El costo elevado y los problemas operativos para criar a C. grandis sobre el picudo del algodonero, o sobre una dieta artificial, estimularon la búsqueda de métodos alternativos para la producción de este parasitoide (Ortiz 1998). En Colombia éste se logró reproducir sobre larvas de Acanthoscelides obtectus Say (Coleoptera: Bruchidae) (García et al. 1994), y en Brasil se reprodujo sobre larvas del gorgojo del garbanzo, Callosobruchus maculatus (F.) (F. Ramalho, CNPA/EMBRAPA Campina Grande, comunicación personal).
El método de producción de C. maculatus consiste en usar grano quebrado de garbanzo (Cicer arietinum L.) para obtener larvas de cuarto estadio que se destinan a la producción de los parasitoides y en forma independiente se utiliza grano entero para mantener la producción de adultos (Ortiz 1998).
Al desarrollar una metodología de producción de C. maculatus, G. Aquino (datos sin publicar, IREGEP, Colegio de Postgraduados) observó que al utilizar garbanzo quebrado de mayor tamaño, eliminando pedazos muy pequeños que resultaban durante la molienda, se podían obtener larvas de mejor calidad. Debido a lo anterior, los objetivos del presente trabajo fueron evaluar: a) la influencia del tamaño de garbanzo quebrado sobre la producción de larvas de C. maculatus, b) la cantidad de garbanzo por recipiente de cría, y c) el número de orificios para la ventilación en los recipientes. En este trabajo se incluye además la descripción del manejo que se proporciona a los brúquidos del pie de cría del Programa de Mejoramiento Genético de C. grandis y C. hunteri en el Colegio de Postgraduados, y algunas recomendaciones para la cría, mantenimiento e incremento de dichos insectos.
Materiales y métodos
Pie de cría de brúquidos
La producción de adultos de C. maculatus en el Colegio de Postgraduados se mantiene en una cámara de cría a 29 ± 2 ºC, 30 ± 5% H.R., y un fotoperiodo de 14 h luz y 10 h obscuridad, en granos de garbanzo que es su hospedero natural.
Para mantener el pie de cría cada tercer día se infestaba 1.5 kg de garbanzo entero con 1500 ± 30 brúquidos adultos de menos de 4 días de edad. El garbanzo y los brúquidos se confinaban en recipientes de plástico transparente de 9.6 L de capacidad con base hexagonal de 12 cm por lado. Para permitir la ventilación, una cara lateral de estos recipientes tenía un orificio circular de 10 cm de diámetro con una tapa cubierta por organdí. El material para la producción de adultos se mantuvo en la cámara de cría en las condiciones ya señaladas, y los brúquidos emergían 30 ó 32 días después de la infestación. De cada recipiente la "cosecha" de adultos se realizaba cada 3 ó 4 días, en 4 ó 5 ocasiones. Los adultos se separaban del grano usando un tamiz de 5 x 5 (siempre que se menciona un tamiz el número se refiere a la cantidad de orificios por 6.45 cm2) y se depositaban en un recipiente de plástico, después se colocaban en un tamiz 14 x 14 y se eliminaban adultos muy pequeños y harina.
Tamaño de garbanzo y forma de selección
Para criar a C. maculatus se usó garbanzo para consumo humano con un contenido de humedad de 4 - 5%; cada grano pesaba en promedio 0.67 g. El garbanzo se trituró en un molino eléctrico y después se hizo pasar por tamices de 4 x 4 y 8 x 8. El garbanzo que se quedaba en el primer tamiz se consideró como grano grande y al garbanzo del segundo tamiz se le denominó grano chico. Durante la trituración la testa se mezclaba con el garbanzo, para separarla se vaciaba una cantidad constante de garbanzo de una altura de 1.20 m hacia un recipiente en el piso, haciéndose pasar al mismo tiempo una corriente de aire transversal a la caída del grano.
El garbanzo quebrado y seleccionado se colocaba en bolsas de polietileno con las cantidades para cada tratamiento. Las bolsas se colocaron dentro de un congelador, a -5ºC durante una semana, antes de destinarse a la cría de los brúquidos. Las bolsas se abrían hasta que alcanzaban la temperatura ambiente.
Recipientes de cría para la producción de larvas de C. maculatus
Para los tratamientos testigos se emplearon los recipientes de rutina. Estos eran recipientes de plástico transparente de forma cilíndrica de 17 cm de alto, 12 cm de diámetro, y 2 L de capacidad. En la parte superior tenían una tapa de rosca de 11 cm de diámetro y ésta tenía un orificio de 8 cm de diámetro cubierto por organdí. En el resto de tratamientos se utilizaron recipientes "experimentales", éstos eran de plástico transparente de 10 lados y con una capacidad de 4 L. Cada recipiente tenía una tapa de rosca de 11 cm de diámetro. A los recipientes con ventilación anterior se les hizo en la tapa un orificio circular de 8 cm de diámetro cubierto por organdí. Los recipientes con ventilación anterior y posterior tenían el orificio en la tapa más un orificio en el lado opuesto a ésta; este orificio era un semicírculo de 11 cm de diámetro cubierto por organdí (Fig. 1).

Los recipientes de cría y herramientas se sumergieron en una solución al 1% de hipoclorito de sodio (Cloralex®, ALEN del norte S. A., Santa Catarina, Nuevo León), se enjuagaron y se dejaron secar antes de reutilizarse. Estas medidas se realizaron con el fin de disminuir el riesgo de contaminación por ácaros, otros insectos, o bacterias.
Producción de larvas de C. maculatus, tratamientos y unidad experimental
Para la producción de larvas se empleaban 2000 ± 38 brúquidos adultos por kilogramo de grabanzo quebrado, o la cantidad proporcional en caso de usar menos de 1 kg. En este experimento se contemplaron los siguientes factores: a) tamaño de garbanzo quebrado, grande o chico; b) cantidad de garbanzo por recipiente de cría, 500, 750 ó 1000 g; c) orificios para la ventilación en los recipientes de cría, un orificio en la parte anterior o dos orificios, uno en la parte anterior y otro en la posterior. La combinación de los niveles de cada factor (2 x 2 x 3) produjo un experimento factorial con 12 tratamientos que se establecieron en los recipientes experimentales. Además, el experimento incluyó dos tratamientos testigo, uno para cada tamaño de garbanzo, que recibieron el manejo convencional y que se analizaron de forma independiente. Así, se establecieron 14 tratamientos en total (Cuadro 1) con 4 ó 6 repeticiones, dependiendo de la disponibilidad de material. Cada tratamiento se colocó en un recipiente, y cada recipiente constituyó una unidad experimental.
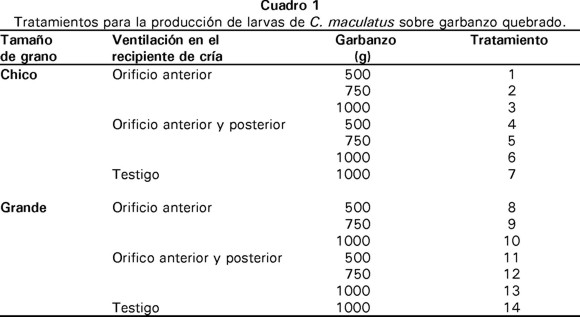
Los tratamientos se agruparon en bloques, y cada bloque se estableció con una semana de diferencia. Las unidades experimentales se distribuían al azar sobre los entrepaños de un estante. Los entrepaños distaban de 25 cm entre sí y los recipientes se acomodaron de manera longitudinal con 2 cm entre cada uno. El experimento permaneció a 24 ± 2 ºC, 60 ± 10% H.R. y fotoperiodo natural de 12 h luz y 12 h obscuridad.
Establecimiento del experimento y cosecha de larvas
Para establecer cada tratamiento testigo se empleaban dos recipientes de cría, cada uno con 500 g de garbanzo se infestaba con 1000 ± 22 brúquidos. Después de 14 días el garbanzo de ambos recipientes se colocaba en uno solo y permanecía así hasta el momento de recolectar las larvas. Para establecer el resto de tratamientos se emplearon los recipientes experimentales. En éstos primero se colocaba la cantidad y tipo de garbanzo, se distribuía a lo largo del recipiente, y se depositaban los brúquidos sobre el garbanzo.
Los tratamientos se revisaban diariamente después de 20 ó 22 días de establecidos, se estimaba visualmente el porcentaje de prepupas y larvas por recipiente, y la primera cosecha se realizaba cuando se observaba 5% de prepupas. Además de ésta, se hicieron 2 ó 3 cosechas más, cada 2 ó 3 días, dependiendo de la cantidad de material en cada caso.
Para cosechar larvas, de cada tratamiento se tamizaban 350-400 g de garbanzo a la vez en una serie de tamices de 8 x 8, 12 x 12, 14 x 14 y un contenedor ajustado a este último (INEZA® S.A., Zapopan, Jalisco). En el primer tamiz quedaba el garbanzo, en el segundo los adultos muertos, prepupas y larvas de diferente tamaño, y en el tercero las larvas más pequeñas. Del segundo tamiz se escogían manualmente las larvas en buen estado, 3 - 4 mm y 8 -10 mg, y para proporcionarlas a los parasitoides se colocaron manualmente en cápsulas de Parafilm® de acuerdo a la metodología de Cate (1987). El garbanzo del primer tamiz se devolvía al recipiente y al cuarto de cría para que las larvas que aún estaban en el garbanzo continuaran su desarrollo.
Análisis de datos
Las variables respuesta fueron: a) número de larvas por tratamiento, b) peso promedio de larvas individuales por tratamiento, y c) temperatura en los tratamientos. Las primeras dos variables se obtuvieron de cada unidad experimental. La temperatura se registró del día 15 de establecido cada bloque, hasta 5 d después de la última cosecha. La temperatura se registró diariamente de 14:00 a 17:00 h introduciendo un termómetro de mercurio en la parte media de las capas de garbanzo, donde se mantenía por 30 - 40 s.
Antes de realizar el análisis de los datos, se comprobó la normalidad de las tres variables con la prueba Kolmogorov-Smirnov. Posteriormente se realizaron análisis independientes para cada variable. Primero, para determinar los efectos principales y las interacciones de los factores sobre cada variable, se realizó un análisis de varianza (ANOVA) para un diseño factorial (2 x 2 x 3) completamente al azar, y una prueba de separación de medias (Tukey P<0.05). En un segundo análisis, se incluyó a los tratamientos testigo y se realizó un análisis de varianza para un diseño de bloques al azar y una prueba de separación de medias (Tukey P<0.05). El efecto de la temperatura se probó con un análisis de varianza, y se completó con un análisis de correlación simple entre temperatura y el número total de larvas por tratamiento. Para los cálculos se utilizó el paquete estadístico SAS para Windows 6.12 (SAS Institute 1988).
Resultados
Las tres variables medidas, número de larvas por tratamiento, peso promedio de larvas individuales por tratamiento, y temperatura por tratamiento presentaron una distribución normal (Kolmogorov-Smirnof, d máxima = 0.6, 0.79 y 0.73 respectivamente). Los resultados de los tratamientos se describen a continuación.
Producción de adultos de C. maculatus
De cada recipiente de cría se obtuvieron entre 16 y 19 mil insectos. El 5% correspondieron a insectos menores al tamaño que se considera normal, se separaron como se indicó en la metodología y no se incluyeron en los resultados. Por lo tanto, de cada recipiente de cría se obtuvieron entre 15,200 y 18,050 adultos útiles, o 6.8 - 8.1 adultos por grano.
Producción de larvas de C. maculatus en garbanzo quebrado y número de cosechas
Con el diseño factorial del experimento se determinó que el mayor número de larvas se produjo con: garbanzo quebrado grande (F[1,43]=5.58, p<0.022), en recipientes de un orificio (F[1,43]=8.95, p<0.004), y sobre 1 kg de grano (F[2,43]=5.58, p<0.001). No obstante, no se encontró interacción entre los factores (Cuadro 2).

En el análisis donde se incluyó a los tratamientos testigo se encontraron diferencias significativas entre tratamientos (F[13,51]=8.95, p<0.004). El tratamiento 10, 1 kg de garbanzo quebrado grande en recipiente experimental con sólo un orificio, fue el que produjo mayor número de larvas y fue significativamente diferente de los tratamientos 12, 4, 1, 5 y 11 (Tukey p<0.05); a este tratamiento le siguió el 13, que contenía la misma cantidad de garbanzo y un recipiente con dos orificios para la ventilación (Cuadro 3).

Por razones prácticas, durante la cosecha de larvas no fue posible considerar el factor número de orificios por recipiente de cría para la ventilación; así, el número total de larvas que se cosecharon se agrupó con base en los factores cantidad y tamaño de garbanzo. El inicio de la cosecha de larvas fue siempre entre 25 y 30 días después del establecimiento, y generalmente no se realizaron más de 2 ó 3 cosechas por recipiente de cría (Cuadro 4).

Peso promedio de las larvas de C. maculatus en garbanzo quebrado
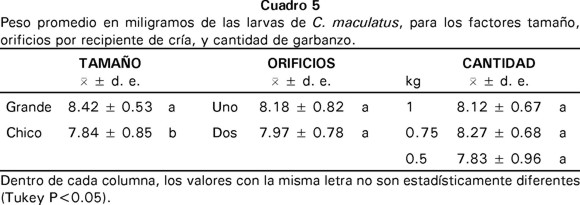
Con el diseño factorial del experimento se determinó que el tamaño de garbanzo influenció el peso promedio de larvas individuales por tratamiento. En el garbanzo quebrado grande se produjeron larvas de mayor peso (F[1,43]=12.72, p<0.001). La cantidad de garbanzo por recipiente (F[2,43]=1.41, p<0.255), y el número de orificios por recipiente (F[1,43]=1.73, p<0.195) no afectaron de manera significativa el peso de las larvas. Además, no hubo interacción entre ninguno de los factores (Cuadro 5).
Temperatura en los recipientes de cría
La temperatura en los recipientes de cría estuvo influenciada por el tamaño de garbanzo (F[1,58]=40.03, p<3.92 -08), por la cantidad de garbanzo (F[2,58]=15.92, p<3.08-6), y por la interacción de tamaño y cantidad de garbanzo (F[2,58]=5.93, p<0.004). El número de orificios en los recipientes de cría no influyó a la temperatura (F[1,58]=0.07, p<0.786) y, por esta razón, no se consideró para presentar estos resultados (Fig. 2a, b).
En todos los tratamientos la temperatura se incrementó considerablemente a partir de los 17 ó 18 días de la infestación con los brúquidos. Después de los 21 días la temperatura se mantuvo entre 30 y 34 ºC por 10 u 11 días en garbanzo grande, y entre 30 y 32 ºC por 7 u 8 días en garbanzo chico; después de que se realizaron las últimas cosechas de larvas la temperatura disminuyó a un nivel cercano a la temperatura ambiental (Fig 2a, b).
Discusión y conclusiones
Producción de adultos de C. maculatus
Los adultos de C. maculatus no necesitan alimentarse ni beber agua ya que obtienen sus requerimientos alimentarios durante el estado larval (Mitchell 1975). Así, la cantidad y calidad de adultos dependerán del tamaño y calidad del garbanzo donde se reproduzcan, y de la competencia de la progenie que las hembras establecen en cada grano. Nwanze y Horber (1975) indicaron que la presencia y proporciones de las dos formas del adulto de esta especie, activa y miniatura, dependían de varios factores, siendo los más importantes el tamaño de semilla y número de larvas por semilla.
Producción de larvas de C. maculatus en garbanzo quebrado
Las hembras de C. maculatus tiene preferencia por ovipositar sobre los cotiledones porque proporcionan mayor superficie de contacto (Nwanze et al. 1975). Por esta razón, es muy probable que los trozos grandes de garbanzo hayan proporcionado más superficie para que ovipositaran las hembras, y más nutrientes para el desarrollo de las larvas comparado con trozos pequeños de garbanzo.
Bajo las condiciones en que se desarrolló este trabajo, el tratamiento 10 (1 kg de garbanzo quebrado en recipientes experimentales con sólo un orificio para la ventilación) fue el que proporcionó las mejores condiciones para el desarrollo de las larvas y logró producir mayor número de éstas; por esta razón, se recomienda dejar de usar menor cantidad de garbanzo y el manejo que se describió como testigo.
Peso promedio de larvas de C. maculatus en grano quebrado
El efecto del tamaño de garbanzo sobre el peso promedio de larvas puede explicarse con los argumentos de Nwanze y Horber (1975) y Mitchell (1975). Según estos autores las larvas de C. maculatus no tienen oportunidad de cambiarse de grano, por lo tanto las semillas grandes pueden proporcionar más nutrientes a las larvas y esto se reflejará en su desarrollo. De acuerdo con los resultados obtenidos, es recomendable usar garbanzo quebrado de tamaño grande porque las larvas del brúquido obtuvieron mayor peso y, aunque esta diferencia fue escasa en miligramos, es importante en la reproducción y desarrollo de los parasitoides que los usarán como hospederos.
Fecha de cosecha de larvas de C. maculatus
Es conveniente que se realicen sólo las cosechas que proporcionen el máximo número de larvas de buena calidad; este número tendrá que ser evaluado para cada caso. En las condiciones del Colegio de Postgraduados, se considera que no es conveniente realizar una cosecha que no proporcione más de 500 a 600 larvas en buen estado por recipiente. Si se considera este número y la cantidad de larvas por cosecha (Cuadro 4), es probable que únicamente sea recomendable realizar 3-4 cosechas en recipientes de 1 kg de garbanzo grande. Considerando que el número de cosechas puede variar dependiendo del tamaño de garbanzo, sería recomendable usar sólo garbanzo grande en un bloque de infestación; si se tiene garbanzo chico, se debería emplear en un bloque diferente.
Esta metodología requiere de poca inversión y puede desarrollarse a diferentes escalas para producir C. grandis o C. hunteri. Además, C. maculatus se puede emplear en la cría de otros parasitoides como eupélmidos (Terrase & Rojas-Rousse 1986), u otros pteromálidos (Mohammed & Al-Jabey 1988, Cross & Chesnut 1971).
Temperatura en los recipientes de cría
La marcha de la temperatura parece asociarse con la cantidad de larvas que se desarrollaron en las diferentes cantidades de garbanzo (1.0 kg de garbanzo tuvo más larvas) y al periodo en el que éstas alcanzaron su 3er y 4to. estadio. En estos estadios se desarrolla una gran actividad metabólica y por tanto producción y liberación de calor. Es muy probable que esta actividad metabólica provocó que la temperatura en los recipientes de cría fuera mayor en varios grados a la temperatura ambiental y, durante algunos días, superior a la temperatura ambiental indicada como óptima para el desarrollo de esta especie por Schoof (1941) 30 ± 0.8 ºC, Nwanze y Horber (1975) 27 ºC, y Chandrakantha y Mathavan (1986) 30 ºC. A pesar de dichos incrementos de la temperatura, los promedios generalmente no rebasaron los 35 ºC, temperatura a la cual todavía se puede desarrollar C. maculatus, pero se incrementa la mortalidad de sus estados inmaduros desde 10% hasta 56% (Chandrakantha & Mathavan 1986).
El incremento de la temperatura o el hacinamiento en cualquier sistema de cría de insectos puede provocar estrés en los organismos y hacerlos más susceptibles a enfermedades provocadas por microrganismos normalmente no patogénicos (Sikorowski & Lawrence 1994). A este respecto se puede indicar que en las primeras cosechas se presentaron algunas larvas con una coloración rojiza, se piensa que esta coloración de las larvas del brúquido está asociada con la presencia de una bacteria y el estrés debido a la temperatura, pero no se ha corroborado.
Con base en la experiencia que se ha obtenido en el manejo de C. maculatus, y para concluir la discusión con respecto a la temperatura y su influencia en la cría de dicha especie, se recomienda que: a) para producir adultos en garbanzo entero es muy importante que la temperatura ambiental no rebase los 31 ºC, y que no sea menor de 27 ºC, ya que con temperaturas menores a ésta se corre el riesgo que los adultos no ovipositen; b) para producir larvas de este insecto en garbanzo quebrado en recipientes con 1 kg de grano la temperatura ambiental debe estar entre 25 ± 2 º C, a una temperatura mayor es muy probable que la presencia de larvas rojas se convierta en el principal problema de la cría.
Como ya se indicó, el número y disposición de los orificios en los recipientes de cría no tuvieron ningún efecto sobre la temperatura, pero es probable que afecten la circulación de aire como lo señalaron Reyes y Vargas (1999), y consecuentemente la humedad relativa dentro de los recipientes. A este respecto Schoof (1941) indicó que C. maculatus se desarrolla en una gran amplitud de humedad relativa si la temperatura ambiental está muy cercana a 30 ºC, y que las humedades relativas entre 44% y 60% para el huevo, y entre 63% y 80% para larvas y pupas son las más adecuadas para esta especie. De acuerdo con el mismo autor, esta especie puede prosperar en humedades más bajas sin problemas porque puede producir agua metabólica durante su desarrollo; la humedad producida durante sus procesos metabólicos puede ser suficiente para incrementar la humedad muy cerca de la saturación y esta especie puede sufrir más por exceso que por falta de humedad (Schoof 1941). Debido a esta característica biológica de la especie, en trabajos posteriores se debe dar mayor atención a la humedad dentro de los recipientes de cría, porque la humedad favorece el desarrollo de levaduras u hongos que pueden afectar a las larvas directamente, o pueden dañarlas indirectamente con la producción de ácidos y alcoholes tóxicos (Schoof 1941).
Agradecimientos
Adriana Ortiz y Gildardo Aquino por su participación en el establecimiento inicial de esta metodología. A Rogelio Malpica y Julián Galloso por su ardua labor en el proceso de molienda del garbanzo, y por su iniciativa en el mejoramiento del mismo. A Teresa Fragoso e Irais y Yarabí Dávila, por colaborar en el desarrollo de este trabajo. Esta investigación se realizó con recursos del USDA-RSED-FAS Grant No. FG-Mx-101, Project No. MX-ARS-2.
Literatura citada
Cate, J. R. 1987. A method of rearing parasitoids of boll weevil without the host plant. Southwest. Entomol. 12: 211-215. [ Links ]
Chandrakantha, J. & S. Mathavan. 1986. Change in developmental rates and biomass energy in Callosobruchus maculatus (F.) (Coleoptera: Bruchidae) reared on different food and temperatures. J. Stored Prod. Res. 22: 71-75. [ Links ]
Cross, W. H. & T. L. Chesnut. 1971. Arthropod parasites of the boll weevil, Anthonomus grandis: 1. An annotated list. Ann. Entomol. Soc. Am. 64: 516-527. [ Links ]
García, R. F., M. J. Sánchez & P. A. Trochez. 1994. Determinación de huéspedes para la cría masiva de Catolaccus sp. parasitoide de Antonomus grandis Boheman. pp 80. En: Resúmenes de Congreso Sociedad Colombiana de Entomología SOCOLEN, Medellín, Colombia. [ Links ]
Mitchell, R. 1975. The evolution of oviposition tactics in the bean weevil Callosobruchus maculatus (F.). Ecology 56: 696-702. [ Links ]
Mohammed, A. K. & Al-Jabey. 1988. Comparative toxicity of some insecticides in laboratory to the southern cowpea weevil Callosobruchus maculatus (F.) and the parasite Anisopteromalus calandrae. J. Agriculture 20: 289-306. [ Links ]
Morales-Ramos, J. A., K. R. Summy & E. G. King. 1995. Estimating parasitism by Catolaccus grandis (Hymenoptera: Pteromalidae) after inundative releases against the boll weevil (Coleoptera: Curculionidae) Environ. Entomol. 24: 1718-1725. [ Links ]
Nwanze, K. F. & E. Horber. 1975. How seed size affects the occurrence of "active" and "miniature" forms of Callosobruchus maculatus in laboratory populations. Environ. Entomol. 4:729-732. [ Links ]
Nwanze, K. F., E. Horber & W. Pitts. 1975. Evidence for ovipositional preference of Callosobruchus maculatus for cowpea varieties. Environ. Entomol. 4: 409-412. [ Links ]
Ortiz, A. 1998. Producción de Catolaccus grandis Burks (Hymenoptera: Pteromalidae) en el huésped facticio Callosobruchus maculatus Fabricius (Coleoptera: Bruchidae). Tesis de Licenciatura, Universidad Autónoma Chapingo, Chapingo, México. 47 pp. [ Links ]
Reyes, R. M. & J. Vargas. C. 1999. Evaluación de métodos de cría para la producción masiva del gorgojo del garbanzo Callosobruchus maculatus (Coleoptera: Bruchidae) en el INIFAP, Rio Bravo. pp. 307-310. En: Memorias del XXXIV Congreso Nacional de la Sociedad Mexicana de Entomología A.C. (ed). Aguascalientes, Ags. [ Links ]
Rodríguez L. E., J. L. Leyva, V. Gómez, N. M. Bárcenas & G. W. Elzen. 2000. Biology of Catolaccus hunteri (Hymenoptera: Pteromalidae), parasitoid of pepper weevil and boll weevil. Ann. Entomol. Soc. Am. 93: 862-868. [ Links ]
Rojas, M. G., J. A. Morales R. & E. G. King. 1996. In vitro rearing of the boll weevil (Coleoptera: Curculionidae) ectoparasitoid Catolaccus grandis (Hymenoptera: Pteromalidae) on meridic diets. J. Econ. Entomol. 89: 1095-1104. [ Links ]
Rojas, M. G., J. A. Morales-Ramos, E. G. King, G. Saldaña & S. M. Greenberg. 1998. Use of a factitious host and supplemented adult diet to rear and induce oogenesis in Catolaccus grandis (Hymenoptera: Pteromalidae). Environ. Entomol. 27: 499-507. [ Links ]
SAS, Institute. 1988. SAS/STAT user's guide, release 6.03. SAS Institute (Ed.) Cary, NC. [ Links ]
Schoof, H. F. 1941. The effects of various relative humidities on the life processes of the southern cowpea weevil, Callosobruchus maculatus (F.) at 30 ± 0.8 ºC. Ecology 22: 297-305. [ Links ]
Sikorowski, P. P. & A. M. Lawrence. 1994. Microbiological contamination and insect rearing. Am. Entomol. 40: 240-253. [ Links ]
Summy, K. R., J. A. Morales-Ramos, & E. G. King. 1992. Ecology and potential impact of Catolaccus grandis (Burks) on boll weevil infestations in the lower Rio Grande valley. Southwest. Entomol. 17: 279-288. [ Links ]
Terrase, C., & D. Rojas-Rousse. 1986. Egg-laying distribution and superparasitism avoidance by the solitary ectoparasite Bruchocida vunello Crawford (Hymenoptera: Eupelmidae) upon stages of its host, Callosobruchus maculatus F. (Coleoptera: Bruchidae). J. Appl. Entomol. 101: 243-256. [ Links ]














