Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta zoológica mexicana
versión On-line ISSN 2448-8445versión impresa ISSN 0065-1737
Acta Zool. Mex no.85 Xalapa abr. 2002
Artículo
Observaciones sobre el ciclo de vida de Pelidnota (Pelidnota) virescens Burmeister, 1844 (Coleoptera: Melolonthidae; Rutelinae)
Miguel Angel Morón y Cuauhtémoc Deloya
Departamento de Entomología, Instituto de Ecología, A.C. (Sector SEP-CONACYT), Apartado Postal 63, 91000 Xalapa, Veracruz, MEXICO.
Recibido: 3 de abril 2001
Aceptado: 31 de agosto 2001
Resumen
Se describe el ciclo de vida de Pelidnota (Pelidnota) virescens Burm. obtenido a partir de 48 huevos puestos por cinco hembras recolectadas en Acamilpa, Morelos, México. Las larvas se desarrollaron en fragmentos de madera podrida de Annona sp. (Annonaceae). El ciclo vital en cautiverio se completó en un año. El primer estadio larvario tuvo una duración de 15 días, el segundo estadio 45 días y el tercer estadio requirió 200 días en promedio para pasar al estadio pupal, que transcurrió por 29 días. Los adultos vivieron 31 días en promedio. Para completar su desarrollo cada larva consumió cuando menos 55 g de madera en peso seco. El peso máximo alcanzado por las larvas de tercer estadio fué de 2.50 g en las hembras y de 2.41g en los machos.
Palabras clave: Rutelini, Biología, saprófagos, estadios inmaduros.
Abstract
The life cycle of Pelidnota (Pelidnota) virescens Burm. is described and discussed, beginning with 48 eggs laid by five females collected in Acamilpa, Morelos, Mexico. Larvae were reared in fragments of soft, rotten wood of Annona sp. (Annonaceae). In captivity, the life cycle was completed in one year. Duration of each instar was as follows: first larvae 15 days, second larvae 45 days, third larvae 200 days, pupae 29 days, and adults 31 days. Each larva consumed at least 55 g of dry rotten wood. Maximum live weights of third instar larvae were from 2.50 g in females and 2.41 g in males.
Key Words: Rutelini, Biology, saprophagous, immature stages.
Introducción
Se conoce muy poco sobre el ciclo de vida de las 685 especies de la tribu Rutelini registradas en el mundo (Machatschke 1972), y solo se han descrito las larvas de 24 especies americanas de dicha tribu. Saunders (1874, 1879), Hayes (1925), Hoffmann (1936), Ritcher (1966), Monné (1969), Morón (1976a; 1983, 1985), Costa et al. (1988), Jameson et al. (1994), Morelli (1996) y Jameson (1997) publicaron datos sobre diversos aspectos de la biología de algunas especies americanas de Rutelini, pero a la fecha no existen datos precisos sobre el ciclo vital completo de ninguna especie. Ritcher (1966) indicó la posibilidad de que los ciclos de vida de Pelidnota (Pelidnota) punctata (Linné) y Parastasia brevipes (LeConte) se completaran en dos años en el este de los Estados Unidos de América.
Como parte de una serie de trabajos sobre los estados inmaduros y la biología de los Rutelini de la Zona de Transición Mexicana y la Región Neotropical (Morón 1976a, b, 1983, 1985, 1993, Morón & Deloya 1991, Solís & Morón 1998; Morón & Nogueira 2000, Jameson & Morón 2001), se han llevado a cabo observaciones para definir los caracteres taxonómicos útiles para reconocer las larvas y las pupas, y para registrar los detalles del ciclo vital de algunas especies.
De acuerdo con Hardy (1975) y Morón et al. (1997) Pelidnota (P.) virescens Burm. se distribuye por los bosques tropicales caducifolios y subcaducifolios ubicados entre el nivel del mar y los 2,100 m de altitud, y se adapta bien a las comunidades secundarias derivadas de éstos, incluyendo los huertos tropicales, en la vertiente del Pacífico mexicano, desde el sur de Sonora hasta Tehuantepec, Oaxaca, y penetra por la cuenca del río Balsas, hasta los límites de los estados de Puebla y Morelos. Sus larvas se han encontrado en troncos y tocones de mango (Manguifera indica L.; Anacardiaceae) y anonos (Annona sp.; Annonceae), mientras que las pupas y adultos tenerales se localizan en el suelo por debajo de los restos xilosos citados, y los adultos maduros consumen el follaje de Guazuma ulmifolia Lam. (Sterculiaceae) y Acacia sp. (Mimosaceae). En algunas localidades pueden ser muy abundantes y son atraídos por las luces entre abril y octubre (Morón et al., loc.cit.). El objetivo del presente trabajo consiste en exponer los detalles del ciclo vital de Pelidnota (P.) virescens en condiciones de cautiverio.
Material y métodos
A principios de julio de 1988 se capturaron cinco parejas de P. virescens en Acamilpa, Morelos, México, las que fueron transportadas al laboratorio del Instituto de Ecología en la Ciudad de México, donde se acondicionaron en un primer terrario de 40 cm de largo, 30 cm de anchura y 20 cm de altura, provisto con trozos de madera en descomposición de Annona sp. (Annonaceae) sobre una capa de 5 cm de espesor de aserrín y humus forestal. El terrario se mantuvo en un cuarto de cría con condiciones controladas, a una temperatura de 29 ºC ± 2 ºC, con 70% ± 10% de humedad relativa. Para observar y analizar el desarrollo larvario se siguió un método similar al utilizado en Morón (1987). Cada huevo fue recuperado del fondo del terrario con una cucharita de plástico para colocarlo en un recipiente de plástico de 5 cm de largo, 4 cm de anchura y 2.5 cm de altura, provisto con 25 g de madera de Annona sp. finamente desmenuzada y asperjada con agua hervida. Todos los recipientes se rotularon con una clave numérica progresiva para poder seguir el desarrollo individual de las larvas. Estos recipientes se conservaron dentro de un contenedor de plástico de 32 cm de largo, 22 cm de anchura y 6 cm de altura, con tapa ventilada por medio de pequeñas perforaciones en las esquinas, dispuesto en las condiciones de temperatura y humedad antes citadas.
Las larvas de primero y segundo estadio se mantuvieron en los mismos recipientes hasta que pasaron por la segunda ecdisis y entonces, respetando las claves individuales, se pasaron a cajas de plástico de 12.5 cm de largo, 10.5 cm de anchura y 5 cm de altura sin tapa, provistas con 150 g de alimento, situadas de cuatro en cuatro dentro de los contenedores con tapas perforadas. En todas las etapas se procedió a revisar las cajas cada semana y a reemplazar por completo el alimento cada mes, pesando las larvas y los excrementos en una ocasión con una balanza electrónica Ohaus 1500 D con sensibilidad de 0.001 g. La cantidad de excrementos se cuantificó directamente al separar con un cernidor los bolos fecales de las otras partículas del substrato producidas durante las actividades larvarias. La fuerza mandibular de las larvas se midió con el dispositivo de Jarman (1980) y Jarman y Reyes-Castillo (1985), obligándolas a morder la palanca del dinamómetro en diez ocasiones para registrar la fuerza máxima.
Para comparar con los resultados del desarrollo individual de las larvas según el método descrito, se preparó un segundo terrario de 32 cm de largo, 22 cm de anchura y 6 cm de altura, provisto con trozos de madera en descomposición de Annona sp. asperjada con agua hervida, en el que se colocaron cinco parejas de adultos obtenidas en la misma localidad el 30 de julio de 1988, a cuya progenie se dejó crecer en grupo. Fueron revisadas en siete ocasiones entre el 15 de agosto de 1988 y el 11 de julio de 1989, para comprobar su estado de desarrollo. Muestras de los ejemplares estudiados se conservan en la colección entomológica del Instituto de Ecología, Xalapa (IEXA), Veracruz, México.
Resultados y discusión
Duración del ciclo vital y crecimiento larvario. Después de una a dos semanas de confinamiento, murieron todos los machos y cuatro hembras, y entre el 8 y el 19 de julio de 1987 se encontraron 54 huevos dispersos entre el aserrín del primer terrario. Los huevos recién puestos son blancos, miden 1.3 mm de largo por 0.9 mm de diámetro, y durante su desarrollo se tornan pardo-amarillentos y casi esféricos. Después de 18-27días de incubación ( = 24 días) emergieron las larvas de primer estadio con un peso de 0.060 g, el que incrementaron a 0.084 g en promedio después de 15 días. Durante el segundo estadio, las larvas alcanzaron un peso de 0.170 a 0.504 g en un período de 29 a 64 días. Después de la ecdisis a tercer estadio las larvas pesaron entre 0.866 y 2.410 g en un lapso de 174 a 265 días. Los pesos máximos que alcanzaron las larvas de tercer estadio corresponden a un incremento de casi 300% sobre el peso inicial del mismo estadio.
= 24 días) emergieron las larvas de primer estadio con un peso de 0.060 g, el que incrementaron a 0.084 g en promedio después de 15 días. Durante el segundo estadio, las larvas alcanzaron un peso de 0.170 a 0.504 g en un período de 29 a 64 días. Después de la ecdisis a tercer estadio las larvas pesaron entre 0.866 y 2.410 g en un lapso de 174 a 265 días. Los pesos máximos que alcanzaron las larvas de tercer estadio corresponden a un incremento de casi 300% sobre el peso inicial del mismo estadio.
La larva de primer estadio tuvo una anchura cefálica de 2.25 mm y una longitud corporal dorsal aproximada de 9 mm. La larva de segundo estadio tuvo una anchura cefálica de 3.80 mm y una longitud corporal dorsal máxima de 16 mm. La larva de tercer estadio tuvo una anchura cefálica de 6.30 mm y una longitud corporal dorsal máxima de 48 mm. Tomando en cuenta el crecimiento de la cápsula cefálica se obtuvo una tasa de crecimiento de 1.68 para pasar del primero al segundo estadio, y una tasa de 1.65 para pasar del segundo al tercero. Con respecto al tamaño y al peso corporal fue más difícil encontrar una tasa por las variaciones que tienen los tejidos suaves y la cantidad de líquidos almacenados, pero podría afirmarse que aproximadamente la larva de primer estadio terminal aumentó 6 veces su peso al llegar al segundo estadio terminal, y que esta larva aumentó 4.9 veces su peso al llegar al máximo desarrollo del tercer estadio. Las larvas de tercer estadio perdieron peso en el período de prepupa, que dura 21-22 días. Las pupas tardan entre 15 y 43 días en dar origen al imago, y pesaron entre 1.244 y 1.386 g, mientras que los adultos recién nacidos tuvieron un peso de 0.850 a 0.900 g, y sobrevivieron 31 días en promedio (Fig. 1).
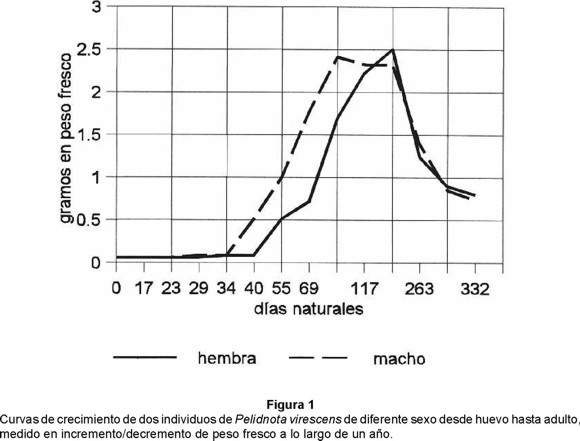
De acuerdo con estos datos, la duración del desarrollo de P. (Pelidnota) virescens desde huevo hasta adulto, en las condiciones de cautiverio empleadas para el primer terrario, fue de un año (Fig. 2). Se observaron pocas diferencias en el desarrollo de machos y hembras (Fig. 1). En el segundo terrario se observó algo muy similar, ya que para el 15 de agosto de 1988 se encontraron 10 huevos, el 5 de septiembre se observaron 10 larvas de segundo estadio, y el 7 de septiembre sobrevivieron 10 larvas de tercer estadio; para el 18 de abril de 1989 se ubicaron 2 larvas de tercer estadio, 2 prepupas, cinco pupas y un adulto teneral, de los cuales se fijaron el adulto y 4 pupas; el 9 de mayo se contaron 3 prepupas, una pupa y un adulto teneral (que fue fijado); el 2 de junio se encontraron una pupa y 3 adultos tenerales, y para el 11 de julio se rescataron 4 adultos muertos.

Mortalidad. Con los datos obtenidos durante el desarrollo de los 54 individuos en el primer terrario, se calculó una tabla de vida (Cuadro 1). La tasa de sobrevivencia para el estadio de huevo fue de 0.88 y la muerte de 6 huevos se debió a desecación (3) y bacteriosis (3). La tasa de sobrevivencia para el primer estadio larvario fue de 1.00, pero en el segundo estadio la tasa descendió a 0.89 por la muerte de 5 individuos afectados por bacterias. Durante el tercer estadio murieron 10 individuos a causa de bacteriosis, por lo que la tasa de sobrevivencia descendió a 0.72. Las pupas de machos perdieron 2 individuos por necrosis y 2 no desprendieron completamente la exuvia larval, y las hembras perdieron 2 individuos, uno con necrosis y otro no desprendió por completo la exuvia larval, lo cual ofrece tasas de 0.75 y 0.81 respectivamente. Los imagos perdieron un individuo de cada sexo por causas desconocidas, que dejaron los ejemplares resecos, y dan lugar a una tasa de sobrevivencia de 0.88 a 0.90. Con los 15 adultos sobrevivientes se formaron siete parejas, que vivieron entre 5 y 35 días sin reproducirse en cautiverio.

En el segundo terrario la tasa de sobrevivencia para los tres estadios larvales fue de 1.00, pero una prepupa murió por causas desconocidas, y durante la pupación la tasa de sobrevivencia descendió a 0.60 por la muerte de 4 pupas que no pudieron desprenderse de la cápsula cefálica de la exuvia larval; y en los imagos se observó una tasa de 0.83, por la muerte de un adulto con deformaciones en las alas y patas.
Consumo de substrato. Las larvas de P. (Pelidnota) virescens tienen unas mandíbulas proporcionalmente grandes y fuertes, lo que puede asociarse con su participación en el tercer estadio de la primera etapa de la microsucesión de los coleópteros xilófilos (según Dajoz, 1967 citado por Morón, 1985). Esta etapa incluye especies saproxilófagas capaces de construir galerías en el xilema de los troncos derribados o muertos en pie. Las pruebas realizadas con el dispositivo de Jarman nos indican que, durante los primeros meses de su tercer estadio, las larvas de esta especie con un peso de 1.580 g ejercieron una fuerza máxima mandibular de 394 g-wt. Estos valores son inferiores a los obtenidos en larvas de los dinastinos Golofa tersander Burm. (876 g-wt), Strategus aloeus (Linné) (516-686 g-wt) y Dynastes hyllus Chevr. (953 g-wt) (Morón, 1987; Jarman, com.pers.), cuyas larvas son notablemente mayores.
Durante el desarrollo de primero a segundo estadio cada larva consumió mensualmente entre 3.58 y 5.08 g de madera en peso seco. Entre el segundo y el tercer estadio cada larva procesó entre 14.47 y 14.70 g de madera. En el tercer estadio cada larva ingirió entre 16.30 y 20.5 g de madera mensualmente. Estas cifras nos dan un consumo mínimo de madera equivalente a 55.53 g para completar el desarrollo hasta el estadio pupal.
Comentarios. Es notable la elevada proporción de pupas que perecieron al quedar atorada su cabeza dentro de la cápsula cefálica larvaria durante la ecdisis pupal. Esto parece deberse a que el punto de unión de la sutura epicraneal y la sutura frontal de la larva de tercer estadio no se abre durante la ecdisis. En principio la pupa no muere por esta situación, pero permanece estrechamente unida a la exuvia larval, y antes de que se inicie la fase final del desarrollo de la pupa, cuando es posible empezar a distinguir los artejos de los apéndices, aparece una necrosis a partir de la cabeza que anuncia la muerte del individuo. Es interesante comentar que durante un gran número de observaciones sobre el desarrollo de los estados inmaduros de Melolonthidae, esta causa de muerte en las pupas se ha observado sobre todo en Rutelinae-Rutelini, especialmente en miembros del género Plusiotis (Morón, obs. pers.).
Para explicar este fenómeno, habría que considerar la secuencia de movimientos que permiten salir a la pupa de la exuvia larval y, como queda dispuesta esta exuvia en relación con la pupa. En algunas especies de esta subfamilia se ha observado que la exuvia queda extendida, envolviendo parcialmente a la pupa (Morón 1993), lo cual sugiere que la cabeza pupal es la última estructura en salir de la exuvia larval. En otros grupos de Melolonthidae, parece ser que la cabeza pupal es una de las primeras estructuras en liberarse de la exuvia larval, ya que la exuvia queda plegada hacia la porción posterior del abdomen pupal (Morón 1993).
En cautiverio este problema podría ser influenciado por una disminución en la humedad del substrato en el tiempo de la pupación, lo que incrementaría la tenacidad de la cutícula cefálica larvaria en un momento crítico para el desarrollo del coleóptero. La experiencia ha demostrado a los autores que durante las últimas semanas del desarrollo de este tipo de larvas es mejor mantener baja la humedad para disminuir los problemas de fungosis y la deformación alar y elitral de los imagos, pero tal vez en este caso dicha práctica favoreció la retención de la cabeza pupal dentro de la cápsula cefálica larval.
En cuanto a la duración del ciclo, es importante anotar que, de acuerdo con Ritcher (1966) Pelidnota punctata y Parastasia brevipes presentan ciclos vitales de dos años en Kentucky, Estados Unidos. Con base en datos de campo y laboratorio, Morón (1985) propuso evidencias de que los ciclos de Plusiotis adelaida Hope y Chrysina macropus Francillón requieren dos años para completarse en las montañas del norte de Hidalgo, México. Mientras que según Morelli (1996) Homonyx chalcea Blanchard se desarrolla en un año en condiciones de laboratorio en Uruguay. Morón y Deloya (1991) observaron que Rutelisca durangoana Ohaus, especie propia de las montañas de Durango, México, puede completar su ciclo en un año en condiciones de laboratorio, aunque algunos ejemplares pueden extender su desarrollo durante dos años si las condiciones ambientales son desfavorables.
Como Pelidnota virescens, las larvas de todas las especies antes mencionadas tienen hábitos saproxilófagos, por lo cual disponen de un recurso alimentario abundante y condiciones de humedad y temperatura más estables durante su desarrollo, que aquellas larvas que habitan en el suelo alimentándose de raíces o materia orgánica; por ende, la disponibilidad de alimento no es un factor limitante primario para su crecimiento. Unas habitan en condiciones más frías o extremosas que otras, debido a factores latitudinales o altitudinales, y sin embargo pueden presentar ciclos de uno o dos años. El tamaño de las larvas y los adultos tampoco parece guardar relación con el tiempo de desarrollo, ya que especies pequeñas (P. brevipes), medianas (P. adelaida) o grandes (Ch. macropus) han mostrado ciclos bianuales. Por ello, podríamos proponer que la diferencia en la duración del ciclo vital puede deberse a una combinación de los factores mencionados que actúan sobre un factor intrínseco de cada especie o género de Rutelini, asociado con su filiación biogeográfica.
Esperamos repetir la cría de Pelidnota (P.) virescens y conocer el desarrollo de otras especies del género y afines, representativas de todos los linajes americanos, para establecer las comparaciones pertinentes y proponer los modelos básicos del ciclo vital en los Rutelini neotropicales, con lo cual sea factible probar nuestra hipótesis.
Agradecimientos
A Roberto Terrón (UAM-X, México, D.F.) por su ayuda durante la recolección de los adultos de Pelidnota virescens empleados para iniciar este trabajo. A Mike G. Jarman (Bristol, Inglaterra) por su ayuda para obtener los registros de fuerza mandibular de las larvas. Este artículo se preparó con el apoyo del Departamento de Entomología, Instituto de Ecología (cuenta 902-02).
Literatura citada
Costa, C., S.A. Vanin & S.A. Casari-Chen. 1988. Larvas de Coleoptera do Brasil. Museu de Zoologia, Universidade de Sao Paulo. 282 pp. [ Links ]
Hardy, A. R. 1975. A revision of the genus Pelidnota of America North of Panama. Univ. Calif. Pub. Entomol. 78: 1-43 [ Links ]
Hayes, W. P. 1925. A comparative study of the life cycle of certain phytophagous scarabaeid beetles. Kansas Agr. Exp. St. Tech. Bull., 16. 146 pp. [ Links ]
Hoffman, C. H. 1936. Additions to our knowledge of the biology of Pelidnota punctata Linn. (Scarabaeidae-Coleoptera). J. Kansas ent. Soc., 9: 103-105 [ Links ]
Jameson, M. L. 1997. Phylogenetic analysis of the subtribe Rutelina and revision of the Rutela generic groups (Coleoptera: Scarabaeidae: Rutelinae: Rutelini). Bull. Univ. Nebraska St. Mus., 14: 1-184 [ Links ]
Jameson, M. L. & M. A. Morón. 2001. Descriptions of the larvae of Chlorota cincticollis Blanchard and Chasmodia collaris (Blanchard) (Scarabaeidae: Rutelinae: Rutelini) with a key to the larvae of the American genera of Rutelini. Coleopt. Bull., 55(3): 380-392 [ Links ]
Jameson, M. L., B. C. Ratcliffe & M. A. Morón. 1994. Synopsis of the Neotropical genus Calomacraspis Bates with a key to larvae of the American genera of Rutelini (Coleoptera: Scarabaeidae: Rutelinae). Ann. entomol. Soc. Amer., 87(1): 43-58 [ Links ]
Jarman, M. G. 1980. Force available at the horns of some scarabaeid beetles. Folia Entomol. Mex., 64: 143-156. [ Links ]
Jarman, M.G. & P. Reyes-Castillo. 1985. Mandibular force of adult and larval Passalidae in family groups. Acta Zool. Mex. (n.s.) 12: 13-22 [ Links ]
Machatschke, J. W. 1972. Scarabaeoidea: Melolonthidae, Rutelinae. In: J.A. Wilcox (Ed.) Coleopterorum Catalogus Supplementa, Pars 66, Fasc. 1 (Ed. Secunda), Dr. W. Junk, N.V. 361 pp. [ Links ]
Monné, M. A. 1969. Descripción del último estadio larval de Macraspis dichroa cribrata Waterh., Blaesia atra Burm., y Marmarina tigrina (Gory y Perch.) (Coleoptera: Scarabaeidae). Revi. bras. Biol., 29: 367-376. [ Links ]
Morelli, E. 1996. Descripción de la larva y de la pupa de Homonyx chalcea Blanchard, 1850 (Coleoptera: Scarabaeidae, Rutelinae). Acta Zool. Mex. (n.s.) 68: 53-60 [ Links ]
Morón, M.A. 1976a. Descripción de las larvas de tres especies mexicanas de pelidnotinos (Coleoptera, Melolonthidae, Rutelinae). Anal. Inst. Biol., Univ. Nal. Aut. Méx., (Zool.) 47(1):7-18. [ Links ]
––––––––––. 1976b. Descripción de las larvas de tres especies mexicanas de melolotinos (Coleoptera: Melolonthidae, Dynastinae y Rutelinae). Anal. Inst. Biol., Univ. Nal. Aut. Méx., (Zool.) 47 (2): 119-134. [ Links ]
–––––––––– . 1983. A revision of the subtribe Heterosternina (Col. Melolonthidae, Rutelinae). Folia Entomol. Mex., 55: 31-101. [ Links ]
–––––––––– . 1985. Observaciones sobre la biología de dos especies de rutelinos saproxilófagos en la Sierra de Hidalgo, México (Coleoptera: Melolonthidae; Rutelinae). Folia Entomol. Mex., 64: 41-53. [ Links ]
––––––––––. 1987. Los estados inmaduros de Dynastes hyllus Chevrolat (Col. Melolonthidae, Dynastinae) con observaciones sobre su biología y el crecimiento alométrico del imago. Folia Entomol. Mex., 72: 33-74. [ Links ]
––––––––––. 1993. Observaciones comparativas sobre la morfología pupal de los Coleoptera Melolonthidae neotropicales. G. Ital. Entomol., 6: 249-255. [ Links ]
Morón, M.A. & C. Deloya. 1991. Los Coleoptera Lamellicornia de la Reserva de la Biósfera La Michilía, Durango, México. Folia Entomol. Mex., 81: 209-283. [ Links ]
Morón, M.A. & G. Nogueira. 2000. Third stage larva and pupa of Paraheterosternus luedeckei (Becker) (Coleoptera: Melolonthidae; Rutelinae). J. Kan. ent. Soc., 73(1): 62-67 [ Links ]
Morón, M.A., B.C. Ratcliffe & C. Deloya. 1997. Atlas de los escarabajos de México. Coleoptera Lamellicornia. Vol. I. Melolonthidae. Sociedad Mexicana de Entomología y CONABIO, México. 280 pp. [ Links ]
Ritcher, P.O. 1966. White grubs and their allies. A study of North American Scarabaeoid Larvae. Oregon State University Press. Corvallis. 219 pp. [ Links ]
Saunders, W. 1874. On some of our common insects. No. 18: The spotted Pelidnota - Pelidnota punctata Linn. Can. Entomol., 6: 141-142 [ Links ]
Saunders, W. 1879. The goldsmith beetle (Cotalpa lanigera). Can. Entomol., 11: 21-22 [ Links ]
Solís, A. & M. A. Morón. 1998. Neotropical genus Platyrutela Bates (Coleoptera: Scarabaeoidea, Melolonthidae, Rutelinae). Ann. entomol. Soc. Amer., 91(3): 269-278 [ Links ]














