Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta zoológica mexicana
On-line version ISSN 2448-8445Print version ISSN 0065-1737
Acta Zool. Mex n.80 Xalapa Aug. 2000
Artículo
Descripción de la larva y la pupa de Paragymnetis chalcipes (Gory & Percheron, 1833) (Coleoptera, Scarabaeidae, Cetoniinae)
Enrique Morelli
Facultad de Ciencias, Sección Entomología Iguá 4225 Montevideo,URUGUAY. E-mail: emorelli@fcien.edu.uy
Recibido: 16 de agosto 1999
Aceptado: 13 de enero 2000
Resumen
Se describe e ilustra la larva de tercer estadio y la pupa de Paragymnetis chalcipes (G.& P., 1833), gimnetino relativamente común en el Uruguay. Se aportan datos sobre el ciclo de vida en el laboratorio y una clave para separar algunas larvas de Gymnetini en el Uruguay.
Palabras clave: Coleoptera, Scarabaeidae, Cetoniinae, Paragymnetis, larva, pupa, taxonomía, biología, morfología, Uruguay.
Abstract
The third-stage larva and pupa of Paragymnetis chalcipes (G.& P., 1833) are described and illustrated. Some biological data and a key to the known third-stage larvae of Gymnetini from Uruguay are also included.
Key words: Coleoptera, Scarabaeidae, Cetoniinae, Paragymnetis, larva, pupa, taxonomy, biology, morphology, Uruguay.
Introducción
La subfamilia Cetoniinae agrupa aproximadamente 3100 especies, la mayor parte de ellas de distribución tropical y subtropical (Krikken, 1984). Más de 200 especies, agrupadas en 33 géneros están descritas para la región Neotropical (Blackwelder, 1944).
Los imagos se alimentan con flores, frutos dulces, polen y néctar de numerosas plantas silvestres y cultivadas. Sus larvas son saprófagas, se desarrollan en el suelo, frecuentemente en acumulaciones de materia orgánica, en detritos de hormigueros de los géneros Atta y Acromyrmex (Ritcher, 1966; Morón et al. 1997).
Monné (1970) citó para el Uruguay, dentro de la tribu Gymnetini las especies, Allorrina cornifrons (Gory & Percheron, 1837); Blaesia atra Burmeister, 1842; Corvicoana reticulata (Kirby, 1818); Gymnetis chalcipes undata (Olivier, 1789) y G. chalcipes litigiosa Gory & Percheron, 1832; Heterocotinis semiopaca (Moser, 1907) y Marmarina tigrina (Gory & Percheron, 1833).
Es común encontrar las larvas de Blaesia atra, Heterocotinis semiopaca y Maculinetis tigrina, desarrollándose dentro de los "basureros" de Acromyrmex spp. (Formicidae).
Monné (1969) publicó la descripción del último estadio larval de dos especies de Gymnetini de nuestro país: Blaesia atra y Marmarina tigrina. En esta oportunidad se describen la larva de tercer estadio y la pupa de Paragymnetis chalcipes, a modo de contribución a los estudios que se vienen realizando en esta tribu (Vanin y Costa, 1984; Morón y Ratcliffe, 1984; Ratcliffe y Deloya, 1992).
Material y métodos
Se colectaron 18 larvas de tercer estadio y cuatro de segundo estadio en detritus vegetal acumulado en tronco vivo de "Timbó" (Enterolobium constorsiliquum), en la ciudad de Sauce, departamento de Canelones, el 3/XII/1997, y 6 larvas de tercer estadio y 2 de segundo estadio en acúmulo de detritus vegetal dentro de un tronco muerto en una localidad próxima a "La Fuente Salus", en el Departamento de Lavalleja, Km. 120, Ruta 8, el 15/XI/97.
Las larvas se acondicionaron individualmente, en recipientes de plástico de 12cm x 10cm x 6cm, con detritus vegetal como alimento. Se mantuvieron durante su desarrollo en una cámara de cría con temperatura y humedad controladas (21ºC y 60%) y a un fotoperiodo de 12 h. Los recipientes se revisaron semanalmente y cuando se formaron las celdas pupales las observaciones fueron diarias.
Para la descripción anatómica se utilizó la terminología propuesta por Böving (1936) y Ritcher (1948, 1966) y el sistema de fórmulas para la quetotaxia torácica y abdominal propuesto por Morón (1987).
Resultados
Descripción de la larva de 3er. estadio (Figs. 1-16, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15)
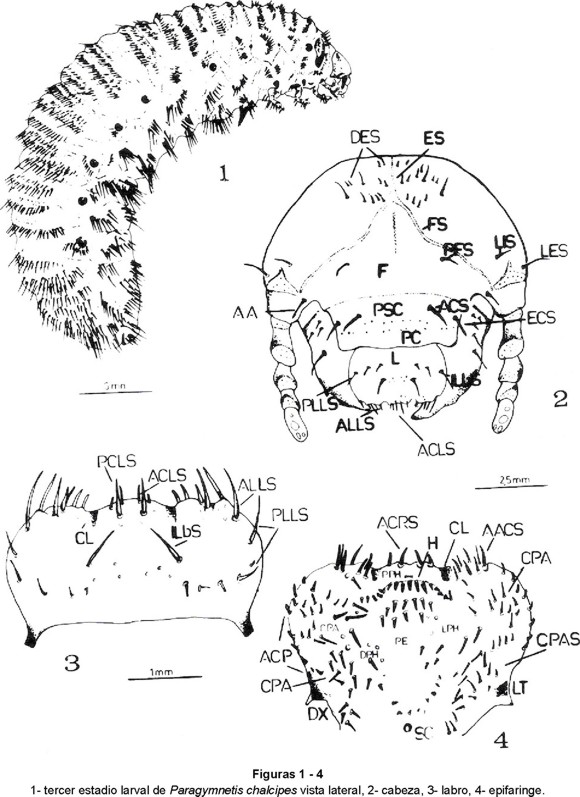


Larva escarabeiforme (Fig. 1), de cuerpo robusto y arqueado. Tegumento muy sedífero de color blanco lechoso, con la cabeza castaño amarillento y extremo de las mandíbulas, negro. Longitud total 39-42 mm.
Cápsula cefálica (Fig. 2) ensanchada, hipognata y bien esclerotizada con un ancho total de 4.5 mm. Epicraneo con sutura epicraneal (ES) corta. Suturas frontales (SF) sinuosas, extendiéndose hasta la base de las antenas. A cada lado de la sutura epicraneal, se visualiza un par de sedas dorso-epicraneales (DES) medianas, insertas dentro de un área de 10-11 sedas más cortas. Frente (F) triangular, de base ensanchada, con dos sedas frontales posteriores (PFS). Sobre la inserción antenal se distinguen de cada lado, una seda lateral interna corta (LIS) y una seda lateral externa (LES) alargada.
Clípeo rectangular, donde pueden distinguirse un postclipeo (PSC) y un preclipeo (PC), separados por una doble hilera de microgránulos. En el postclipeo se insertan un par de sedas anteriores (ACS) y otro de sedas externas (ECS) de forma similar.
Labro (L) trilobulado, ensanchado y de bordes redondeados (Fig. 3). Presencia de microgránulos en la región central y sobre el borde externo. Tres pares de sedas laterales (PLLS), la externa más alargada, y un par de sedas internas (ILbS). Borde externo trilobulado, con pequeñas granulaciones. En el lóbulo central se insertan un par de sedas anteriores (ACLS) y otro posterior (PCLS), mucho más alargado. Bordes laterales con 8-10 sedas (ALLS) y 2 sedas alargadas (PLLS) posteriores.
Epifaringe (Fig. 4) con dexiotorma (DX) triangular y laeotorma (LT) más reducida y subtriangular, ambos bien esclerotizados. Nesium representado por un cono sensorial central (SC). Clithra (Cl) presentes. Región haptomeral (PPH) con una hilera transversal de 19-20 sedas cortas y gruesas, dirigidas hacia la región pedial. Acanthoparia (ACP) con 7-9 sedas cortas y gruesas y un grupo de 9 sedas gruesas y más alargadas en la región anterior (AACS). Chaetoparia (CPA) con 12-14 sedas medianas y delgadas sobre la región externa y 16-20 sedas más gruesas y alargadas hacia la región central. Protophoba (PPH) con Dexiophoba (DPH) y Laeophoba (LPH) con 6-8 sedas cortas y delgadas (CPAS), un tanto dispersas y dirigidas hacia la región pedial. Mesophoba (MPH) con 10-12 sedas espiniformes, de ubicación irregular.
Antenas (Fig. 14) de 4 artejos. El primero subrectangular, macizo; segundo y tercero, subiguales; este último con un nódulo ventral sobresaliente con una papila sensorial en el extremo. Cuarto artejo alargado y romo con 4 papilas sensoriales, de bordes irregulares con una papila muy grande y 2 papilas ventrales subiguales.
Mandíbulas (Figs. 7-12) asimétricas, robustas y cuadrangulares. Mandíbula derecha (Figs. 10-12) con región incisiva macisa, distinguiéndose un dentículo cuneiforme superior. S2 y S3 insinuados por ondulaciones del borde externo. Se destaca la región molar con 2 lóbulos molares M1 y M2 y un lóbulo distal prominente. Dorsalmente se visualiza una hilera de 4 sedas dorso laterales (DLS), la seda superior mucho más alargada. En la base de la región molar se inserta un grupo de sedas cortas (DMS) y próximo al vértice, dos grupos de sedas (DIS), el superior de sedas más alargadas. Región ventral con área estridulatoria (STA) alargada y de bordes sinuosos con carenas transversales. Un grupo de sedas alargadas se insertan próximo a la región molar (VMS).
Mandíbula izquierda (Fig. 7-9) con 3 dentículos incisivos, S1 cuneiforme, S2 y S3, romos. Región molar sobresaliente con 3 lóbulos (M1,M2, M3). Dorsalmente, con un grupo de sedas en la base de la región molar (DMS). 4-6 sedas laterales alargadas (BLS) y 2 sedas incisivas, la superior más grande.
Maxila (Fig. 5,6) con galea y lacinia soldadas (Mala, MA). Región de la galea con uncus (GD) cuneiforme. Unci (LV) de la lacinia formado por dos dentículos. Cardo (CAR) ensanchado con dos grupos de 6 sedas externas (ECARS) e internas (ICARS). Estipe (ST), dorsalmente con 10-12 sedas laterales, finas y alargadas (LSTS) y una hilera de 6 dentículos estridulatorios cónicos (SD), el superior más alejado. Por delante, un grupo de 6-8 sedas alargadas (ASTS). Galea, en región dorsal, con una hilera de 10 sedas internas finas y alargadas (IDGS) y por lo menos 3 gruesas sedas externas (EGS). Ventralmente, menos sedífera con una hilera de 6-10 sedas alargadas y finas (IVLAS). Palpo maxilar (MP) de cuatro artejos. Palpífero (PF) con 3 sedas alargadas (DPFS), segundo artejo con 2 largas sedas ventrales y una hilera de 3 papilas sensoriales (VMPS). Último artejo con una papila sensorial y microsensilas distales y 2 papilas sensoriales ventrales.
Labio-hipofaringe (Fig. 13). Escleroma hipofaríngeo (HSC) y proceso hipofaríngeo (TP) cuneiformes. Lóbulos laterales (LL) sobresalientes con grupos de 10-12 sedas cortas y finas, 6-8 sedas alineadas próximas a la base del escleroma. 8-10 sedas medianas se insertan en la región póstero-lateral de las glosas (PLGlS) y un grupo de 8-10 sedas alargadas y finas en los lóbulos laterales (LLGlS). Lóbulo central de la glosa con dos hileras de gránulos sensoriales y limitando en la región basal, próxima al escleroma, una hilera de 16-20 sensilas cónicas, pequeñas. Palpos labiales de tres artejos, el distal con una papila sensorial apical.
Tórax. Placa esclerotizada de gran tamaño, ocupando casi toda el área propleural. Presenta bordes redondeados y color amarillento, con una depresión central y dos microsensilas próximas a ésta. Dorso del protórax con 3 LF (10-12) intercaladas con microsetas que se continúan hacia la región pleural bordeando la placa esclerotizada, en un apretado grupo de CF, intercaladas con LF. Dorso del mesotórax con 1 LF (20-25); 2 LF (25-30) intercaladas con CF. Las tres hileras espaciadas entre sí. Región pleural con grupos bien limitados de aproximadamente 30 LF. Dorso del metatórax con tres grupos de hileras de sedas espaciadas entre sí: 2 CF (15-17), LF (15-20); 3 CF (20-22 hileras irregulares) LF (16) CF (intercaladas); 3 CF (29-30 hileras irregulares) LF (24) y LF intercaladas). Región pleural con agrupaciones de sedas similares a la de la región mesopleural.
Patas subiguales, pubescentes, con coxa, trocánter, fémur, tibia y tarsúngulo. Pata I (Fig. 15) con coxa alargada y de forma algo irregular, trocánter pequeño y cuadrangular, fémur grueso y alargado con una corona de sedas cortas sobre la inserción fémur-tibial. Tibia de bordes redondeados y tarsúngulo algo alargado, de extremo romo con 6 sedas formando una corona distal de sedas gruesas y alargadas. Todos los artejos de las patas muy pilosos.
Abdomen. Dorsa de los segmentos 1-6 con tres grupos de hileras de sedas similares a las descritas para el metatórax, segmento 7 con tres anillos de sedas y segmento 8 con dos anillos. Región ventral muy sedífera con 5 CF (55-60) en alineación irregular, limitadas hacia la región distal con 1 LF (18-20). Segmentos 9 y 10, soldados. Dorsa de los últimos segmentos prácticamente cubierta por CF intercaladas con LF.
Raster (Fig. 16) con palidia (PLA) formada por dos hileras longitudinales de 13-14 sedas denticulares cortas. A los lados de la palidia, zonas de 26-30 sedas cortas, intercaladas en la región anterior por 4-6 sedas más alargadas y sobre el borde externo del ráster con 17-20 sedas alargadas, intercaladas con sedas más pequeñas y cónicas.
Descripción de la pupa (Figs. 17 y 18).
Pupa adéctica y exarata, de tegumento amarillento, liso. Pronoto trapezoidal, ensanchado. Pterotecas unidas al cuerpo y extendiéndose hasta el 4º segmento abdominal. Segmentos 1-4 con espiráculos con bordes gruesos bien esclerotizados. Espiráculos del 5to. segmento, poco nítidos, espiráculos del 6-8 segmentos, bien notorios. Cuatro pares de "gin-traps" (Hinton, 1946) ubicados en el centro tergal de los segmentos 2/3; 3/4; 4/5; 5/6. Último segmento semicónico con una fina pubescencia.
Datos sobre la biología de la larva.
Las larvas de segundo estadio, colectadas durante el mes de marzo de 1998, alcanzaron el estado pupal a partir de la tercera semana del mes de octubre. La emergencia de imagos tuvo lugar durante los primeros diez días del mes de diciembre del mismo año.
Por otro lado, larvas de tercer estadio colectadas durante el mes de diciembre de 1997, completaron su ciclo biológico durante el mes de marzo de 1998. Estos datos nos indican la posible superposición de generaciones.
De acuerdo con los datos obtenidos en el laboratorio, la duración de los distintos estados preimaginales sería la siguiente: estado larval: 289 días, estado prepupal: 15 días y estado pupal: 51 días.
Discusión
Para nuestro país, sólo se han descrito los estados preimaginales de Blaesia atra Burm. y Marmarina tigrina (G.& P.), no existiendo hasta el presente referencias sobre la duración del ciclo biológico. Las características etológicas de la larva de Paragymnetis chalcipes durante su desarrollo, responden a los patrones habituales del grupo, tanto en su desplazamiento, forma de alimentación y construcción de las celdas pupales (Vanin y Costa, 1984; Arce-Pérez y Morón, 1999). Las larvas de los otros dos Gymnetini presentes, Marmarina tigrina y Blaesia atra siempre han sido colectadas en "basurero de Acromyrmex sp.", diferenciándose de Paragymnetes que se desarrolla bien en restos de materia orgánica vegetal.
De acuerdo con la clave de Morón & Ratcliffe (1984) para larvas de 3er. estadio de los Gymnetini del Nuevo Mundo, Paragymnetis chalcipes se aproxima a la especie Paragymnetis flavomarginata sallei Schaum, con palidia presente, 3-5 dientes estridulatorios maxilares y 10-12 sedas tarsales distales.

Agradecimientos
Al colega, Rodrigo Ponce de León por la colecta de las larvas en la localidad de Sauce, Canelones.

Literatura citada
Arce-Pérez, R. & M.A. Morón. 1999. El ciclo de vida de Paragymnetis flavomarginata Sallei Schaum, 1849 (Coleoptera: Melolonthidae: Cetoniinae), con observaciones sobre su biología. Folia Entomol. Mex. 105: 37-54. [ Links ]
Blackwelder, R. 1944. Checklist of the coleopterous insects of Mexico, Central America the West Indies and South America. Bull. U. S. National Mus. 185 (2): 189-265. [ Links ]
Böving, A. 1936. Description of the larva of Plectris aliena Chapin and explanation of new terms applied to the epipharynx and raster. Proc. Ent. Soc. Wash. 38 (8):169-185. [ Links ]
Hinton, H. 1946. The "gin traps" of some beetle pupae: a protective device which appears to be unknown. Transc. R. Ent. Soc. London 97 (19): 473-496. [ Links ]
Krikken, J. 1984. A nex key to the supragenerix taxa in the beetle family Cetoniidae, with annotated lists of the known genera. Zool. Verhandelingen, Leiden 210: 1-75. [ Links ]
Monné, M., 1969. Descripción del último estadio larval de Macraspis dichroa cribrata Waterh., Blaesia atra Burm. y Marmarina tigrina (Gory & Perch.) Coleoptera Scarabaeidae. Revta. brasil. Biol., 29 (3): 367-376 + 28 figs. [ Links ]
––––––––––.1970. Fauna de los Coleópteros del Uruguay. Tesis Inédita. Facultad de Agronomía, Montevideo, Uruguay. 216 pp. [ Links ]
Morón, M.A. 1987. Los estados inmaduros de Dynastes hyllus Chevrolat (Coleoptera, Melolonthidae, Dynastinae); con observaciones sobre su biología y el crecimiento alométrico del imago. Folia Entomol. Mex. 72: 33-74. [ Links ]
Morón, M.A. & B. Ratcliffe. 1984. Description of the larva and pupa of Argyripa lansbergei (Sallé) with new distributional records for the genus and key to new world Gymnetini larvae (Coleoptera: Scarabaeidae: Cetoniinae). Proc. Entomol. Soc. Wash. 86 (4): 760-768. [ Links ]
Morón, M.A., B. Ratcliffe & C. Deloya. 1997. Atlas de los Escarabajos de México. I. Familia Melolonthidae. Sociedad Mexicana de Entomología, 280 pp. [ Links ]
Ratcliffe, B. & C. Deloya. 1992. The biogeography and phylogeny of Hologymnetis (Coleoptera: Scarabaeidae: Cetoniinae) with a revision of the Genus. The Coleopterist Bulletin 46 (2): 161-202. [ Links ]
Ritcher, P. 1948. Description of the larvae of some ruteline beetles with keys to tribes and species. Ann. Ent. Soc. Amer. 41 (2): 206-212. [ Links ]
––––––––––. 1966. White Grubs and their allies. Oregon State University Press. 219 pp. + 501 figs. [ Links ]
Vanin, S. & C. Costa. 1980. Larvae of Neotropical Coleoptera. III: Scarabaeidae, Rutelinae. Papéis Avulsos Zool., S.Paulo, 33 (17): 275-282. [ Links ]
––––––––––. 1984. Larvae of Neotropical Coleoptera. IX: Scarabaeidae, Cetoniinae, Gymnetini. Rvta. bras. Ent. 28 (3): 329-335. [ Links ]














