Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta zoológica mexicana
versión On-line ISSN 2448-8445versión impresa ISSN 0065-1737
Acta Zool. Mex no.79 Xalapa abr. 2000
Artículo
Diversidad de coleopteros coprofagos (Scarabaeidae: Scarabaeinae) en un mosaico de habitats en la reserva natural Nukak, Guaviare, Colombia
Federico Escobar S.1
Programa de lnventarios de Biodiversidad Instituto de Investigación de Recursos Biológicos Alexander von Humboldt Apartado Aéreo 8693, Santafé de Bogotá, COLOMBIA.
Recibido: 12 de abril 1999
Aceptado: 27 de agosto 1999
Resumen
Este trabajo se desarrolló en la Reserva Natural Nukak, Departamento del Guaviare, Colombia, durante la época de verano en ocho sitios agrupados en tres tipos de bosque: bosque de tierra firme, bosque inundable y sabana natural; los cuales se diferencian por el tipo de suelo, estructura y composición de la vegetación. Las capturas fueron realizadas utilizando trampas de caída con excremento humano, trampas de interceptación de vuelo y captura manual. Se capturó un total de 48 especies de 14 géneros en una muestra de 1556 individuos. Las curvas de acumulación, los modelos asintóticos y las estimaciones de riqueza mediante métodos no paramétricos indican que se capturó más del 90% de las especies del área de estudio. En todos los casos, los modelos se ajustan a los datos observados (r2 > 95%). Tanto la riqueza (Χ2 = 18.74; p = 0.009) como la abundancia (Χ2 = 41 6.08; p = 0.001) dependen del sitio de captura. La mayor riqueza de especies y abundancia se encontró en tierra firme, mientras que los valores más bajos se registraron en sabana. Una gran proporción de las especies son más abundantes en tierra firme, mientras que otras incrementan su abundancia en bosque inundable. El recambio de especies entre los distintos tipos de bosque es bajo y, se encontraron cambios de acuerdo al tamaño y forma de relocalización del excremento entre los tipos de vegetación, con una alta predominancia de pequeños cavadores en bosque de tierra firme y bosque inundable. En la sabana predominan especies de hábitos rodadores.
Palabras clave: Diversidad de escarabajos coprófagos, Scarabaeinae, Heterogeneidad espacial, Amazonia, Colombia.
Abstract
This study was done in Nukak Natural Reserve, at Guaviare department - Colombia, during the summer season. Eight different sites were grouped into three types of forest: non- inund ed terrain forest, annually flooded forest and natural savanna. The forests were classified in accordance with the kind of soil and vegetation structure and composition. The sampling was made with pit fall trap bait human excrement, intersection traps and manual capture. 1556 individuals distributed in 48 species and 14 genera were captured. The accumulation curves, asymptotic models and richness estimations using no parametric methods showed that capture included more that 90% of species at the sampled area. Both, richness (Χ2 = 18.74; p = 0.009) and abundance (Χ2 = 416.08; p = 0.001 ) are dependent on the site where the capture was done. The non-inundated terrain forest showed the biggest richness and abundance, and the lowest was found in the savanna. The species exchange between the different types of forest was low. Changes according to the body size and the relocation habit among different type of forests were found. There was a high small tunnelers predominance in the non-inundated terrain forest and the annually flooded forest. In the savanna the rollers species were predominant.
Key words: Dung beetles, Scarabaeinae, Diversity, Spatial heterogeneity, Amazonian, Colombia.
Introduccion
La amazonía colombiana comprende cerca del 30% del territorio nacional y presenta extensas zonas en donde no se han realizado estudios de flora y fauna (Hernández et al. 1992), como es el caso de la región nororiental, caracterizada por una mezcla de selvas típicamente amazónicas y sabanas naturales, localizadas sobre afloramientos rocosos, formando verdaderos archipiélagos de vegetación (Hernández et al. 1992, Etter 1997).
Para la Amazonía se reconoce el papel que tiene la variación de las característica edáficas como una explicación a la alta diversidad florística (Campbell et al. 1986, Gentry 1988, Tuomisto y Ruokolainen 1994, Tuomisto et al. 1995). En este sentido, el mosaico de suelos y las condiciones microtopográficas particulares puede influenciar la composición y la estructura de las comunidades vegetales y jugar un papel importante en el mantenimiento de la diversidad (Campbell 1986, Tuomisto et al. 1995).
Varios trabajos indican la importancia de las características de la vegetación y en especial del tipo de suelo en la ecología de los escarabajos del estiércol (Halffter y Matthews 1966, Nealis 1977, Doube 1991, Lumaret y Kirk 1991). La gran mayoría de los especies cumplen su ciclo biológico en galerías construidas al interior del suelo (Halffter y Matthews 1966), las cuales utilizan el excremento de un gran variedad de mamíferos de tamaño grande y mediano para su alimentación y como sustrato de oviposición (Hanski y Cambefort 1991a), contribuyendo al funcionamiento de los ecosistemas (Estrada y Coates-Estrada 1991, Mittal 1993).
Este trabajo documenta la fauna de escarabajos del estiércol en tres tipos de bosque: bosque de tierra firme, bosque inundable y sabana natural en la Reserva Natural Nukak en la amazonía colombiana, departamento del Guaviare. Compara la diversidad de escarabajos entre los tipos de bosque, determina el efecto de las condiciones edáficas sobre la comunidad y los resultados son contrastados con otras localidades de la Amazonía.
Área de estudio y descripción de los sitios de muestreo
La Reserva Natural Nukak se encuentra localizada en el municipio de San José del Guaviare (1 °20' - 2°20'N; 70°50'-7°10'O) en el Departamento del Guaviare. Presenta una extensión de 855.000 Ha. (Fig. 1A). Aunque no existen datos climáticos para la Reserva, se estima que la temperatura varía entre 25° y 27°C y la precipitación alcanza los 3500 mm anuales (Etter 1997).
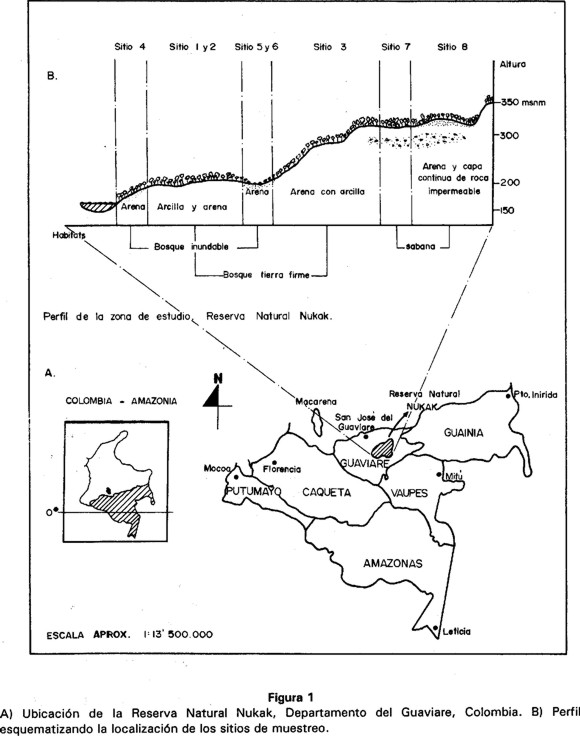
La Reserva pertenece a la provincia biogeográfica de la Guyana y se encuentra ubicada dentro de lo que se conoce como el Distrito Complejo Vaupés (Hernández et al. 1992): En esta unidad, extensas áreas de bosques de tierra firme, bien drenados y de bosque inundable, comúnmente conocidos como varzeas e igapos, se entremezcla con afloramientos rocosos, que en algunos casos pueden alcanzar entre 400 y 500 m de elevación. La vegetación en la parte alta de estos afloramientos es de matorrales con elementos arbóreos poco desarrollados, arbustos y hierbas, semejantes en su aspecto a las sabanas de los Llanos Orientales de Colombia y Venezuela (Etter 1997). Los bosques inundables se localizan sobre la vega de ríos y quebradas, y en algunos casos pueden permanecer inundados durante seis meses. En términos generales, los bosques emergen en zonas donde puede formarse suelo con cierta profundidad, con marcadas diferencias en la estructura y composición de la vegetación, determinadas por la condiciones microtopográficas y edáficas (Hernández et al. 1992).
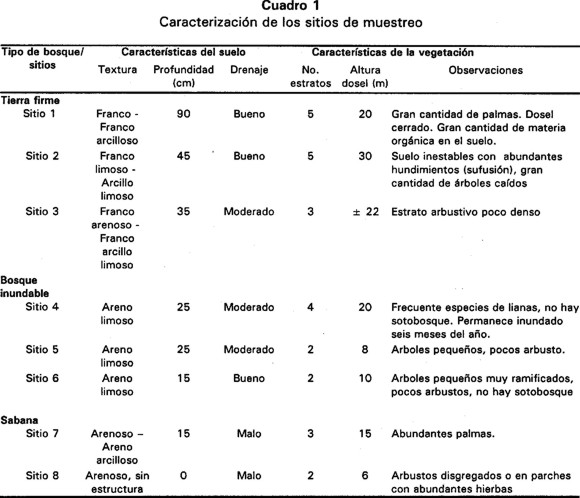
Para el muestreo se escogieron ocho sitios distribuidos en tres tipos de vegetación: tres en bosque de tierra firme, tres en bosque inundable y dos en sabana natural (Fig. 1B). Para la caracterización de cada uno de los sitios se tuvo en cuenta las siguientes variables: textura y profundidad del suelo, drenaje, número de estratos de la vegetación, altura del dosel, así como observaciones sobre la estructura y fisonomía de la vegetación (Cuadro 1).
Material y métodos
Técnicas de captura, diseño del muestreo y análisis de datos.
Para la captura de los escarabajos se utilizaron diferentes técnicas de captura, las cuales incluyen el uso de dos tipos de cebo o atrayente:
- Trampas de caída con atrayente - compuesta por un vaso desechable de 250 ml con alcohol enterrado a ras de suelo, al cual se le acondiciona un alambre en forma de "L" invertida en donde se instala un vaso de 25 ml con excremento humano.
- Trampa de interceptación de vuelo - consiste en una tela de toldillo o mosquitero de 2 m de largo por 1 m de ancho de color negro, templada de tal manera que el borde inferior toque el suelo. En el suelo se realiza un canal de aproximadamente 20 cm de profundidad, al cual se le acondiciona un plástico y se adiciona una mezcla de alcohol, agua y detergente para la captura y preservación de los especímenes. Como atrayente se utilizó pescado en descomposición.
- Captura manual - consiste en la colección de individuos posados en la vegetación, en depósitos de detritos, al interior de troncos caídos y en focos de luz eléctrica.
El muestreo se llevó a cabo entre el 25 de enero y el 15 de febrero de 1996, sobre un área aproximada de 8 Km2. En cada sitio se instalaron cinco trampas de caída separadas 30 m entre sí, formando un transecto de aproximadamente 150 m y una trampa de interceptación de vuelo. Las trampas permanecieron en el campo por un período de 48 horas, al final del cual los especímenes fueron recogidos en bolsas de seguridad (Whirl-Pack) con alcohol al 70% para su posterior determinación. Adicionalmente, se invirtió un total de 4 horas/hombre en la búsqueda manual de especímenes en cada uno de los sitios de muestreo. La búsqueda fue realizada en sitios aledaños a los transectos y en caminos de acceso a los distintos tipos de bosque.
Mediante el análisis de curvas de acumulación se evaluó la eficiencia de los muestreos en cada uno de los tres tipos de bosque y para el área en conjunto. Para esto se utilizaron dos de los modelos asintóticos propuestos por Soberon & Llorente (1993) y estimadores de riqueza no paramétricos basados en la presencia-ausencia (Jack 1 y MMmean) y la abundancia de las especies (ACE y Chao 1) (ver Colwell y Coddington 1994).
1. Modelo de dependencia lineal: predice que el número de especies decrece de forma lineal cuando el esfuerzo de muestreo se incrementa:
S(t)= a/b [1- exp (-bt)]
donde, S(t) es el número de especies estimado siendo t la medida del esfuerzo, a = tasa de incremento al comenzar el muestreo y b = acumulación de especies. Soberon y Llorente (1993) recomiendan este modelo para los casos en que el taxon es bien conocido o el área de estudio es relativamente pequeña.
2. El modelo de Clench: predice que la probabilidad de adicionar una nueva especie a la lista decrece con el número de especies ya registradas, pero se incrementa con el tiempo. Ellos recomiendan este modelo para datos provenientes de largos períodos de muestreo en el campo o sobre áreas extensas:
S(t) = a t/ (1 + bt)
Las curvas de acumulación fueron realizadas teniendo en cuenta todas las técnicas de captura utilizadas. Con el fin de eliminar este efecto, así como el efecto del orden en el cual fueron adicionadas las muestras, éstas fueron aleatorizadas 100 veces usando el programa Estimates (Colwell 1997).
Se utilizó una aprueba de Chi2 para determinar si el número de especies y de individuos capturados eran independientes de los sitios de muestreo (Zar 1996).
Se aplicó el índice de complementareidad (IC) propuesto por Colwell y Coddington (1994), como una medida del recambio de especies entre los tipos de bosque:
IC = Ujk / Sjk
Ujk = Sj + Sk - Vjk
Sjk = Sj + Sk - 2jk
En donde: Sj = número de especies sitio A
Sk = número de especies sitio B
Vjk = número de especies comunes entre A y B;
El valor del índice varía entre 0 y 1;cuando el valor se acerca a 0, indica que la composición de especies entre los dos sitios es similar, mientras que valores cercanos a 1, indica que la composición de especies difiere entre sitios.
Para el análisis de la comunidad, las especies fueron agrupadas en cuatro categorías o gremios de acuerdo a lo propuesto por Cambefort (1991), el cual tiene en cuenta: la forma de relocalización del excremento, (cavadores y rodadores) y el tamaño corporal, grandes (> 10 mm) y pequeños (< 10 mm).
Resultados
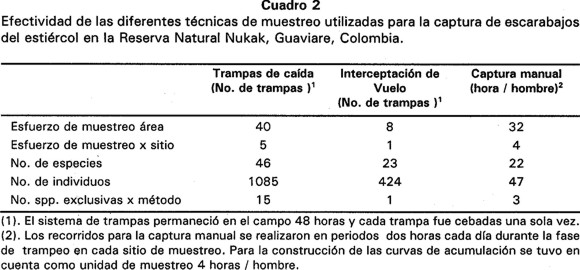
Se capturaron 48 especies de 14 géneros en una muestra de 1556 individuos. El mayor número de capturas se registró en trampas de caída cebadas con excremento humano, representando el 96% de las especie y cerca del 70% de los individuos capturados (Cuadro 2). Tan solo una especie, Scatonomus ca. insignis, fue exclusiva de las trampas de interceptación de vuelo, mientras que tres especies, Uroxys sp.3, Canthidium ruficolle y Canthidium sp.3, fueron registradas únicamente mediante captura manual.
Las curvas de acumulación de especies y de los modelos aplicados en los tres tipos de bosque y para el área de estudio alcanzan una asíntota (Fig. 2). En todos los casos los modelos de acumulación de especies se ajustan a los datos observados (r2 > 95%, Cuadro 3). Sin embargo, el comportamiento de los modelos difiere entre sí, en bosque de tierra firme y bosque inundable, el modelo de dependencia lineal predice un valor cercano a la riqueza observada, contrario al modelo de Clench, en donde los valores son superiores al observado. En sabana, ambos modelos predicen valores mucho más altos de riqueza. Para el área de estudio, el modelo de dependencia lineal indica que se capturó más del 100% de las especies que predice la asíntota, mientras que el modelo de Clench indica que el muestreo registró el 90.6% (Cuadro 3).
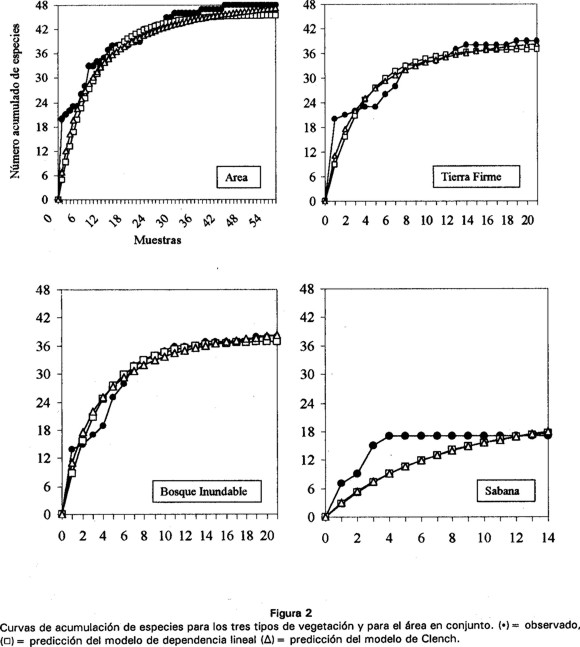
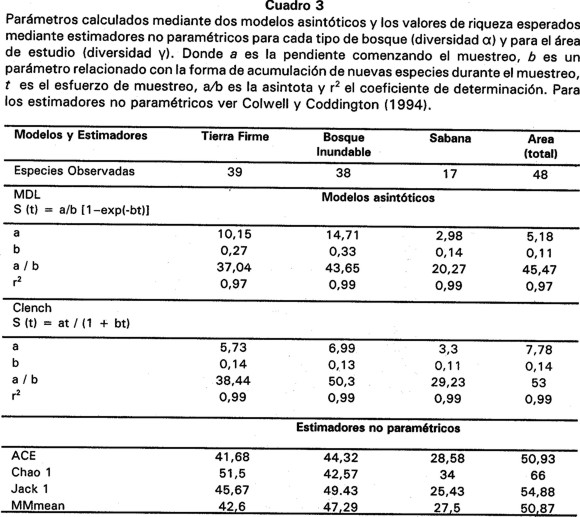
Los valores de riqueza esperados mediante estimadores no paramétricos muestran un patrón similar al descrito para los modelos asintóticos. En todos los casos, para el bosque inundable y la sabana, los estimadores muestran un valor mucho más alto de riqueza con respecto al observado. Tan sólo en bosque de tierra firme y para el área de estudio se obtuvo porcentajes de captura superiores al 90% (Cuadro 3).
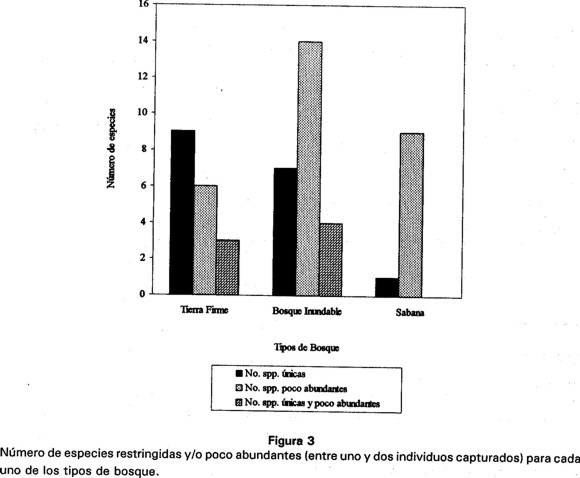
El muestreo revela la existencia de nueve especies capturadas exclusivamente en tierra firme, siete en zonas de inundación y una especie en sabana (Canthon cf. triangularis) (Fig. 3). De estas 17 especies, el 41.1% son poco abundantes, entre uno y dos individuos capturados, de las cuales tres especies se encontraron en bosque de tierra firme y cuatro en bosque indudable (Fig. 3). Del total de especies encontradas en sabana, el 53% son poco abundantes, mientras que en bosque inundable este grupo de especies corresponde al 37% y en bosque de tierra no sobrepasa el 16% (ver Apéndice 1).
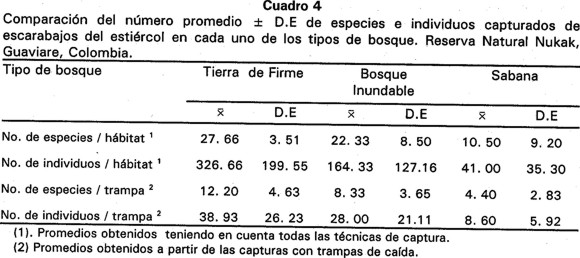
Tanto la riqueza de especies como el número de individuos capturados dependen del sitio de muestreo (Χ2 = 18.74, p = 0.009; Χ2 = 416.08, p = 0.001 respectivamente). La mayor riqueza de especies en promedio se encontró en bosques de tierra firme, mientras que en zonas de sabana se registro el valor más bajo. En cuanto al número de capturas, la tendencia es similar, con un número promedio mayor de individuos en tierra firme con respecto a la sabana (Cuadro 4).
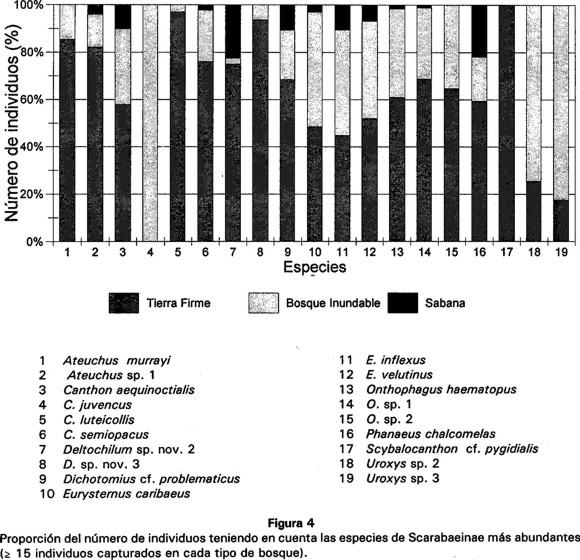
Al comparar el número de capturas para las especies más abundantes, con valores ≥ 15 individuos en cada uno de los tipos de bosque, se observa que la mayoría de las especies son más abundantes en tierra firme. Sin embargo, algunas especies presentan valores de abundancia más altos en bosque inundable como es el caso de Canthon juvencus, Uroxys sp.2 y U. sp.3 (Fig. 4).
Los valores del Indice de Complementareidad o el grado con el cual cada tipo de hábitat aporta a la diversidad total del área (Colwell y Coddington 1994), presenta los valores más altos cuando se compara la sabana con bosque de tierra firme y bosque inundable, indicando la presencia de un número menor de especies compartidas. El valor más bajo del índice se registró entre bosque de tierra firme y bosque inundable (Cuadro 5).

De las 48 especies encontradas, 10 son grandes cavadores y 17 son de hábitos cavadores de tamaño pequeño, mientras que 9 especies son rodadores de tamaño grande y 12 de tamaño pequeño. Al comparar las categorías de hábito (técnica de relocalización) y tamaño corporal en los tres tipos de bosque, se observa que la proporción de especies es similar (Fig. 5A). Sin embargo, cuando se compara el número de individuos capturados en cada categoría, se presenta una mayor abundancia de pequeños cavadores en bosque de tierra firme y bosque inundable, disminuyendo de manera considerable en sabana. En este hábitat los rodadores de tamaño grande y pequeño son más abundantes (Fig. 5B).
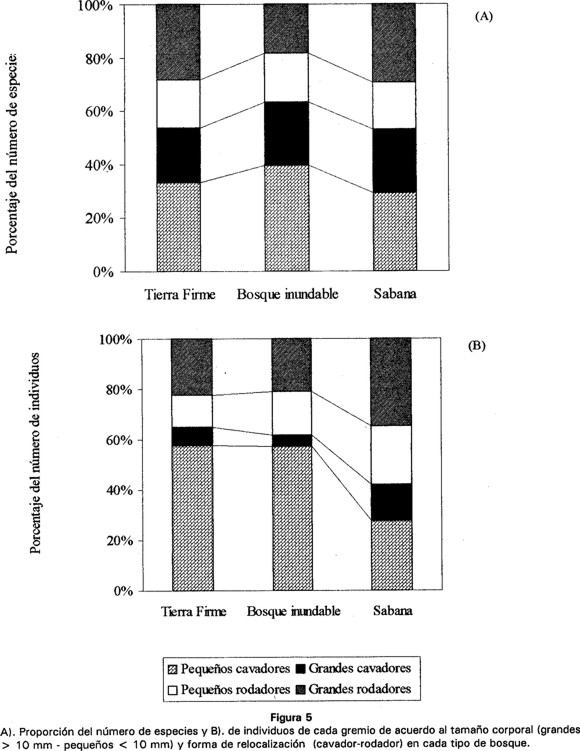
Discusion
De acuerdo con los métodos de estimación utilizados se obtuvo una buena representación de las especies de escarabajos del área de estudio, indicando que más del 90% de éstas fueron registradas en el muestreo, lo cual facilita y hace mucho más rigurosa las comparaciones entre los distintos tipos de bosque estudiados. Para la sabana en particular, los dos modelos y todos los estimadores no paramétricos predicen un mayor número de especies con respecto a lo observado. Este resultado puede estar relacionado con la presencia de una fauna empobrecida, provenientes de áreas de selva, de hábitos héliofilos, con capacidad para penetrar en ambientes semi-abiertos (Martin-Piera y Fernández-Torres 1996); tal como lo sugiere el alto número de especies poco abundantes y que de forma ocasional podrían aprovechar recursos esporádicos presentes en estos ambientes.
La riqueza de especies y el número de capturas difiere entre los tipos de bosque estudiados. Estas diferencias podrían estar relacionadas con la complejidad estructural de los hábitats, las cuales varían de acuerdo con las características del suelo y las condiciones microtopográficas (Tuomisto et al. 1995). Los suelos con texturas Franco-arcillosa o Arcillo-limosa, con bajo contenido de arena, como los que se encuentran por lo general en bosque de tierra firme, presentan una mayor diversidad de escarabajos estercoleros que los suelos con texturas Areno-limosa y arenosos, dominantes en bosque inundable y sabana natural.
De otro lado, en los bosques inundables y la sabana, las condiciones de estres son mucho más acentuadas. El efecto de la lluvia marca un pulso importante en la dinámica de bosques (Remsen y Parker 1983), produciendo la inundación temporal sobre las riveras de los ríos y en las sabanas, debido a la baja capacidad de drenaje de sus suelos (Etter 1997). Similar a lo encontrado en este estudio, Lumaret y Kirk (1991), registran una disminución de escarabajos en este tipo de suelos, aparentemente debido a la alta mortalidad de adultos y larvas a causa de la inundación. Este evento y sus implicaciones en la dinámica de las poblaciones de escarabajos ha sido muy poco estudiado en la Amazonía.
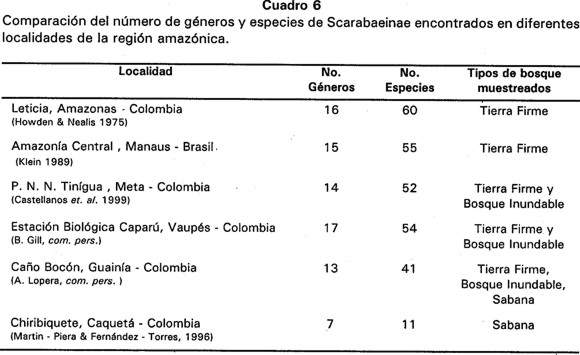
Congruente con lo encontrado en este trabajo, en la Estación Biológica Caparú (Departamento Vaupés) y en Caño Bocón (Departamento del Guainía) en la Amazonía colombiana, se registra una mayor diversidad de Scarabaeinae en bosques de tierra firme, con una notable disminución en zonas de inundación y sabana (Lopera com. pers.). Así mismo, Martín-Piera y Fernández-Torres (1996), encontraron que la fauna de escarabajos del estiércol en las sabanas de la Serranía del Chiribiquete, Amazonas-Colombia, es extremadamente pobre (Cuadro 6). Un patrón similar ha sido encontrado para hormigas en la Amazonía brasileña (Majer & Delabie 1992) y para mamíferos de tamaño pequeño en los Llanos Orientales de Venezuela (August 1983).
La extrema pobreza de mamíferos y en general de vertebrados en las sabanas en comparación con otros tipos de bosque (August 1983), es un factor que contribuye a explicar la disminución de la fauna de Scarabaeinos en este ambiente. La oferta de recursos, en especial la cantidad de alimento y la variedad de tipos de excremento, juega un papel importante en el mantenimiento de las poblaciones de escarabajos del estiércol (Hanski y Cambefort 1991b, Anzures et al. 1998, Castellanos et al. 1999).
Las sabanas incrustadas en la región amazónica se localizan sobre colinas bajas y se caracterizan por la presencia de suelos sin estructura, con un capa de arena que puede alcanzar más de dos metros de profundidad o sobre rocas (Etter 1997, Escobar, obs. pers.), esto podría explicar la reducción de los escarabajos de hábitos cavadores de tamaño pequeño en este hábitat. La habilidad competitiva de los cavadores, al parecer es afectada por su sensibilidad al tipo de suelo, disminuyendo la rapidez con que las especies pueden enterrar el alimento (Hanski y Camberfort 1991b).
De forma adicional, la alta incidencia de luz en zonas abiertas y semi-abiertas, sería un factor importante a tener en cuenta como explicación a los cambios en la proporción de cavadores/rodadores en sabana. La predominancia de especies rodadoras en estos ambientes, podría estar relacionado con el comportamiento de relocalización horizontal, permitiéndoles escapar a la fuerte insolación.
La textura y en especial el contenido de humedad del suelo, además de influenciar la distribución espacial de los coleópteros coprófagos, puede afectar los sucesos de reproducción y la supervivencia de las especies (Fincher 1973, Lumaret y Kirk 1991, Sowig 1996). Al parecer estas restricciones están relacionadas con la capacidad de establecimiento de nidos en galerías al interior del suelo y con los procesos de desecación al interior de los nidos (Fincher 1973, Sowig 1995, 1996), como efectivamente ocurre en sabana en donde la luz incide de forma directa sobre la superficie del suelo.
Los resultados de este trabajo sugieren el uso de los distintos tipos de bosque por parte de los Scarabaeinae, al parecer regulado por los periodos de lluvia en zonas de bosque inundable y sabana y, por la fuerte insolación en áreas abiertas y semi-abiertas. En este sentido, valdría la pena conocer las preferencias de las especies en cuanto a sitios para la nidificación, controlada por la disponibilidad de alimento y tipo de suelo; factores que a su vez, podrían estar actuando de forma sinergética con diferente intensidad a lo largo del año, determinando la estructura de la comunidad en cada tipo de bosque.
Agradecimientos
Deseo agradecer a Humberto Mendoza por su ayuda con la información de suelos y vegetación del área de estudio. Una primera versión del manuscrito recibió comentarios de Germán Andrade, Natalia Arango y Gonzalo Halffter. Los comentarios y sugerencias de dos evaluadores anónimos enriqueció y mejoró de forma sustancial este trabajo.
Literatura citada
Anzures, D.A., A. Estrada & R. Coates-Estrada. 1998. Monos aulladores (Alouatta palliata), escarabajos coprófagos y la fragmentación de las selvas en Los Tuxtlas, Veracruz. México. Neotropical Primates. 6 (4): 111-114. [ Links ]
August, P.V. 1983. The role of habitat complexity and heterogeneity in structuring tropical mammal communities. Ecology. 64 (6): 1495-1507. [ Links ]
Cambefort, Y. 1991. Biogeography and Evolution. Pp. 51 - 67 :In I. Hanski & Y. Cambefort (Eds.). Dung beetles ecology, Princeton University Press, New Jersey. [ Links ]
Campbell, D.G., D.C. Daly, G.T. Prance & U.N. Maciel. 1986. Quantitative ecological inventory of terra firme and varzea tropical forest on the rio Xingu, brazilian amazon. Brittonia. 38 (4): 369-393. [ Links ]
Castellanos, M.C., F. Escobar & P. Stevenson. 1999 Dung beetles (Scarabaeidae: Scarabaeinae) attractted to Woolly Monkey (Lagotrix lagotricha) dung at Tinigua National Park, Colombia. Coleopt. Bull. 53 (2): 155-159. [ Links ]
Colwell, R.K. 1997. Estimates: Statistical estimation of species richness and shared species from samples. Version 5. [ Links ]
Colwell, R.K. & J.A. Coddington. 1994. Estimating terrestrial biodiversity through extrapolation. Phil. Trans. R. Soc. Lond. Ser. B. 345: 101-118. [ Links ]
Doube, B.M. 1991. Dung beetles of southern Africa. Pp. 133 -156. In: I. Hanski & Y. Cambefort (Eds.). Dung beetles ecology. Princeton University Press, New Jersey. [ Links ]
Estrada, A. & R. Coates-Estrada. 1991. Howler monkey (Alouatta palliata), dung beetles (Scarabaeidae) and seed dispersal: Ecological interactions in the tropical rain forest of Los Tuxtlas, Veracruz. México. J. Trop. Ecol. 7 (3): 459-474. [ Links ]
Etter, A. 1997. Sabanas. Pp. 76-95. En: M. E. Chavez y N. Arango (Eds.). Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. Informe Nacional del estado de la Diversidad 1997, Instituto Humboldt, PNUMA, Ministerio del Medio Ambiente. Santafé de Bogotá, Colombia. [ Links ]
Fincher, G.T. 1973. Nidification and reproduction of Phanaeus spp. in three textura1 classes of soil (Coleoptera: Scarabeidae). Colep. Bull. 27: 33-37. [ Links ]
Gentry, A.H. 1998. Changes in plant community diversity and floristic composition on enviromental and geographic gradients. Ann. Mo. Bot. Gard. 75: 1-34 [ Links ]
Halffter, G. & E.G. Matthews. 1966. Natural history of dung beetles of the subfamily Scarabaeinae (Coleoptera: Scarabaeidae). Folia Entomol. Mex. 12-14: 1-132. [ Links ]
Hanski, I & Y. Cambefort. 1991a. Dung beetles population biology. Pp. 36-51. In: I. Hanski & Y. Cambefort (Eds.). Dung beetles ecology. Princeton University Press, New Jersey. [ Links ]
––––––––––. 1991b. Competition in dung beetles. Pp. 305-329. In: I. Hanski & Y. Cambefort (Eds.). Dung beetles ecology. Princeton University Press, New Jersey. [ Links ]
Hernández, C.J., A. Hurtado, R. Ortiz & T. Walschburger. 1992. Unidades biogeográficas. Pp 105-151. En: G. Halffter (Ed.). La diversidad biológica de Iberoamérica I. Acta Zool. Mex., CYTED-D, Instituto de Ecología, México. [ Links ]
Howden, H.F. & V.G. Nealis. 1975. Effects of clearing in a tropical rain forest on the composition of the coprophagous scarab beetle fauna (Coleoptera).Biotropica.7: 77-83. [ Links ]
Klein, B.C. 1989. Effects of forest fragmentation on dung carrion beetle communities in Central amazonia. Ecology. 70: 1725-1725. [ Links ]
Lumaret, J.P. & A.A. Kirki. 1991. South temperate dung beetles. Pp. 97-115. In: I. Hanski & Y. Cambefort. (Eds). Dung beetles ecology. Princeton University Press. Princeton, New Jersey, USA [ Links ]
Majer, J.D. & J. H.C. Delabie. 1994. Comparison of the ant communities of anually inundate and terra firme forest at Trobetas in the brasilian amazon. Ins. Soc. 41: 343-359. [ Links ]
Mital, I.C. 1993. Natural manuring and soil conditioning by dung beetles. Tropical Ecology. 34(2): 150-159. [ Links ]
Nealis, G.V. 1977. Habitat associations and community analysis of South Texas dung beetles (Coleoptera: Scarabaeinae). Can J. Zool. 55: 138-147. [ Links ]
Martin-Piera, F. & A. Fernández-Torres. 1996. Coleópteros de la sierra de Chiribiquete (Dpto. del Caquetá, Colombia). Elytron. 10: 23-50 [ Links ]
Remsen, J.V. & T.A. Parker 1983. Contribution of river-created habitats to bird species richness in Amazonia. Biotropica.15(3): 223-231. [ Links ]
Soberon, J.M. & J. Llorente. 1991. The use of species accumulation functions for the prediction of species richness. Conservation Biology. 7(3): 480-488. [ Links ]
Sowig, P. 1995. Habitat selection and offspring survival rate in three paracoprid dung beetles: the influence of soil type and soil moisture. Ecography 18: 147-154. [ Links ]
––––––––––. 1996. Brood care in the dung beetle Onthophagus vacca (Coleoptera. Scarabaeidae): the effect of soil on time budget, nest structure, and reproductive success. Ecography. 19: 254-258 [ Links ]
Tuomisto, H. & K, Ruokolainen. 1994. Distribution of Pteridophyta and Melastomataceae along on edaphic gradient in a amazonian rain forest. J. Veg. Sci. 5: 25-34. [ Links ]
Tuomisto, H., K. Ruokolainen, R. Kalliola, A. Linna, W. Danjoy & Z. Rodriguez. 1995. Dissecting amazonian biodiversity, Science. 269: 63-66. [ Links ]
Zar, J. 1996. Biostatistical analysis. Third Edition. Prentice Hall, New Jersey. 662 pp. [ Links ]
Nota
1 Para Correspondencia: Instituto de Ecología, A.C. Depto. De Ecología y Comportamiento Animal. Km 2.5 antigua carretera a Coatepec Apdo. Postal 63, CP 91000 Xalapa, Ver. México














