Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta zoológica mexicana
versión On-line ISSN 2448-8445versión impresa ISSN 0065-1737
Acta Zool. Mex no.79 Xalapa abr. 2000
Artículo
Composición de dieta de Cnemidophorus tigirs marimoratus (Sauria: Teiidae) en dunas del centro del Desierto Chihuauhense
Héctor Gadsden y Luis Palacios-Orona
Instituto de Ecología, A.C. Centro Regional Chihuahua Carretera Chihuahua-Ojinaga Km. 33.3, C.P. 32900 Aldama, Chihuahua MEXICO. gadsden@sequia.edu.mx
Recibido: 17 de agosto 1998
Aceptado: 1 de julio 1999
Resumen
Durante 1990 obtuvimos muestras estacionales del Huico Jaspeado, Cnemidophorus tigris marmoratus, (35 machos y 20 hembras en total) en dunas de arena del centro del Desierto Chihuahuense. A cada organismo se le extrajo el estómago y se determinaron sus presas a nivel de Orden o Familia. Se calcularon los índices de diversidad (Shannon-Wiener), de similitud intersexual (verano y otoño) y el de valor de importancia alimentaria. Esta lagartija presentó una dieta básicamente insectívora, predominando adultos de Isoptera durante las tres estaciones analizadas, lo cual se reflejó en una disminución del índice de diversidad alimentaria calculado por el número de organismos presa. Isoptera fue la categoría que obtuvo los valores de importancia más elevados (V.I. = 38.8 % para ambos sexos). Otras categorías importantes fueron larvas de Lepidoptera, ninfas de Dictyoptera, adultos de Coleoptera y Araneae. El promedio de los índices de diversidad alimentaria fue de H' = 1.1 para la abundancia relativa y H'v = 2.7 para el volumen relativo de las presas, lo que nos permite ubicar a este organismo como alimentador generalista. El elevado índice de similitud alimentaria intersexual en verano y otoño (Ojk = 0.961, mostró la alta semejanza de la dieta entre ambos sexos. No se obtuvieron diferencias intersexuales significativas en la longitud de las principales presas consumidas. El coeficiente de variación alimentaria intersexos fue mayor para la longitud de las presas (CV-LP) en el caso de los machos, mientras que el coeficiente de variación para la longitud hocico-cloaca (CV-LHC) fue menor que el de las hembras. Existe dimorfismo sexual significativo en el tamaño y peso corporal, siendo los machos más grandes que las hembras. Este dimorfismo puede deberse a las diferencias en la tasa anual de sobrevivencia detectada en ambos sexos, de manera que las hembras más grandes tiendan a no estar representadas en la población.
Palabras clave: Desierto Chihuahuense, lagartijas, diversidad trófica, sobreposición alimentaria, dimorfismo sexual.
Abstract
In 1990 we studied the seasonal feeding patterns of the Western Marbled Whiptail (Cnemidophorus tigris marmoratus) in sand dunes of central Chihuahuan Desert, México (26° 50' N, 103° 49' W). The stomachs of 35 males and 20 females were examined and the importance value (relative abundance + relative volume + prey constancy), Shannon-Wiener diversity index and intersexual niche overlap (summer and autumn) of prey items were determined. Adult Isoptera were the most important prey during the three seasons studied (I.V. = 38.8 %, both sexes). Other important food items were Lepidoptera (larvae), Dictyoptera (nymphs), Coleoptera (adults) and Araneae. This lizard showed an average H' = 1.1 and H'v = 2.7 and thus is considered to have a generalist diet. The intersexual niche overlap was large in summer and autumn (Ojk = 0.95). There were no differences in prey size between the sexes. The coefficient of variation for prey length (CV-PL) was larger in males, whereas it was smaller for snout-vent length (CV-SVL) in males. Males were significantly larger and heavier than females. The observed differences in body size between sexes might be related to differences in finite rate of annual survival among them.
Key Words: Chihuahuan Desert, lizards, trophic diversity, diet overlap, sexual dimorphism.
Introducción
El alimento es un componente esencial del medio ambiente que influye en la sobrevivencia y reproducción de los organismos. Tanto la cantidad como la calidad del alimento son factores que pueden influir en esos aspectos (Simon, 1975; Martin, 1977; Ballinger, 1977, 1978; Ballinger & Congdon, 1980). En los lacertilios la dieta también puede ser afectada por los cambios estacionales en el medio (Mayhew, 1966; Ballinger, 1977; Whitford & Creusere, 1977; Maury, 1995; Gadsden & Palacios-Orona, 1997).
En un estudio de composición de dieta de C. tigris, Barbault & Maury (1981) sugirieron que esta especie de lagartija es un consumidor generalista, pero con preferencia por termitas. Maya (1989) propuso que esta especie es un carnívoro oportunista. No obstante, Maury (1981) ubicó a C. tigris como un organismo oportunista, lo cual fue resultado del mayor consumo de termitas y de la conducta de forrajeo intensivo de esta lagartija. Huey y Pianka (1981) mostraron que esta lagartija come más termitas por número y volumen que aquellos iguánidos que cazan al acecho, y Pianka (1970) detectó la existencia de una diferenciación alimentaria de esa especie dependiendo de la latitud en donde habita.
Por otro lado, Guerra (1995) encontró dimorfismo sexual significativo en C. tigris. Schoener (1967) sugirió que el dimorfismo sexual puede ser causado por la competencia de recursos alimentarios y la distribución del microhábitat. Sin embargo, Schoener et al. (1982) propusieron que la selección sexual también puede ser la causa probable de la diferencia intersexual en la morfología de las lagartijas.
Observaciones sobre el comportamiento social han llevado a postular que el dimorfismo sexual en el tamaño del cuerpo entre las lagartijas se debe a la selección intrasexual en los apareamientos (Trivers, 1972, 1976).
Los objetivos de este trabajo fueron a) conocer las categorías de presa de mayor valor de importancia en la alimentación de C. tigris marmoratus en la parte sur de su distribución, así como sus fluctuaciones estacionales en un hábitat de dunas de arena, b) calcular los índices de diversidad alimentaria y c) analizar diferencias sexuales en la composición de la dieta y su relación con el dimorfismo sexual.
Material y métodos
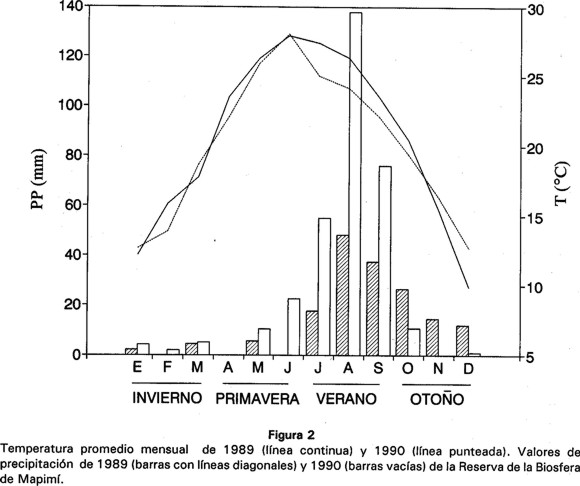
Durante 1990, obtuvimos muestras mensuales de individuos adultos de C. t. marmoratus cazándolas con un rifle de diábolos de 4.5 mm (35 machos y 20 hembras en total). La zona de muestreo se ubica en las dunas de arena del centro del Desierto Chihuahuense (26° 50' N, 103° 49' W) en la Reserva de la Biosfera de Mapimí (Fig. 1), que presenta una altitud entre 1000 y 1350 m (Barbault & Halffter, 1981). Para cada sexo combinamos las muestras mensuales de cada estación del añ0 en la que se encuentra activo este organismo (primavera = abril, mayo y junio; verano = julio, agosto y septiembre; otoño = octubre y noviembre). La zona de estudio presenta una temperatura anual promedio de 20.8°C y una precipitación anual promedio de 230 mm, con una fuerte variabilidad interanual (Cornet, 1988) (Fig. 2). La vegetación dominante en las dunas consiste en Acacia greggii, Yucca elata y Larrea tridentata (Breimer. 1985).
A cada organismo se le extrajo el estómago, obteniéndose posteriormente el volumen total del contenido estomacal al restarle el volumen del estómago vacío, utilizando una probeta de 10 ml (0.1 ml). El contenido estomacal fue separado por categorías de alimento, identificando las presas al nivel de Orden (o Familia en dos casos) con un microscopio estereoscópico (Roth, 1973; Bland & Jaques, 1978). Una vez determinadas las categorías a las que pertenecían las presas, se procedió a contar el número de organismos para cada Orden-presa (o Familia-presa) y se midieron (longitud y ancho del cuerpo) (Paulissen, 1987; Gutiérrez & Sánchez, 1986). Se obtuvo el volumen de las presas suponiendo que éstas tienen una forma esferoidal (Vitt & Morato de Carvalho, 1992) por medio de la fórmula:
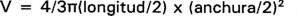
Los ejemplares están depositados en el Instituto de Ecología, A.C., Centro Regional Durango (México).
Con esta información se determinó la abundancia relativa (porcentaje promedio de tipo de presa por estómago), volumen relativo (porcentaje del volumen total de cada tipo de presa) e incidencia de presa (porcentaje de estómagos conteniendo una determinada categoría de presa) (Maury, 1981). Con la suma de los tres parámetros alimentarios mencionados arriba, se obtuvo el valor de importancia (Brower & Zar, 1980; Acosta,1982) por estación para cada Orden (o Familia de presa) y por sexo, utilizando la siguiente fórmula:

Los valores obtenidos del índice V.I. varían entre 100 y 300% y se ajustaron al 100 %.
Para la evaluación de la diversidad de las categorías alimentarias que constituyen la dieta de los organismos, se utilizó el índice de Shannon-Wiener para el número (H') y el volumen (H'v) de organismos (Pianka, 1973; Barbault et al., 1978). Para determinar el grado de semejanza entre la dieta de hembras y machos se utilizó el índice de similitud Ojk (Pianka, 1986) para V.I.
Resultados
Con respecto a la abundancia relativa, la categoría más ampliamente consumida fue Isoptera de primavera a otoño ( = 82%) (Cuadro 1). Sin embargo, cuando se tomaron en cuenta los datos de volumen relativo, se observó que existen otros Ordenes que por ser voluminosos también fueron de consideración (Cuadro 2). Las presas voluminosas que consumieron los machos en primavera fueron araneidos (24%) y material vegetal (37%).
= 82%) (Cuadro 1). Sin embargo, cuando se tomaron en cuenta los datos de volumen relativo, se observó que existen otros Ordenes que por ser voluminosos también fueron de consideración (Cuadro 2). Las presas voluminosas que consumieron los machos en primavera fueron araneidos (24%) y material vegetal (37%).
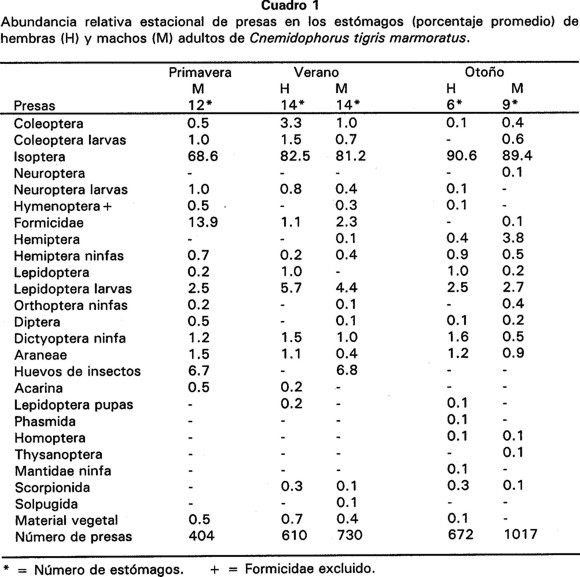
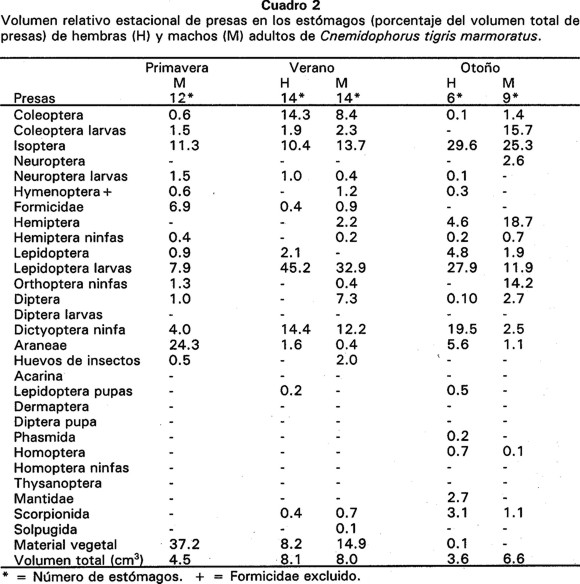
En verano, las larvas de Lepidoptera fueron depredadas tanto por hembras como por machos (45% y 33%, respectivamente) superando en volumen a Isoptera; en esta estación las hembras y los machos también consumieron ninfas de Dictyoptera y material vegetal en proporciones semejantes. En otoño (cuando se registró la mayor cantidad de lluvias) se incrementó el volúmen relativo de algunas presas; en las hembras se incrementaron las larvas de Lepidoptera (28%) y ninfas de Dictyoptera (20%), y en los machos se incrementaron adultos de Hemiptera (19%), larvas de Coleoptera (16%) y ninfas de Orthoptera (14%).
La mayor abundancia de Isoptera se evidenció cuando se analizó el índice de diversidad alimentaria por número de organismos, presentando un valor promedio de H' = 1.19 (Cuadro 3), lo cual indica que esta especie presentó en mayor abundancia ciertas categorías de presa. El mayor índice de diversidad para volumen de organismos se debió a que algunas categorías como larvas y adultos de Coleoptera, ninfas de Dictyoptera, larvas de Lepidoptera y material vegetal, no fueron consumidas en abundancia, pero ocuparon mucho volumen. Tanto larvas de Lepidoptera como ninfas de Dictyoptera, son categorías que fueron depredadas en mayor cantidad principalmente en verano y otoño, que es cuando ocupan una mayor proporción de volumen y fue cuando se presentó la mayor cantidad de precipitación pluvial en la zona de estudio (Fig. 2).

Isoptera fue también la presa más constante. Otras categorías con menor proporción pero también constantes fueron adultos de Coleoptera, larvas de Lepidoptera y Araneae de primavera a otoño (Cuadro 4).
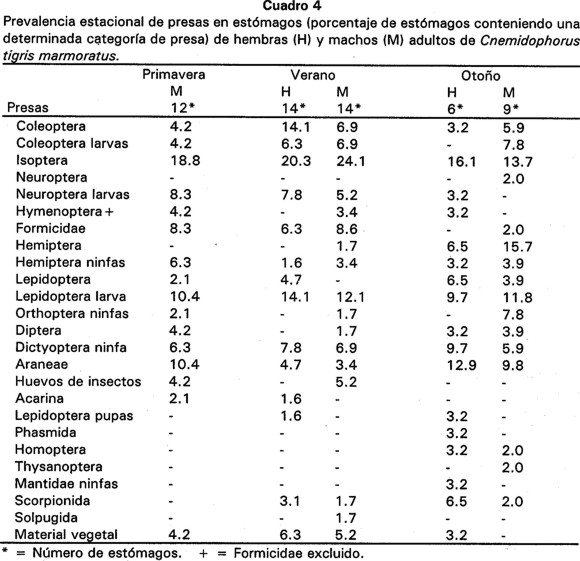
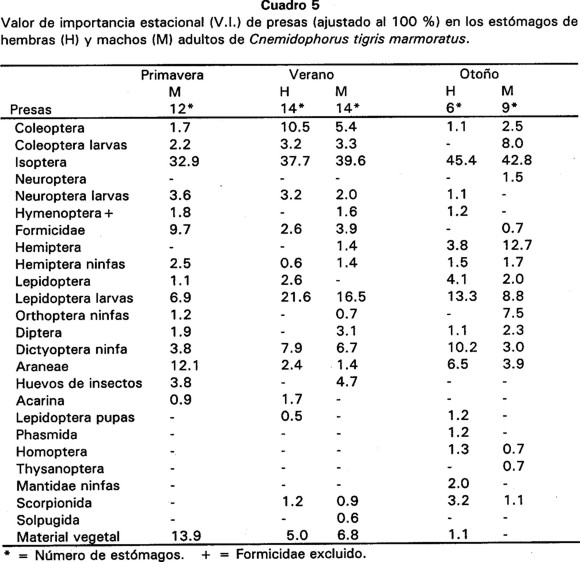
Durante las tres estaciones, la presa más importante fue Isoptera para ambos sexos, debido a que siempre se obtuvieron V.I. elevados para esta categoría de alimento (V.I. = 39%), (Cuadro 5). Otras categorías con un V.I. de consideración para las hembras fueron adultos de Coleoptera, ninfas de Dictyoptera y larvas de Lepidoptera. En el caso de los machos lo fueron el material vegetal, larvas de Lepidoptera, adultos de Hemiptera y larvas de Coleoptera. Asimismo, el V.I. de larvas de Lepidoptera fue poco mayor en hembras que en machos (21.6% y 16.5% en verano, 13.3% y 8.8% en otoño, respectivamente), siendo en verano y otoño cuando este tipo de presa ocupó un mayor volumen (45.2 % en hembras y 32.9% en machos). También durante el otoño los machos presentaron un V.I. de 13% para adultos de Hemiptera, mientras que las hembras tuvieron ese mismo porcentaje para larvas de Lepidoptera (Cuadro 5).

Por otra parte, se encontró dimorfismo sexual en el tamaño de longitud hocico-cloaca (LHC) y en el peso corporal de estas lagartijas. La LHC y el peso de los machos adultos fue significativamente mayor que el de las hembras adultas (t = 3.7 y t = 3.2, respectivamente; g.l. = 102, p < 0.01, en ambos casos). El promedio de LHC y el peso promedio (± DE) de las hembras fue de 76.7 ± 4.2 mm y 11.9 ± 3.1 g, respectivamente (n = 37). Y el de los machos fue de 80.9 ± 6.0 mm y 14.3 ± 3.7 g, respectivamente (n = 37).
La similitud alimentaria intersexual fue elevada para el V.I. en verano y otoño (Ojk = 0.96). No se obtuvieron diferencias intersexuales significativas en la longitud de las principales presas (t = 0.18, g.l. = 218, p = 0.85). El promedio de la longitud (± DE) de presas (n = 112) de los machos fue de 6.5 ± 5.5 mm, y el de la longitud (± DE) de presas (n = 110) de las hembras, fue de 6.4 ± 4.9 mm. En ambos casos, los tipos de presa que se tomaron en consideración fueron adultos de Isoptera, larvas de Lepidoptera, ninfas de Dictyoptera, y adultos de Coleoptera. Sin embargo, el coeficiente de variación intersexual en la longitud de las presas (CV-LP) fue mayor en los machos (72%) que en las hembras (59%), mientras que el coeficiente de variación de la longitud hocico-cloaca (CV-LHC) fue menor en los machos.
Discusión
La diversidad de categorías de presa consumidas indica que C. t. marmoratus consume numerosos artrópodos que encuentra durante sus actividades de forrajeo. Consumió principalmente termitas y este fue el tipo de presa que presentó los valores de importancia más elevados (anual V.I. = 38.8%). Otras categorías de menor importancia fueron larvas de Lepidoptera, ninfas de Dictyoptera, adultos y larvas de Coleoptera y adultos de Hemiptera (ver Cuadro 5). En un hábitat de nopalera, Maury (1981) encontró que C. tigris consumió termitas en un 84% y el resto de otras categorías de presa y la ubicó como un organismo oportunista, sugiriendo que la dieta de esta lagartija fue resultado de la disponibilidad abundante y localizada de termitas y de su modo de forrajeo activo. Calculó un índice de diversidad alimentaria de H' = 1.0, el cual fue muy similar al obtenido en este trabajo durante primavera y verano con un H' = 1.3. En general, nosotros calculamos valores de H' < 1.5 tanto en hembras como en machos, lo cual se debe a que C. t. marmoratus también consumió en gran cantidad adultos de Isoptera. Sin embargo, en primavera obtuvimos un H' = 1.7 en machos, lo que probablemente se debió a que al igual que otros reptiles como Sceloporus virgatus (Rose, 1982), éstos utilizan una área de actividad mayor durante la época de apareamiento en primavera (Gadsden, resultados no publicados) y en ese recorrido podrían tener la oportunidad de encontrar más diversidad de presas, por lo que se incrementaría H'. De acuerdo con Huey y Pianka (1981) la distribución de termitas en el espacio es imprevisible y las lagartijas utilizan ámbitos hogareños grandes, por consiguiente se incrementa la probabilidad de encontrar más termitas y al consumirlas en mayor cantidad entonces disminuye H'. Magnusson et al. (1985) no encontraron diferencias intersexuales significativas en el consumo de artrópodos de Cnemidophorus lemniscatus y la proporción de termitas en la dieta fue proporcional al área que utilizó esta especie. También mencionan que el porcentaje de insectos activos en la dieta de esa lagartija, fue inversamente proporcional a la intensidad del forrajeo. Esto último parece ser convergente con lo encontrado en C. t. marmoratus, debido a que este organismo es un forrajeador muy activo y presentó una mayor abundancia de Isoptera durante todas las estaciones.
Por otra parte, después que C. t. marmoratus terminó su etapa reproductora a fines del verano (Gadsden, resultados no publicados), se observó en otoño un abatimiento significativo del índice de diversidad alimentaria en ambos sexos (H' = 0.70 hembras y H' = 0.79 machos). Un factor que pudo haber influido en este decremento de los indices de H', es el efecto de la mayor precipitación pluvial en el verano, que según Maury (1995) puede incrementar la actividad reproductora de las termitas, aumentando la disponibilidad de las mismas para ser consumidas. Las relaciones entre la precipitación y la fluctuación de los recursos alimentarios han sido demostrados por varios autores (Ballinger, 1977; Whitford & Creusere, 1977; Dunham, 1981; Maury, 1995).
Al observar los resultados de los indices de diversidad alimentaria por volumen de las presas, se puede apreciar que en las tres estaciones tanto las hembras como los machos presentaron valores de H'v > 2. Esto se debió al consumo de presas que ocuparon un volumen considerable, como fueron larvas de Lepidoptera, adultos de Isoptera, adultos y larvas de Coleoptera, ninfas de Dictyoptera, adultos de Hemiptera, y material vegetal. De acuerdo con Barbault y Maury (1981) un bajo H'(< 1.5) y un alto H'v(> 1.5) son características de especies generalistas, aunque con una tendencia a consumir en mayor proporción una cierta categoría de presa, como Isoptera en el caso de C. tigris.
Dixon & Medica (1966) observaron que Cnemidophorus inornatus usualmente utiliza el hocico para voltear pedazos de corteza, hojas muertas y ramas para buscar alimento. Este método de alimentación es el que exhibe C. t. marmaratus y podría explicar el alto porcentaje de larvas en su dieta y cierta preferencia por este tipo de alimento.
Maya (1989) también consideró a C. tigris como carnívoro oportunista al observar que esta especie puede consumir incluso huevos de ave de Oceanodroma melania y O. microsoma, y algunas veces come embriones de las mismas especies.
Barbault y Maury (1981) encontraron que C. tigris consumió Isoptera y que también ésta fue la categoría más importante en proporción volumétrica (46.6%), seguida de Blattidae (19.9%) y Coleoptera (13.7%). Nosotros encontramos en la muestra de primavera que los machos tuvieron dos categorías con mayor proporción volumétrica que Isoptera (11.3%) y estas fueron el material vegetal (37.2%) y Araneae (24.3%). En verano, las larvas de mariposas tuvieron un mayor volumen relativo (hembras 45.2% y machos 32.9%) que Isoptera (hembras 10.4% y machos 13.7%).
La mayor proporción volumétrica de material vegetal consumido en primavera por los machos (durante la época de apareamiento), probablemente se debe a algo similar a lo registrado por Durtsche (1992) en la época reproductora de la lagartija Uma inornata. Los machos de esa especie presentaron menor gasto de energía dedicada al forrajeo y también una mayor proporción de material vegetal consumido en comparación con las hembras. Sin embargo, en nuestro caso la muestra de hembras de C. t. marmoratus en la primavera, solamente fue de 3 ejemplares y no se tomó en consideración en el análisis alimentario. No obstante, ninguna de estas lagartijas presentó material vegetal en sus contenidos estomacales.
Por otra parte, Pianka (1970) encontró diferencias alimentarias entre C. tigris del sur de Idaho con las del sur de Arizona y norte de Sonora, encontrando una tendencia latitudinal en la cual las lagartijas distribuidas en el sur consumen principalmente termitas, mientras que las del norte consumen escarabajos, chapulines y pocas termitas. En nuestro caso y en el de otros trabajos llevados a cabo en el centro del Desierto Chihuahuense (Barbault et al., 1978; Barbault & Maury, 1981; Maury, 1981), Isoptera fue la presa de mayor relevancia para C. t. marmoratus, y por lo tanto también se ajusta a la tendencia latitudinal antes mencionada.
A pesar de que C. t. marmoratus presenta dimorfismo sexual, la similitud de alimento entre ambos sexos fue elevada y no se obtuvieron diferencias significativas en la longitud de las principales presas consumidas. Una explicación sería que el dimorfismo sexual haya sido causado por selección sexual como sugirió Schoener et al. (1982) para Leiocephalus, en donde tampoco se encontraron diferencias intersexuales en el tamaño de sus presas, aunque sí se observaron diferencias entre ambos sexos en el tamaño de cabeza y de cuerpo.
Otra hipótesis para explicar las diferencias observadas en el tamaño y peso del cuerpo entre los sexos de C. t. marmoratus, puede deberse a las diferencias en las tasas de sobrevivencia, de modo que los individuos más grandes de un sexo tiendan a no existir en la población, no porque la selección sexual esté causando las diferencias entre los sexos, pero sí por la alta probabilidad de mortalidad antes de alcanzar un tamaño de cuerpo potencialmente mayor (Dunham, 1978, 1981; Vitt & Cooper, 1985). En otro estudio de C. t. marmoratus en la misma zona de trabajo, detectamos que las hembras adultas tuvieron una tasa anual de sobrevivencia más alta (0.24, N = 17) que los machos adultos (0.13, N = 31) (Gadsden, datos no publicados). Por consiguiente, esta última alternativa podría ser más factible para explicar el dimorfismo sexual encontrado en esta subespecie de lagartija.
Agradecimientos
Damos las gracias a la familia Herrera del Ejido la Flora R. Gil y M.E. Maury por su ayuda en el trabajo de campo. Agradecemos a R. Gil su colaboración en el trabajo de laboratorio. Este proyecto fue apoyado por CONACYT (D112-903514). Asimismo, es una contribución al programa MAB-UNESCO de Reservas de Biosfera.
Literatura citada
Acosta, M. 1982. Indice para el estudio del nicho trófico. Ciencias Biológicas. Academia de Ciencias de Cuba 7: 125-127. [ Links ]
Ballinger, R.E. 1977. Reproductive strategies: food availability as a source of proximal variation in a lizard Ecology 58: 628-635. [ Links ]
––––––––––. 1978. Variation in and evolution of clutch and litter size. In: R.E. Jones (ed.). The Vertebrate Ovary. Plenum Publishing Corporation, USA, pp. 789-825. [ Links ]
Ballinger, R.E. & J.D. Congdon. 1980. Food resource limitation of body growth rates in Sceloporus scalaris (Sauria:Iguanidae). Copeia 1980: 924-923. [ Links ]
Barbault, R. & G. Halffter. 1981. A comparative and dynamic approach to the vertebrate community organization of the desert of Mapimí (México). In: R. Barbault & G. Halffter (eds). Ecology of the Chihuahuan Desert: organization of some vertebrate communities. Publ. Instituto de Ecología, México, pp. 11-18. [ Links ]
Barbault, R. & M.E. Maury. 1981. Ecological organization of a Chihuahuan Desert lizard community. Oecologia 51: 335-342. [ Links ]
Barbault, R., C. Grenot & Z. Uribe. 1978. Le partage des Ressources alimentaires entre les espéces de lézards du desert de Mapimí (Mexique). La Terre et la Vie 32: 135-150. [ Links ]
Bland, R.G. & H. E. Jaques. 1978. How to know the Insects. The Pictures-Key Nature Series. Third ed. Wm. C. Brown Company Publ., Dubuque, lowa. 409 pp. [ Links ]
Breimer, R. 1985. Soil and Landscape Survey of the Mapimí Biosphere Reserve Durango, México. UNESCO (MAB). 45 pp. [ Links ]
Brower, J.E. & J.H. Zar. 1980. Field and Laboratory Methods for General Ecology. Wm. C. Brown Co. Publ., Dubuque, lowa. 180 pp [ Links ]
Cornet, A. 1988. Principales caractèristiques climatiques. In: C. Montafia (ed.). Estudio Integrado de los Recursos Vegetación, Suelo y Agua en la Reserva de la Biosfera de Mapimí. Publ. Instituto de Ecología, México, pp. 45- 76. [ Links ]
Dixon, J.R. & P.A. Medica. 1966. Summer food of four species of lizards from the vicinity of White Sands, New Mexico. Contrib. Sci. 121: 1-6. [ Links ]
Dunham, A.E. 1978. Food availability as a proximate factor influencing individual growth rates in the iguanid lizard Sceloporus merriami. Ecology 59: 770-778. [ Links ]
––––––––––. 1981. Populations in a fluctuating environment: the comparative population ecology of the iguanid lizards Sceloporus merriami and Urosaurus ornatus. Misc. Publ. Mus. Zool. Univ. Michigan 158: 1-62. [ Links ]
Durtsche, R.D. 1992. Feeding time strategies of the fringe- toed lizard, Uma inornata during breeding and non-breeding seasons. Oecologia 89: 85-89. [ Links ]
Gadsden, H.E. & L.E. Palacios-Orona. 1997. Seasonal Dietary Patterns of the Mexican Fringe-toed Lizard (Uma paraphygas). J. Herpetol. 31: 1-9. [ Links ]
Guerra, G.M. 1995. Ambito hogareño de un gremio de lagartijas en las dunas de la Reserva de la Biosfera de Mapimí, Durango. Tesis de Doctorado. Universidad Nacional Autónoma de México, Facultad de Ciencias. 86 pp. [ Links ]
Gutierrez, G.M. y T.R. Sanchez. 1986. Repartición de los recursos alimenticios en la comunidad de lacertilios de Cahuacán, Estado de México. Tesis de Licenciatura. Escuela Nacional Estudios Profesionales-Iztacala, Universidad Nacional Autónoma de México, México. 190 pp. [ Links ]
Huey, R.B. & R.E. Pianka. 1981. Ecological consequences of foraging mode. Ecology 62: 991-999. [ Links ]
Magnusson, W.E., L.J. Paiva, R.M. Rocha, C.R. Franke, L.A. Kasper, & A.P. Lima. 1985. The correlates of foraging mode in a community of Brazilian lizards. J. Herpetol. 41: 324-332. [ Links ]
Martin, R.F. 1977. Variation in reproductive productivity of range margin tree lizards (Urosaurus ornatus). Copeia 1977: 82-95. [ Links ]
Maury, M.E. 1981. Food partition of lizard communities at the Bolsón de Mapimí (México). In: R. Barbault & G. Halffter (eds.). Ecology of the Chihuahuan Desert: organization of some vertebrate communities. Publ. Instituto de Ecología, México, pp. 119-142. [ Links ]
––––––––––. 1995. Diet composition of the greater earless lizard (Cophosaurus texanus) in central Chihuahuan Desert. J. Herpetol. 29: 266-272. [ Links ]
Maya, J.E. 1989. Feeding habits and behavior of the whiptail lizard, Cnemidophorus tigris tigris. J. Herpetol. 23: 311-314. [ Links ]
Mayhew, W.W. 1966. Reproduction in the arenicolous lizard Uma notata. Ecology 21: 9-18. [ Links ]
Paulissen, M.A. 1987. Diet of adult and juvenile six-lined racerunners, Cnemidophorus sexlineatus (Sauria: Teiidae). Southwest. Nat. 32: 395-397. [ Links ]
Pianka, E.R. 1970. Comparative autoecology of the lizard Cnemidophorus tigris in different parts of its geographic range. Ecology 51: 703-720. [ Links ]
––––––––––. 1973. The structure of lizard communities. Ann. Rev. Ecol. Syst. 4: 53-73. [ Links ]
––––––––––. 1986. Ecology and Natural History of Desert Lizards. Princeton Univ. Press, New Jersey. 208 pp. [ Links ]
Rose, B. 1982. Lizard home range: methodology and functions. J. Herpetol. 16: 253-269. [ Links ]
Roth, M. 1973. Sistemática y Biología de los Insectos. Ed. Paraninfo, Madrid, España. 130 pp. [ Links ]
Schoener, T.W. 1967. The ecological significance of sexual dimorphism in size in the lizard Anolis conspersus. Science 155: 474-477. [ Links ]
Schoener, T.W., J.B. Slade & C.H. Stinson. 1982. Diet and sexual dimorphism in the very catholic lizard genus Leiocephalus of the Bahamas. Oecologia 53: 160-169. [ Links ]
Simon, C.A. 1975. The influence of food abundance on territory size in the iguanid lizard Sceloporus jarrovi. Ecology 56: 993-998. [ Links ]
Trivers, R.L. 1972. Parental investment and sexual selection. In: B.G. Campbell (ed.). Sexual selection and the descent of Man. Aldine, Chicago, Illinois. pp. 136-139. [ Links ]
––––––––––. 1976. Sexual selection and resource-accruing abilities in Anolis garmani. Evolution 30: 253-269. [ Links ]
Vitt, L.J. & W.E. Cooper. 1985. The evolution of sexual dimorphism in the skink Eumeces laticeps: an example of sexual selection. Can. J. Zool. 63: 995-1002. [ Links ]
Vitt, L.J. & C. Morato De Carvalho. 1992. Life in the trees: the ecology and life history of Kenotropyx striatus (Teiidae) in the lavrado area of Roraima, Brazil, with comments of the life histories of tropical teiid lizards. Can. J. Zool. 70: 1995-2006. [ Links ]
Whitford, W.G. & F.M. Creusere. 1977. Seasonal and yearly fluctuations in Chihuahuan Desert lizard communities. Herpetologica 33: 54-65. [ Links ]














