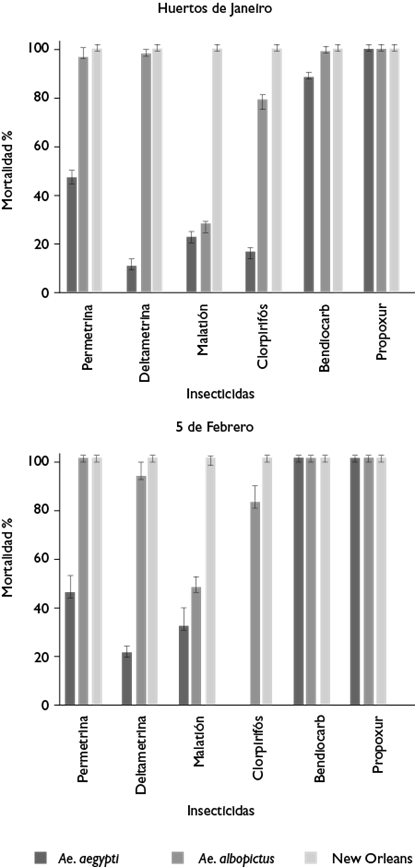Los virus del dengue (DENV), chikungunya (CHIKV), Zika (ZIKV) y fiebre amarilla (FA) son transmitidos principalmente por los mosquitos Aedes aegypti y Ae. albopictus (Skuse).Aedes aegypti (Linneo) (Stegomyia) está ampliamente distribuido en las regiones tropicales y subtropicales de México, mientras que Ae. albopictus es una especie endémica de Asia que ha sido introducida a Estados Unidos y al norte de México desde hace menos de dos décadas1 y que se ha propagado rápidamente hacia Coahuila,2 Nuevo León,3 Chiapas,4 Yucatán5 y Sinaloa.6
Aedes aegypti es el principal vector del dengue en México y recientemente incriminado como vector de los virus CHIKV7 y ZIKV en Chiapas. Por otro lado, aunque Ae. albopictus aún no se ha relacionado con la transmisión de ninguna enfermedad en México, existe reporte de la presencia de DENV en mosquitos hembras silvestres.8
Los insecticidas han sido la principal herramienta para controlar vectores y prevenir las enfermedades que transmiten. Los insecticidas (adulticidas) más usados en México durante 2014 fueron los piretroides (PYR) cipermetrina, deltametrina, ciflutrina y bifentrina (64%), organosforados (OP) temefos, malatión y clorpirifós (18%), y carbamato (CARB) bendiocarb 18%.9,10
El uso constante de estos insecticidas ha provocado la aparición de resistencia en mosquitos para todos los grupos toxicológicos usados en el control vectorial.11 La resistencia en Ae. aegypti en México ha sido principalmente a los PYR12,13,14aunque también se ha reportado a OP en casi todo el continente americano15 y en algunas partes de México.16
Aedes aegypti aún no registra reportes de resistencia a CARB en México. De Ae. albopictus no se conoce su condición de susceptibilidad o resistencia a ningún grupo toxicológico en México.
La resistencia metabólica y la alteración en el sitio blanco de los insecticidas son dos de los mecanismos de resistencia más importantes. La primera se confiere por alteraciones en los niveles o actividades de las enzimas de desintoxicación, predominantemente esterasas, glutatión transferasa (GST) y citocromo P450.17
Aedes aegypti se ha adaptado muy bien a las condiciones urbanas, mientras Ae. albopictus establece sus criaderos principalmente en hábitats rurales.18 Actualmente, ambas especies coexisten en áreas de Tapachula, Chiapas. Se asume que el uso de los grupos toxicológicos disponibles para el control de vectores podría estar induciendo resistencia en Ae. albopictus. Aquí se reporta la resistencia a insecticidas utilizados por los programas de control en salud pública en larvas y adultos de una población de Ae. albopictus, que comparte hábitats urbanos con Ae. aegypti, incluyendo el diagnóstico de los mecanismos de resistencia involucrados en ambas especies.
Material y métodos
Área de estudio
El material biológico se recolectó en dos sitios urbanos de Tapachula, Chiapas (Fraccionamiento Huertos de Janeiro; N14°56´26.63” W 92°15´03.74” y 5 de Febrero; N 14°55´09.120” W 92°15´32.82).
La recolecta de huevos se realizó durante febrero-abril de 2015 siguiendo las recomendaciones señaladas en la Guía Metodológica para la Vigilancia Entomológica con Ovitrampas.19 El papel filtro (12 x 35 cm) de las ovitrampas se reemplazó cada cinco días y los huevos se transportaron dentro de bolsas plásticas al insectario del Centro Regional de Investigación en Salud Pública (CRISP), en Tapachula, Chiapas, México. El número de huevos se contabilizó por sitio de recolecta; una vez eclosionados y obtenidos los adultos se contabilizó el número de mosquitos por especie. Para determinar asociación entre especie de mosquito y sitio de colecta se realizó un análisis de ji cuadrada.20
Cría de mosquitos
La generación F0 correspondió a los adultos provenientes de los huevos recolectados en campo. Las tiras de papel con huevos se colocaron dentro de recipientes con agua para obtener la eclosión de los huevos. Una vez eclosionados, 500 larvas se colocaron en recipientes de 22 x 35 x 5 cm que contenían 1.2 L de agua, equivalente a 1.5 cm de profundidad. Las larvas de primero y segundo estadio se alimentaron durante los primeros tres días con 0.4 gr de una dieta larvaria. Las larvas de tercer y cuarto estadio se alimentaron con 0.8 gr de esta misma dieta hasta el sexto día. La dieta larvaria fue elaborada con una mezcla de proteínas, grasas, fibra y minerales, previamente molida, tamizada y esterilizada (LabDiet 5001). Las pupas se pasaron a charolas de 20 cm de diámetro y se cubrieron con una malla tricot sostenida con ligas para confinar a los adultos después de su emergencia. Los mosquitos adultos se identificaron taxonómicamente según Balta 1997.21 Se colocó cada especie en jaulas de cría (30 cm3) y fueron mantenidos con una solución de azúcar al 10%. Los mosquitos se mantuvieron a 27° ± 2°C, humedad relativa de 60% ± 5% y 12:12 horas luz: oscuridad. Se alimentaron a repleción con sangre de conejo para obtener la primera generación F1. A las 72 hrs post-alimentación se colocaron dentro de las jaulas recipientes de plástico recubiertos con papel filtro húmedo para que los mosquitos ovipositaran. La F1 fue usada para los bioensayos de susceptibilidad y ensayos bioquímicos.
Bioensayos de susceptibilidad con larvas
El bioensayo con larvas se realizó según el procedimiento de la Organización Mundial de la Salud (OMS),22 con un mililitro del larvicida temefos (3 ppm) (T-Mfos 1%, Agromundo) preparado en etanol. Se adicionaron 249 ml de agua destilada contenida en un vaso de plástico desechable #12 para obtener la concentración diagnóstica final de 0.012 ppm. El bioensayo se realizó con un total de 300 larvas de tercer estadio tardío y de cuarto estadio temprano; consistió en doce réplicas de 25 larvas cada una. La mortalidad se registró 24 horas después, considerando como larva muerta aquélla que estaba sumergida y era incapaz de nadar a la superficie.23 Las condiciones ambientales durante estos bioensayos fueron 28°C ± 2°C de temperatura y 65 ± 10% de humedad relativa.
Bioensayo de susceptibilidad con adultos
Los bioensayos con adultos se realizaron aplicando el protocolo de las botellas CDC (Centers for Disease Control and Prevention/Atlanta USA).24 Cada bioensayo se realizó con 240 adultos de tres a cuatro días de edad para cada insecticida. Se realizó un total de 16 réplicas con 15 adultos cada una. Los mosquitos se introdujeron en botellas ya recubiertas internamente con 1 mL de cada uno de los insecticidas con concentraciones diagnósticas recomendadas por el CDC24 (cuadro I).
La concentración diagnóstica para clorpirifós y propoxur se determinó en experimentos preliminares en el laboratorio, usando adultos de Ae. aegypti de la cepa susceptible New Orleans, siguiendo el método del CDC.24 Se consideró una población resistente cuando la mortalidad fue menor a 80%, sospecha de resistencia de entre 81-97% y susceptible de entre 98-100%, según criterios de la OMS.11
Los resultados de los bioensayos se analizaron mediante tablas de contingencia en Excel, para determinar si entre repeticiones existía consistencia en los resultados, así como para determinar si los niveles de resistencia por especie detectados para cada insecticida eran independientes del lugar de colecta de los mosquitos.
Cuadro I: Insecticidas empleados para la determinación de susceptibilidad/resistencia en adultos deAe. aegypti y Ae. albopictus. Tapachula, Chiapas, México, febrero-abril 2015
| Insecticida | Grupo | Nombre comercial | Concentración diagnóstica (µg/botella) | |||||||||
| Permetrina* | Piretroide Tipo I | AquaReslin SUPER, Bayer | 15 | |||||||||
| Deltametrina* | Piretroide Tipo II | K-Othrine, Bayer | 10 | |||||||||
| Malatión* | Organofosforado | Lethal mist, Quimix | 50 | |||||||||
| Clorpirifós‡ | Organofosforado | Mosquitocida UNO/ULV | 60 | |||||||||
| Bendiocarb* | Carbamato | Ficam W, Bayer | 12.5 | |||||||||
| Propoxur‡ | Carbamato | Grado técnico Químix | 10 |
* Concentración diagnóstica registrada por Brogdon y Chan24
‡Determinada a partir de una línea base de concentraciones con la cepa susceptible New Orleans
Ensayos bioquímicos
Se realizaron ensayos bioquímicos para determinar niveles de esterasas, monooxigenas o GST, así como frecuencia de aceticolinesterasa (AChE), siguiendo el protocolo descrito por Penilla y colaboradores.25 La actividad enzimática de los mosquitos de campo se comparó con la cepa susceptible New Orleans mediante un análisis de varianza (ANOVA). El estadístico e histogramas se realizaron usando el software IBM SPSS Statistic 21.0 (2007). Las frecuencias de los genes de resistencia de AChE se calcularon asumiendo un equilibrio con la ecuación de Hardy-Weinberg.
Resultados
De 2 092 huevos obtenidos en las ovitrampas, 25.5% (534) correspondió a Ae. albopictus respecto a Ae. aegypt, pero la presencia de Ae. albopictus fue similar en ambos sitios, 22.3% (Huertos de Janeiro) y 31.5 % (5 de Febrero). Sin embargo, la abundancia de Ae. aegypti fue mayor en Huertos de Janeiro (p=0.0024).
Bioensayo de susceptibilidad con larvas
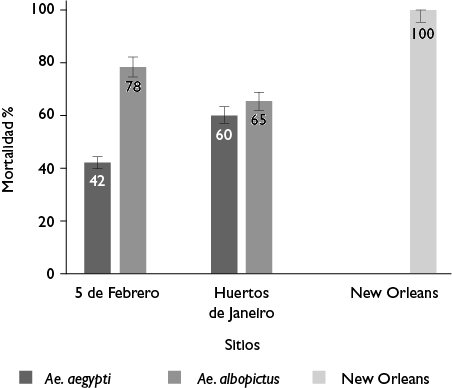
La mortalidad de larvas con temefos en la cepa New Orleans fue de 100% a la concentración diagnóstico. No se encontraron diferencias entre las repeticiones de los bioensayos de ambos sitios en ninguna de las especies. Los datos se agruparon para la comparación mediante ji cuadrada (p>0.1). En ambas especies y en ambos sitios de recolecta, la mortalidad fue significativamente más baja comparada con la cepa susceptible control (p=0.0000). La mortalidad fue diferente entre sitios de recolecta (p=0.0000): más elevada para 5 de Febrero (79%) que para Huertos de Janeiro (61%) con Ae. aegypti, mientras que con Ae. albopictus fue mayor en Huertos de Janeiro (65%) que en 5 de Febrero (43%). Al analizar por sitio de recolecta, 5 de Febrero mostró una mortalidad significativamente menor en Ae. aegypti (20.8%) que en Ae. albopictus (57.2%) (p=0.0000). En Huertos de Janeiro, la mortalidad entre ambas especies no fue diferente (p=0.2059) (figura 1).
Bioensayos de susceptibilidad con adultos
Aedes aegypti registró 0% de mortalidad con clorpirifos en 5 de Febrero (p<0.00001), mientras que en Huertos de Janeiro la mortalidad más baja fue con deltametrina, con 10% (p<0.00001). Con el resto de los insecticidas, a excepción del malatión (p=0.0306), no existió diferencia significativa entre las mortalidades de Ae. aegypti provenientes de ambos sitios (p>0.3). Aedes aegypti registró una mortalidad significativamente menor para propoxur en Huertos de Janeiro en comparación con Ae. albopictus (p>0.00001).
La mortalidad más baja en Ae. albopictus se registró con malatión en 5 de Febrero (27.5%) y Huertos de Janeiro (47.5%). Las mortalidades con permetrina y deltametrina registraron diferencias significativas entre sitios de recolecta (p>0.01). Con el resto de los insecticidas, las mortalidades fluctuaron entre 80 y 100% en ambos sitios. Ambas especies registraron 100% de mortalidad con bendiocarb y propoxur en 5 de Febrero (figura 2).
Ensayos bioquímicos
Aedes aegypti registró niveles enzimáticos más elevados que Ae. albopictus para α esterasas (F=121.1, p<0.0001), β-esterasas (F=84.92, p<0.0001) y monooxigenasas (Citocromo P450) (F=43.83, p<0.0001) en Huertos de Janeiro. Asimismo, los niveles de GST registraron niveles más altos en 5 de Febrero (F=61.4, p<0.0001) como en Huertos de Janeiro (F=190.0, p<0.0001) (figura 3).
Las enzimas de β-esterasas (F=11.31, p<0.000) y monooxigenasas (citocromo p450) (F=53.54, p<0.000) de Ae. albopictus se mostraron diferentes a la actividad en Ae. aegypti de 5 de Febrero. La actividad de para-nitrofenil acetato (ρ-NPA) fue más alta en Ae. albopictus que en Ae. aegypti en ambos sitios, 5 de Febrero (F=60.99, p<0.000) y Huertos de Janeiro (F=9.60, p<0.000).
Las frecuencias de la AChE insensible al propoxur fueron más altas en 5 de Febrero para ambas especies, pero mayor en Ae. albopictus, (Ae. aegypti 0.29, n=72; Ae. albopictus 0.40, n=56), mientras que en Huertos de Janeiro mostraron similar proporción para ambas especies (Ae. aegypti 0.24, n=27; Ae. albopictus 0.22, n=85).
Los histogramas muestran el comportamiento y la distribución de los niveles enzimáticos observados en ambas especies y en ambos sitios urbanos (figura 3).

GST: glutatión transferasa
CiT: citocromo
Fiura 3. Concentración de esterasas con los substratos a y β-naftil acetatos (β-naftil) y ρ-nitro fenilacetato (ρNPA), actividad de GST y contenido de Cit P450en Ae. aegypti y Ae. albopictus, provenientes 5 de Febrero y Huertos de Janeiro, de Tapachula, Chiapas, México, comparadas con la cepa susceptible New Orleans
Discusión
Este estudio registra por primera vez en México estudios de resistencia/susceptibilidad a insecticidas en Ae. albopictus. La resistencia observada a temefos en las especies de Ae. aegypti y Ae. albopictus, con rangos de mortalidad de 35-79%, indica una resistencia importante para ambos vectores. Temefos es un larvicida usado desde hace aproximadamente tres décadas para el control de Ae. aegypti en México y su resistencia ya se ha reportado previamente en Baja California, México.15
Estudios en Asia, Europa y Estados Unidos reportaron resistencia de Ae. aegypti a OP como malatión,26 temefos27,28,29,30,31 y clorpirifós.32 Los resultados de este estudio indican una resistencia menor al clorpirifós en Ae. albopictus que en Ae. aegypti en ambos sitios de recolecta. Consecuentemente, la resistencia exhibida por Ae. albopictus al cloripirifós podría estar condicionada por mecanismos distintos al del malatión, ya que el uso de éste ha sido más prolongado en ambos sitios monitoreados.
Las poblaciones de Ae. aegypti de ambos sitios recolectados fueron resistentes a PYR, sin embargo, sólo existen registros del uso intensivo de permetrina en la década de los noventa.33
Aedes albopictus es una especie de reciente presencia en México4 en comparación con Ae. aegypti. Además de ser una especie más exofílica,34 está favorecida por una mayor variedad de criaderos en zonas silvestres que incluye criaderos alternativos como bromelias y huecos de árboles y de bambú, entre otros.18Aedes albopictus no demostró ser completamente doméstico en comparación con Ae. aegypti, ya que la proporción de mosquitos adultos obtenidos de las ovitrampas fue mucho menor.
Los presentes resultados también mostraron que la población de Ae. aegypti en ambos sitios estudiados fue resistente a PYR. La resistencia de Ae. aegypti a PYR ya ha sido reportada durante la última década en varios estados de México.13,34,35,36,37 Esta resistencia probablemente es resultado del uso intensivo de la d-fenotrina, otro piretroide del tipo I que sustituyó a la permetrina hasta la reciente introducción del clorpirifós y el malatión. Además, espacialmente es evidente la dinámica de la resistencia.
El malatión ha sido poco estudiado en poblaciones de mosquitos de Ae. aegypti en México. Poblaciones de mosquitos Ae. aegypti de Baja California mostraron ser susceptibles al malatión.16 La resistencia encontrada en este estudio puede ser una consecuencia de las acciones de control aplicadas a los casos permanentes de dengue y al reciente brote de CHIKV, ocurridos a principios de 2014 en Tapachula, Chiapas.7
Ambas especies de mosquitos provenientes de los dos sitios estudiados exhibieron alta susceptibilidad a los CARB (bendiocarb y propoxur), con la excepción de Ae. aegypti de Huertos de Janeiro donde se encontró casi 80% de mortalidad al bendiocarb, aun cuando este insecticida ha sido usado recientemente en la ciudad sólo para rociados intradomiciliares.
En México se han reportado para Ae. aegypti mecanismos metabólicos de resistencia a insecticidas.13,35,37,38 No obstante, la resistencia a PYR en Ae. aegypti ha sido mayormente correlacionada con mutaciones en el sitio blanco, aunque las GSTs pudieran también estar involucradas en la detoxificación de los productos del metabolismo de los PYR.39 En ambas especies se encontraron niveles altos de esterasas determinadas con los tres sustratos, lo cual podría explicar la resistencia observada a OP. Por otra parte, las monooxigenasas podrían estar involucradas en la incipiente resistencia metabólica a PYR en Ae. albopictus.
Se ha reportado la presencia de AChE insensible en Ae. albopictus en poblaciones de Malasia29 y Singapur39 y se sugiere que está asociada con la resistencia a OP y CARB. El presente estudio reporta individuos con AChE insensible en ambos sitios, sin embargo, no se observó resistencia en Ae. albopictus a los CARB. Esto puede ser explicado, según Perera,40 a partir de que los resultados de los ensayos bioquímicos no coinciden con los de susceptibilidad, ya que la dosis estándar del propoxur fue establecida con otras especies de mosquitos y podría no ser lo suficientemente fuerte para inhibir las enzimas de estas poblaciones de Ae. albopictus.
En conclusión, según los criterios de la OMS, Aedes aegypti mostró resistencia a los PYR y OP en ambos sitios, con excepción del propoxur, y posible resistencia al bendiocarb en mosquitos de Huertos de Janeiro. Aedes albopictus registró resistencia a malatión y una incipiente resistencia hacia permetrina, deltametrina y cloripirifos. Estos resultados sugieren la necesidad de hacer cambios en los programas de control con el objetivo de implementar estrategias de control que retarden la resistencia en esta especie o bien para disminuir la presión de selección en las poblaciones donde se detectó resistencia. Una supresión de insecticidas podría conllevar a la reversión de la susceptibilidad en las poblaciones de insectos,41,42 sin embargo, las medidas de manejo de resistencia a insecticidas tendrán que ser dirigidas hacia la especie de mayor importancia epidemiológica.











 text new page (beta)
text new page (beta)