Introducción
La mortalidad del cáncer de cuello uterino (CC) está disminuyendo en Chile: entre 1997 y 2008 la tasa anual de incidencia de CC descendió 6.2% y la de mortalidad 4.4%.1 Sin embargo, en el país todavía mueren más de 500 mujeres cada año y la brecha de mortalidad según nivel socioeconómico es aún muy marcada. Lo anterior se evidencia en la extrema desigualdad según escolaridad (mortalidad cuatro veces mayor en mujeres con menos de cuatro años de educación que en aquéllas con más de 12 años en 2009) (figura 1).2

Elaborado con base en los datos del Departamento de Estadísticas de Salud, del Ministerio de Salud de Chile, 2011. Ed= Educación; Ed básica o menos = < de ocho años de escolaridad; Ed media = de 8 a 12 años de escolaridad; Ed mayor a media: > de 12 años de escolaridad.
Figura 1 Mortalidad por cáncer cervicouterino según nivel de educación. Tasas por 100 000 mujeres, ajustada por edad. Chile, 1999-2008
En 2013 se incorporó a nivel nacional la vacuna contra el virus del papiloma humano (VPH) gratuita para las niñas chilenas entre 9 y 10 años, ampliándose en 2015 hasta los 13 años. Sin embargo, niñas y mujeres mayores de 13 años del seguro público de salud no tuvieron este beneficio, y su riesgo de padecer CC dependerá, en gran medida, de la efectividad del programa de prevención del cáncer cervicouterino. Nuestro objetivo es discutir la epidemiología del VPH en Chile y los esfuerzos del Estado por controlar el CC.
Programa Nacional de Pesquisa y Control del Cáncer Cervicouterino de Chile 1966-2017
El Programa se fundó en 1966 como resultado de un acuerdo entre el Ministerio de Salud (Minsal) y la Universidad de Chile (UCh); consistía en un examen de Papanicolaou anual y servicios ginecoobstétricos ofrecidos a las consultantes, la mayoría en edad reproductiva. Los casos de Papanicolaou anormal (ASCUS [Atypical Squamous Cells of Undetermined Significance] o peores) se referían a manejo en el Sistema Nacional de Salud. Este primer Programa no superó 40% de cobertura y no tuvo impacto en la mortalidad.3 En 1987 se rediseñó en función de la rentabilidad y la evidencia disponible. El Programa se focalizó en mujeres de 25 a 64 años, a las que se les realizó un Papanicolaou cada tres años, con meta de cobertura poblacional de 80% y estableció criterios de calidad para la citología.3 Se dispusieron recursos técnicos y económicos para implementar un programa en red desde el nivel primario hasta el terciario, cubriendo todo el país. Dicho programa incluyó capacitación y evaluación en todos los niveles de la red.3 En 2003, una ley fijó plazos máximos para la confirmación diagnóstica, tratamiento y seguimiento del CC, con gratuidad para mujeres de menores ingresos, copagos de 10 a 20% para el resto del sistema público; en el sistema privado, 13% de las mujeres del país, el copago es variable.
Aunque el Programa nunca logró la cobertura de 80% (67% máximo), se asoció con una baja de la mortalidad por CC en Chile, que fue considerada como una demostración del éxito del Programa. A 30 años de su rediseño y a pesar de los grandes recursos de los servicios de salud y municipalidades, en 2011 la cobertura llegó a 59% a nivel nacional, variando entre regiones (figura 2).4 Asimismo, existen amplias brechas de cobertura de Pap entre el sistema público y el sistema privado de salud. Según la encuesta socioeconómica de 2015, la cobertura de Pap vigente entre mujeres de 30 a 54 años de edad fue de 80% en el sistema privado contra 60% en el sistema público.5 La desigualdad de cobertura y la brecha de mortalidad en perjuicio de las mujeres del sector público es un indicador de la necesidad de revisar la estrategia vigente. Centraremos la discusión en la incorporación del examen de VPH al Programa, que es la innovación que se podría implementar a corto plazo en Chile.
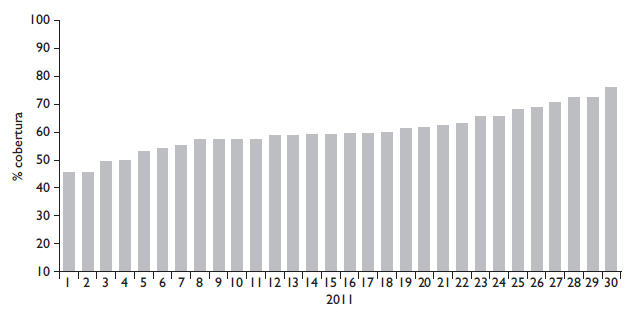
Fuente: Ministerio de Salud de Chile4
Figura 2 Porcentaje de cobertura de mujeres entre 25 y 64 años, beneficiarias del sector público, con Pap vigente, por servicio de salud. Chile, 2011
Virus del Papiloma Humano (VPH) en mujeres de la población general de Santiago de Chile
En el año 2001 se realizó el primer estudio de prevalencia de VPH y sus factores de riesgo en mujeres chilenas. El estudio, cofinanciado por la OPS y la IARC, incluyó una muestra poblacional aleatoria de 1 038 mujeres de 15 a 69 años, residentes de La Pintana. Las muestras cervicales se obtuvieron en el centro de salud y fueron tomadas por una enfermera-matrona para realizar las pruebas de Papanicolaou y VPH. El examen de VPH GP5+/6+ PCR para 44 genotipos de VPH se realizó en Holanda y la citología, Papanicolaou convencional, en Chile.6 Se encontraron 34 genotipos de VPH, 13 (prevalencia 9.1%) genotipos de alto riesgo (AR) y 21 (prevalencia 3.7%) de bajo riesgo (BR). Los VPH AR más frecuentes en orden decreciente son 16, 56, 58, 31, 59, 52, 39. Estos siete tipos representaron 77.4% de las infecciones de AR. Por edad, el VPH AR se presentó principalmente en menores de 20 años, disminuyendo rápidamente hasta los 50, donde presentó un leve aumento (curva en J invertida). En cambio, el VPH BR presentó una curva claramente bimodal: alta en menores de 30 años y aún más elevada en mayores de 60 años.6 Solamente 3.6% de las mujeres tuvo un Pap alterado (ASCUS o peor); el Pap alterado fue significativamente más frecuente entre las mujeres con VPH AR (18.4%) que en las VPH negativas (1.8%). El principal factor de riesgo, tanto para VPH como para alteraciones citológicas, fue el número de parejas sexuales en la vida. Este estudio demostró que a pesar del histórico aislamiento geográfico de Chile, la epidemiología de la infección y de las lesiones preneoplásicas coincidían con lo descrito en otros países de Latinoamérica.7,8,9
Distribución geográfica del VPH en Chile
En 2003 se realizó la primera Encuesta Nacional de Salud de Chile (ENS2003) en una muestra representativa de la población de todas las regiones y estratos socioeconómicos. A 1 506 mujeres (mayores de 16 años) participantes se les ofreció una autotoma vaginal para estudiar el VPH; 83.1% aceptó, con una muestra analizable de 1 110 mujeres. En la Universidad de John Hopkins se analizó el examen de VPH, PGMY PCR line blot assay para 37 genotipos.10 La prevalencia de VPH AR fue de 15% y en VPH BR de 14%. Los VPH AR predominantes en orden decreciente fueron 16, 52, 51, 56 y 58; cuatro coincidieron con los más frecuentes en cérvix en 2001 (16, 52, 56 y 58). La prevalencia bruta de VPH 16 y 18 en autotoma (2.6 y 0.5%) fue igual a la encontrada en muestras cervicales en 2001. Se encontraron diferencias importantes en la distribución relativa de genotipos AR y BR a lo largo del país, siendo el VPH AR significativamente más prevalente en mujeres de los extremos norte (22.7%) y sur (24.7%) de Chile, que en las del centro y centro-sur del país (13.9 y 14.5%). Por el contrario, las prevalencias más altas sólo de infección por VPH BR fueron en residentes del centro y centro-sur, con una correlación inversa entre las prevalencias de VPH de AR y BR en el territorio (Pearson-0.62 p= 0.023).10 La distribución por edad de los VPH AR y VPH BR fue similar a lo encontrado en el estudio de 2001 en Santiago, en el que predominaron los VPH AR en las jóvenes y los VPH BR en las mayores. Este estudio demostró que la epidemiología de la infección por VPH no es homogénea al interior del país y que los VPH AR son más prevalentes en las zonas extremas, que son fronterizas. También demostró, hace 15 años, que la autotoma era bien aceptada por la población, pudiendo ser una estrategia práctica para vigilar la infección por VPH en la población femenina.10
Evolución de la infección cervical y serológica a los cinco años de seguimiento
La cohorte de mujeres estudiada en Santiago en 2001 fue reexaminada en 2006 con la misma metodología que en aquel año.11 En el estudio basal, siguiendo la normativa de salud vigente, sólo se envió a evaluación por especialista a las mujeres con Pap alterado. En 600 mujeres se obtuvo muestra cervical y serológica en ambas ocasiones. La persistencia de infección cervical por el mismo genotipo de VPH fue de 0% en las mujeres menores de 30 años, y sube linealmente con la edad para llegar a 100% en las mayores de 70 años. El principal factor de riesgo para persistir con una infección por algún VPH AR, además de la edad, fue tener un Papanicolaou anormal al inicio del estudio (OR 10.73 IC95% 2.8-42.0).12 Los análisis serológicos para la detección de anticuerpos contra la proteína L1 de los VPH AR 16, 18, 31, 33, 35, 45, 52 y 58 se realizaron en la Universidad de Heidelberg mediante serología multiplex. La seropositividad para los ocho tipos de VPH AR estudiados subió de 43.2 a 50.2% entre 2001 y 2006. La seropositividad aumentó significativamente con la edad, particularmente en los anticuerpos contra VPH 16 y 18, que llegaron al máximo después de los 60 años. La mayoría de las mujeres seropositivas (82%) en 2001 se mantuvieron positivas en 2006; en tanto, 21.6% de las que eran inicialmente seronegativas se convirtieron en el intervalo de cinco años. Los principales factores de riesgo para la seropositividad fueron la edad temprana de la primera relación sexual y haber tenido dos o más compañeros sexuales en la vida. Tener un Papanicolaou alterado (ASCUS o peor) se asoció con la presencia del ADN viral, pero no con los anticuerpos contra VPH.11 El estudio demostró alta seropositividad (41%) en mujeres de 15 a 19 años, lo que avala la recomendación de vacunar antes de los 15 años; además se constituye en una línea de base prevacunación de la serología poblacional contra VPH en Chile.
Prevalencia de VPH en cáncer de cuello de útero en Chile
Entre 2002 y 2005 se analizaron 293 muestras de CC provenientes de hospitales de Santiago y Temuco, en las que se identificó VPH mediante el reverse-line blotting assay.13 Se encontró que VPH AR 16, 18, 31 y 45, solos o en infecciones múltiples, estaban presentes en 89.8% de las biopsias; 85.0% de ellas presentaba ya sea VPH 16 (82.6%) o 18 (16.0%). Entre las infecciones por un solo genotipo, el más frecuente fue el VPH 16 (50.5%), seguido por VPH 18 (7.8%).13 Este estudio demostró que en Chile los genotipos que se encuentran con mayor frecuencia en cáncer son los mismos descritos en todo el mundo y están incorporados en todos los kits diagnósticos de VPH, así como en todas las vacunas contra VPH disponibles.
Comparación de la sensibilidad y especificidad del examen de VPH versus Papanicolaou para el tamizaje de lesiones cervicouterinas en Chile
Entre 2009 y 2013 se condujo un ensayo poblacional de detección de lesiones precancerosas comparando el examen de VPH contra el Papanicolaou en mujeres de 25 a 64 años que acudían a tamizaje en cuatro centros de atención primaria en Santiago; se excluyó a embarazadas, histerectomizadas o sin inicio de relaciones sexuales.2 Se ingresaron 8 265 mujeres (98.8% de las elegibles); cada una recibió simultáneamente una inspección visual del cuello del útero, un Papanicolaou y un examen de VPH AR basado en captura de híbridos 2 (CH2). Las mujeres con cualquier examen positivo y un grupo control de mujeres negativas a VPH y Pap pero con examen visual alterado o con algún factor de riesgo de CC (más de dos parejas sexuales o que reporte que su pareja mantiene otras relaciones, fumadora, y >35 años) fueron derivadas a colposcopia y biopsia dirigida. El Papanicolaou y la biopsia fueron analizados como parte de los exámenes de rutina en el laboratorio de patología del hospital público correspondiente, donde también se realizaron las colposcopias. Estas últimas fueron supervisadas por los dos ginecooncólogos del estudio. El examen de VPH se realizó en el Laboratorio Clínico de la Pontificia Universidad Católica de Chile.2 El proyecto tuvo gran aceptabilidad por parte de las mujeres (99.3%) y del personal de salud (98.8% con resultados disponibles para análisis).14 La positividad de VPH AR fue de 10.7% y de Papanicolaou (ASCUS o peor) de 1.7%. De las 931 mujeres con tamizaje positivo, 94.3% asistió a una colposcopia; del grupo control se derivó a 295 y 78% de ellas asistió. En total se identificaron 42 neoplasias intraepiteliales cervicales (NIC) grado 2, 45 NIC3 y 9 cánceres. La sensibilidad para detectar NIC grado 2 o lesiones más severas (NIC2+), corregida por sesgo de verificación, fue de 92.7% (IC95% 84.4-96.8) para VPH y 22.1% (16.4-29.2) para Pap; las especificidades correspondientes fueron 92% (91.4-92.6) y 98.9% (98.7-99.0). La positividad de VPH fue máxima en las menores de 25 años, la cual bajó rápidamente hasta los 49 años; después de los 50 años subió discretamente, tal como se había reportado en 2001.2,6 El tamizaje con VPH fue más sensible que el Pap en todas las edades. Este estudio poblacional entregó evidencia contundente a nivel nacional de la mayor efectividad del examen de VPH. Su incorporación permitiría ampliar el intervalo entre tamizajes a cinco años y, con ello, es más probable alcanzar las metas de cobertura.15
Tipificación VPH 16 y 18 en mujeres VPH AR positivas
Las mujeres con VPH AR (n= 776) se tipificaron para VPH 16 y 18 (Digene HPV Genotyping PS test); 38.8% resultaron positivas para VPH 16 o 18 (24% para VPH16, 9.7% para VPH 18 y 5.1% para ambos).16 La positividad de VPH 16/18 aumentó linealmente con la gravedad de las lesiones de las mujeres: 8% en Pap negativo, 40.5% en NIC2, 66.7% en NIC3 y 75% en cáncer, lo que se demuestra en Chile lo descrito internacionalmente respecto a la mayor agresividad de los tipos VPH 16/18. La tipificación VPH16/18 redujo la tasa de referencia a colposcopia de 10.7 a 3.7%. Cuando se agregó a la tipificación 16/18 el resultado del Papanicolaou como criterio adicional para derivación de las mujeres VPH16/18 negativas pero positivas a otro VPH AR la referencia a colposcopia aumentó a 4.2%, pero se detectó 14% adicional de las lesiones NIC2+ (lesiones VPH AR positivas pero 16/18 negativas). Esto sugirió un rol complementario para el Papanicolaou.16 Cabe mencionar que éste fue un triaje ciego, es decir, el citotecnólogo desconocía la condición de VPH; la sensibilidad del Pap es significativamente mayor cuando el citotecnólogo conoce la condición de portador de VPH.17
Autotoma en el tamizaje de CC en Chile
La baja cobertura de tamizaje se debe a problemas de acceso al sistema de salud, agravado por el rechazo al examen ginecológico.18 El examen de VPH permite que la mujer obtenga su propia muestra mediante la autotoma vaginal. Entre 2010 y 2013 se seleccionó a las mujeres mayores de 30 años inasistentes a su control de Pap (>3 años sin control) de la comuna de Puente Alto en Santiago y se les invitó a asistir a su centro de salud, donde serían atendidas sin demora. A las que no podían asistir se les ofreció la opción de realizarse una autotoma.19 Entre las 1 254 mujeres visitadas, 86.5% prefirió tomarse una muestra vaginal en su domicilio. De ellas, 11.4% fue positiva (captura híbrida 2) siendo referidas a colposcopia, 106 (85.5%) acudió a la cita y 11.3% de éstas presentó lesiones: 5 NIC2 (4.7%), 6 NIC3 (5.7%) y 1 cáncer (0.9%).19 Este estudio confirmó la alta aceptabilidad de la autotoma, ya reportada en 2003 en la Encuesta Nacional de Salud, lo que abre una alternativa clara para aumentar el acceso de la población que más lo requiere y lograr la meta de cobertura del Minsal.10,19
Evaluación de la costoefectividad de incorporar el tamizaje con el examen VPH en Chile
Antes de elegir una innovación en salud se requiere determinar su costoefectividad y su carga al presupuesto anual de los sistemas de salud. Se realizaron dos estudios para determinar ambas cuestiones en Chile. El primero modeló el impacto en el presupuesto anual de salud de incorporar los exámenes de detección de VPH en el Programa chileno. Dicho estudio reportó que, comparado con la estrategia de realizar un Papanicolaou cada tres años, era mejor usar el examen para detectar VPH AR y otro para VPH 16/18, seguido de un Pap reflejo (Pap que se toma al mismo tiempo que la muestra de VPH pero sólo se analiza cuando esta última resulta positiva) con un intervalo de cinco años. Esta estrategia representaría sólo 0.4% de aumento del presupuesto anual, logrando una disminución de 50% en la mortalidad.20 El análisis de costoefectividad realizado por el mismo autor demostró que la estrategia VPH AR más VPH 16/18 seguido de Pap reflejo era también rentable, y hacía ahorrar al pagador 23 USD por mujer por año y aumentar los años de vida ganados ajustados por calidad.21 Esta evidencia nacional de costoefectividad se suma a diversos estudios internacionales que concluyen que es rentable cambiar la citología por la detección de VPH como tamizaje primario. Por ejemplo, en Suecia demostraron que es rentable ofrecer acceso a la autotoma; en Inglaterra mostraron que el examen de VPH era más rentable que la citología y que es seguro ampliar el intervalo entre los tamizajes; en Holanda demostraron que cuando 50% de la población de mujeres esté vacunada, gracias a la inmunidad de rebaño, sería posible ampliar aún más el intervalo del tamizaje en toda la población, disminuyendo el número total de tamizajes de ocho a tres en la vida; otros han demostrado que es rentable realizar el tamizaje con VPH cada cinco años, seguido del triaje reflejo con Pap.22,23,24,25,26 En China, nuevos exámenes de menor costo para identificar VPH AR, como el care-HPV y técnicas de triaje altamente específicas como el Onco E6 Cervical Test, fueron altamente efectivos.27 Estos y otros avances bajarán aún más los costos de tamizaje basado en el examen de VPH, lo que hace más positivos los balances de costoefectividad del cambio de paradigma de tamizaje de CC.
Situación actual
En la nueva Guía Clínica de prevención del CC, vigente en Chile entre 2015 y 2020, el Minsal abrió por primera vez la posibilidad del tamizaje primario basado en el examen de VPH.28 Dicho documento incorpora dos algoritmos: uno para el caso de optar por un examen con tipificación VPH16/18 y el otro sólo para detección de VPH AR (figuras 3 y 4); en ambos algoritmos se incorpora el Pap reflejo para triaje de las VPH AR positivas en quienes VPH16/18 fueron negativos o se desconoce la tipificación. Aunque se abre la opción para quienes decidan usar el examen de VPH, dicha prueba no es cubierta por el seguro de salud. El Programa Nacional 2015-2020 mantiene sin modificación alguna la estrategia de 1987: Pap cada tres años para mujeres de entre 25 y 64 años. En la misma guía, en la sección de Recomendaciones Clave, indica que la detección de VPH se limita al triaje de ASCUS o como coexamen con Pap.28 En cualquier caso, es un avance frente a la guía previa que desconocía cualquier tamizaje distinto al de Papanicolaou. Hoy, las autoridades de salud reconocen la necesidad de cambiar el examen de tamizaje primario; sin embargo, en lugar de iniciar su implementación de forma progresiva y controlada, optaron por desarrollar nuevos estudios de prevalencia de VPH en consultantes de atención primaria de salud29 o comparar el desempeño del examen de VPH contra el Pap (estudio piloto en curso desde 2016 en el Hospital Base de Valdivia). Por su diseño y tamaño, estos estudios no entregarán nueva ni mejor evidencia epidemiológica que la ya descrita y, en la práctica, postergan la toma de decisiones.
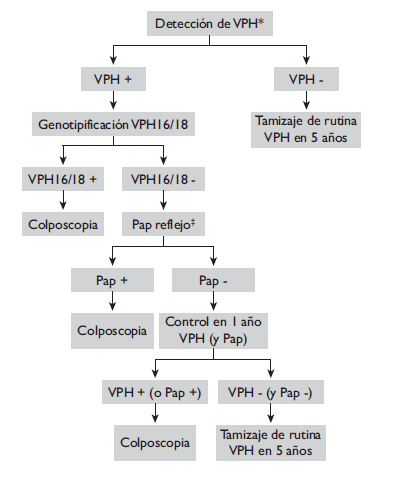
A. Alternativa de tamizaje para mujeres entre 30 y 64 años, si está disponible examen de detección de VPH y genotipificación clínicamente validado
* Prueba de detección de VPH de alto riesgo clínicamente validada
‡ El Pap se toma junto con el VPH pero se lee solamente ante un resultado VPH+ 16/18-; el citotecnólogo/patólogo debe conocer qué muestra es VPH+
Fuente: Ministerio de Salud de Chile28
Figura 3 Tamizaje de CC basado en examen de VPH: alternativa VPH AR con genotipificación VPH 16 y 18. Chile, 2015

B. Alternativa de tamizaje para mujeres entre 30 y 64 años, si está disponible examen de detección de VPH clínicamente validado
* Prueba de detección de VPH de alto riesgo clínicamente validada
‡ El Pap se toma junto con el VPH pero se lee solamente ante un resultado VPH+; el citotecnólogo/patólogo debe conocer que muestra es VPH+
Fuente: Ministerio de Salud de Chile28
Figura 4 Tamizaje de CC basado en examen de VPH: alternativa VPH AR sin genotipificación. Chile, 2015
Discusión
El Papanicolaou, al ser un examen altamente dependiente de las condiciones en que se ejecuta, presenta una importante variabilidad entre citotecnólogos y patólogos de un mismo laboratorio y entre regiones (sensibilidad de 15.4 a 72.7%), con mayor variabilidad entre sitios con menos recursos.30,31 Chile no escapa a esta realidad, habiéndose demostrado una sensibilidad de Papanicolaou inferior a 30% para CIN2+.2 Por otro lado, actualmente un número significativo de mujeres con lesiones ASCUS o con Pap insatisfactorio (18.6%) no regresa a repetirse el examen o no acepta la derivación.32 Esta pérdida disminuirá cuando no sea necesario citar a las mujeres para repetirse un examen, sino que sólo se citen cuando se requiera un proceso diagnóstico o de seguimiento. La nueva guía clínica de prevención del CC del Minsal muestra que, a pesar de la evidencia, no fue posible innovar el examen de tamizaje. Entre las dificultades está la comodidad que representa mantener un programa de 30 años que ha sido considerado muy exitoso.3 Sin embargo, el éxito del programa no está dado por el Papanicolaou, sino por su excelente organización y alta cobertura territorial; la misma que se usaría para el tamizaje con otro examen, como el de detección de VPH en lugar de la citología convencional. Son esos 30 años de experiencia los que permitirían terminar con las 600 muertes anuales en un periodo mucho más breve y ahorrando recursos del Estado.
Alternativas de tamizaje de CC para Chile
Las pruebas moleculares de detección de VPH son automatizadas, tienen alta reproducibilidad y permiten manejar grandes volúmenes de muestras al mismo tiempo. El tamizaje se puede centralizar en las regiones o macroregiones desde donde se envíen los resultados e indicaciones de modo digital, proceso que implica mucho menos tiempo y menos recursos humanos que el sistema actual de Papanicolaou. Al disminuir la carga de los laboratorios locales se liberan recursos humanos que pueden derivarse a cubrir la demanda creciente de los servicios de patología. Las pacientes podrán consultar el resultado de su examen y las indicaciones en línea, usando el código de identidad que se le haya entregado al momento de tomar la muestra. La misma mujer puede tomarse la muestra para el examen de VPH, lo que permite incluir en el tamizaje a las mujeres con barreras de acceso.
Riesgos de la nueva estrategia basada en el examen de VPH
El problema de la baja especificidad del examen puede conducir a un sobrediagnóstico y éste a un sobretratamiento, lo que representa un problema en cualquier programa de tamizaje. En Chile, en el área privada se usa el Papanicolaou en exceso; se indica a mujeres menores de 25 años y se repite anualmente. Aunque el Pap también tiene problemas asociados con el exceso de uso, ya que su especificidad es mucho mayor, causa menos daño que lo que causaría el sobreuso del VPH. Se demostró en un modelo matemático que si se indicara VPH anualmente a partir de los 20 años (como en muchos lugares se hace con el Pap) el daño por sobreuso, en años de vida perdidos ajustados por calidad, sobrepasaría el beneficio de incorporar el examen de VPH.33 Para prevenir dicho fenómeno se requiere un liderazgo fuerte y mecanismos de información eficaces para detectar y corregir precozmente desviaciones y abrir espacios de comunicación con la población para empoderarlos sobre el significado del examen.
El contrapunto de la Vacuna contra VPH: Chile entre los innovadores de la región
Finalmente, cabe mencionar que en el área de incorporación de la vacuna contra VPH, Chile está entre los innovadores de la región. En la discusión sobre su utilización, que duró cerca de tres años, nunca se planteó la necesidad de hacer un ensayo clínico de la vacuna en el país. El grupo asesor de las inmunizaciones es un cuerpo técnico independiente del Minsal, constituido por salubristas, infectólogos, inmunólogos, eticistas, epidemiólogos y virólogos coordinados por un salubrista. Las recomendaciones se basaron estrictamente en criterios de evidencia y costoefectividad, teniendo en cuenta el contexto del país y sus oportunidades.34
Conclusiones
En esta revisión hemos demostrado que se dispone de un amplio conocimiento epidemiológico del VPH y CC en Chile y que existen las condiciones técnicas y económicas para implementar una mejora sustancial en la situación del CC en este país al cambiar el examen de tamizaje de Papanicolaou por el de detección de VPH según los algoritmos presentados. La meta de 80% de cobertura con tamizaje cada tres años, que se ha demostrado imposible de cumplir por el sector público, sería fácilmente lograda con un examen que sólo requiera repetirse cada cinco años a partir de que la mujer cumple 30 y que, además, ofrece la opción de autotoma y se incorpora el triaje reflejo con base en la tipificación de VPH 16 /18 o Papanicolaou.
Además de la cuestión ética de mantener un examen demostradamente inferior, teniendo a la mano alternativas más rentables, la mantención del Papanicolaou como tamizaje primario implica asumir el costo social que provoca la baja cobertura en los grupos de mayor riesgo. Ignorar el examen de VPH que está dispónible para la población del sector privado de salud contribuye a la inequidad en salud en Chile. La evidencia epidemiológica no es suficiente y se requiere un amplio consenso.35 Para ello, el principal reto son las resistencias a la innovación por parte de los responsables de la salud pública, quienes son llamados a liderar este proceso.











 nueva página del texto (beta)
nueva página del texto (beta)


