Introducción
Durante los últimos años se ha observado un aumento en la incidencia de infecciones causadas por bacterias multidrogorresistentes (MDR), lo cual se ha convertido en un problema de salud pública en el mundo.1 La prevalencia de cepas MDR es diferente en cada hospital y está relacionada con el tipo de pacientes, los procedimientos terapéuticos, el tipo de cirugías y las políticas para el uso de antibióticos y programas de prevención de infecciones asociadas con el cuidado de la salud (IACS).
Los patógenos que se describen habitualmente son agrupados con el acrónimo de ESKAPE, que incluye Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa y Enterobacter cloacae. En este estudio se ha incluido una doble E, ya que Escherichia coli es el germen más frecuentemente aislado en el Instituto Nacional de Cancerología; un alto porcentaje de estas cepas produce beta-lactamasas de espectro extendido (BLEE). De esta manera, el acrónimo queda como E-ESKAPE.
Los pacientes con cáncer constituyen un grupo de alto riesgo para adquirir infecciones asociadas con el cuidado de la salud, particularmente por cepas MDR, ya que reciben diversos procedimientos terapéuticos como quimioterapias mieloablativas (particularmente, los pacientes con neoplasias hematológicas; secundariamente, los que desarrollan neutropenia febril), hospitalizaciones repetidas, procedimientos quirúrgicos extensos, instalación de dispositivos vasculares a permanencia prolongada, reservorios de Omaya, trasplantes de médula ósea, entre otros.
Estos pacientes cursan con diferentes tipos de inmunosupresión, por lo que presentan alto riesgo de padecer procesos infecciosos y, en los casos en los que hay bacterias MDR involucradas, esta situación puede convertirse en una urgencia infectológica. Aunado a lo anterior, el retraso en el inicio de antibióticos específicos puede también ser un factor relacionado con la mortalidad.2 Las infecciones por microorganismos MDR incrementan la morbimortalidad, los días de estancia hospitalaria y los requerimientos en el uso de antibióticos de amplio espectro, asociados también con mayores costos de atención y otras complicaciones secundarias como colitis por Clostridum difficile.3
Con frecuencia, estos pacientes, en particular los enfermos con neoplasias hematológicas, reciben diversos esquemas de antibióticos sucesivamente, lo que condiciona la presión selectiva bacteriana y favorece el desarrollo de cepas MDR.3 La toma de hemocultivos anterior al inicio de antibióticos es un estudio indispensable para confirmar la presencia de bacteriemia y conocer la sensibilidad de las cepas aisladas.
Conocer la epidemiología de los principales microorganismos MDR que prevalecen en cada hospital permite iniciar un tratamiento antimicrobiano empírico dirigido, lo cual es de gran utilidad especialmente para pacientes inmunosuprimidos que cursan con datos de sepsis grave.4
El objetivo de este estudio fue describir la tendencia de cepas bacterianas E-ESKAPE y la prevalencia de la resistencia antimicrobiana de aislados de hemocultivos en pacientes del Instituto Nacional de Cancerología (INCan), y comparar la prevalencia de estas bacterias entre pacientes con neoplasias hematológicas con las aisladas de pacientes con tumores sólidos, en un periodo de 11 años.
Material y métodos
El INCan es un hospital de tercer nivel, centro de referencia de pacientes adultos con cáncer. Cuenta con 135 camas y anualmente reporta una media de 35 00 aplicaciones de quimioterapia ambulatoria, 3 00 cirugías mayores y 7 00 egresos hospitalarios. Se incluyeron los aislamientos de hemocultivos tomados entre el 1 de enero de 2005 y el 31 de diciembre de 2015, obtenidos a través de los registros del Laboratorio de Microbiología. Durante este periodo, se registraron 78 801 egresos hospitalarios, de los cuales 13 569 (17.2%) fueron pacientes con neoplasias hematológicas y 65 232 (83.8%), pacientes con tumores sólidos.
Procedimientos diagnósticos
En todos los pacientes con fiebre o sospecha de un evento infeccioso, se toman hemocultivos con técnica estéril (barrera máxima) de acuerdo con las instrucciones del fabricante, en medio enriquecido Bactec Plus aerobic F.* En todo el transcurso del estudio se utilizaron siempre los frascos Bactec Plus aerobic F. No se utilizaron frascos para gérmenes anaerobios. Se toman dos muestras con intervalo de 20 a 30 minutos entre cada una. En pacientes con catéter venoso central, se tomó un cultivo inicial por vía periférica, uno a través de cada lumen del catéter y un último por punción periférica. Cada botella de hemocultivos fue etiquetada con la fecha, hora de toma y sitio donde se obtuvo la muestra.
La identificación y susceptibilidad antimicrobiana se realizaron a través de métodos de microdilución automatizados (Microscan ‡ de 2004 a 2010 y BD-Phoenix de 2011 a 2013§). Se incluyeron la siguientes cepas: E. coli con fenotipo de resistencia por producción de BLEE, E. faecium resistente a vancomicina (EVR), S. aureus resistente a meticilino (SARM), K. pneumoniae BLEE, P. aeruginosa MDR, A. baumanii MDR, y E. cloacae (cepas que corresponden al acrónimo E-ESKAPE).
Los antibióticos que se analizaron para los gérmenes gramnegativos fueron amikacina (AK), gentamicina (GM), ceftazidima (CAZ), trimetoprim/sulfametoxazol (STX), ciprofloxacina (CIP) e imipenem (IMP). Para P. aeruginosa se excluyó STX. Para E. faecium se analizó vancomicina (VAN) y para S. aureus, oxacilina (OXA), CIP, VAN y GM. Se consideraron gérmenes MDR cuando se documentó resistencia a tres o más familias de antimicrobianos; extensamente resistente (XDR), cuando se reportaron resistentes a antibióticos de todas las categorías excepto una o dos, y panresistentes, cuando fueron resistentes a todos los antimicrobianos disponibles.5 Se distinguieron patrones de susceptibilidad de acuerdo con los parámetros establecidos por el Clinical and Laboratory Standards Institute (CLSI) según el año de estudio.6
Análisis estadístico
Se realizó análisis descriptivo con base en los porcentajes de susceptibilidad de los microorganismos identificados, por cada uno de los antibióticos estudiados por año de aislamiento. Se utilizó prueba de ji cuadrada o prueba exacta de Fisher para comparar los grupos, considerando como estadísticamente significativa una diferencia de p≤0.05.
Resultados
Durante el periodo de estudio, se procesaron 33 27 cultivos de sangre, de los cuales 5604 (16.9%) fueron positivos. Se recuperaron 6397 aislados, de los cuales 793 cultivos tuvieron aislamiento polimicrobiano. Del total de gérmenes aislados, 3732 (58.4%) fueron bacilos gramnegativos, 2355 (36.9%) cocos grampositivos, 179 (2.7%) levaduras, 126 (1.9%) bacilos grampositivos y 5 (0.08%) hongos. En la figura 1 se presentan los principales grupos de gérmenes identificados en hemocultivos de 2005 a 2015 por año de aislamiento.
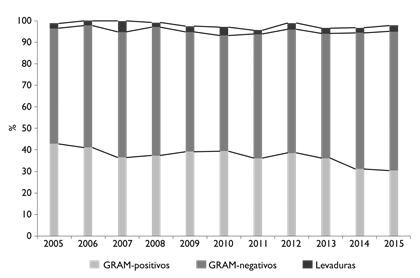
Figura 1 Principales grupos de bacterias identificados en hemocultivos. México, Instituto Nacional de Cancerología, 2005-2015
E. coli se identificó en 1591 aislamientos (24.5%), de los cuales 652 (41%) fueron BLEE. En la figura 2 se presenta el número de aislamientos de E coli BLEE y su tendencia a lo largo de los 11 años por tipo de paciente. Se identificaron 384 (5.6%) P. aeruginosa, de los cuales 43 (11.2%) se identificaron como MDR, 367 (5.6%) K. pneumoniae, 41 (11.2%) de estas fueron BLEE, 143 (2.1%), E. faecium, de los cuales 45 (31.5%) fueron EVR, 96 (1.4%) A. baumannii 23 (24%) de estos MDR, 250 (4.4%) Enterobacter sp., seis de estos fueron BLEE (2.4%). En la figura 3 se presenta el número de cepas gramnegativas aisladas de hemocultivos por cada año y la tendencia por cepas estudiadas
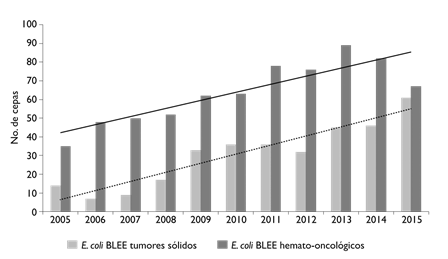
BLEE: beta-lactamasas de espectro extendido
Figura 2 Aislamientos de E coli BLEE en pacientes con neoplasias hematológicas (barras negras, línea de tendencia continua) y en pacientes con tumores sólidos por año (barras grises, línea de tendencia punteada). México, Instituto Nacional de Cancerología, 2015
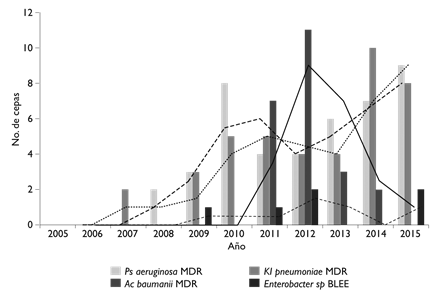
BLEE: beta-lactamasas de espectro extendido
MDR: multidrogorresistentes
Figura 3 Número de cepas de bacilos gramnegativos multirresistentes de hemocultivos por año de aislamiento y su tendencia: K. pneumoniae BLEE (línea punteada), P. aeruginosa MDR (línea negra discontinua), A. baumanii MDR (línea negra continua), Enterobacter sp. BLEE (línea con cuadrados). México, Instituto Nacional de Cancerología, 2005-2015
S. aureus 571 (8.7%), siendo 121 (21.2%) resistentes a meticilina. En la figura 4 se presenta el número de aislamientos de cocos grampositivos y la tendencia en el patrón de resistencia de SARM y de EVR. El primer aislamiento de EVR en sangre fue en 2008 y no hubo otro aislamiento hasta 2011.
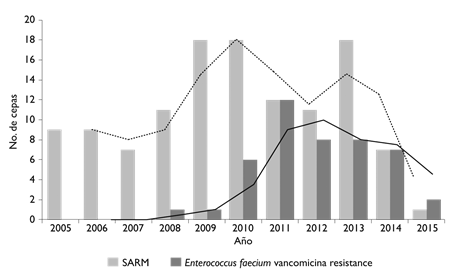
SARM: S. aureus resistente a meticilino
Figura 4 Número de cepas de cocos grampositivos multirresistentes de hemocultivos por año de aislamiento y su tendencia. SARM(barra gris, línea de tendencia punteada). Enterococcus faecium resistente a la vancomicina (barra negra y línea de tendencia negra). México, Instituto Nacional de Cancerología, 2005-2015
Al comparar los aislamientos de cepas MDR se encontraron diferencias estadísticamente significativas entre los pacientes con neoplasias hematológicas vs. tumores sólidos durante todo el periodo de estudio para SARM, E. coli BLEE, A. baumannii MDR y Enterobacter sp. (figura 5). El riesgo reportado fue SARM (RM=4.48, IC95% 2.9-6.8), E coli BLEE (RM=1.13, IC95% 1.10-1.65), P. aeruginosa MDR (RM=1.04, IC95% 0.55-1.96), EVR (RM=0.77, IC95% 0.34-1.6), A. baumannii MDR (RM=3.2, IC95% 1.2-8.5), K. pneumoniae BLEE (RM=0.77, IC95% 0.4-1.5) y Enterobacter sp. (RM=11.9, IC95% 1.37-104).
Discusión
La Organización Mundial de la Salud ha decretado la emergencia de resistencia antimicrobiana como un problema de salud pública que requiere de un plan de acción en el contexto de cada país y a nivel internacional. Una de las estrategias de este programa es conocer la tendencia que existe en la resistencia antimicrobiana de aislados clínicos. Es por ello que se considera relevante la información que aquí se presenta porque permite conocer la tendencia en la resistencia antimicrobana de aislados de sangre de un hospital de pacientes adultos con cáncer.7,8
En los resultados obtenidos se observó que E. coli fue el patógeno más frecuentemente aislado en hemocultivos en todos los pacientes (figura 2) y que existe una tendencia creciente del aislamiento de E. coli BLEE, consistente para todos los años de estudio. Este hallazgo es similar al que reportaron los autores del presente estudio en un trabajo previo que describió los aislados de sangre de 1998 a 2003,9 donde E. coli fue el germen que se aisló con mayor frecuencia. E coli es el patógeno identificado en sangre con mayor frecuencia en bacteremias nosocomiales en la última década, particularmente en la población de pacientes con neoplasias hematológicas asociadas con bacteremia por daño a mucosas.10,11 En este estudio se reportó un incremento sostenido en la resistencia de 18% en 2003 a 48.6% en 2015, tendencia que también se ha reportado en algunos otros países del mundo, en bacteremia asociada con el cuidado de la salud.12,13,14,15
El comportamiento de otras bacterias MDR es diverso; se observa un incremento progresivo para K. pneumoniae BLEE y para P. aeruginosa tanto en pacientes con neoplasias hematológicas como en pacientes con tumores sólidos.
En relación con S. aureus, casi se duplicó el número de aislamientos y, al compararlo con el estudio previo en el cual sólo 4% era resistente a meticilina, se encontró un incremento de la resistencia a meticilina de casi cinco veces, ya que en 2014 alcanzó 20.5%, para posteriormente disminuir a 14.1% en 2015. Lo anterior se debió a un brote en el transcurso de este periodo y su disminución a medidas preventivas como el reforzamiento del lavado de manos.
El aislamiento de cepas MDR fue significativamente mayor en pacientes hemato-oncológicos en todos los años estudiados (figura 5). Esta diferencia fue mayor a partir de 2011, y disminuyó en 2015. El aumento en la detección de cepas MDR coincide con los años en los que se registraron tres brotes por cepas MDR: en 2010 por SARM, lo cual implicó un incremento en el uso de vancomicina, y un año después un brote por EVR.16 El tercer brote fue por A. baumannii MDR y se presentó en 2012 en la Unidad de Cuidados Intensivos, particularmente en el grupo de pacientes hematológicos.17
El servicio de pacientes hemato-oncológicos ha jugado un papel fundamental en promover el problema de la mutirresistencia antimicrobiana, ya que éstos requieren combinaciones de agentes antineoplásicos para tratar enfermedades altamente agresivas como leucemias agudas y linfomas. Estos esquemas de quimioterapia combinan fármacos altamente mielosupresores, que condicionan periodos prolongados de agranulocitosis, donde los pacientes prácticamente tienen cuentas de menos de 100 neutrófilos por espacio de 2 a 4 semanas, aunado al daño producido a las mucosas causado por la misma quimioterapia, lo que favorece la translocación bacteriana del tubo digestivo y promueve el desarrollo de bacteriemias y neumonías.18
El tratamiento antimicrobiano de los pacientes con neutropenia grave y fiebre, con o sin bacteriemia documentada microbiológicamente, requiere del uso de antibióticos de amplio espectro, generalmente cefalosporinas de tercera generación, piperacilina/tazobactam o carbapenémicos, durante el periodo que dure la neutropenia. Usualmente, este periodo es de 7 a 10 días, pero puede ocurrir que se requieran periodos más prolongados que pueden llegar a ser de hasta 3 o 4 semanas. Además, estos episodios no son únicos sino que se pueden repetir en el mismo paciente después de la aplicación de cada ciclo de quimioterapia. Un estudio de seguimiento de 24 meses que incluyó 43 pacientes con diagnóstico reciente de leucemia aguda mostró que la mediana de eventos infecciosos fue de 4.7 ± 2 por paciente; la tasa de infecciones fue de 0.91/100 días-paciente y de 0.67/100 días-paciente en casos de neutropenia y fiebre. Lo anterior refleja una población con un uso repetido de antibióticos, que condiciona presión selectiva en la microbiota de estos enfermos.19
El análisis por cepas mostró que los pacientes con neoplasias hematológicas tienen mayor número de aislamientos de cepas MDR. Al analizarlo por cada una de las bacterias estudiadas, solamente E. coli, SARM y A. baumannii MDR tuvieron significancia estadística.
En la mitad del año 2013, se inició un programa de control y desescalonamiento de antibióticos, con el que se observó una tendencia decreciente en el número de aislamientos de SARM, A. baumannii MDR y EVR (figura 5). Por todo ello es indispensable continuar implementando estrategias para disminuir la presión antimicrobiana, como el uso racional de antibióticos, desescalamiento de esquemas antimicrobianos, adherencia a la profilaxis antimicrobiana en cirugía (en tiempo y tipo de antibióticos administrados), programas estrictos para la prevención de infecciones asociadas con el cuidado de la salud para asegurar el uso adecuado y racional de los antibióticos, así como continuar con el monitoreo y reporte de la resistencia antimicrobiana en los hospitales, entre otras medidas.16











 nueva página del texto (beta)
nueva página del texto (beta)



