Introducción
Las metástasis al sistema nervioso central (SNC) son una de las complicaciones más relevantes del cáncer debido a su potencial gravedad y a sus repercusiones en la calidad de vida y supervivencia del paciente.1 Aunque la incidencia en el ámbito mundial está subregistrada, se considera que las metástasis al SNC ocurren en 9 a 17% de todos los tumores sólidos, según datos de 2012, y ello se asocia principalmente con el cáncer de pulmón, el melanoma y el cáncer de mama.2
El cáncer de mama es el tumor maligno más frecuente entre las mujeres en el mundo.3 En México, para 2014, representó 20% de todos los cánceres femeninos, y la incidencia en la población de 20 años o más era de 14.80 por cada 100 000 mujeres. Algunos informes indican que en la década pasada esa incidencia fue de 35.6, y que pasó de 14.2 en 2001 a 25.2 en 2011, con afección principalmente entre mujeres mayores de 55 años, así como que la mortalidad en el país es de 15 por cada 100 000 mujeres mayores de 20 años.4,5,6,7
En una escala mundial, el cáncer de mama es la segunda neoplasia con mayor índice de metástasis al SNC (10-16%).8,9 Debido a la detección temprana y al acceso a un tratamiento óptimo, la supervivencia global de esta enfermedad se ha elevado por distintos factores; sin embargo, la frecuencia de metástasis al SNC también se han incrementado, lo que agrava el pronóstico.10,11 Se ha informado que, de la fecha del diagnóstico de cáncer de mama a la metástasis al SNC, trascurren alrededor de 31 meses,12 aunque entre pacientes en etapas avanzadas se registra una mediana de cinco meses.13
Una de las implicaciones de padecer enfermedad metastásica en el SNC es la poca respuesta al tratamiento sistémico, dado que la mayoría está basada en la quimioterapia (QT), la cual no atraviesa la barrera hematoencefálica.10
Se han identificado diversos factores de riesgo relacionados con el desarrollo de metástasis cerebrales. Entre los factores asociados con el tumor se encuentran la etapa clínica y la edad al diagnóstico, así como la presencia de subtipos moleculares agresivos, en particular del inmunofenotipo triple negativo (TN); Adicionalmente, se ha observado que los pacientes con resultado positivo para el receptor 2 del factor de crecimiento humano epidérmico (HER2+), y que reciben tratamiento con trastuzumab y QT, tienen mayor riesgo de presentar extensión al SNC.9,12,14
Pocos estudios han profundizado en la descripción de factores pronósticos, características clínicas y patológicas y la terapéutica, asociados con el desarrollo de metástasis al SNC entre pacientes con cáncer de mama en México, así como en su supervivencia. Estudios internacionales han identificado que el estado funcional y la etapa clínica al momento del diagnóstico, al igual que el subtipo molecular, son los factores pronósticos de mayor relevancia en este grupo de pacientes.11,12,15
El objetivo de este estudio es evaluar los factores pronósticos (características clínicas y patológicas, y tratamientos) de pacientes con cáncer de mama y metástasis al SNC como primer sitio de extensión del cáncer.
Material y métodos
Se realizó un estudio de cohorte retrospectivo, el cual fue aprobado por el Comité de Ética en Investigación del Instituto Nacional de Cancerología (INCan), y que incluyó a 5 529 pacientes diagnosticadas con cáncer de mama atendidas, entre 2007 y 2015, bajo la cobertura del Fondo de Protección de Gastos Catastróficos en dicho Instituto. De ellas, fueron incluidas en el análisis 125 mujeres con diagnóstico de cáncer de mama en etapas tempranas (etapa IA-IIB) y localmente avanzadas (etapa IIIA-IIIC), de 18 a 81 años, y que presentaron afección del SNC como primer sitio de recurrencia durante su seguimiento. La información fue recabada mediante la revisión de expedientes clínicos, con la colaboración de capturistas previamente capacitados y estandarizados por un grupo de oncólogos especialistas en la atención del cáncer de mama. Los datos recolectados incluyeron características clínico-patológicas de las pacientes, como etapa al diagnóstico, tratamiento oncológico inicial, tipo histopatológico, perfil de inmunohistoquímica (IHQ) y estado actual de la paciente. La información fue validada periódicamente por un epidemiólogo y un oncólogo independientes. Las evaluaciones histopatológicas fueron realizadas por patólogos dedicados a cáncer de mama. La presencia de receptores hormonales (RH) fue determinada por IHQ utilizando el H-Score.16 Una puntuación mayor a 10 (1 a 10% de células positivas) fue utilizada para definir la positividad de los receptores de estrógeno (RE) y progesterona (RP). Los casos con una puntuación menor o igual a 10 fueron clasificados como RE y RP negativos. En los casos RH positivos, se utilizó la puntuación semicuantitativa H-score para definir la intensidad de la expresión del receptor. Este método proporciona una puntuación global (0-300) basada en la suma ponderada del porcentaje de células con diferente intensidad de tinción (leve, moderado e intenso).17 El estado de HER2 se determinó por IHQ y se consideró negativo a aquéllos identificados como cero (sin tinción de membrana) o 1+ (débil e incompleta tinción). Los tumores se consideraron HER2+ en los casos clasificados como 3+ en la tinción de membrana, o FISH amplificado, y HER2 negativo en los casos con 0, 1+ y 2+ IHQ más FISH amplificado negativo. Se definieron cuatro subtipos de acuerdo con los resultados de la IHQ: triple negativo (RE-/RP-/HER2-), HER2 positivo (HER2+/RE-/RP-), triple positivo (RE+/RP+HER2+) y luminales (RE+/RP+/HER-). La etapa clínica de cada paciente se llevó a cabo mediante criterios universales estandarizados, usando el sistema TNM del American Joint Committee on Cancer (AJCC), el cual se basa en el tamaño del tumor, el estado de los ganglios linfáticos y la metástasis.18 El sistema de graduación histológica de Scarff-Bloom-Richardson (SBR) se utilizó para establecer el grado de malignidad según la diferenciación celular notificada en los análisis de laboratorio,19 caso similar a lo reportado para Ki67.20
Análisis estadístico
La supervivencia global se calculó considerando el intervalo desde la fecha del diagnóstico de metástasis hasta la fecha de muerte o de la última visita, siendo la muerte el evento final; los pacientes vivos se consideraron censuras.
Se realizó estadística descriptiva de las características clínicas, patológicas y de tratamiento recolectadas, y se presentaron medidas de tendencia central y dispersión en las variables cuantitativas, así como frecuencias y porcentajes en las variables cualitativas. El análisis para identificar las diferencias entre aquellas pacientes que fallecieron y las que no se realizó utilizando la prueba estadística correspondiente de acuerdo con el tipo de variable por analizar (ji cuadrada o t de Student). El análisis de supervivencia se llevó a cabo empleando el método de Kaplan-Meier y tablas de vida. Se estimó el tiempo de supervivencia global (de la fecha de diagnóstico a la fecha de muerte o última consulta) y de supervivencia con metástasis (del diagnóstico de metástasis a la fecha de muerte o última consulta). Las diferencias estadísticas entre las funciones de supervivencia de las características clínicas fueron calculadas mediante la prueba de Log-Rank o Wilcoxon. Un modelo de riesgos proporcionales de Cox ajustado (MRP) fue empleado para identificar las variables clínicas predictoras de la supervivencia en la población de estudio. El diagnóstico del modelo se realizó mediante el análisis de residuos y la verificación del supuesto de proporcionalidad.21 Se consideró estadísticamente significativa una p≤0.05. Todos los análisis fueron realizados con STATA v. 14.2.
Resultados
El análisis incluyó a 125 pacientes diagnosticadas, entre 2007 y 2015, con cáncer de mama y cuyo primer sitio de metástasis fue el SNC. La mediana de edad al momento del diagnóstico fue de 47 años (P25 40.59-P75 54.48). El carcinoma ductal invasivo fue el tipo histológico más frecuente al presentarse en 108 pacientes (86.4%). Respecto a la etapa clínica, 112 (86.6%) pacientes fueron diagnosticadas en etapa localmente avanzada (IIB-IIIC). El análisis de inmunohistoquímica se ilustra en el cuadro I. El 28.8% (n=36) tenía un subtipo luminal; 28.8% (n=36), TN; 25.6% (n=32), HER2 positivo (RH-HER2+), y 16.8% (n=21), triple positivo (RH+Her2+).
Cuadro I Características clínicas y tratamientos recibidos. Pacientes con cáncer de mama, con el SNC como primer sitio de metástasis. Instituto Nacional de Cancerología, México, 2007-2015

* Son variables cuantitativas, por lo que se presenta media y desviación estándar (DE), y mediana y rango
SNC: sistema nervioso central
SBR: escala de Scarff-Bloom-Richardson
IHQ: Inmunohistoquímica
RH: receptores hormonales
HER2: receptor 2 del factor de crecimiento humano epidérmico
De las 125 mujeres que presentaron metástasis al SNC como primer sitio de recurrencia, 23% lo mostraron durante el primer año de seguimiento (n=29); a los tres años el porcentaje de afección del SNC fue de 80% (n=100).
Al estratificar por subtipos, a un año, 34% (n=11) de las clasificadas como HER2+ y 25% (n=9) de las TN ya mostraban metástasis; únicamente 14% (n=3) de las pacientes identificadas como triple positivo habían sido diagnosticadas como metastásicas, y a los tres años, 92% (n=33) de las pacientes con tumor TN y 88% (n=28) de aquéllas con HER2+ ya sufrían la extensión del cáncer a SNC.
Los tumores luminales y principalmente triple positivos tuvieron el menor riesgo de metástasis al SNC en los primeros tres años [69% (n=25) y 67% (n=14), respectivamente; p<0.016].
El principal tratamiento primario fue la QT. El 99% de las pacientes (n=124) la recibieron (80.7% en el contexto neoadyuvante); 90% (n=111) recibió QT basada en antraciclinas y taxanos; en el caso de los HER2+ y triple positivos, se suministró traztuzumab. En 83.2% (n= 104) de las pacientes se realizó un manejo quirúrgico para el tumor primario, y 91.4% de las intervenciones consistieron en mastectomías radicales. La radioterapia adyuvante fue indicada en 81.4% (n=102) de los casos, y 39.2% (n=49) recibió hormonoterapia adyuvante (33%, tamoxifeno, y 32%, inhibidor de la aromatasa). El 78.4% (n=98) llegó a recibir algún tratamiento paliativo (cuadro I).
Un 42% (n=52) de las pacientes incluidas en el estudio habían fallecido, tomando en cuenta el periodo de estudio. La mediana de seguimiento fue de 29.6 meses (P25 21.7- P75 46.1). La mediana de supervivencia global (SG) fue de 14.2 meses (IC95% 11.83-26.93); al considerar a todas las pacientes, la supervivencia a un año fue de 59.97%, y a tres años, de 33.22% (figura 1).

SNC: sistema nervioso central
INCan: Instituto Nacional de Cancerología
Figura 1 Supervivencia global general en pacientes con cáncer de mama, con el SNC como primer sitio de metástasis. Instituto Nacional de Cancerología, México, 2007-2016
La edad al diagnóstico no mostró diferencias significativas, aunque el grupo de mujeres mayores de 50 años presentó una mediana de supervivencia mayor, en comparación con el grupo de menores de 50 años; a cinco años, las mujeres mayores de 50 años presentaban porcentajes de supervivencia superiores.
Aquellas pacientes que fueron tratadas quirúrgicamente (control local del primario) tuvieron una mayor supervivencia (16.6 meses) que aquéllas que no fueron intervenidas (11 meses). Las pacientes diagnosticadas inicialmente en etapas tempranas mostraron supervivencia de 14 meses más, en comparación con aquéllas diagnosticadas como localmente avanzadas; sin embargo, estas variables no fueron significativamente diferentes. Respecto a la hormonoterapia, se observaron mayores porcentajes de supervivencia a un año para las mujeres que recibieron dicho tratamiento de forma adyuvante (p=0.079) (cuadro II).
Cuadro II Supervivencia global del diagnóstico de cáncer de mama a la fecha del último contacto o de la muerte (meses.) Pacientes con cáncer de mama, con el SNC como primer sitio de metástasis. Instituto Nacional de Cancerología, México, 2007-2015
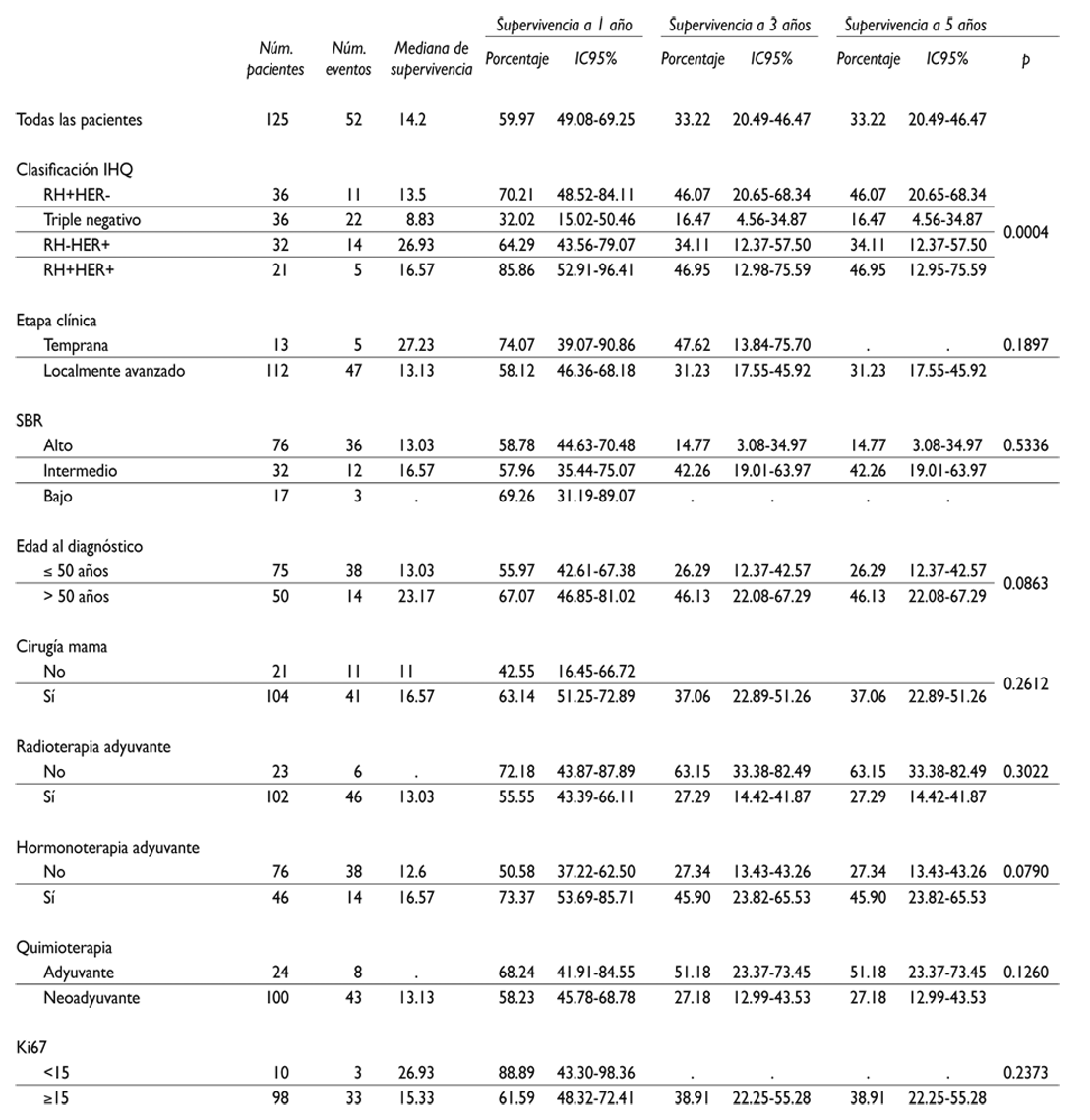
SCN: sistema nervioso central
lINCan: Instituto Nacional de Cancerología
IHQ: inmunohistoquímica
RH: receptores hormonales
HER2: receptor 2 del factor de crecimiento humano epidérmico
SBR: escala de Scarff-Bloom-Richardson
IC: intervalo de confianza
p=comparación de curvas de supervivencia, prueba Log-Rank o Wilcoxon
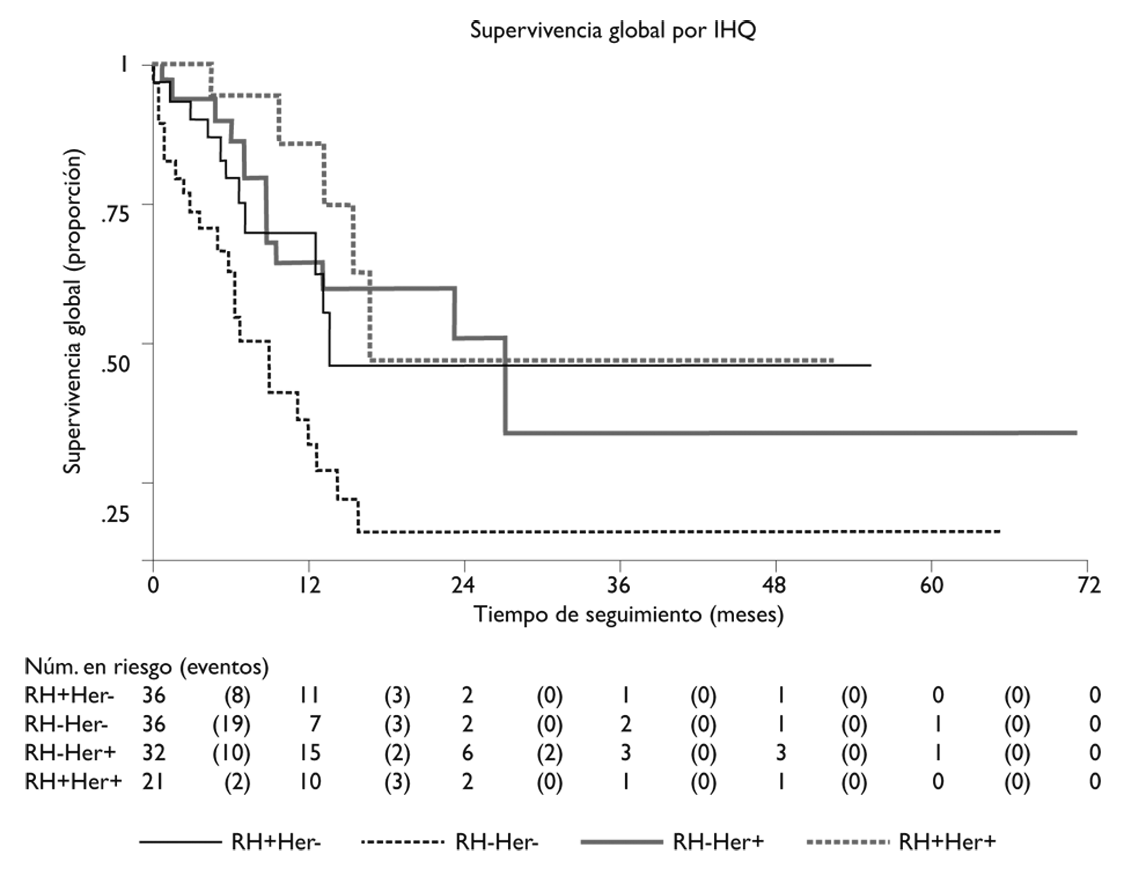
Las mujeres con clasificación de IHQ Her2+ y las triple positivo presentaron las mayores medianas de supervivencia (26.9 y 16.6 meses, respectivamente); la menor mediana se observó en las mujeres con tumor TN (8.8 meses). La supervivencia a un año fue sustancialmente superior en las pacientes con tumor triple positivo (85.86%), en comparación con sólo 32.0% de las pacientes con TN (p<0.004) (figura 2).
*Prueba estadística Wilcoxon
SNC: sistema nervioso central
INCan: Instituto Nacional de Cancerología
IHQ: inmunohistoquímica
RH: receptores hormonales
HER2: receptor 2 del factor humano epidérmico
Figura 2 Supervivencia global por IHQ en pacientes con cáncer de mama, con el SNC como primer sitio de metástasis. Instituto Nacional de Cancerología, México, 2007-2016
En el cuadro III se presentan los resultados del MRP ajustado por edad al diagnóstico, cirugía y Ki67, de diagnóstico de cáncer de mama a muerte o última consulta. Las pacientes con tumores TN mostraron un riesgo tres veces mayor de morir debido a la metástasis al SNC, en comparación con las mujeres que registraron tumores luminales (HR= 2.77; IC95% 1.10-6.99; p=0.031). Haber presentado tumor triple positivo fue un factor favorable, ya que esto reduce el riesgo de morir debido a la metástasis en 73% (IC95% 0.07-1.00; p=0.051). Asimismo, el diagnóstico en etapas localmente avanzadas incrementa el riesgo de fallecer por la afección al SNC en casi cinco veces (HR=4.86; IC95% 1.27; p=0.021). Un grado SBR intermedio acrecienta la probabilidad de muerte debida a la metástasis tres veces (HR=2.76; IC95% 1.17-6.51; p=0.021), en comparación con las pacientes con un grado alto.
Cuadro III Modelo de riesgos proporcionales de Cox ajustado para supervivencia global de diagnóstico de cáncer de mama a muerte en pacientes con cáncer de mama, con el SIN como primer sitio de metástasis. Instituto Nacional de Cancerología, México, 2007-2015

Notas: Núm. observaciones = 97; Núm. eventos = 36; razón de probabilidad X2 (9)= 24.37; log de la probabilidad = -124.27; prob > X2 = 0.0037. Diagnóstico:Harrel´s C: 75.26.
SNC: sistema nervioso central
IHQ: inmunohistoquímica
RH: receptores hormonales
HER2: receptor 2 del factor de crecimiento humano epidérmico
HR: hazard ratio
SBR: escala de Scarff-Bloom-Richardson
IC: intervalo de confianza
Veintidós pacientes (17.6%) se mantuvieron vivas por más de 18 meses posterior al diagnóstico de metástasis al SNC; de éstas, 11 (50.0%) presentaron subtipo HER2+, y cinco, luminal. Diecisiete (77.3%) fueron diagnosticadas en etapas localmente avanzadas, y 14 (63.6%) eran menores de 50 años al diagnóstico. Todas fueron sometidas a cirugía de mama y recibieron quimioterapia previa al desarrollo de metástasis; 18 (81.8%) tratamientos se basaron en antraciclinas y taxanos, más trastuzumab en el caso de HER2+ y triple positivos.
Discusión
Este estudio constituye una de las primeras evidencias en México para conocer los factores pronóstico en pacientes con cáncer de mama metastásico al SNC como primer sitio. El grupo de pacientes presentó una supervivencia global de 14 meses, y la supervivencia a un año fue de 60%, con una mediana de seguimiento de 29.6 meses. Presentar tumor TN es de los principales factores de mal pronóstico, ya que ello incrementa el riesgo de morir asociado con metástasis cerebral.
La supervivencia al cáncer de mama ha incrementado al paso de los años debido a múltiples factores, principalmente al avance en los tratamientos oncológicos, los programas de detección temprana y los cambios en el estilo de vida.22,23 Sin embargo, la incidencia de metástasis al SNC ha aumentado durante las últimas décadas; ello se explica parcialmente por la mejoría en las herramientas para su detección, el aumento en los casos de cáncer o el uso de tratamientos que, al prolongar la supervivencia, favorecen la aparición de este tipo de metástasis.11 Aunque los estudios sobre la población con cáncer de mama y metástasis al SNC son limitados, se han identificado varios factores pronósticos, principalmente relacionados con el estado funcional. Una calificación en Karnofsky ≤70 al diagnóstico, por ejemplo, se ha asociado con un mayor riesgo de muerte por metástasis al SNC.8,11,15,24
Los resultados del presente estudio son similares a los datos publicados previamente por Anders y colaboradores 25 pues, según los resultados de su trabajo, las metástasis al SNC se presentan principalmente en mujeres que fueron diagnosticadas en etapas localmente avanzadas y con subtipos luminal y TN. En ese mismo trabajo, el tratamiento con QT fue administrado a 89% de las pacientes, en comparación con 99% de este estudio. Es de destacar el tiempo de supervivencia global previamente notificado por los autores mencionados, con una mediana de ocho meses, en comparación con los 14 meses de esta investigación. Sin embargo, las medianas de supervivencia suelen ser menores en otros estudios que han valorado la presencia de metástasis al SNC (≤6 meses);24 ello concuerda con la evidencia de que las pacientes con tumores TN presentan las medianas de supervivencia más bajas y un riesgo de morir superior a dos, en comparación con los demás subtipos (IC95% 1.33-3.96; p=0.003).25 En una revisión, Tabouret y colaboradores11 identificaron que la supervivencia es diferente y depende del grupo específico de pacientes de acuerdo con la clasificación IHQ; asimismo, que las más afectadas son las pacientes con tumores TN (mediana de supervivencia de 4.9 meses).11 En la serie de la presente investigación, la mediana de supervivencia para este grupo de mal pronóstico fue de 8.8 meses. Igualmente, se ha observado que los tumores HER2+ tienen un curso más benévolo, pues casi triplican la mediana de supervivencia en comparación con las mujeres con tumores TN; la serie mencionada confirmó dicha observación, ya que la población HER2+ y triple positivo tuvieron 26.9 y 16.6 meses de supervivencia, respectivamente. Lo anterior probablemente está relacionado con la existencia de mejores opciones de tratamiento y el acceso a terapias anti-HER2 en el contexto neo/adyuvante y paliativo que brinda el esquema del Seguro Popular.8,15,26,27
Publicaciones recientes indican que el peor pronóstico de los pacientes TN puede deberse a una mayor expresión del receptor activador del factor nuclear k B (RANK) y del ligando de receptor del factor nuclear k B (RANKL), al presentar una menor supervivencia global y una menor supervivencia con metástasis,28 bajo el entendido de que la proteína promueve la progresión y la metástasis del cáncer de mama.29
En el presente estudio la edad al diagnóstico no mostró asociaciones significativas. Sin embargo, se ha notificado que a edades menores de 40 años se incrementa el riesgo de muerte por sufrir metástasis al SNC, independientemente del subtipo biológico (IHQ).30 Lo anterior puede deberse al número reducido de pacientes menores de 40 años que presentaron metástasis al SNC (24%); este planteamiento es similar al que se hace en el estudio de Harputluoglu y colaboradores,31 donde ésta no se asoció con la supervivencia.
Diversos trabajos han profundizado en el tipo de tratamiento posterior a la metástasis, como es el caso de la radioterapia holoencefálica.32 En este caso, el índice de Karnofsky, la presencia de metástasis extracraneales y la clasificación IHQ son factores pronósticos; así, se ha documentado que, posterior al tratamiento, la mediana de supervivencia es de únicamente 5.2 meses.32
Kühnöl y colaboradores 33 estudiaron el papel de los tratamientos posterior a la metástasis cerebral en pacientes con cáncer de mama, y demostraron que la radioterapia afecta positivamente el tiempo de supervivencia (p=0.030), mientras que la QT y la cirugía no muestran asociaciones estadísticamente significativas.33 En relación con la QT se sabe que ofrece beneficios limitados dada la pobre penetración que tiene a través de la barrera hemato-encefálica; se vuelve una opción terapéutica cuando las metástasis al SNC son progresivas o cuando la radioterapia deja de ser una opción.34 Una limitante del presente estudio es que, al momento, no se cuenta con la información terapeútica posterior a la aparición de la metástasis.
Es poco común una supervivencia mayor a 18 meses posterior al diagnóstico de metástasis cerebral. De manera similar con lo que afirma el estudio de Altundag y colaboradores,12 18% de las pacientes sobrevive con metástasis más de año y medio. A diferencia de lo encontrado en este trabajo, ellos identificaron que la mayoría de estas pacientes presenta subtipo luminal o triple positivo (30%); además, fueron diagnosticadas en etapas tempranas, y tenían, en el momento del diagnóstico de cáncer de mama, más de 50 años.12 En tanto, en la presente investigación se identificó que 50% de las mujeres incluidas en el análisis eran HER2+; 64%, menores de 50 años, y que 77% se presentaron con una etapa localmente avanzada.
Una limitante adicional de este estudio es que menos de 20% de los expedientes de las pacientes incluidas contaban, al diagnóstico, con la evaluación de Karnofsky o escala ECOG, por lo que fue imposible realizar alguna comparación con estos factores pronósticos. No obstante, ello sirve de experiencia para enfatizar la evaluación funcional de las pacientes al momento de ser diagnosticadas, dentro de la buena práctica clínica.
Por sus pocas opciones de tratamiento, las metástasis al SNC continúan siendo un factor de mal pronóstico que, independientemente de la disminución en la supervivencia, afectará de manera negativa la calidad de vida de las pacientes. Es necesario establecer sistemas de vigilancia enfocados en las pacientes con cáncer de mama para identificar manifestaciones clínicas neurológicas tempranas durante su seguimiento. En particular, durante los primeros tres años es recomendable desarrollar modelos de riesgo que puedan detectar a pacientes con alto riesgo de desarrollar metástasis al SNC; asimismo, realizar una revisión sistemática de los esquemas terapéuticos, sobre todo de la radioterapia de carácter paliativo y haciendo hincapié en el subtipo triple negativo, ya que esto conlleva un peor pronóstico.











 nueva página del texto (beta)
nueva página del texto (beta)


