La Fiebre maculosa de las Montañas Rocosas (FMMR) es la más letal de las infecciones del grupo de las fiebres manchadas.1 Es un padecimiento endémico en diversos países del continente americano.2 Su presencia se asocia con las garrapatas, que viven en climas cálidos.3 En México, esta enfermedad ocurría en el norte del país hasta las décadas de los cuarenta y cincuenta.4 Por razones desconocidas, hubo un registro aislado de casos hasta comienzos de la década pasada cuando se documentó su presencia en Sonora y otros estados del país.5-7
La FMMR es una enfermedad reemergente en Sonora, al noroeste de México, así como en otras regiones del país,8 con una creciente incidencia y elevada letalidad. En México se transmite por la mordedura de la garrapata Rhipicephalus sanguineus, parásito común en los perros.9 La garrapata transmite la bacteria Rickettsia rickettsii, y tras un periodo de incubación que oscila entre 2 y 14 días, ocasiona un cuadro agudo, inespecífico en su comienzo, que si no es diagnosticado y tratado oportunamente con doxiciclina puede ser fatal.10,11
En Sonora ocurren unos 100 casos cada año, con conglomerados aislados en localidades rurales y urbanas del estado.5 Aunque el padecimiento ocurre a cualquier edad, es particularmente grave en niños menores de 10 años.12 La letalidad observada en Sonora para la población general oscila entre 8 y 10%, pero se eleva hasta 30% en población pediátrica,13 una cifra que es superior a la reportada (2-7%) en áreas endémicas de Estados Unidos,14-16 pero similar a la de otras regiones latinoamericanas.17 Las condiciones de pobreza, las dificultad de acceso a los servicios de salud y los patrones culturales asociados con la migración y estilos de vida agravan la problemática sanitaria y, probablemente, incrementan el riesgo y vulnerabilidad de los sujetos expuestos a ambientes infestados por garrapatas.8
El abordaje de este padecimiento amerita intervenciones integrales a fin de reducir su carga de enfermedad y su nivel de mortalidad. Una de tales intervenciones es la capacitación del personal de salud y de la propia comunidad acerca de las características clínicas de los niños afectados, las complicaciones médicas asociadas con la virulencia de R. rickettsii y el comportamiento epidemiológico del evento. Por tal motivo, este estudio examina las características clínico-epidemiológicas y cuáles se asocian con el riesgo de muerte por FMMR en niños y adolescentes hospitalizados.
Material y métodos
Se llevó a cabo un estudio transversal en una serie consecutiva de pacientes hospitalizados, cuya edad osciló entre 1 y 18 años, ingresados a un hospital pediátrico de referencia de Sonora entre el 1 de enero de 2004 y el 30 de junio de 2015. Solamente fueron incluidos casos que recibieron el diagnóstico de egreso de fiebre maculosa de las Montañas Rocosas o fiebre maculosa no especificada, códigos A77.0 y A77.9, respectivamente, de la 10ma Revisión de la Clasificación Internacional de Enfermedades (CIE-10) de la Organización Mundial de la Salud. El Comité de Ética en Investigación del Departamento de Medicina y Ciencias de la Salud de la Universidad de Sonora aprobó los procedimientos de la investigación.
Considerando las dificultades para corroborar el padecimiento mediante pruebas de laboratorio y que su diagnóstico se sustenta en la sospecha clínica, los sujetos fueron incluidos si la enfermedad fue confirmada mediante la titulación de anticuerpos IgM ≥ 1:64 y/o IgG ≥1:320 contra R. rickettsii en una muestra sanguínea única examinada por inmunofluorescencia indirecta (IFI), el método estándar para confirmar casos de FMMR, o si fue positiva en la prueba de Reacción en Cadena de Polimerasa, de acuerdo con protocolos y recomendaciones ya aceptadas.8,10 Además, se incluyó al sujeto si cumplió con los criterios clínicos y epidemiológicos registrados en los expedientes médicos pero que tuvo un resultado negativo por IFI, o si no hubo disponibilidad de la prueba de laboratorio.
Los datos fueron colectados de manera retrospectiva de los registros médicos. Se recabó información sociodemográfica, clínica y de laboratorio al ingreso hospitalario. Se buscó el tiempo transcurrido entre el inicio del padecimiento y el comienzo con doxiciclina e información sobre atención médica previa a la hospitalización. También se documentaron las complicaciones clínicas, particularmente la presencia de falla renal aguda, cuando se identificó incremento en el nivel de creatinina sérica por arriba del valor de corte para la edad (>0.9 mg/dL) empleado en la unidad hospitalaria; y de sepsis cuando se documentó hipotensión arterial, hubo evidencia de hipoperfusión tisular manifestada por oliguria, alteraciones del estado mental y/o pobre perfusión periférica, y se identificaron valores de procalcitonina sérica >0.5 ng/mL; cuando los valores fueron >10 ng/mL se le consideró como sepsis severa.18 Para fines de comparación, los casos fueron clasificados como fatales si el evento final fue la muerte, y no fatales cuando sobrevivieron a la enfermedad.
Se utilizó estadística descriptiva para caracterizar la distribución y las diferencias fueron evaluadas mediante prueba de ji cuadrada y T de Student o U de Mann-Whitney. Para estimar la tendencia de la enfermedad en los pacientes hospitalizados, se usó como numerador al total de defunciones y como denominador a la cobertura potencial de la población menor de 19 años de edad sin seguridad social. Esta estimación se hizo para el periodo 2004-2014. Para examinar la asociación entre variables clínicas y el riesgo de muerte, se empleó regresión logística multivariada. Las variables que tuvieron significancia estadística (p<0.05) en el análisis bivariado fueron retenidas mediante el procedimiento de eliminación en reversa (backward elimination) e incluidas en un modelo final multivariado, cuya significancia fue examinada mediante una prueba de ji cuadrada. Para estimar el exceso de riesgo de muerte, se calcularon razones de momios ajustadas (RMa) y su correspondiente intervalo de confianza al 95% (IC95%) para evaluar la significancia. Los datos fueron analizados con el paquete estadístico NCSS versión 9.0.20.
Resultados
Se estudió a 210 sujetos, 63 fueron casos fatales (30%). No se apreciaron diferencias en las variables sociodemográficas investigadas, pero 68% de los pacientes fueron menores de 10 años de edad. El promedio de edad en años de toda la muestra fue de 6.5±0.3; los que fallecieron fueron menores (5.0±0.5, rango de 1.1, 12.1) que los sobrevivientes (7.2±0.3, rango de 1.3, 17.1) [p=0.003]. Noventa por ciento de los sujetos tuvo una historia de contacto con garrapatas.
Únicamente en 15.7% de los pacientes se sospechó de fiebre maculosa en su primer contacto con un médico (Cuadro I).
Cuadro I Características epidemiológicas seleccionadas en niños con fiebre maculosa de las Montañas Rocosas. Sonora, México, 2004-2015
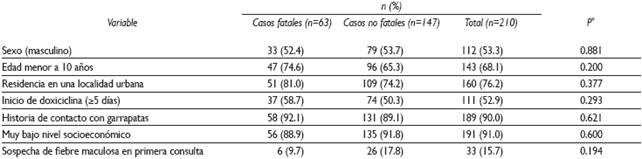
* Basada en una prueba exacta de Fisher
En el periodo se apreció una tendencia ascendente tanto en la morbilidad como en la mortalidad de pacientes hospitalizados, pues la incidencia pasó de 19.7 a 125.1 por millón, y la mortalidad aumentó de 3.3 a 23.3 por millón de habitantes (Figura 1). En general, la letalidad también mostró un incremento consistente, pasando de 16.7% en 2004 a 28.6% en 2014.
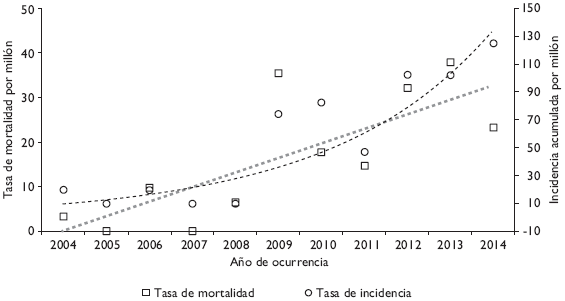
Figura I Incidencia y mortalidad de la fiebre maculosa en niños hospitalizados de Sonora, México. 2004-2014
Respecto de las características clínicas, se observó que los pacientes acudieron a consulta médica al segundo día de evolución y fueron enviados a un hospital de referencia tras 5.2 días de progreso de la enfermedad. La doxiciclina se comenzó al sexto día, tanto en los individuos que fallecieron (6.3±0.3) como en los sobrevivientes (6.1±0.7). El padecimiento pudo ser confirmado por estudios de laboratorio en 148 (70.5%) sujetos, aunque fue menor la proporción (52.4%) en los pacientes fatales que en los no fatales (78.2%) [p<0.001]. Los síntomas y signos más frecuentemente reportados fueron la fiebre (99.5%), exantema (96.1%) y cefalea o irritabilidad (81.9%); el exantema fue petequial en 88% de los pacientes e involucró característicamente palmas y plantas. La presencia de sepsis severa fue más frecuente (52.4%) en los casos fatales que en los no fatales (23.8%) (p<0.001); lo mismo ocurrió con la falla renal aguda (p<0.001) que se observó en 60.3% de los pacientes que murieron y en 10.2% de los sobrevivientes (Cuadro II).
Cuadro II Características clínicas al momento de la admisión hospitalaria en niños con fiebre maculosa de las Montañas Rocosas. Sonora, México, 2004-2015
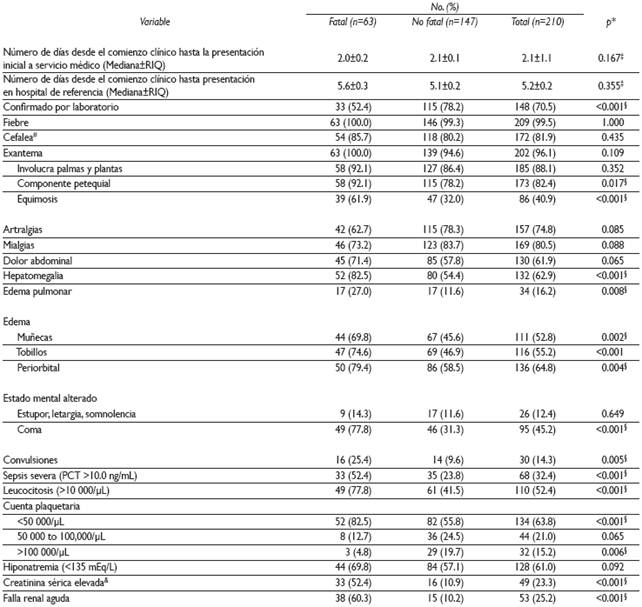
* Basada en una prueba exacta de Fisher
‡ Basada en una prueba de U de Mann-Whitney. RIQ=Rango inter cuartil
§ Estadísticamente significativa al 95% de confianza
# Considerado como irritabilidad en los niños menores de dos años de edad
& Nivel de creatinina plasmática arriba del punto de corte (0.9 mg/dL)
Respecto de los datos de laboratorio, la cuenta leucocitaria promedio (15.6±1.3) de los casos fatales fue superior (p<0.001) a la de los no fatales (8.8±0.7). Otro dato relevante fue la presencia de trombocitopenia (μL), con una media de 33.5±5.6, pero fue más baja (17.4±5.3) en las defunciones que en los sobrevivientes (44.0±7.3). También destacó la ocurrencia de hiponatremia (meq/L) tanto en los que fallecieron (130.6±0.8) como en los no fatales (133.2±0.4) (Cuadro III).
Cuadro III Hallazgos de laboratorio en niños con fiebre maculosa de las Montañas Rocosas. Sonora, México, 2004-2015
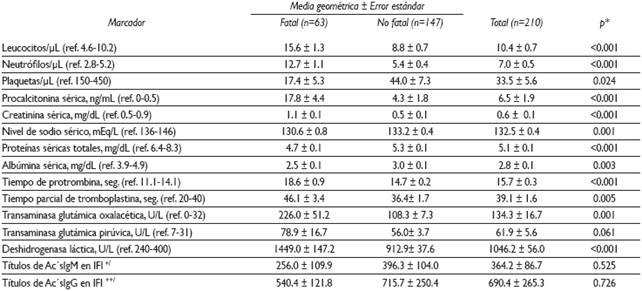
* Basada en una prueba de T
‡ Títulos de inmunoglobulina M en prueba de inmunofluorescencia indirecta [Casos fatales=32; Casos no fatales=92]
§ Títulos de inmunoglobulina G en prueba de inmunofluorescencia indirecta [Casos fatales=23; Casos no fatales=89]
Por otra parte, no hubo asociación significativa con variables sociodemográficas como localidad de residencia, pertenencia a algún grupo étnico, condición socioeconómica ni antecedentes de contacto con garrapatas. En el análisis multivariado, tres variables mantuvieron una relación significativa: la ocurrencia de falla renal aguda, con una RMa de 8.79, IC 95% (3.4622.33); la presencia de sepsis severa [RMa=3.71, IC95% (1.44-9.58)] y el retraso en el inicio de la doxiciclina [RMa=2.95, IC95% (1.10-7.95)] (Cuadro IV).
Cuadro IV Predictores de mortalidad en niños hospitalizados por fiebre maculosa de las Montañas Rocosas. Sonora, 2004-2015. Resultados de la regresión logística multivariada*
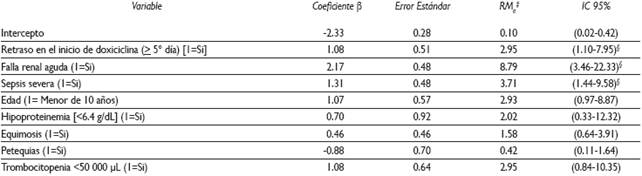
* La significancia del modelo final fue examinada por Log Likelihood [-66.36229]. R2 del modelo = 0.50224
‡ RMa=Razón de momios ajustada tomando en cuenta todas las variables incluidas en el modelo final
§ Estadísticamente significativos al 95% de confianza
Discusión
El presente estudio muestra que la fiebre maculosa de las Montañas Rocosas provoca una elevada letalidad en población pediátrica hospitalizada, pues tres de cada diez sujetos hospitalizados murieron a consecuencia de la enfermedad. La letalidad observada es similar a la de otros reportes17,19 pero superior a la de regiones endémicas de Estados Unidos.14,16 La elevada frecuencia de resultados fatales es atribuida principalmente al retraso del diagnóstico y al comienzo tardío (≥ 5 días) de la doxiciclina,8,10 provocando un incremento de costos económicos y sociales20 lo que ha sido asociado con desconocimiento del personal médico acerca del perfil clínico de la enfermedad.21,22
La sospecha temprana de la FMMR constituye un desafío médico, ya que el cuadro clínico puede imitar padecimientos endémicos como el dengue, paludismo y hepatitis virales,23,24 así como ser enmascarado por coinfecciones que agravan las condiciones de los sujetos.25 Por ello, el personal de salud debe familiarizarse con manifestaciones clínicas de la FMMR como la fiebre, la cefalea o irritabilidad y el exantema petequial que característicamente involucra a palmas y plantas, aunque esto puede indicar que la enfermedad fue tardíamente sospechada.26,27 La presencia de sepsis, alteraciones neurológicas, hepáticas y renales son frecuentes en pacientes críticos que reciben tratamiento tardíamente.8,10,17,26
Es necesario que los médicos consideren FMMR en cualquier niño o adolescente que solicite atención debido a fiebre persistente (≥48 horas) que no responde a los antibióticos convencionales y con una historia de exposición a garrapatas.15,28-30 Es decir, debe evaluarse cuidadosamente el entorno socioeconómico del paciente y buscar antecedentes que puedan orientar al médico a la sospecha temprana.8
Aunque idealmente la FMMR debe corroborarse mediante pruebas de laboratorio, su diagnóstico aún se basa en la sospecha clínica, pues la confirmación por IFI es tardía para guiar el manejo médico31,32 y no debe utilizarse como sustento para iniciar el tratamiento con doxiciclina.10 Técnicas más precisas y de mayor rapidez como la prueba de reacción en cadena de polimerasa (PCR),32 mejor si se asocia con inmunohistoquímica,33 así como la PCR en tiempo real, incrementan la oportunidad diagnóstica pero aún no son de uso extendido.34
Al respecto, una limitación del presente estudio es que solamente obtuvimos evidencia serológica de infección por R. rickettsii en 70% de los pacientes, lo que pudo sobrestimar el diagnóstico de la enfermedad. Tampoco se exploraron las condiciones inmunológicas de los pacientes, lo que pudiera generar un sesgo en la estimación de la letalidad; futuros estudios pueden examinar el papel del estado inmunitario, enzimático y de micronutrientes en el resultado final de la enfermedad. Adicionalmente, los hallazgos clínicos que se identificaron son únicamente de pacientes hospitalizados, lo que introduce un sesgo de selección que puede sobrestimar los resultados, por lo que no pueden ser trasladados a la población general.
Por otra parte, los hallazgos de laboratorio son poco específicos, aunque algunos de ellos son relativamente frecuentes y pueden orientar a la sospecha diagnóstica. La trombocitopenia es un dato muy recurrente, que es consecuencia del secuestro plaquetario y su destrucción en la microcirculación.11 En nuestra serie, la media de plaquetas/μL fue inferior a 50 000 en dos tercios de los pacientes y ocurrió en 8 de cada 10 casos fatales, una proporción superior a un estudio de Walker.35 El hallazgo es importante pues su presencia se relaciona con el desarrollo de falla renal aguda, así como con deterioro neurológico, e indica la severidad de la vasculitis que ocurre en pacientes hospitalizados.36
Otro dato importante es la elevación de la creatinina sérica como un indicador de una fase avanzada de la enfermedad.35,36 Aunque se ha señalado que la cuenta leucocitaria no es útil para diferenciar FMMR de otras condiciones,11 se aprecia que la leucocitosis a expensas de neutrofilia fue significativamente más frecuente en los casos fatales que en los sobrevivientes, lo que pudo estar relacionado con el estado séptico de 52% de los pacientes que murieron.
Respecto de los factores asociados con la mortalidad por FMMR, se corroboró que el principal es el retraso (≥ 5 días) en el inicio de la doxiciclina que fue tres veces más frecuente en los niños que murieron, lo que puede ser un indicador indirecto de calidad de atención médica.37,38 Mientras, el desarrollo de falla renal aguda (FRA) fue el predictor más poderoso, pues el riesgo de muerte fue nueve veces mayor en los que presentaron FRA. Este hallazgo es consistente con reportes previos27,35,36,39 por lo que debe ponerse especial cuidado al comportamiento de biomarcadores y datos clínicos que sugieran FRA en niños hospitalizados por FMMR. La presencia de FRA se asocia con el retraso en el tratamiento antimicrobiano específico, y es resultado de las alteraciones en la permeabilidad capilar inducidas por R. rickettsii35,36,39 de modo que esta complicación puede evitarse con la sospecha diagnóstica temprana. Finalmente, la presencia de sepsis incrementó casi cuatro veces la probabilidad de muerte en los niños hospitalizados por FMMR. Al respecto, la ocurrencia de sepsis en pacientes con FMMR ha sido ya señalada y debe considerarse cuidadosamente cuando existe el antecedente de casos previos por R. rickettsii en una determinada región geográfica.40
Conclusión
La FMMR es una enfermedad reemergente en Sonora, con un número creciente de niños y adolescentes hospitalizados, así como con una elevada letalidad si no se prescribe oportunamente el uso de doxiciclina. Sus manifestaciones clínicas principales son fiebre, cefalea y exantema, pero son poco específicas y son comunes a diversos padecimientos endémicos de la región, por lo que su sospecha temprana debe sustentarse, adicionalmente, en criterios epidemiológicos. El retraso ≥5 días del inicio del tratamiento con doxiciclina después del comienzo sintomático se asocia con complicaciones fatales como la sepsis y la falla renal aguda, que son dos predictores de la mortalidad en niños infectados por R. rickettsii.











 nova página do texto(beta)
nova página do texto(beta)


