Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Salud Pública de México
versión impresa ISSN 0036-3634
Salud pública Méx vol.57 no.5 Cuernavaca sep./oct. 2015
Artículo original
Evaluación de un panel reducido de cepas de leptospiras para el diagnóstico en humanos por microaglutinación (MAT)
Evaluation of a reduced panel of leptospira strains for microagglutination
Paulina Jacob, L en Biot,(1) María F Schmeling, MSc,(1) Yosena T Chiani, MSc,(1) Noelia Y Landolt, Bioq,(1) Exequiel Scialfa, D en CA,(2) Silvia Fusco, Bioq,(3) Bibiana Vanasco, D en C.(1,4)
(1) Laboratorio de Leptospirosis. Instituto Nacional de Enfermedades Respiratorias, Dr. E. Coni, Administración Nacional de Laboratorios e Institutos de Salud, Dr. Carlos G. Malbrán. Santa Fe, Argentina.
(2) Departamento de Zoonosis Rurales. Buenos Aires, Argentina.
(3) Laboratorio Central de la Provincia de Santa Fe. Santa Fe, Argentina.
(4) Facultad de Bioquímica y Ciencias Biológicas de la Universidad Nacional del Litoral. Santa Fe, Argentina.
Resumen
Objetivo. Evaluar si el uso del panel de 19 cepas de leptospiras, sugerido por la Sociedad Internacional de Leptospirosis para la microaglutinación (MAT, por sus siglas en inglés), permite mayor confirmación de casos que el de 12 cepas.
Material y métodos. Estudio observacional de corte transversal. Se estudiaron 441 muestras de sueros de pacientes de Argentina, derivadas para el diagnóstico de leptospirosis en los periodos de julio de 2009 a diciembre de 2010 y enero a octubre de 2013.
Resultados. Se obtuvo el mismo resultado con el panel reducido que con el ampliado. En seis casos resultó presumiblemente infectante algún serovar del panel ampliado, aunque siempre coaglutinando con cepas del reducido.
Conclusión. En Argentina, el diagnóstico de leptospirosis por MAT podría continuar realizándose con el panel reducido, lo que reduciría el costo y tiempo de diagnóstico. La información adicional que aportaría el panel ampliado está relacionada con la epidemiología, mediante un mejor conocimiento del serogrupo presumiblemente infectante.
Palabras clave: leptospirosis; microaglutinación; serovares; Argentina.
Abstract
Objective. To evaluate if the use of the 19 Leptospira strains panel suggested by the International Leptospirosis Society of World Health Organization for microagglutination allows confirmation of more cases that the 12 strains panel used in Argentina.
Materials and methods. Cross-sectional observational study. We studied 441 serum samples corresponding to Argentinean patients with suspected leptospirosis derived during from July to December, 2009 and from January to October, 2013.
Results. The same number of positive samples was obtained using the MAT with the 19 or 12 strains. In six cases a serovar of the expanded collection was presumably infecting, but always coagglutinated with strains of the reduced panel.
Conclusion. In Argentina, the diagnosis of leptospirosis by MAT could be made using the reduced 12 strains panel, obtaining the same result in case detection as using the 19 strains panel. Additional information provided by the use of all strains could be the presumably infecting serogroup.
Key words: leptospirosis; microscopic agglutination test (MAT); serovars; Argentina.
La leptospirosis es una zoonosis de distribución universal, causada por la infección con especies patógenas de Leptospira spp. Pequeñas variaciones en las cadenas polisacarídicas del lipopolisacárido (LPS) de este microorganismo determinan la existencia de más de 200 serovariedades (serovares) patógenas, las cuales se agrupan en 24 serogrupos según las similitudes antigénicas.1,2 El espectro de la enfermedad humana es extremadamente amplio, ya que puede ocasionar desde una infección subclínica hasta un síndrome grave de infección multiorgánica con alta mortalidad.2,3
El patrón de oro para conocer las variedades infectantes es el aislamiento bacteriano a partir del cultivo de muestras de sangre. Sin embargo, ésta es una técnica poco sensible y difícil de poner en práctica debido a que debe realizarse durante los cinco días posteriores al comienzo de los síntomas, cuando las leptospiras aún se encuentran en sangre.2,4 El diagnóstico mediante esta técnica es lento, ya que el cultivo necesita de, al menos, 13 semanas de observación para poder ser descartado como negativo.2,3 Además, presenta otras limitaciones como la necesidad de medios de cultivo especializados, que son más costosos que los métodos tradicionales, y personal entrenado y capacitado para leer e interpretar los resultados ya que la presencia de contaminaciones es muy frecuente.2 Por estas razones, la mayoría de los casos humanos de leptospirosis en Argentina y en el mundo son detectados mediante técnicas serológicas.3
Las pruebas serológicas más utilizadas para el diagnóstico de leptospirosis son, como tamizaje, los enzinmunoensayos (ELISA, por sus siglas en inglés) IgG e IgM y la aglutinación macroscópica con antígeno termorresistente (TR);5,6 la técnica serológica confirmatoria de referencia internacional es la aglutinación microscópica con antígenos vivos (MAT, por sus siglas en inglés).2,3 La mayor ventaja de este método es que presenta alta especificidad, porque se trata de una prueba serogrupo específica. Sin embargo, la capacidad de estimar el serogrupo infectante según los títulos de las muestras en fase convaleciente puede ser baja, como de 40%.3 Sin embargo, es un test poco sensible en muestras tempranas (menores a cinco días de evolución) y tiene ciertas limitaciones, como la dificultad de estandarización, el uso de un amplio número de cepas y el mantenimiento de las mismas en óptimas condiciones. Además, presenta subjetividad en la interpretación de los resultados debido a la posibilidad de coaglutinaciones (reacciones paradojales entre serogrupos), a la existencia de un nivel basal de anticuerpos por infecciones pasadas, o a reacciones cruzadas con otras enfermedades.3,7 Además, la confirmación del diagnóstico requiere, la mayoría de las veces, muestras de suero pareadas.7,8
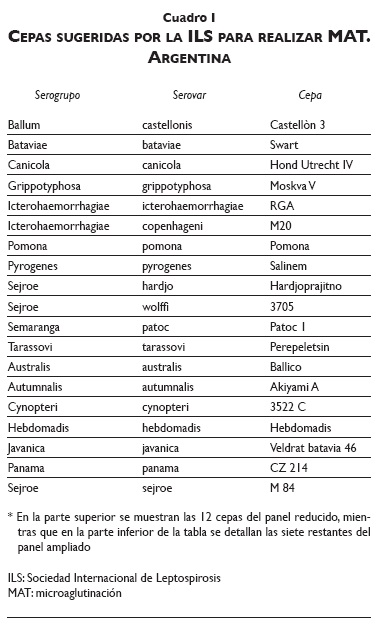
Para la realización de la MAT, la Sociedad Internacional de Leptospirosis de la Organización Mundial de la Salud (WHO-ILS, por sus siglas en inglés) publicó una guía de diagnóstico y control de leptospirosis en 2003, en la que sugiere la utilización de 19 cepas en el panel de antígenos.7 Entre éstas incluye una cepa no patógena (Patoc), con el fin de detectar casos por reacciones cruzadas con aquellos serovares que pueden no estar representados en el panel utilizado, al compartir antígenos de superficie con especies patógenas.9 Sin embargo, para agilizar el diagnóstico, reducir costos y facilitar el manejo y mantenimiento del panel utilizado en la MAT de rutina, la mayoría de los laboratorios de Argentina utilizan 12 de las 19 cepas sugeridas por la ILS (cuadro I), las cuales, según estudios anteriores, son de mayor circulación en el país.10,11 En primer lugar, en un trabajo realizado por Vanasco y colaboradores en 2008 con muestras de todo el país, los serogrupos presumiblemente infectantes fueron Icterohaemorrhagiae (31%), Pomona (15%), Ballum (14%), Canicola (10%), Sejroe (4%) y Tarassovi (2%).10 En otro trabajo realizado por Scialfa y colaboradores en la provincia de Buenos Aires, los serogrupos más reactivos fueron Canicola, Sejroe y Ballum durante el periodo 2000-2009.11 En el periodo 2000-2012, en el laboratorio de leptospirosis de la División Zoonosis Rurales, los casos humanos reaccionaron frente a los siguientes serogrupos: Canicola (21.5%), Sejroe (11.6%), Ballum (10.4%), Pomona (9.9%), Pyrogenes (9.7%), Icterohaemorrhagiae (9%), Grippotyphosa (8.9%), y Tarassovi (7.7%).11 En ambos trabajos, el porcentaje restante fue de coaglutinaciones (24% y 11.3%, respectivamente) por lo que no fue posible detectar el serogrupo presumiblemente infectante en ninguna de ellas.
El objetivo de este estudio retrospectivo fue evaluar el uso del panel de 19 cepas en la microaglutinación (MAT) sugerido por la Sociedad Internacional de Leptospirosis (ILS) y comparar el resultado con el obtenido a través del uso del panel de 12 cepas actualmente empleado en Argentina.
Material y métodos
Se realizó un estudio observacional de corte transversal en dos etapas. En la primera, se seleccionaron prospectivamente muestras de sueros correspondientes a pacientes con sospecha de leptospirosis derivadas para su diagnóstico a tres laboratorios de Argentina durante el periodo de julio de 2009 a diciembre de 2010 (18 meses). En la segunda, se seleccionaron retrospectivamente sólo muestras del Instituto Nacional de Enfermedades Respiratorias (INER) Dr. E. Coni, pertenecientes al año 2013. El estudio fue aprobado por el Comité de Ética de la Facultad de Bioquímica y Ciencias Biológicas de la Universidad Nacional del Litoral (FBCB-UNL).
Definiciones de caso
En ambas etapas se utilizó la definición de caso empleada por el Ministerio de Salud de la Nación en el Sistema de Vigilancia Laboratorial (Sivila):
Caso sospechoso: enfermo febril agudo, con cefaleas, mialgias, en ausencia de síntomas en vías aéreas superiores, con epidemiología compatible. Puede presentar además ictericia, meningitis, nefropatía, neumonía, hemorragias.
Caso probable: todo caso sospechoso sumado a:
• Un resultado reactivo para estudios realizados por las pruebas de tamizaje de macroaglutinación (antígeno TR) y/o ELISA IgG o IgM.
• Un resultado reactivo para la prueba de referencia: microaglutinación (MAT) con título menor a 1:200 en una única muestra.
Caso confirmado: caso sospechoso sumado a:
• En una única muestra: MAT positivo a un título mayor o igual a 200, aislamiento bacteriano y/o detección de genoma bacteriano por PCR.
• En dos o más muestras de al menos siete días de evolución de diferencia: Seroconversión a la MAT, 1º muestra negativa y 2º positiva, o ambas muestras positivas con diferencia de al menos 2 títulos entre ellas (directa o inversa).12
Selección de muestras de la primera etapa
Los tres laboratorios participantes fueron el Laboratorio de Zoonosis Rurales (Azul, Provincia de Buenos Aires), el Laboratorio Central de la Provincia de Santa Fe –ambos seleccionados por estar localizados en las provincias con mayores tasas de prevalencia de la enfermedad– y el Laboratorio Nacional de Referencia de Leptospirosis del INER de la ciudad de Santa Fe, que recibe muestras del país.
En esta etapa, las muestras se seleccionaron a partir de un protocolo definido al comienzo de la investigación (julio de 2009). Dado que no se contaba con datos exactos acerca de la incidencia de leptospirosis en Argentina y a fin de poder incluir todos los meses del año en el estudio, se calculó el número de muestras mínimo que cada laboratorio recibía por mes considerando la demanda diagnóstica de los cinco años anteriores (2004-2008), de acuerdo con lo que informó cada responsable de laboratorio.
El número calculado fue de siete muestras mensuales, que debían seleccionarse al final de cada mes según el protocolo definido. Como primera condición, éstas debían ser segundas muestras con resultados de TR positivo. Luego, tres de ellas debían tener resultado de MAT positivo y cuatro, negativo (con panel reducido). Las muestras TR positivo se seleccionaron debido a que presentan más días de evolución y, por lo tanto, mayor probabilidad de poseer anticuerpos. A su vez, las muestras MAT negativo fueron incluidas para detectar posibles falsos negativos mientras que las MAT positivo, para evaluar si alguna de las siete cepas adicionales del panel ampliado actuó como presumiblemente infectante.
En los meses en los cuales los laboratorios recibieron menos de siete segundas muestras TR positivo, se seleccionaron las que hubieran recibido en ese mes más el número necesario para completar las siete muestras mensuales, para lo cual se seleccionaron, en primer lugar, las segundas muestras con TR negativo; luego, primeras muestras con TR positivo, y por último, primeras muestras con TR negativo.
Las muestras seleccionadas fueron conservadas en refrigeración a -20 ºC hasta la finalización del estudio. En ese momento se les realizó MAT con panel ampliado a todas ellas.
Selección de muestras de la segunda etapa
Como la epidemiología de la enfermedad es variable y el padrón de leptospiras circulantes puede cambiar a través del tiempo, se realizó una segunda prueba.
El criterio de selección en esta etapa fue diferente, principalmente debido a que, en 2012, se incorporó la técnica de tamiz ELISA IgM, la cual presenta mayor sensibilidad que el TR.13 Se seleccionaron todas las muestras recibidas de enero a octubre de 2013 que tuvieran más de cinco días de evolución –debido a que es entonces cuando los anticuerpos comienzan a detectarse por MAT,3,13,14 que hubieran tenido resultado positivo al ELISA IgM y con MAT negativa, o positiva con títulos menores a 1/200 (casos probables). En esta etapa, al igual que en la primera, el resultado de MAT tomó como base la técnica con panel reducido.
Microaglutinación con antígenos vivos (MAT)
Se realizó la MAT con el panel sugerido por la ILS de 19 cepas de acuerdo con el protocolo descrito por Faine a todas las muestras seleccionadas según los criterios detallados anteriormente.14 Para facilitar la interpretación de los resultados, se definió como "panel reducido" el de las 12 cepas utilizadas en la MAT de rutina, y como "panel ampliado" (cuadro I) el sugerido por la ILS de 19 cepas.
La MAT se consideró reactiva a partir del título de corte 1:50.* Luego, se realizaron diluciones en los sueros reactivos seriadas a fin de determinar el título de anticuerpos antileptospiras.15,16 Aquellas muestras con títulos 1:200 o mayores se consideraron casos confirmados, tal como se definió en el punto anterior.
Se consideró como serogrupo presumiblemente infectante a aquél con el mayor título de anticuerpos en la MAT en relación con los otros serogrupos reactivos.3,14
Resultados
Selección de muestras
En la primera etapa, de julio de 2009 a diciembre de 2010, se recibieron, entre los tres laboratorios, 2775 muestras para el diagnóstico de leptospirosis humana. De éstas, según el criterio, fueron seleccionadas 378 muestras: 200 primeras y 178 segundas. Hubo 11 pacientes de los cuales se seleccionaron las dos muestras, por lo tanto, el total de pacientes fue 367. Entre las primeras muestras, resultaron seleccionadas 38 muestras TR positivo (21 MAT positivo y 17 MAT negativo) y 162 TR negativo (2 MAT positivo y 160 MAT negativo); mientras que entre las segundas muestras, hubo 129 TR positivo (71 MAT positivo y 58 MAT negativo) y 49 TR negativo (1 MAT positivo y 48 MAT negativo). Es decir que en total se seleccionaron 95 muestras MAT positivas y 283 negativas.
En la segunda etapa del presente trabajo, se incluyeron 63 nuevas muestras ELISA IgM positivo de 717 recibidas en el INER durante 2013; de éstas, 41 eran primeras muestras (9 MAT positiva y 32 MAT negativa) y 22 eran segundas (8 MAT positiva y 14 MAT negativa). Hubo dos muestras seleccionadas pertenecientes al mismo paciente. Por lo tanto, en esta etapa, se seleccionaron 17 muestras positivas a la MAT y 46 negativas.
Microaglutinación
En la primera etapa, el total de muestras positivas a la MAT con panel reducido fue de 95 (25%), y el de negativas, de 283; los mismos números se obtuvieron con el panel ampliado. Es decir que, además de no haberse detectado nuevas muestras positivas a las ya seleccionadas, no hubo diferencias significativas entre ambos paneles (p<0.05). El número de casos confirmados fue 92, entre los que hubo tres con muestras pareadas.
En el cuadro II se muestra la reactividad de los sueros seleccionados en la primera etapa frente a cada serovar. Los más reaccionantes fueron Copenhageni en 68 casos (73.9%), Canicola en 62 (67.4%) y Wolffi en 58 (63.0%). El serovar Patoc (cepa saprófita) presentó aglutinación en los 92 casos. Además, los serovares Canicola y Copenhageni fueron presumiblemente los más infectantes pues resultaron serlo en 27 y 18 casos, respectivamente.
Por último, en la primera etapa hubo cinco casos en los cuales resultó ser presumiblemente infectante alguna de las siete serovariedades adicionales del panel ampliado. Serjroe/Serjroe lo fue en tres muestras y Cynopteri/Cynopteri en una, al igual que Autumnalis/Autumnalis (cuadro II). Sin embargo, en todos estos casos ocurrió coaglutinación con serovares del panel reducido en títulos iguales o mayores a 1:50 (cuadro III). Cabe aclarar que la reactividad de estas tres cepas del panel ampliado no significó la detección de más casos, sino que se trató de reacciones cruzadas entre serovares ya que todos ellos reaccionaron a serovares del panel reducido con títulos mayores a 1/200.
En la segunda etapa, de las 63 muestras seleccionadas, hubo 16 (25%) que tuvieron resultados de MAT positivos tanto con el panel reducido como con el ampliado; no hubo diferencias significativas entre la detección de casos, tal como ocurrió en la primera etapa (p<0.05). Hubo una muestra positiva a la MAT al momento de la selección que luego resultó negativa, lo que pudo ser consecuencia del congelamiento-descongelamiento de la misma.
Todas las muestras positivas reaccionaron al título de corte (1:50), con excepción de dos, pertenecientes al mismo paciente, cuyos títulos fueron mayores a 1:200. Esto ocurrió tanto con el panel reducido como con el ampliado. Por lo tanto, se detectó un solo caso confirmado, con títulos de 1/200 a la cepa Canicola/Canicola y 1/400 para Australis/Australis. Es decir que, al igual que en la primera etapa, no se obtuvieron más muestras MAT positivas por utilizar el panel ampliado; además, hubo un serovar del panel ampliado que resultó presumiblemente infectante (Australis), que coaglutinó con otros serovares del panel reducido.
Discusión
El panel reducido para la realización de la MAT fue seleccionado entre las 19 sugeridas por la ILS de modo que representara la mayor cantidad posible de serogrupos circulantes en Argentina según estudios anteriores10,11 y registros propios del INER no publicados. Los resultados del presente trabajo indican que, en Argentina y otros países con características epidemiológicas similares, el diagnóstico de leptospirosis por MAT podría continuar realizándose con el panel reducido aquí evaluado, y que con ello se obtendría el mismo resultado en cuanto a la detección de casos humanos que si se emplean las 19 serovariedades sugeridas por la ILS. El trabajo con un número menor de cepas acelera el diagnóstico, suma practicidad a la técnica y reduce el riesgo, para el laboratorista, de manipular y mantener un número menor de antígenos patógenos. Además, reduce los costos por utilizar menor cantidad, no sólo de reactivos específicos de la técnica, sino también del medio de cultivo empleado en el crecimiento y mantenimiento de las cepas.
La información adicional que aportaría el uso del panel ampliado es el conocimiento del serogrupo presumiblemente infectante, en el caso de que fuera una de las siete no incluidas en el panel reducido. Sin embargo, si bien esto es importante en el ámbito epidemiológico, debe considerarse que la capacidad de la MAT de estimar el serogrupo infectante es de 40% y que en la actualidad existen técnicas moleculares que caracterizan el organismo infectante de manera más específica,17,20 aunque aún están en desarrollo y optimización. Lo anterior significa que, mediante avances y perfeccionamiento de estas técnicas en el futuro, una combinación de MAT con panel reducido y biología molecular brindaría un diagnóstico más rápido, efectivo y específico.
En ambas etapas se observó que, además de no haberse detectado más casos por el uso del panel ampliado, el porcentaje de muestras reactivas a la MAT fue de 25%. Esto quiere decir que, independientemente del criterio de selección y de la técnica de tamizaje empleada durante la misma, los resultados fueron similares. Lo anterior deja ver que la selección de muestras en la primera etapa fue buena, a pesar de haber estado basada en estimaciones de años anteriores, ya que los resultados son comparables con los de la segunda etapa, en la cual, además se seleccionaron todas las muestras positivas a ELISA IgM, que es más sensible que el TR.21,22
Los resultados obtenidos en la primera etapa indican que los serovares más prevalentes de Argentina están representados en el panel reducido utilizado para el diagnóstico de leptospirosis en el país, lo que a su vez coincide con los últimos hallazgos de este mismo grupo de trabajo –algunos no publicados– en los cuales se observó que, tanto los aislamientos obtenidos de muestras humanas en el INER23 como las muestras de ADN tipificadas,24,25 están representados en el panel reducido de la MAT.
Debido a que la epidemiología de la leptospirosis y sus reservorios es variable, es posible, no sólo que cambie el patrón de leptospiras circulantes en el tiempo y espacio, sino también que surjan nuevas variedades. Por esta razón, resalta la importancia de este tipo de estudios, que permitirían la evaluación de la utilidad del panel de la MAT para diagnóstico con el fin de realizar modificaciones si fuera necesario. Como en los últimos años se ha incentivado el cultivo por parte del INER, se espera obtener y tipificar nuevos aislamientos, con el objetivo de monitorear el patrón de cepas circulantes en el país y, de esta manera, evaluar la incorporación de nuevas cepas al panel de la MAT para el diagnóstico de leptospirosis.
Referencias
1. González-Rodríguez A, Rodríguez-Jiménez Y, Batista-Santiesteban N, Valdés-Abreu Y, González-González M. Caracterización microbiológica de cepas candidatas vacunales de leptospira interrogans serogrupo Ballum. Rev Cubana Med Trop 2003;55:146-152. [ Links ]
2. Haake DA, Levett PN. Leptospirosis in humans. Curr Top Microbiol Immunol 2015;387:65-97. [ Links ]
3. Adler B, de la Peña-Moctezuma A. Leptospira and leptospirosis. Vet Microbiol 2010;140:287-296. [ Links ]
4. Bharti AR, Nally JE, Ricaldi JN, Matthias MA, Díaz MM, Lovett MA, et al. Leptospirosis: a zoonotic disease of global importance. Lancet Infect Dis 2003;3:757-771. [ Links ]
5. Mailloux M, Mazzonelli J, Dorta de Mazzonelli GT. Thermoresistant antigen in leptospires. Possibility of a macroscopic diagnosis of leptospirosis with a single antigen. Zentralbl Bakteriol Orig A 1974;229(2):238-241. [ Links ]
6. Vanasco NB, Lottersberger J, Schmeling MF, Gardner IA, Tarabla HD. Diagnóstico de leptospirosis: evaluación de un enzimoinmunoensayo en fase sólida en diferentes etapas de la enfermedad. Rev Panam Salud Publica 2007;21:388-395. [ Links ]
7. World Health Organization, International Leptospirosis Society. Human leptospirosis guidance for diagnosis, surveillance and control [documento en internet]. WHO, 2003. Disponible en: http://public.eblib.com/EBLPublic/PublicView.do?ptiID=753855 [ Links ]
8. Faine S. Leptospira and leptospirosis. Boca Ratón, EUA; CRC Press Inc, 1994:353. [ Links ]
9. Goris MGA, Leeflang MMG, Boer KR, Goeijenbier M, van Gorp E, Wagenaar JFP. Establishment of valid laboratory case definition for human leptospirosis. J Bacteriol Parasitol 2012;3:132. [ Links ]
10. Vanasco NB, Schmeling MF, Lottersberger J, Costa F, Ko AI, Tarabla HO. Clinical characteristics and risk factors of human leptospirosis in Argentina (1999-2005). Acta Trop 2008;107:255-258. [ Links ]
11. Scialfa E, Gallicchio O, Benitez M. Leptospirosis humana en la provincia de Buenos Aires, Argentina, periodo 2000-2009. Libro de resúmenes de la jornada del Congreso Internacional de Zoonosis y Enfermedades Emergentes, VII Congreso Argentino de Zoonosis. 8 a 10 de junio de 2011; Buenos Aires, Argentina. [ Links ]
12. Sistema de Vigilancia Laboratorial, Ministerio de Salud de la Nación. Leptospirosis: normativa y tutorial para la vigilancia a través del Sistema Nacional de Vigilancia Laboratorial (SIVILA-SNVS). Argentina, 2013 [ Links ]
13. Adler B, Murphy AM, Locarnini SA, Faine S. Detection of specific anti-leptospiral immunoglobulins M and G in human serum by solid-phase enzyme-linked immunosorbent assay. J Clin Microbiol 1980;11:452-457. [ Links ]
14. Faine S. Guidelines for the control of leptospirosis [documento en internet]. 1982. Disponible en: http://libdoc.who.int/offset/WHO_OFFSET_67_%28p1-p98%29.pdf [ Links ]
15. Comisión Científica Permanente sobre Leptospirosis, Buenos Aires, Asociación Argentina de Veteranos de Laboratorios de Diagnóstico (AAVLD). Manual de leptospirosis. Buenos Aires: AAVLD, 1994:36. [ Links ]
16. Comisión Científica sobre Leptospirosis, A. A. de V. de L. de D. (AAVLD). Informe sobre leptospirosis en la República Argentina 36. Buenos Aires: AAVLD, 2002. [ Links ]
17. Morey RE, Galloway RL, Bragg SL, Steigerwalt AG, Mayer LW, Levett PN. Species-specific identification of leptospiraceae by 16S rRNA gene sequencing. J Clin Microbiol 2006;44:3510-3516. [ Links ]
18. Majed Z, Bellenger E, Postic D, Pourcel C, Baranton G, Picardeau M. Identification of variable-number tandem-repeat loci in leptospira interrogans sensu stricto. J Clin Microbiol 2005;43:539-545. [ Links ]
19. Cerqueira GM, Picardeau M. A century of leptospira strain typing. Infect Genet Evol 2009;9:760-768. [ Links ]
20. Boonsilp S, Thaipadungpanit J, Amornchai P, Wuthierkanun V, Bailey MS, Holden MT, et al. A Single Multilocus Sequence Typing (MLST) scheme for seven pathogenic leptospira species. PLoS Negl Trop Dis 2013;7:e1954. [ Links ]
21. Vanasco NB, Schmeling MF, Chiani Y, Lottersberger J, Tarabla HD. Diagnóstico de leptospirosis humana: evaluación de la aglutinación macroscópica en diferentes etapas de la enfermedad. Salud Publica Mex 2012;54:530-536. [ Links ]
22. Signorini ML, Lottersberger J, Tarabla HD, Vanasco NB. Enzyme-linked immunosorbent assay to diagnose human leptospirosis: a meta-analysis of the published literature. Epidemiol Infect 2013;141:22-32. [ Links ]
23. Cudós MC, Landolt NY, Jacob P, Schmeling MT, Chiani YT, Brazza S, et al. Vigilancia intensificada de leptospirosis en Santa Fe y Entre Ríos (2012-2013). Rev Argent Salud Publica 2014;5:24-30. [ Links ]
24. Chiani Y, Schmeling MT, Jacob P, Landolt NY, Cudós MC, Varni V, et al. Especies de leptospiras en aislamientos y muestras clínicas humanas, Argentina (2007-2013). En: Libro resúmenes 4o Encuentro Int. Sobre Enfermedades Olvidadas, XVI Simp. Sobre Control Epidemiológico Enfermedades Transmitidas por vectores. Buenos Aires, Argentina: Fundación Mundo Sano, 2013. [ Links ]
25. Varni V, Ruybal P, Chiani Y, Vanasco NB, Caimi K. Esquema de MLST reducido para tipificación molecular de leptospira sp. directamente sobre muestras clínicas. Libro Resúmenes III del Congreso Panamericano. Buenos Aires, Argentina: Asociación Argentina de Zoonosis, 2014. [ Links ]
Fecha de recibido: 22 de septiembre de 2014
Fecha de aceptado: 27 de julio de 2015
 Autor de correspondencia:
Autor de correspondencia:
Paulina Jacob.
Laboratorio Central de la Provincia de Santa Fe.
Av. Blas Parera 8260. 3000 Santa Fe, Argentina.
Correo electrónico: paujcb@gmail.com
Declaración de conflicto de intereses. Los autores declararon no tener conflicto de intereses.
* AAVLD, 1994.













