Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Salud Pública de México
Print version ISSN 0036-3634
Salud pública Méx vol.53 suppl.1 Cuernavaca Jan. 2011
ENSAYO
Nuevos avances en el manejo de la hepatitis C
Current advances in hepatitis C treatment
Laura E. Cisneros-Garza, ME, D en M
Unidad Médica de Atención Especializada # 25 Instituto Mexicano del Seguro Social, Monterrey, Nuevo León, México
RESUMEN
La hepatitis por virus C constituye un problema de salud importante en México. El diagnóstico de poblaciones de alto riesgo es esencial dada la probabilidad de desarrollar enfermedad crónica, cirrosis, descompensación de la cirrosis y la consecuente necesidad de un trasplante hepático o de desarrollar carcinoma hepatocelular. Actualmente, el tratamiento de elección establecido (TEE) incluye interferón pegilado y ribavirina, los cuales han mostrado una tasa de respuesta de alrededor de 57% en el caso del genotipo 1, el más prevalente en México. Sabemos que entre 30 y 60% de la población no muestra una respuesta viral sostenida (RVS) o curación. Por lo tanto, en este artículo se revisan las estrategias terapéuticas existentes para optimizar el tratamiento, y se describen también las estrategias de tratamiento para el futuro. Eventualmente, será posible adicionar una o dos moléculas de los nuevos antivirales que actúan directamente (AAD) sobre áreas específicas del virus al TEE. Cada una de ellas cuenta con mecanismo de acción diferente y se está contemplando la posibilidad de una terapéutica libre de interferón después del año 2015.
Palabras clave: virus de hepatitis C; tratamiento de elección establecido; antivirales que actúan directamente; respuesta viral rápida.
ABSTRACT
Infection by hepatitis C virus constitutes an important health problem in Mexico. Diagnosis of high-risk population is essential given the probability of developing chronic disease, cirrhosis and cirrhosis decompensation, likely leading to the need of a liver transplant and/or the development of hepatocellular carcinoma. Currently, the standard of care (SOC) treatment includes pegylated interferon and ribavirin, which have shown an approximately 57% rate response in genotype 1, the most prevalent in Mexico. It is known that between 30 and 60% of the infected population does not show a sustained virological response or cure. Therefore, in this article, we review existing therapeutic strategies in order to optimize the treatment. Future treatment strategies are also described. Eventually, it will be possible to add one or two molecules of the new directly acting antiviral drugs, to the SOC treatment. Each of them has a different action mechanism, and we are envisioning the possibility of an interferon-free therapy after 2015.
Key words: Hepatitis C virus; standard of care; direct acting antivirals; rapid virological response.
En México, de acuerdo a los resultados de la Encuesta Nacional de Salud (ENSA) 2000, la seroprevalencia de anticuerpos contra el virus de hepatitis C (Ac-VHC) fue de alrededor de 1.6%; la presencia de ARN del virus se corroboró por PCR en 25% de los casos.1 Según la ENSA 2006, la seroprevalencia de Ac-VHC disminuyó a .8%; 50% de los casos resultó positivo al ARN viral.2 Esto podría explicarse debido a que en la primera encuesta probablemente hubo mayor cantidad de falsos seropositivos, los cuales disminuyeron en la segunda.2 De acuerdo a la evolución natural de la enfermedad, se sabe que entre 60 y 90% de los pacientes con carga viral desarrollará hepatitis crónica; existe, además, una morbilidad grave que conducirá a cirrosis (en 20% de los casos), a descompensación de cirrosis, a la necesidad de un trasplante hepático o a la posibilidad de desarrollo de carcinoma hepatocelular (en alrededor de 3 a 5% de la población por año). Por lo tanto, la detección y el tratamiento oportunos son prioritarios.
A partir del Consenso en hepatitis C realizado en 2002 por el Instituto Nacional de Salud en Estados Unidos,3 se determinó como tratamiento de elección establecido (TEE) para el manejo del padecimiento el uso de interferón pegilado (INF-PEG) junto con otro anti viral, ribavirina, en una dosis de 1 000 mg en pacientes con peso menor a 75 kg y de 1 200 mg en pacientes con peso mayor a 75 kg durante 48 semanas para los genotipos 1 y 4. En el caso de los genotipos 1 y 3, las dosis serán de 800 mg durante 24 semanas Este tratamiento fue ratificado en la actualización de las guías de diagnóstico y tratamiento de hepatitis C correspondientes a 20094 y las guías de la EASL 2011.*
Actualmente, alrededor de 50% de la población mundial no ha respondido al tratamiento de elección establecido (interferón pegilado + ribavirina) y, puesto que hasta el momento es la única terapia disponible, es necesario optimizarla. Para ello se tienen que tomar en cuenta las siguientes estrategias.
Estrategias actuales
Adaptar la duración del tratamiento según la respuesta viral de cada paciente en particular
Existen factores propios del huésped implicados en una pobre respuesta viral sostenida (RVS) o curación. Estos incluyen los siguientes: edad (mayor de 40 años),5 sexo (masculino), y raza. Con respecto al último, el estudio latino demostró que los latinos tienen una menor probabilidad de respuesta en comparación con el grupo de no latinos 34% vs 49%, respectivamente; p < 0.0001.6 Ya se sabía que la raza afroamericana es la que tiene menor posibilidad de respuesta. También influyen el índice de masa corporal (IMC) (mayor de 30) y la resistencia a la insulina. Con respecto a la segunda, un índice de HOMA > 2 disminuye la posibilidad de RVS en menos de 40%; un índice de HOMA > 4 disminuye la RVS en un 20%, mientras que los pacientes con un índice de HOMA < 2 presentan una RVS de 60.5%.7 La presencia de esteatosis hepática y la coinfección con otros virus, como VHB y VIH también están relacionadas con una menor probabilidad de respuesta. Finalmente, en cuanto a los factores del propio VHC relacionados con una pobre RVS, se cuentan los siguientes: una carga viral inicial alta mayor de 600 000 UI/mL8 y el genotipo; se sabe que el genotipo 1 se ha asociado a este fenómeno. La probabilidad de RVS depende de la interacción de múltiples factores teniendo que pacientes jóvenes, con carga viral baja, con transaminasas elevadas, delgados y sin fibrosis ni cirrosis tienen una posibilidad de RVS de alrededor de 97% en comparación con pacientes mayores de 60 años, con carga viral alta, transaminasas discretamente elevadas y con cirrosis; la posibilidad de RVS podría disminuir alrededor de 7 a 10%. La combinación de todas estas variables influye sobre la tasa de respuesta.8
Hay que tomar en cuenta también los factores propios de los fármacos implicados en el proceso:
1) Ribavirina: juega un papel fundamental en el tratamiento, como antiviral asociado al interferón. Los estudios han demostrado que su suspensión, su uso durante menos de 24 semanas 9 o la disminución paulatina de la dosis (estrategia que se seguía al principio para contrarrestar los efectos secundarios de la anemia) pueden aumentar el porcentaje de recaídas durante el tratamiento. En otras palabras, la exposición acumulada a ribavirina influye sobre la RVS y sobre las posibles recidivas. Es clave garantizar una exposición a ribavirina superior a 60% de la dosis inicial prescrita y mantenerla durante el curso del tratamiento10 para evitar recaídas.
Actualmente, en lugar de modificar la dosis de ribavirina, se agrega eritropoyetina al tratamiento, lo cual debe hacerse desde el inicio. Los estudios de Sulkowski presentados en la Asociación Europea para el Estudio del Hígado (European Association for the Study of the Liver - EASL) en 200911 mostraron una diferencia significativa con respecto a la RVS si se inicia la eritropoyetina desde las primeras ocho semanas del tratamiento; además de que se presentan menores tasas de discontinuación del mismo.
El mecanismo por el cual la ribavirina produce anemia se describe a continuación: el fármaco entra al eritrocito y se trasforma en ribavirín-trifosfato. Puesto que los eritrocitos carecen de las enzimas para hidrolizar los fosfatos de ribavirina, se ocasiona una marcada depleción de su ATP, el cual constituye un mecanismo de defensa antioxidante. Esto, a su vez, provoca una hemolisis extravascular y la consecuente remoción por el sistema reticuloendotelial de los eritrocitos, lo cual finalmente se manifiesta como anemia.12
2) Importancia del tipo de interferón: en estudios clínicos controlados presentados en la EASL en 2008 y en la Asociación Americana para el Estudio de Enfermedades Hepáticas (American Association for the Study of Liver Diseases - AASLD) en 200813,14 se demostró la superioridad de interferón pegilado alfa 2-a en comparación con interferón pegilado alfa 2-b. Se encontraron respuestas virales sostenidas de 66 a 68.7% con IFN PEG alfa 2-a vs respuestas de 54 a 54.4% con IFN PEG alfa 2-b, con una significancia estadística de p = 0.008.
En un metaanálisis de ocho estudios con asignación aleatoria en los cuales se comparó el uso de IFN PEG alfa 2-a (40 KD) con el de IFN PEG alfa 2b- (12 KD), se demostró una franca superioridad del interferón pegilado 2a con un RR de 1.10 (IC de 95%, 1.04, 1.19; p=0.004).15
Otro tipo de interferones: albuferón es una proteína recombinante de 87.5 kDa, que consiste en una molécula de interferón alfa a la que se ha añadido una molécula de albúmina. Se administra en un esquema de 900 µg cada dos semanas con la ventaja de que cuenta con una vida media más larga y se aplica en un lapso mayor de dos veces por mes. Los estudios realizados con este fármaco junto con ribavirina no han demostrado una diferencia significativa con respecto a la tasa de respuesta cuando se compara con el tratamiento estándar con IFN PEG alfa 2-a más ribavirina (79.8% vs 84.8% en el caso del genotipo 2 [ACHIVE 2/3] y 48.2% vs 51% en el caso del genotipo 1 [ACHIVE 1], respectivamente. La única ventaja consistiría, entonces, en su aplicación cada dos semanas.16 Existe otro tipo de interferón: el consensus (interferón a cons-1 cuyo peso molecular es de 19 500 daltons; consta de 166 aminoácidos y su homología con el interferón beta es de 30%; es un receptor celular de enlace con alta afinidad con el tipo 1 de interferones). La dosis diaria de interferón consensus es altamente acumulativa por lo que su tratamiento puede ser benéfico y eficaz. En EUA se ha usado en estudios de investigación como retratamiento en el caso de pacientes que no han respondido a la terapia y cuya tasa de RVS varía entre 27 y 37%.17
3) La adherencia al tratamiento: esta cuestión se abordó en el artículo publicado por McHutchison, donde se mostraba el impacto sobre la respuesta viral si el paciente seguía la regla de 80/80/80, o sea, 80% interferón y 80% de ribavirina durante 80% del tiempo.18 Posteriormente, se han llevado a cabo otros trabajos que incluyen el apoyo de un grupo multidisciplinario que está en contacto con el paciente la mayor parte del tiempo. Gracia-Retortillo evaluó la eficacia de uno de tales grupos que constaba de hepatólogos, enfermeras, un farmacéutico, un psicólogo y un psiquiatra para lograr una mayor adherencia al tratamiento. Encontró que el porcentaje de adherencia en este grupo fue de 94.6% vs. 78.95% alcanzado en el grupo control; la RVS en el primer grupo fue de 77.9%, mientras que en el grupo control fue de 61.9%.19
4) Duración individualizada del tratamiento según el genotipo y el tipo de respuesta: una vez que la presencia de Ac-VHC se ha corroborado y se ha llevado a cabo una determinación cuantitativa del VHC por PCR, con o sin una biopsia hepática previa, se inicia el tratamiento con IFN PEG alfa 2 a una dosis de 180 mcgr/semana y con ribavirina a una dosis de 800 mg, en el caso de los genotipos 2 y 3; mientras que en el caso del genotipo 1, se hace de acuerdo al peso: 1 000 mg con un peso < 75 Kg y 1 200 mg con un peso > 75Kg. También puede iniciarse tratamiento con IFN PEG alfa 2-b a una dosis de 1.5 µg/ kg/semana y con ribavirina dosificada según el peso: 800 mg para personas con un peso < 65 kg; 1 000 mg para personas entre 65 y 85 kg; 1 200 mg para personas entre 85 y 105 kg, y 1 400 mg para personas con peso > 105 kg. Se debe realizar un seguimiento estrecho con determinación de la carga viral de control en la semana 4. Si se logra una respuesta viral rápida (RVR), o sea, se alcanza la negativización del ARN a la semana 4, significa que existe la posibilidad de alcanzar una RVS muy alta (de entre 86 y 90%), independientemente del genotipo.20,21 La respuesta virológica rápida es altamente predictora de una RVS.
Si el paciente no ha respondido para la semana 4, se debe tomar una carga viral a la semana 12 y existen dos posibilidades:
a) Una respuesta viral temprana completa (RVTc), que consiste en la presencia de ARN positivo en la semana 4 pero negativo en la semana 12. Esto implica una posibilidad de curación de alrededor de 69% en los pacientes con genotipo 1 al final del seguimiento.22
b) Una respuesta viral temprana parcial (RVTp), que consiste en la presencia de ARN positivo tanto en la semana 4 como en la 12, pero con una disminución de dos logaritmos en comparación con la carga viral basal. En este subgrupo de pacientes, la posibilidad de lograr una respuesta viral sostenida es de alre dedor de 29% en el caso del genotipo 1 y de 0% en el caso de los demás genotipos. Por lo tanto, en este subgrupo se ha propuesto extender el tratamiento a 72 semanas, para aumentar la posibilidad de alcanzar una RVS.2 3
La meta del tratamiento, que constituye el principal indicador de una respuesta efectiva, es lograr una RVS, es decir, la ausencia cuantitativa de ARN del VHC en suero 24 semanas después de terminar el tratamiento.
Una RVR constituye el mejor predictor de una RVS. Por lo tanto, la estrategia terapéutica se individualizaría según el siguiente esquema:
Personas con genotipo 1 con RVR: la duración del tratamiento será de 48 semanas.
Personas con genotipo 1 sin RVR y con RVTc: la duración del tratamiento será de 48 semanas.
Personas con genotipo 1 sin RVR y con RVTp: la duración del tratamiento será de 72 semanas.
Personas con genotipo 2/3 con RVR: el tratamiento podría reducirse a 12 semanas.**
Personas con genotipo 2/3 sin RVR: la duración del tratamiento será de 24 semanas.
Estrategias futuras
Agentes en desarrollo clínico
Desde el descubrimiento del virus de la hepatitis C en 1989, el tratamiento disponible ha ido mejorando la tasa de respuesta. Sin embargo, la hepatitis por virus C continúa siendo un problema de salud mundial y la morbimortalidad secundaria a la enfermedad sigue en aumento. Es por ello que se han desarrollado nuevas terapias dirigidas a blancos específicos. Determinar el ciclo vital del virus abrió la posibilidad de desarrollar nuevas moléculas cuyo mecanismo de acción fuera independiente según cada fase. En la actualidad, existen moléculas en desarrollo conocidas en inglés como specifically targeted antiviral therapies for HCV (STAT-C) o como direct-acting antivirals (DAA), o sea, antivirales que actúan directamente.24 A continuación se describe el sitio de acción de estas moléculas de acuerdo al ciclo biológico del virus de la hepatitis C.
A) Inhibidores del sitio de entrada del virus en la célula huésped: bloquean los receptores y los sitios de enlace del virus a la célula. El virus se introduce en la célula por endocitosis y los inhibidores potenciales de fusión y entrada (anticuerpos neutralizantes) actúan a nivel de las glicoproteínas de envoltura E1/E2.
B) Inhibidores de los sitios de entrada ribosomales internos (internal ribosomal entry site - IRES): entre ellos se encuentran los siguientes: los oligonucleótidos antisentido (AVI-4065 [BioPharma] e ISIS 14803); la ribozima heptazima (RPI-13919) retirada actualmente debido a sus efectos adversos de hepatotoxicidad, y las small interfering RNA (siRNA) que son pequeñas moléculas que interfieren con el RNA (SIRNA-034RNAi) que se han estudiado en ensayos preclínicos de laboratorio y en el estudio BEN de Benitec.25
C) Agentes de replicación del RNA: incluyen los siguientes: 1) Inhibidores de las proteasas: bloquean la serín proteasa, en particular la porción NS3/4 A y bloquean el proceso de la poliproteína dependiente de la proteasa y así impiden la replicación viral (cuadro I). Algunos, como el BILN 206, ya han sido retirados de estudios clínicos debido a sus efectos adversos.26 El más promisorio en estos momentos es el telaprevir o VX-950. Durante 2005 se demostró que a dosis de 750, 950 y 1 250 mg una vez al día lograba disminuir la carga viral hasta en 4.4 log a 14 días de inicio del tratamiento.27 Sin embargo, se pudo corroborar que al suspender el medicamento, se producía un efecto rebote en la carga viral, lo cual se debe a la aparición de mutantes resistentes dentro de los cuatro a siete días posteriores a la interrupción del tratamiento. Se encontraron las sustituciones V36M/A/L, T54A, R155K/T/S/M (con bajo nivel de resistencia) y las sustituciones A156T and A156V (con alto nivel de resistencia), y resultaron ser las variantes resistentes a fármacos las que presentan una mutación de aminoácidos única en un inhibidor de la proteasa.28 Con respecto a tres grupos de tratamiento (uno con IFN PEG alfa 2-a, uno con telaprevir y uno con ambos), en el último, Keiffer demostró una disminución de hasta 5.5 log en la carga viral a 14 días de iniciado el tratamiento. Hizo notar que los mutantes resistentes quedaban suprimidos con la combinación de IFN PEG + ribavirina + VX-950.29 El efecto antiviral rápido y sustancial fue demostrado en el estudio de Rodríguez (AASLD 2007). La combinación de IFN PEG alfa 2-a y telaprevir (750 mg) se administró cada 8 horas durante 28 días; a continuación se administró IFN PEG alfa 2-a solo. A los 28 días de tratamiento, se encontró que no había carga viral en 100% de los pacientes.30 En el estudio Prove 2,28 se incluyeron cuatro grupos de tratamiento y se demostró que en el grupo de tratamiento con IFN PEG alfa 2-a (180mcgr/semana) + ribavirina durante 28 semanas al que se añadían 750mg de telaprevir cada 8 horas durante las primeras 12 semanas, la RVS fue de 68%; hubo una diferencia significativa con respecto al grupo de tratamiento estándar (IFN PEG alfa 2-a + ribavirina) con p = 0.01. Entre los estudios Fase III sobre pacientes vírgenes de tratamiento para el genotipo 1, en el estudio ADVANCE mostró una tasa de respuesta de hasta 75% y una tasa de discontinuación de 6.9% entre los pacientes que recibieron una dosis de telaprevir durante 24 semanas, en comparación con una tasa de respuesta de 44% en el grupo control que recibió el TEE durante 48 semanas, con una diferencia estadística significativa (p < 0.0001). Recientemente se presentaron los resultados del estudio C209, en el cual se administró telaprevir solo y combinado con IFN PEG y ribavirina en el caso de pacientes vírgenes de tratamiento para los genotipos 2 y 3; se mostró que telaprevir como monoterapia presenta una respuesta en el caso del genotipo 2, pero su actividad con respecto al genotipo 3 es limitada. Además, las mejores tasas de RVS ocurrieron cuando se asoció con IFN PEG y ribavirina.31

En el estudio Sprint-1 se mostró la respuesta al tratamiento con boceprevir, inhibidor de la HCV NS3 serín proteasa, en combinación con IFN PEG y ribavirina en pacientes con genotipo 1 vírgenes de tratamiento. Se evidenció que la tasa mayor de RVS (74%) correspondió al grupo que recibió tratamiento con IFN PEG y ribavirina durante 4 semanas seguido por 44 semanas de IFN PEG alfa 2-b, ribavirina y boceprevir.32 Es de llamar la atención que estos resultados se mantuvieron a largo plazo sin recaída de los pacientes que habían respondido al tratamiento. Se pudieron apreciar 18 mutaciones resistentes, principalmente la R155K, en 64% de los casos y hubo diferentes grados de declinación de mutantes resistentes: V36M declinó más rápido, mientras que T4S y R155K disminuyeron en niveles similares, lo cual demuestra la adaptabilidad de los mutantes.33
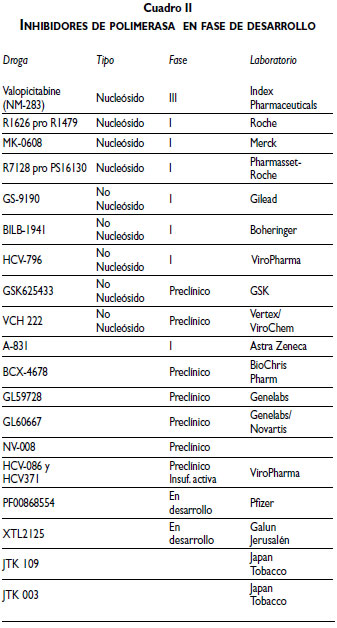
2) Inhibidores de la polimerasa: actúan sobre la ARN polimerasa dependiente en la región NS5B y se dividen en dos grupos.
a) Nucleósidos: inhiben directamente el sitio de actividad con lo que ocasionan la terminación de la cadena.
b) No-nucleósidos: llevan a cabo una inhibición alostérica en la superficie de la enzima cerca de su sitio activo, lo cual ocasiona un cambio conformacional de la proteína en cuanto a su estructura y su función. El mejor ejemplo es la pro-droga R7128 del PS16130 en el caso del genotipo 1. Se estudió en cuatro brazos de tratamiento, en dosis de 500, 1 000 y 1 500 mg dos veces al día, aunado a IFN PEG y ribavirina, y un grupo control con IFN PEG y ribavirina seguido con IFN PEG y ribavirina durante 44 semanas. La RVS fue de 30, 88 y 85% en cada uno de los grupos, respectivamente. Con respecto al genotipo 2, las dosis fueron de 1 500 mg dos veces al día + IFN PEG alfa 2-a vs el TEE. Se mostró una RVR de 90% con una disminución de 5.0 log10 IU/mL.34 Otro estudio reportó datos muy importantes y prometedores con el uso de dos moléculas: un inhibidor de la proteasa y un inhibidor de la polimerasa con y sin IFN PEG. Es la primera vez que se usan dos moléculas con sitios de acción diferentes en los seres humanos (estudio INFORM-1).35 Además, se han empleado dosis bajas de ritonavir (RTV), un inhibidor CYP3A, para incrementar la farmacocinética del inhibidor de la proteasa (RG7227). Este es sustrato del CYP3A e incrementa la respuesta terapéutica mediante el boosting, lo cual parece ser un parámetro clave para aumentar la eficacia y disminuir la posibilidad de resistencias.36
3) Inhibidores de la función de la proteína N5A: se trata de una proteína no estructural multifuncional que carece de actividad enzimática y actúa sobre la replicación del ARN y el ensamblaje viral, en la modulación de las vías de señal celular y en la respuesta al interferón; se desconocen aún sus papeles moleculares. Se ha demostrado una actividad antiviral potente in vitro del BMS-790052, con disminución de hasta 3.2 log de la carga viral posterior a la dosis oral de 10 mgr en pacientes con genotipo 1; está asociado a una RVR de 92% y una RVT de 83% en combinación con el TEE37,38 (cuadro II).
D) Inhibidores de la ciclofilina B: son pequeñas moléculas orales que actúan en la región NS5A, necesaria en la membrana perinuclear y en el ensamblaje de complejos de replicación. Son análogos de la ciclosporina y se han evaluado por su efecto inhibitorio en la replicación del virus de la hepatitis C. Tienen propiedades antivirales in vitro contra el VIH y el VHC. Con una dosis de 1 200 mg al día durante 14 días vs placebo en paciente coinfectados con VIH y VHC, mostraron una disminución de 3.63 log 10 en el caso de 23 pacientes. Recientemente se ha demostrado la actividad potente y el efecto aditivo de DEBIO 025 en combinación con IFN PEG alfa 2-a en el caso de los genotipos 1 y 4, con una disminución de 4.61 log 10 con una dosis de 600 mg por día y de 4.75 log 10 con 1 000 mg diarios.39 En este grupo también se encuentran el A-689 y el A-831.
E) Ensamblaje y liberación de los nuevos viriones: inhibidores de la glucosilación: el MX3253 (celgosivir) es una prodroga oral de castanospermina, derivada del árbol australiano de castañas. Es un potente inhibidor de la alfa-glucosidasa 1, una enzima que altera el procesamiento de las glucoproteínas, por interferencia en el ensamblaje, multiplicación y liberación viral del VHC. En una dosis de 400 mg diarios, previene la glucosilación de las proteínas de la envoltura viral en los flavivirus, con una disminución de hasta 1.2 log 10 cuando se usa en combinación con IFN PEG alfa 2-b más ribavirina y un anticuerpo antifosfolípido como bavituximab . Se trata de un anticuerpo monoclonal cuyo blanco es la fosfatidilserina en la superficie de la célula infectada y en la superficie del virus; se usa en infusión intravenosa dos veces por semana en una dosis de 6 mg, que es segura, bien tolerada y disminuye el ARN del VHC en 0.5 log.
F) Otros: Nitazoxamida (NTZ): se trata de un fármaco con efectos antibacterianos y antiprotozoarios aprobado en 2002 por la Agencia Reguladora de Alimentos y Medicamentos de Estados Unidos (FDA) para el tratamiento de la diarrea en el caso de parásitos como Cryposporidium parvum y en la Giardia lamblia. También posee potentes efectos antivirales. Su acción antiviral se produce a través de la fosforilación de la proteincinasa activada por el ARN de doble cadena; esto conduce a un incremento del factor 2-alfa fosforilado, una proteína intracelular con efectos antivirales.
Existe un estudio de tratamiento con IFN PEG + ribavirina + NTZ (500 mg dos veces al día después de los alimentos) en pacientes con genotipo 4, comparado con controles que recibieron IFN PEG + NTZ e IFN PEG + ribavirina. Los resultados mostraron una RVS de 79% en el grupo que recibió terapia triple (IFN PEG, ribavirina y NTZ), mientras que los grupos control mostraron una RVS de 64% y 45%, respectivamente.40,41
Genotipos del huésped
Se sabe también que el genotipo del huésped influye sobre la probabilidad de respuesta al tratamiento. La presencia de polimorfismos de los nucleótidos (single nucleotide polymorphism -SNP) localizados en el gen IL28B del cromosoma 19 son altamente predictores del aclaramiento o eliminación del virus de la hepatitis C.42 En el estudio VIRALHEP-C, se encontró una variación genética asociada al alelo CC que tiene que ver con una mayor RVR en pacientes afroamericanos y europeosamericanos.43 Este mismo polimorfismo se asocia a una disminución de hasta 2 log 10 en pacientes que reciben tratamiento con IFN PEG y ribavirina a partir de las primeras 24 horas.44 Los pacientes con alelos TT y CT presentan una disminución de menos de 1 logaritmo en la carga viral. Por otro lado, los pacientes que presentan una menor respuesta experimentan una sobrerregulación de la expresión de los genes intrahepáticos y una
disminución de los genes que estimulan el interferón (interferon-stimulated genes - ISG) capaces de permitir una respuesta al interferón exógeno.
Se ha sugerido, pues, que la variación en el IL28B regula la respuesta inmune innata al VHC en el hígado.45 En biópsias hepáticas hechas en pacientes antes del tratamiento se determinó el perfil de expresión génica y se percibió que este cambia entre pacientes que responden al tratamiento y los que no. Los cambios más importantes se observan en los genes que estimulan el interferón, en los genes relacionados con los factores de crecimiento y en los de las citocinas. El nivel basal de expresión de los genes que estimulan el interferón fue más alto entre los pacientes que no respondieron al tratamiento comparado con quienes presentaron RR y RVT. Esto se debió probablemente a que en estos sujetos los genes que estimulan el interferón están siendo inducidos al máximo.46 Asimismo se encontró que todos los SNP corresponden a la región IL28 B del cromosoma 19. Existe especialmente una clara asociación con el rs12979860, tanto en la RVR como en la RVS en pacientes vírgenes de tratamiento con IFN PEG y ribavirina y no existe ningún otro marcador en la región IL28B asociado con la respuesta viral.47
Conclusiones
Se debe hacer un esfuerzo para detectar oportunamente la hepatitis crónica C e iniciar el tratamiento para evitar la evolución natural de la enfermedad, puesto que se sabe que la cirrosis hepática es un problema de salud muy importante en México. Ha constituido la tercera causa de muerte desde 2005 hasta la fecha entre los individuos del sexo masculino, solo precedida por la diabetes mellitus y la cardiopatía isquémica. Entre las personas del sexo femenino, figura como la sexta causa de mortalidad. Además, se sabe también que la principal causa de cirrosis hepática en México, así como la principal causa de necesidad de trasplante hepático en nuestro país y en el mundo, es la cirrosis hepática secundaria al virus de la hepatitis C. En este momento no existe más opción que la terapéutica médica establecida, o sea, el uso de interferón pegilado y ribavirina que se debe optimizar al máximo, tomando en cuenta las medidas anteriormente descritas, mientras pueda tenerse acceso al tratamiento con moléculas antivirales que actúan directamente sobre las diferentes fases del ciclo viral.
Los estudios más recientes han demostrado que el uso de estas pequeñas moléculas implica ciertas ventajas que incluyen las siguientes: ayudar a reducir la duración del tratamiento cuando se usan en combinación con la terapéutica estándar, alcanzar mayores porcentajes de RVR y de RVS, y actuar directamente sobre el virus, independientemente de la genética del huésped. Sin embargo, entre las desventajas se cuenta el riesgo de que aparezcan variantes resistentes y el aumento en el perfil de efectos adversos. No hay que olvidar tampoco que entre más moléculas se usen, existe siempre el potencial de interacciones medicamentosas, sobre todo con los antirretrovirales en el manejo de coinfecciones VIH + VHC.48
El futuro se muestra incierto, así que habrá que esperar los resultados de los nuevos estudios y valorar las combinaciones más potentes y menos dañinas. Dado el número de efectos secundarios, gran parte de las moléculas que estaban en estudio se han eliminado, pero existen aún muy buenas posibilidades de tratamientos con combinaciones de medicamentos que actualmente se están experimentando in vitro (ver resumen en el cuadro III). En tanto no se encuentren disponibles en el mercado estas nuevas opciones, de momento sólo se puede optimizar la terapéutica disponible.
Referencias
1. I.Valdespino JL, Conde-González CJ, Olaiz-Fernández G, Palma O Kershenobich D, Sepúlveda J. Seroprevalencia de la Hepatitis C en adultos de México ¿un problema de salud pública emergente? Salud Publica Mex 2007:49(Suppl.3):S395-403. [ Links ]
2. Olaiz-Fernández G, Rivera-Dommarco J, Shamah-Levy T, Rojas R, Villalpando-Hernández S, Hernández-Avila M, Sepúlveda-Amor J. Encuesta Nacional de Salud y Nutrición 2006. Cuernavaca, México: Instituto Nacional de Salud Pública, 2006. [ Links ]
3. National Institutes of Health. National Institutes of Health Consensus Development Conference Statement Management of hepatitis C. Hepatology 2002:36(Suppll):S3-20. [ Links ]
4. Ghany MG, Strader DB, Thomas DL, Seeff LB. Diagnosis, Management and Treatment of Hepatitis C: An Update. Hepatology 2009;49:1335-1374. [ Links ]
5. Ferenci P Predictors of response to Therapy for Chronic Hepatitis C. Semnin Liver Dis 2004;24:25-31. [ Links ]
6. Rodríguez- Torres M, Jeffers LJ, Sheikh M Y, Rossaro L, Ankoma-Sey V, Hamzeh FM, et al. Peginterferon Alfa -2a and Ribavirin in Latino and Non-Latino whites with Hepatitis C. N Engl J Med 2009;360:257-267. [ Links ]
7. Romero- Gómez M,Viloria MM, Andrade RJ, Salmerón J, Diego M, Fernández-Rodríguez CM, et al. Insulin resistance impairs sustained response rate to peginterferon plus ribavirin in chronic hepatitis C patients. Gastroenterology 2005;128(3):636-641. [ Links ]
8. Foster GR, Fried MW, Hadziyannis SJ, Messinger D, Freivogel K, Welland O Prediction of sustained virological response in chronic hepatitis C patients treated with peginterferon alfa -2a and ribavirin. Scan J Gastroenterol 2007;42(7):247-255. [ Links ]
9. Bronowicki J, Ouzan D, Asselah T, Desmurat H,Zarski JP,Foucher J, et al. Effect of Ribavirin in Genotype 1 Patients with Hepatitis C Responding to Pegylated Interferon alfa -2a plus Ribavirin. Gastroenterology 2006;131(4):1040-1048. [ Links ]
10. Reddy K, Shiffman M, Morgan T, Zeusem S, Hadziyannis S, Hamzeh FM, et al. Impact of ribavirin dose reduction in Hepatitis C virus genotype 1 patients completing Peginterferón alfa- 2/Ribavirin treatment. Clin Gastroenterol Hepatol 2007;5(1):124-129 [ Links ]
11. Sulkowski MS, Shiffman ML, Afdhal N, Reddy KR, Mc Core J, Lee WM , et al. Hepatitis C virus treatment - related anemia is associated with higher sustained virological response rate. Gastroenterology 2010:129(5)1602-1611 [ Links ]
12. De Franceschi L. Fattovichi G, Turrini F, Ayi K, Brugrara C, Noventa F, et al. Hemolytic anemia induced byrivabirin therapy in patients with chronic hepatitis C virus infection:role of membrane oxidative damage Hepatology 2000;31(4):997-1004. [ Links ]
13. Ascione A ,De Luca M, Tartaglione MT, Lampasi F, di Constanzo GG , Lanza AG, et al. Gastroenterology 2010;138(1):116-122 [ Links ]
14. Rumi M ,Aghemo A, Prati GM, D'Ambrosio R, Donato MF, Soffredini R, et al. Randomized Study comparing Peginterferon alfa 2a plus Ribavirin vs Peginterferon alfa 2b plus ribavirin in Chronic Hepatitis C. Gastroenterology 2010;138(1):108-115 [ Links ]
15. Awad T,Thorlund K, Hauser G, Stimac D, Mabrouk M, Gluud C. Peginterferón alfa -2a is associated with higer sustained virological response than Peginterferon alfa -2b in chronic HepatitisC: systematic review of randomized trials. Hepatology 2010;51(4):1176-1184. [ Links ]
16.- Bain V, Kaita K, Yoshida E, Swain MG, Heathcote EJ, Neumann AU , et al. A phase 2 study to evaluate the antiviral activity, safety and pharmacokinetics of recombinant human albumin-interferon alpha fusion protein in Genotype 1 Chronic hepatitis C Patients. J Hepatol 2006;44:671-678. [ Links ]
17. Witthóft T. Review of consensus interferon in the treatment of chronic hepatitis C. Biologics 2008;2(4):635-643. [ Links ]
18. Mc Hutchinson J, Manns M, Patel K. Adherence to Combination therapy Enhances Sustained Response in genotype-1 infected Patients with Chronic Hepatitis C. Gastroenterology 2002;123:161-169. [ Links ]
19. Garcia-Retortillo M, Cirera I, Gimenez MD. The impact of a Multi-Disciplinary support program in adherence and the Efficacy of Hepatitis C treatment. Hepatology 2008;48(Suppl I):870A [ Links ]
20. Jensen DM, Morgan TR, Marcellin P, Pockros PJ, Reddy KR, Hadziyannis SJ, et al. Early identification of HCV genotype 1 patients responding to 24 weeks Peginterferon alfa -2a(40 KD) Ribavirin therapy. Hepatology 2006;43(5):954-960. [ Links ]
21. Poordad FF. The role of rapid virological reponse in determining treatment duration for chronic hepatitis C. Alimentary Pharmacology Ther 2010;31(12):1251-1267. [ Links ]
22. Marcellin P, Jensen DM, Hadziyannis H. Differentiation of early virological response (EVR) into RVR, complete EVR(CEVR) and partial EVR (PEVR) allows for a more precise prediction of SVR in HCV genotype 1 patients treated with peginterferon alfa-2a(40kd) and ribavirin. Hepatology 2007;46:818A [ Links ]
23. Sánchez-Tapias JM, Diago M, Escartin P, Enriquez J, Romero-Gómez M, Bercenas R, et al. Peginterferon alfa 2a plus ribavirin for 48 versus 72 weeks in patients with detectable hepatitis C virus RNA at week 4 of treatment. Gastroenterology 2006;131:451-460. [ Links ]
24. Manns MP, Foster GR, Rockstroh JK, Zeuzem S, Zolim F, Houghton M, et al. The way forward in HCV treatment finding the right path. Nature 2007;6(2):991-1000 [ Links ]
25. Martinand-Marie C, Lebleu B, Robbins I. Oligonucleotide -based strategies to inhibit human hepatitis C virus. Oligonucleotides 2003;13(6):539-548. [ Links ]
26. Resiser M, Hinrichsen H, Benhamou Y, Reesink HW, Wedemeyer H, Avendano C, et al. Antiviral efficacy of NS3-serine protease inhibitor BILN-2061 in patients with chronic genotype 2 and 3 hepatitis C. Hepatology 2005; 41(4):832-835. [ Links ]
27. Forestier N, Reesink HW, Weegink CJ, Mc Nair L, Kieffer TL, Chu HM, et al Antiviral activivity of Telaprevir (VX-950) and peginterferon alfa-2a in patients with hepatitis C. Hepatology 2007;46(3):640-648 [ Links ]
28. Dusheiko GM, Hezode C,Pole S . Treatment of chronic hepatitis C with Telaprevir (TVR) in combination with PegInterferon- alfa- 2a with or without Ribavirin: Futher Interim Analysis results of the Prove 2 Study. J Hepatol 2008;48(Suppll):S26. [ Links ]
29. Kieffer TL, Sarrazin C, Miller JS,Weiker MW, Forestier N, Reesink HW, et al. Telaprevir and pegylated intrreferon alfa-2a inhibit wild type and resistant genotypeI hepatitis C virus replication in patients. Hepatology 2007;46(3):631-639. [ Links ]
30. Lawitz E, Rodriguez-Torres M, Muir AJ, Kieffer TL, McNair L, Khunvidal A, et al. Antiviral effects and safety of telaprevir, peginterferon alfa-2a, and ribavirin for 28 days in hepatitis C patients. J Hepatol 2008;49(2):163-169. [ Links ]
31. Foster GR, Hezode C, Bronowicki P. Activity of Telaprevir alone or in combination with Peginterferon alfa-2a and Ribavirin in treatment-naive genotype 2 and 3 Hepatitis -C patients : interim results of study C209. J Hepatol 2009;50(Suppll):S27 [ Links ]
32. Kwo P; Lawitz EJ; Jonathan McC. HCV Sprint-I: Final Results SVR 24 NS3 Protease Inhibitor Boceprevir plus PegIFN alpha 2b/Ribavirin HCVI treatment Naive patients. J Hepatol 2009;50(Suppll):S4 [ Links ]
33.Vierling JM,Ralston R, Lawitz EJ. Long Term outcomes following combination treatment with Boceprevir plus Peg-Intron/Ribavirin (P/R) in patients with chronic Hepatitis C, G, Genotype 1 (CHC-GI) J Hepatol 2010;52(suppl I):S470 [ Links ]
34. Lalezari J, Gane E., Rodriguez-Torres M. Potent Antiviral activity of HCV Nucleoside polymerase Inhibitor R7128 500mg BID for 28 days. J Hepatol 2008;48(Suppll):S29 [ Links ]
35. Gane EJ, Roberts SK, Stedman CA. Combination Therapy With A Nucleoside Polymerase (RG7128) And Protease (RG7227/ITMN-191) Inhibitor In HCV: Safety, Pharmacokinetics, And Virologic Results From INFORM-I. Hepatology 2009;50(Suppl4):394A [ Links ]
36. Haznedar JO, Fretlanda J, Leon G. Impact of low dose ritonavir boosting on the pharmacokinetics of RG7227(ITMN-191), a highly potent and selective inhibitor of the HCV NS3/4A protease. J Hepatol 2010;52(suppl I):S293 [ Links ]
37. Buckman B. Discovery of potent NS5A inhibitors with favorable pharmacokinetics and robust activity in a HCV animal model. The 5th international workshop on clinical pharmacology of hepatitis therapy. Boston, MA. pp.23-24,2010. [ Links ]
38. Gao M, Nettles RE, Belema M, Synder LB, Nguyen VN, Fridell RA, et al. Chemical genetics strategy identifies an NS5A inhibitor with a potent clinical effect. Nature 2010;465(7296):96-100. [ Links ]
39. Flisiak R, Feinman SVJablkowski M, Horban A, Kryczka W, Pavlowska M, et al. The Ciclophilin Inhibitor Debio 025 combined with PEGIFNalfa 2 a significantly reduces viral load in treatment -naiveHepatitis C patients. Hepatology 2009;45(5);1460-1468 [ Links ]
40. Rossignol F, Elfert A, El-Gohary Y, Elfert A, Keefe EB. Improved virological response in chronic hepatitis C genotype 4 treated with nitazoxanide, peginterferon, and ribavirin. Gastroenterology 2009;136:856-63. [ Links ]
41. Darling JM, Fried MW. Nitazoxanide: beyond parasites toward novel agent for hepatitis C. Gastroenterology 2009;136(3):760-763. [ Links ]
42. Ge D, Fellay J, Thompson AJ, Simon JS, Shianna KV, Urban TJ, et al. Genetic variation in IL28B predicts hepatitis C treatment -induced viral clearance. Nature 2009;461(7262):399-401. [ Links ]
43. Howell CD,Thompson AJ,Ryan K. IL28B Genetic variation associated with early viral kinetics and SVR in HCV genotype 1. The VIRALHEP-C Study. J Hepatol 2010;52(Suppl I):S451 [ Links ]
44. Neumann A, Bibert S, Haagmans R. IL28B polimporphism is significantly correlated with IFN and viral effectiveness already on first day of pegylated interferon and rivabirin therapy of chronic HCV infection. J Hepatol 2010;52(Suppll):S468 [ Links ]
45. Thompson A, Schuppan D, Urban T. IL28B polymorphism is associated with intrahepatic ISG expression and peg interferon-A ribavirin response rate in chronic HCV infection. J Hepatol 2010;52(Suppl I):S2 [ Links ]
46. Duces A, Bieche I, Jardin-Watelet B. Liver gene expression signature to predict response to pegylated interferon plus rivabirin in chronic hepatitis C. J Hepatol 2010;52(Suppl I):S266 [ Links ]
47. Asselah T, Essioux L, Marcellin P. A chromosome 19 SNP (RS12979860) predicts outcome (EVR/SVR) in HCV patients treated with interferon, independent of pegylation or rivabirin. J Hepatol 2010;52 (Suppl I):S456 [ Links ]
48. Seden K, Back D, Khoo S. New direct acting antivirals for hepatitis C: potential for interaction with antiretrovirals . J Antimicrob Chemother 2010;65(6):1079-1085. [ Links ]
 Solicitud de sobretiros:
Solicitud de sobretiros:
Dra. Laura E. Cisneros Garza
UMAE # 25 IMSS, Departamento de Gastroenterología. Lincoln y Gonzalitos
Monterrey, N.L. México
Correo electrónico: laura_cisneros@yahoo.com
Fecha de recibido: 21 de octubre de 2010
Fecha de aceptado: 6 de julio de 2011
Declaracion de conflicto de interés: Los autores declararon no tener conflicto de intereses.
* EASL clinical practice guidelines 2011. Journal of Hepatology (en prensa).
** Sólo se podrá reducir el tratamiento de aquellos pacientes con genotipo 2/3 que hayan logrado una RVR, que no tengan cirrosis y cuya carga viral sea baja (< 400,000 Ul/ml).














