Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Salud Pública de México
versión impresa ISSN 0036-3634
Salud pública Méx vol.52 no.5 Cuernavaca sep./oct. 2010
ENSAYO
Consumo de fumonisinas y daños a la salud humana
Fumonisin intake and human health.
Luisa Torres-Sánchez, Dr SP,(I) Lizbeth López-Carrillo, PhD.(I)
(I) Instituto Nacional de Salud Pública. Cuernavaca, Morelos, México
Resumen
Las fumonisinas son una familia de micotoxinas que contaminan al maíz, alteran el metabolismo de los esfingolípidos y del folato, se asocian con defectos del tubo neural y están catalogadas por la Agencia Internacional de Investigación en Cáncer (IARC por sus siglas en inglés) como posibles carcinógenos humanos. Debido a que en México los derivados de maíz constituyen una parte importante de la dieta y existe alta prevalencia de población genéticamente susceptible a la deficiencia de folato, en este ensayo se presentan las evidencias mundiales y nacionales de la exposición a fumonisinas y la relevancia que para México representa la evaluación de esta exposición.
Palabras claves: fumonisinas; salud; México
Abstract
Fumonisins are mycotoxins that contaminate maize, disrupt the folate and sphingolipid metabolism, are associated with neural tube defects, and are considered by the International Agency for Research on Cancer (IARC) as possible human carcinogens. Since maize-based foods are significant components of the Mexican diet and there is a high prevalence of genetic susceptibility for folate deficiency among Mexicans, this essay presents international and national evidence of fumonisin exposure and the relevance that such exposure represents for Mexico.
Key words: fumonisins, mycotoxins; health; Mexico
Las fumonisinas son una familia de micotoxinas que contaminan al maíz y son producidas principalmente por los hongos F. moniliforme y el F. proliferatum, durante el cultivo y almacenamiento del grano. Estas micotoxinas fueron aisladas y descritas por primera vez en Sudáfrica en 1988 y de acuerdo con la Agencia Internacional de Investigación en Cáncer (IARC por sus siglas en inglés), desde 1993 se encuentran catalogadas como posibles carcinógenos humanos (Grupo 2B).1 Existen 15 tipos de fumonisinas, agrupadas en cuatro categorías; las más conocidas son la FB1, FB2 y FB3, de las cuales la FB1 es la más tóxica y representa aproximadamente 70% de la fumonisina total.2,3
La producción de fumonisinas está influenciada por la variedad de semilla usada para el cultivo, por las diferentes formulaciones de fertilizantes, así como por las variaciones en las condiciones de almacenamiento y características ambientales como temperatura, humedad y precipitación.4,5 Los métodos usados para el procesamiento del maíz también influyen en la concentración final de las fumonisinas. Por ejemplo, la nixtamalización que es necesaria para la obtención de la masa de maíz y que consiste en cocer los granos de maíz en una solución alcalina (CaOH2), a una temperatura cercana al punto de ebullición, reduce la concentración de la FB1 en aproximadamente 90% y la cantidad restante permanece en su forma hidrolizada (HFB1), la cual es menos potente in vitro que la FB1.6,7 No obstante, cuando el proceso es incompleto y no se elimina adecuadamente el pericarpio, 31% de la FB1 permanece en forma original.8 Asimismo, la tecnología de extrusión usada en la industria productora de cereales para desayuno, botanas y alimentos para animales, y durante la cual la harina de maíz se somete a alta presión a temperaturas que varían entre los 100 y 200 ºC y a una humedad entre 13 y 30%, disminuye significativamente las fumonisinas, en especial bajo condiciones de poca humedad, en contraste con el aumento que se observa para otras micotoxinas.9
En la masa de maíz las concentraciones de fumonisina a nivel mundial varían desde <10ppm en Estados Unidos hasta > 100ppm en algunos lugares de China y Ãfrica.1 Considerando que el consumo per cápita de maíz en Ãfrica se encuentra entre los más altos del mundo (400 g/d), Shephard y colaboradores10 estimaron que la ingestión promedio diaria de FB1 de un adulto promedio (60kg) está entre los 3.43 y 8.67mg/kg de peso al día, superando en mucho la ingestión máxima tolerable provisional de 2 mg/kg de peso al día, establecida por la Organización Mundial de la Salud (OMS).11
Metabolismo
En humanos no existen estudios acerca del metabolismo y cinética de las fumonisinas. En animales de experimentación, una vez que ingresa al tracto gastrointestinal, la fumonisina se distribuye y elimina rápidamente en su forma original (80% en las heces y 3% en la orina). En el hígado y el riñón se encuentran bajas concentraciones y no existe evidencia de transporte transplacentario, lo que sugiere que el metabolismo endógeno y la exposición in utero, son improbables.11
Efectos tóxicos
Debido a que las fumonisinas tienen una estructura química similar a la cadena larga de los precursores de los esfingolípidos3 (figura 1) se considera que el metabolismo de estos últimos es el blanco de la acción tóxica de la fumonisina. El metabolismo de los esfingolípidos consta de dos etapas, la síntesis de novo a partir del complejo serina palmitoil-CoA y el recambio de esfingolípidos que incluye la hidrólisis de esfingolípidos complejos. En ambas etapas interviene la enzima ceramida sintetasa, la cual es bloqueada por la acción de la fumonisina. Este bloqueo conlleva la inhibición en la síntesis de ceramida, incremento de la esfinganina y la esfingosina, una mayor degradación de las bases esfingoides provenientes de la dieta y, finalmente, una reducción en la formación de esfingomielina.12
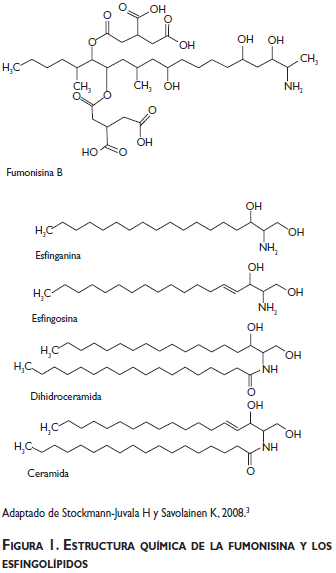
Los esfingolípidos forman parte de la membrana celular e intervienen en los procesos de crecimiento, diferenciación y muerte celular al mantener la estructura de la membrana, la comunicación intercelular, la interacción entre las células y la matriz extracelular, regulando los receptores del factor de crecimiento y actuando como segundos mensajeros.13 El agotamiento de esfingolípidos complejos (ceramida, esfingomielina y glicofosfolípidos) y la acumulación de las bases esfingoides (esfinganina y esfingosina) alteran las funciones celulares mencionadas anteriormente, y favorecen el estrés oxidativo y la proliferación de peroxisoma, entre otros.3,14,15 A través de la activación del factor de necrosis tumoral, la exposición a FB1 altera el balance de muerte celular y replicación y de esta forma contribuye a la carcinogénesis.16
Un mecanismo tóxico adicional es a través de una relación compleja con el metabolismo del folato. La incorporación de folato a la célula depende de dos proteínas presentes en la membrana que requieren de la esfingomielina para su adecuado funcionamiento: el transportador de folato reducido (hRFC1) y el receptor de folato (RF).14 En condiciones de deficiencia de esfingomielina, disminuye la incorporación de folato a la célula y se produce un estado deficiente de folato. Por otro lado, estudios experimentales recientes muestran que los efectos tóxicos de la exposición a FB1 (apoptosis y daño al ADN) se incrementan en condiciones de deficiencia a folato, especialmente deficiencia de 5-Metilentetrahidrofolato.12 La deficiencia de folato puede ser independiente de la inducida por la FB1, y puede ser de origen dietético por disminución en el consumo de alimentos fuentes de folato o por disminución en la actividad de las enzimas involucradas en el metabolismo del folato, como por ejemplo la metilentetrahidrofolato reductasa (MTHFR).
Biomarcadores de exposición
El conocimiento sobre el metabolismo y los efectos tóxicos de la exposición a FB1 ha servido de punto de partida para el desarrollo de algunos biomarcadores de exposición. En estudios experimentales, el incremento en las concentraciones de esfinganina (Sa) y esfingosina (So) observado, posterior a la administración de alimentos contaminados con fumonisinas, permitió el desarrollo de un biomarcador de exposición basado en la medición en suero, orina y plasma de la razón esfinganina/esfingosina (Sa:So). Aunque en animales esta alteración en la razón Sa:So es dependiente de la dosis y el tiempo de exposición, en humanos la prueba parece ser poco sensible y está en discusión su utilidad como biomarcador de exposición a FB en estudios epidemiológicos. En la búsqueda de biomarcadores más sensibles, Gong y colaboradores17 usaron técnicas de cromatografía de líquidos para determinar FB1 en orina. En este estudio, la concentración urinaria de FB1 se correlacionó significativamente con el consumo de tortillas reportado por mujeres mexicanas, y aunque los autores consideran que aún necesita ser validada con la ingestión individual de fumonisina, la técnica promete ser mucho más sensible en humanos que la razón Sa:So.16
Efectos en animales
En animales, dependiendo de la especie, la exposición a fumonisina se asocia con diversos daños. Por ejemplo en caballos, la exposición a fumonisina produce leucoencefalomalacia, una enfermedad caracterizada por necrosis y licuefacción de la materia blanca del cerebro. A finales del siglo pasado, brotes de esta enfermedad acaecidos en varios países del mundo se atribuyeron a la exposición de FB1.1 Otros daños observados principalmente en roedores son la toxicidad hepática y renal, ambos con marcadas diferencias de acuerdo al sexo. En ratas hembras, el daño hepático es mucho más evidente que en los machos y se caracteriza por necrosis del hepatocito y disminución del peso del hígado. En contraste, la atrofia tubular y la disminución del peso renal que ocurre como consecuencia de la exposición a FB1 se observa principalmente en ratas macho.3 En cerdos alimentados con maíz contaminado con FB1, la manifestación relevante es un cuadro de edema pulmonar atribuido a la acción tóxica de la fumonisina sobre la célula pulmonar, pero también a una alteración en los canales de calcio de las células del miocardio y a una disminución en la eficiencia del ventrículo izquierdo. Todo ello como consecuencia de la disfunción en el metabolismo de los esfingolípidos.18
Experimentos con embriones de ratón muestran que a través de la potenciación de otros factores, como por ejemplo la deficiencia de folato, la fumonisina puede ser embriotóxica. En ratonas embarazadas a las que se les administró intraperitonealmente FB1 entre los días 7 y 9 de gestación, 79% de los embriones presentaron alteraciones en el cierre del tubo neural mientras que en el grupo control no se observó ningún caso. Este efecto disminuyó en aproximadamente 30% cuando el experimento incluyó suplementación con ácido fólico.19
Efectos en humanos
La información acerca del efecto de la fumonisina sobre la salud humana es limitada y no concluyente. Estudios ecológicos realizados principalmente en Sudáfrica y China, en los que compararon la concentración de fumonisina presente en el maíz entre zonas de alta y baja incidencia de cáncer esofágico, sugieren que éste podría ser uno de los daños a la salud relacionados con la exposición a fumonisina.1 Sin embargo, los estudios a nivel individual realizados en China son contradictorios. Un estudio de casos y controles anidado en una cohorte no encontró asociación entre la razón Sa:So y el riesgo de cáncer de esófago;20 por su parte, un estudio de casos y controles con base poblacional estimó un incremento de dos veces más riesgo de cáncer esofágico asociado con el consumo de alimentos contaminados con hongos.21 La limitante de este último estudio es que no menciona cuáles son los alimentos considerados en la categoría de contaminados con hongos y además, aunque supone que estos alimentos pueden estar contaminados con fumonisina, no existe ninguna determinación al respecto.
Una situación similar ocurre con los defectos del tubo neural (DTN). En las regiones donde el maíz es el principal componente de la dieta y donde también la ingestión estimada de fumonisinas es elevada (Guatemala, norte de China, y Transkei en Sudáfrica), la prevalencia de DTN es 6 a 10 veces mayor que el promedio mundial (1 por 1000 nacidos vivos).14,19 Por su parte, un estudio de casos y controles donde la exposición a fumonisina durante el primer trimestre del embarazo se evaluó a través de varios indicadores (consumo de tortillas hechas en casa vs. comerciales, número total de tortillas, ingestión estimada de fumonisina y razón Sa:So) mostró diferencias en el riesgo para DTN de acuerdo con el tipo de indicador. Las mujeres que reportaron comer tortillas hechas en casa presentaron un incremento significativo de tres veces más riesgo de tener un niño con DTN, comparado con las que consumieron tortillas de origen comercial. En contraste, cuando se usó el número total de tortillas consumidas, la ingestión estimada de fumonisina o la razón Sa:So sólo se observó un incremento no significativo en el riesgo de DTN en aquellas mujeres ubicadas en las categorías intermedias de exposición.22 Una explicación para estas discrepancias en los resultados puede ser la baja sensibilidad de los indicadores de exposición, lo que favorece la presencia de un error de medición no diferencial en la exposición y, en consecuencia, una disminución en el poder para detectar una asociación.
Situación en México
En México, el cultivo del maíz es uno de los más importantes y anualmente se producen en promedio alrededor de 18.2 millones de toneladas de grano, de las cuales 90% es maíz blanco y se destina al consumo humano.23,24 La producción nacional de maíz se centra en cuatro estados: Jalisco, Sinaloa, México y Chiapas; seguidos por Guerrero, Michoacán, Puebla y Oaxaca en menor proporción.23 Para 2007, el consumo anual de maíz fue de 296.2 kilogramos por persona, principalmente en forma de tortilla elaborada a partir de masa de nixtamal o de harina de maíz nixtamalizada.
La contaminación por fumonisina del maíz o sus derivados (cuadro I) para consumo humano2,25-30 y consumo animal31 está documentada. El hongo principalmente involucrado en la producción de fumonisina en México es el F. moniliforme (~75%); no obstante existen diferencias geográficas en el tipo de cepas prevalecientes en diferentes regiones del país. En el Noroeste de México las cepas de hongos aisladas son en su mayoría grandes productores de FB1, mientras que las aisladas en la zona centro, principalmente en el Estado de México, son productoras de bajas cantidades de FB1.28
Las concentraciones de fumonisinas reportadas en la mayoría de los estudios superan por mucho el contenido de fumonisinas totales establecido por la FDA (2-4 ppm) para el maíz destinado a la producción de tortillas o masa.32
Dos estudios experimentales evaluaron los efectos tóxicos de la fumonisina, uno de ellos sobre la integridad celular de la planta de maíz33 y otro sobre las células intestinales de porcino.34 El primero muestra que la fumonisina altera la función de la enzima H+-ATPasa de la membrana plasmática y compromete algunos procesos claves para la nutrición, elongación y homeostasis celular de las plantas. El segundo demuestra un efecto tóxico sinérgico entre aflatoxina y fumonisina sobre la fisiología de la célula intestinal, favoreciendo así la entrada de otros microorganismos e impactando in vivo negativamente la salud animal y humana.
En relación con los efectos de la exposición a fumonisina, en México sólo existe un informe acerca de un brote de leucoencefalomalacia equina ocurrido en Oaxaca,35 y en el que las concentraciones de FB1 presentes en muestras de maíz usado como parte del alimento de los burros estaban entre 0.67 y 13.3 ppm. Estas concentraciones de FB1 reportadas superan las 5 ppm establecidas por la FDA para la alimentación en animales.32
Igualmente, sólo existe un estudio en México que evaluó el consumo de tortilla como fuente de exposición a fumonisinas en humanos.17 Se trata de un estudio transversal llevado a cabo con 75 mujeres en edad reproductiva (15-36 años), residentes en cuatro municipios del estado de Morelos y donde el consumo de maíz fue clasificado como alto, medio o bajo con base en el número y frecuencia de consumo de tortillas reportado en un cuestionario de frecuencia de consumo de alimentos. La determinación de FB1 se realizó en orina mediante cromatografía de líquidos (HPLC). El 75% de las muestras tuvieron concentraciones detectables de FB1 con un máximo observado de 9 312 pg/ml, y se correlacionaron significativamente (prueba de tendencia p=0.001) con la ingestión de maíz (figura 2). Las concentraciones urinarias de FB1 fueron 3.5 veces mayores entre las mujeres ubicadas en la categoría más alta de consumo de maíz en comparación con las de la categoría más baja. Las concentraciones de FB1 fueron mayores en mujeres más jóvenes residentes en zonas suburbanas.

La ingestión diaria promedio de fumonisinas estimada para esta población fue mucho menor a la ingestión máxima tolerable establecida por la OMS (0.4 vs. 2 µg/kg de peso corporal). No obstante, algunos sujetos tuvieron una ingestión estimada de FB1 de hasta 23 µg/kg/d, lo cual es mayor a lo informado en Estados Unidos pero menor que la ingestión estimada para Sudáfrica. A concentraciones superiores a 1 ppm de FB1, una mujer de 60 kg de peso que consuma 120 g/d de tortilla o productos derivados de la masa de maíz podría rebasar la ingestión diaria tolerable.30
Relevancia de la contaminación de fumonisina en México
Las fumonisinas pueden interactuar con el transporte celular y la disponibilidad de folato y 5-metiltetrahidrofolato. La MTHFR es una enzima clave en la síntesis de nucleótidos, en la síntesis de S-adenosil-metionina y en los procesos de metilación de la homocisteina, DNA, proteínas, neurotransmisores y fosfolípidos.36 Para el gen que codifica a esta enzima se conocen algunos polimorfismos, entre ellos el 677 C>T, el cual es altamente prevalente en México (58%).37 En sujetos que son homocigotos (677 TT), la enzima presenta una disminución de 50-60% de su actividad enzimática, y en condiciones de baja disponibilidad de folato se manifiesta con altas concentraciones séricas de homocisteina.36
Varios estudios epidemiológicos asocian la deficiencia de folato, y en especial el polimorfismo de la MTHFR, con algunos daños a la salud: incremento en el riesgo de enfermedades cardiovasculares, defectos del tubo neural, alteraciones neurológicas, preeclampsia, aborto espontáneo e incremento en la incidencia de algunos tipos de cáncer.
En México, los daños a la salud estudiados son defectos del tubo neural,38,39 aborto espontáneo,40 alteración en el desarrollo mental de los hijos de madres con bajo consumo dietético de folato (< 400 mg/d) durante el primer trimestre del embarazo,41 así como un incremento en el riesgo de cáncer gástrico entre los portadores del genotipo 677TT.42
Conclusiones
En este contexto, el consumo de fumonisina es un co-factor adicional a la deficiencia en el consumo de folato y la susceptibilidad genética individual que participa en la génesis de las enfermedades antes mencionadas, y representa, como tal, un problema potencial de salud pública poco evaluado en México. Al considerar que el maíz, y específicamente el consumo de tortilla, son alimentos imprescindibles en la dieta mexicana, es necesario contar con mayor información acerca de la prevalencia e ingestión de fumonisinas en diferentes áreas geográficas y, en su caso, desarrollar los programas de monitoreo y prevención del consumo de dichas toxinas.
Declaración de conflicto de intereses
Declaramos no tener conflicto de intereses.
Referencias
1. Marasas WF. Discovery and occurrence of the fumonisins: a historical perspective. Environ Health Perspect 2001;109 Suppl 2:239-243. [ Links ]
2. Dombrink-Kurtzman MA, Dvorak TJ. Fumonisin content in masa and tortillas from Mexico. J Agric Food Chem 1999;47:622-627. [ Links ]
3. Stockmann-Juvala H, Savolainen K. A review of the toxic effects and mechanisms of action of fumonisin B1. Hum Exp Toxicol 2008;27:799-809. [ Links ]
4. Ariño A, Herrera M, Juan T, Estopañan G, Carramiñana JJ, Rota C, et al. Influence of agricultural practices on the contamination of maize by fumonisin mycotoxins. J Food Prot 2009;72:898-902. [ Links ]
5. David-Miller J. Factors That Affect the Occurrence of Fumonisin. Environ Health Perspect 2001;109(suppl 2):321-324. [ Links ]
6. Dombrink-Kurtzman MA, Dvorak TJ, Barron ME, Rooney LW. Effect of nixtamalization (Alkaline cooking) on fumonisin-contaminated corn for production of masa and tortillas. J Agric Food Chem 2000;48:5781-5786. [ Links ]
7. De La Campa R, Miller JD, Hendricks K. Fumonisin in tortillas produced in small-scale facilities and effect of traditional masa production methods on this mycotoxin. J Agric Food Chem 2004;52:4432-4437. [ Links ]
8. Sydenham EW, Stockenström S, Thiel PG, Shephard GS, Koch KR, Marasas WFO. Potential of alkaline hydrolysis for removal of fumonisins from contaminated corns. J Agric Food Chem 1985;43:1198-1201. [ Links ]
9. Scudamore KA, Guy RC, Kelleher B, MacDonald SJ. Fate of Fusarium mycotoxins in maize flour and grits during extrusion cooking. Food Addit Contam Part A Chem Anal Control Expo Risk Assess 2008;25:1374-1384. [ Links ]
10. Shephard GS, Marasas WF, Burger HM, Somdyala NI, Rheeder JP, Van der Westhuizen L, et al. Exposure assessment for fumonisins in the former Transkei region of South Africa. Food Addit Contam 2007;24:621-629. [ Links ]
11. World Health Organization 2002. Evaluation of certain mycotoxins in food. Fifty-sixth report of the joint FAO/WHO expert committee on food additives (JECFA). WHO technical report 906: 16-27. [ Links ]
12. Abdel-Nour AM, Ringot D, Guéant JL, Chango A. Folate receptor and human reduced folate carrier expression in HepG2 cell line exposed to fumonisin B1 and folate deficiency. Carcinogenesis 2007;28:2291-2297. [ Links ]
13. Merrill AH Jr, Schmelz EM, Wang E, Dillehay DL, Rice LG, Meredith F, et al. Importance of sphingolipids and inhibitors of sphingolipid metabolism as components of animal diets. J Nutr 1997;127(5 Suppl):830S-833S. [ Links ]
14. Marasas WF, Riley RT, Hendricks KA, Stevens VL, Sadler TW, Gelineau-van Waes J, et al. Fumonisins disrupt sphingolipid metabolism, folate transport, and neural tube development in embryo culture and in vivo: a potential risk factor for human neural tube defects among populations consuming fumonisin-contaminated maize. J Nutr 2004;134:711-716. [ Links ]
15. Turner PC, Nikiema P, Wild CP. Fumonisin contamination of food: progress in development of biomarkers to better assess human health risks. Mutat Res 1999;443:81-93. [ Links ]
16. Wild CP, Gong YY. Mycotoxins and human disease: a largely ignored global health issue. Carcinogenesis 2010;31:71-82. [ Links ]
17. Gong YY, Torres-Sanchez L, Lopez-Carrillo L, Peng JH, Sutcliffe AE, White KL, et al. Association between tortilla consumption and human urinary fumonisin B1 levels in a Mexican population. Cancer Epidemiol Biomarkers Prev 2008;17:688-694. [ Links ]
18. Constable PD, Smith GW, Rottinghaus GE, Haschek WM. Ingestion of fumonisin B1-containing culture material decreases cardiac contractility and mechanical efficiency in swine. Toxicol Appl Pharmacol 2000;162:151-160. [ Links ]
19. Gelineau-van Waes J, Voss KA, Stevens VL, Speer MC, Riley RT. Chapter 5 maternal fumonisin exposure as a risk factor for neural tube defects. Adv Food Nutr Res 2009;56:145-181. [ Links ]
20. Abnet CC, Borkowf CB, Qiao YL, Albert PS, Wang E, Merrill AH Jr, et al. Sphingolipids as biomarkers of fumonisin exposure and risk of esophageal squamous cell carcinoma in china. Cancer Causes Control 2001;12(9):821-828. [ Links ]
21. Wang Z, Tang L, Sun G, Tang Y, Xie Y, Wang S, et al. Etiological study of esophageal squamous cell carcinoma in an endemic region: a population-based case control study in Huaian, China. BMC Cancer 2006;6:287. [ Links ]
22. Missmer SA, Suarez L, Felkner M, Wang E, Merrill AH Jr, Rothman KJ, et al. Exposure to fumonisins and the occurrence of neural tube defects along the Texas-Mexico border. Environ Health Perspect 2006;114:237-241. [ Links ]
23. Vega-Valdivia DD, Ramírez-Moreno P. Situación y perspectivas del maíz en México. [Monografía en internet] México DF: Universidad Autónoma de Chapingo, 2004. [Consultado 5 de abril de 2010]. Disponible en http://www.senado.gob.mx/comisiones/LX/grupo_tlcan/content/blanco_datos/maiz/maiz1/.pdf. [ Links ]
24. Food and Agriculture Organization of the United Nations. El maíz blanco: un grano alimentario tradicional en los países en desarrollo. [Consultado el 5 de abril de 2010.] ftp://ftp.fao.org/docrep/FAO/006/w2698s/w2698s00.pdf [ Links ]
25. Desjardins AE, Plattner RD, Nelson PE. Fumonisin production and other traits of Fusarium moniliforme strains from maize in northeast Mexico. Appl Environ Microbiol 1994;60:1695-1697. [ Links ]
26. Cortez-Rocha MO, Ramírez-Astudillo WR, Sánchez-Mariñez RI, Rosas-Burgos EC, Wong-Corral FJ, Borboa-Flores J, et al. Fumonisins and fungal species in corn from Sonora, Mexico. Bull Environ Contam Toxicol 2003;70:668-673. [ Links ]
27. Cortez-Rocha MO, Gil-León ME, Suárez-Jiménez GM, Rosas-Burgos EC, Sánchez-Mariñez RI, Burgos-Hernández A, et al. Occurrence of fumonisin B1 and hydrolyzed fumonisin B1 in Mexican nixtamalized cornmeal. Bull Environ Contam Toxicol 2005;74:73-77. [ Links ]
28. Sánchez-Rangel D, SanJuan-Badillo A, Plasencia J. Fumonisin production by Fusarium verticillioides strains isolated from maize in Mexico and development of a polymerase chain reaction to detect potential toxigenic strains in grains. J Agric Food Chem 2005;53:8565-8571. [ Links ]
29. Reyes-Velázquez WP, Isaías-Epinoza VH, Rojo F, Jiménez-Plasencia C, de Lucas Palacios E, Hernández-Góbora J, et al. Ocurrence of fungi and mycotoxins in corn silage, Jalisco State, México. Rev Iberoam Micol 2008;25:182-185. [ Links ]
30. Dvorak NJ, Riley RT, Harris M, McGregor JA. Fumonisin mycotoxin contamination of corn-based foods consumed by potentially pregnant women in southern California. J Reprod Med 2008;53:672-676. [ Links ]
31. Robledo M de L, Marin S, Ramos AJ. [Natural contamination with mycotoxins in forage maize and green coffee in Nayarit State (Mexico)]. Rev Iberoam Micol 2001;18:141-4. [ Links ]
32. US FDA/CFSAN, 2001. Guidance for Industry: Fumonisin levels in human foods and animal feeds; Final Guidance. [Consultado 07/10/09] http://www.fda.gov/Food/GuidanceComplianceRegulatoryInformation/GuidanceDocument. [ Links ] .
33. Gutiérrez-Nájera N, Muñoz-Clares RA, Palacios-Bahena S, Ramírez J, Sánchez-Nieto S, Plasencia J, et al. Fumonisin B1, a sphingoid toxin, is a potent inhibitor of the plasma membrane H+-ATPase. Planta 2005;221:589-596. [ Links ]
34. Del Río-García JC, Moreno-Ramos C, Pinton P, Mendoza-Elvira S, Oswald IP. Evaluation of the cytotoxicity of aflatoxin and fumonisin in swine intestinal cells]. Rev Iberoam Micol 2007;24:136-141. [ Links ]
35. Rosiles MR, Bautista J, Fuentes VO, Ross F. An outbreak of equine leukoencephalomalacia at Oaxaca, Mexico, associated with fumonisin B1. Zentralbl Veterinarmed A 1998;45:299-302. [ Links ]
36. Botto LD, Yang Q. 5, 10 Methylenetetrahydrofolate reductase gene variants and congenital anomalies: a huge review. Am J Epidemiol 2000; 151: 862-877. [ Links ]
37. Guéant-Rodriguez RM, Guéant JL, Debard R, Thirion S, Hong LX, Bronowicki JP, et al. Prevalence of methylenetetrahydrofolate reductase 677T and 1298C alleles and folate status: a comparative study in Mexican, West African, and European populations. Am J Clin Nutr 2006;83:701-707. [ Links ]
38. Mutchinick OM, López MA, Luna L, Waxman J, Babinsky VE.High prevalence of the thermolabile methylenetetrahydrofolate reductase variant in Mexico: a country with a very high prevalence of neural tube defects. Mol Genet Metab 1999;68:461-467. [ Links ]
39. Blanco-Muñoz J, Lacasaña M, Cavazos RG, Borja-Aburto VH, Galavíz-Hernández C, Garduño CA. Methylenetetrahydrofolate reductase gene polymorphisms and the risk of anencephaly in Mexico. Mol Hum Reprod 2007;13:419-424. [ Links ]
40. Rodríguez-Guillén M del R, Torres-Sánchez L, Chen J, Galván-Portillo M, Blanco-Muñoz J, Anaya MA, et al. Maternal MTHFR polymorphisms and risk of spontaneous abortion. Salud Publica Mex 2009;51:19-25. [ Links ]
41. Del Río Garcia C, Torres-Sánchez L, Chen J, Schnaas L, Hernández C, Osorio E, et al. Maternal MTHFR 677C>T genotype and dietary intake of folate and vitamin B(12): their impact on child neurodevelopment. Nutr Neurosci 2009;12:13-20. [ Links ]
42. Lacasaña-Navarro M, Galván-Portillo M, Chen J, López-Cervantes M, López-Carrillo L. Methylenetetrahydrofolate reductase 677C>T polymorphism and gastric cancer susceptibility in Mexico. Eur J Cancer 2006;42:528-533. [ Links ]
Solicitud de sobretiros: Dra. Luisa Torres Sánchez. Instituto Nacional de Salud Pública Av. Universidad 655,
col. Santa María Ahuacatitlán, 62100 Cuernavaca, Morelos, México.
Correo electrónico: ltorress@insp.mx
Fecha de recibido: 7 de diciembre de 2009 • Fecha de aceptado: 31 de mayo de 2010














