Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Salud Pública de México
versión impresa ISSN 0036-3634
Salud pública Méx vol.52 no.5 Cuernavaca sep./oct. 2010
ARTÍCULO ORIGINAL
Reproducibilidad del diagnóstico histopatológico de lesiones precursoras del carcinoma gástrico en tres países latinoamericanos
Reproducibility of histopathologic diagnosis of precursor lesions of gastric carcinoma in three Latin American countries.
Elena Kasamatsu, MD(I); Luis Eduardo Bravo, MD, MSc(II); Juan Carlos Bravo, MD(II,III); Jesús Aguirre-García, MD(IV,V); Lourdes Flores-Luna, PhD(VI); María del Carmen Nunes-Velloso, MD(I); Gustavo Hernández-Suárez, MD, MSc. (VII)
(I) Instituto de Investigaciones en Ciencias de la Salud, Universidad Nacional de Asunción. Asunción, Paraguay.
(II) Registro Poblacional de Cáncer de Cali. Universidad del Valle. Cali, Colombia.
(III) Fundación Valle de Lili. Cali, Colombia.
(IV) Facultad de Medicina, Universidad Nacional Autónoma de México. México DF, México.
(V) Hospital General de México, OD. México DF, México.
(VI) Centro de Investigación en Salud Poblacional, Instituto Nacional de Salud Pública. Cuernavaca, Morelos, México.
(VII) Grupo de Investigación Epidemiológica. Instituto Nacional del Cancerología de Colombia. Bogotá, Colombia.
Resumen
Objetivo. Evaluar la concordancia en el diagnóstico de lesiones precursoras del carcinoma gástrico de tipo intestinal entre observadores con diferente experiencia. Material y métodos. Se estudiaron 1 056 casos de biopsias gástricas: 341 de Colombia, 382 de México y 333 de Paraguay. En el diagnóstico de cada caso participaron patólogos sin experiencia en patología gastrointestinal (A), patólogos con experiencia en patología gastrointestinal (B) y expertos que trabajan en un centro de referencia internacional (C). Resultados. La concordancia (k) entre patólogos inexpertos y expertos fue pobre en el diagnóstico de gastritis atrófica (k=0.04 a 0.12) y displasia (k=0.11 a 0.05) y buena en el diagnóstico de metaplasia intestinal (k=0.52 a 0.58); la supervisión de un patólogo inexperto por un experto mejoró notablemente la concordancia en el diagnóstico de gastritis atrófica (k=0.65) y metaplasia intestinal (k=0.91) y, en un menor grado, de displasia (k=0.28). Al comparar la concordancia entre expertos antes y después de la reunión de consenso no hubo variación en el diagnóstico de gastritis atrófica (k=0.57); la concordancia varió de buena a excelente en el de metaplasia intestinal (k=0.67 a 0.81) y de pobre a buena en el de displasia (k=0.18 a 0.66). Conclusión. Los principales problemas se presentan en el diagnóstico de la gastritis crónica atrófica y la displasia. La concordancia interobservador depende de la experiencia del observador y la lectura de consenso.
Palabras clave: carcinoma; estómago; diagnóstico; reproducibilidad de resultados; Helicobacter pylori.
Abstract
Objective. The aim was to evaluate the concordance in the diagnosis of precursor lesions of intestinal-type gastric carcinoma among observers with different levels of experience. Material and Methods. Gastric biopsies from 1 056 cases were studied: 341 from Colombia, 382 from Mexico, and 333 from Paraguay. Pathologists without experience (A) and with experience (B) in gastrointestinal pathology, as well as experts working in an international reference center (C) participated in the diagnosis of each case. Results. The concordance (k) between pathologists with experience and those without was poor for the diagnosis of atrophic gastritis (k=0.04 to 0.12) and dysplasia (k=0.11 to 0.05), and good for the diagnosis of intestinal metaplasia (k=0.52 to 0.58). Supervision of pathologists without experience by those with experience remarkably improved the concordance in the diagnosis of atrophic gastritis (k=0.65) and intestinal metaplasia (k=0.91), and to a lesser degree, of dysplasia (k=0.28). The concordance among experts before and after the consensus meeting showed no variation in the diagnosis of atrophic gastritis (k=0.57); the concordance varied from good to excellent in the diagnosis of intestinal metaplasia (k=0.67 to 0.81) and from poor to good in that of dysplasia (k=0.18 to 0.66). Conclusion. The greatest differences arose in the diagnosis of chronic atrophic gastritis and dysplasia. The interobserver concordance depended on the experience of the observer and the consensus reading.
Key words: carcinoma; stomach; diagnosis; reproducibility of results; Helicobacter pylori.
La incidencia del carcinoma gástrico varía considerablemente entre diferentes regiones geográficas. En América Latina varios países tienen una tasa elevada, como Chile (46.1 x 100000), Costa Rica (41.2 x 100000), Ecuador (37.8 x 100000) y Perú (37.5 x 100000); entre los países con una tasa baja se encuentran Paraguay (19.5 x 100000), Argentina (14.6 x 100000) y México (13.1 x 100000).1 La variedad histológica del carcinoma gástrico que muestra esta variabilidad es la de tipo intestinal; el carcinoma gástrico de tipo difuso aparentemente presenta una incidencia similar en todo el mundo.
Los estudios epidemiológicos e histológicos han mostrado que el carcinoma gástrico de tipo intestinal y las lesiones que lo preceden son el resultado de infección por Helicobacter pylori (H. pylori).2 La frecuencia e intensidad de las lesiones precursoras varía en las regiones de alto y bajo riesgo.3-5 De acuerdo con la hipótesis propuesta por Correa,6 la secuencia en el desarrollo de la neoplasia es la siguiente: gastritis crónica no atrófica -"gastritis crónica atrófica-" metaplasia intestinal -"displasia-" carcinoma. La biopsia gástrica es el único método diagnóstico que permite conocer el tipo, la intensidad y la extensión de estas alteraciones.
En la clasificación y gradación de la gastritis crónica se ha utilizado el sistema de Sidney actualizado, que incluye una escala visual analógica.7 A pesar de que este sistema ha sido de gran utilidad para uniformar el diagnóstico de las lesiones que preceden al carcinoma gástrico, varios estudios han revelado una pobre concordancia diagnóstica interobservador, en especial de la gastritis crónica atrófica.8-11 En los estudios en los que se ha efectuado un consenso previo de las variables histológicas se ha podido observar una mayor concordancia.12,13
Para evitar esta variabilidad diagnóstica se requiere que el patólogo tenga un adiestramiento adecuado y, en estudios de investigación, que el diagnóstico se haga por consenso entre los observadores.
El objetivo de este trabajo fue evaluar la concordancia diagnóstica de lesiones gástricas producidas por H. pylori entre observadores con diferente experiencia y patólogos expertos en lesiones gastrointestinales, antes y después de una reunión de consenso.
Material y métodos
Se revisaron 1056 casos de biopsias gástricas tomadas por endoscopía a pacientes adultos que acudieron al hospital por presentar síntomas gastrointestinales; los pacientes no habían recibido ningún tratamiento en las dos semanas previas a la toma de la biopsia, no habían sido tratados por alguna neoplasia gastrointestinal y no tenían enfermedades crónicas graves o algún padecimiento que ocasionara trastornos mentales. De los 1056 casos, 341 provenían de los Hospitales de Tunja y Barranquilla, de Colombia (país 1), 382 del Hospital General de México (país 2) y 333 del Hospital de Clínicas y del Hospital General del Instituto de Previsión Social de Paraguay (país 3). El estudio fue aprobado por el Comité de Investigación de ética del Instituto Nacional de Cancerología de Colombia, el Comité de Investigación de ética del Instituto Nacional de Salud Pública y del Hospital General de México, y el Comité de ética en Investigación del Instituto de Investigaciones en Ciencias de la Salud de la Universidad Nacional de Asunción, Paraguay. Todos los participantes firmaron la forma de consentimiento informado.
A cada paciente se le tomaron seis biopsias: dos de curvatura menor de antro, una de curvatura mayor de antro, una de la incisura angularis, una de curvatura mayor de cuerpo y una de cara anterior de cuerpo. Las biopsias se fijaron en formaldehído al 10%, se incluyeron en parafina, se cortaron a 4 micras de espesor y se tiñeron con hematoxilina-eosina. Para la detección de H. pylori se utilizó la técnica de Giemsa modificada. En cada caso se revisaron 12 laminillas, seis teñidas con hematoxilina-eosina y seis con Giemsa, con tres secciones histológicas en cada laminilla.
Los observadores que participaron en la revisión se dividieron en tres grupos:
A: Residentes de tercer año de patología o patólogos sin adiestramiento en lesiones gastrointestinales; este grupo se subdividió en dos:
A1: sin supervisión por experto
A2: con supervisión por experto
B: Patólogos expertos en lesiones gastrointestinales, que también se subdividió en dos:
B1: antes de la reunión de consenso
B2: después de la reunión de consenso
C: Patólogos expertos con adiestramiento específico en el diagnóstico de lesiones por H. pylori, que trabajan en un centro de referencia internacional.
En cada caso se evaluaron los siguientes datos: tipo de mucosa (antro, cuerpo, cardias), calidad de la biopsia: adecuada (bien orientada, con muscularis mucosae) o inadecuada (sin muscularis mucosae); y presencia de H. pylori, leucocitos polimorfonucleares, mononucleares (linfocitos y células plasmáticas), atrofia y metaplasia intestinal; estas alteraciones se graduaron en leve, moderada o intensa de acuerdo con la escala visual analógica mencionada previamente. Se anotó la presencia de folículos linfoides y el número de éstos, la presencia de regeneración, el tipo de metaplasia intestinal (completa, mixta e incompleta)14 y el grado de displasia (leve o intensa).
Los expertos C revisaron todos los casos de los países 1 y 3 y entrenaron al experto B del país 3 en la interpretación de los criterios diagnósticos.
En la reunión de consenso efectuada en Cali, Colombia, se revisaron 126 casos del país 2, que incluyeron todos los casos diagnosticados originalmente como gastritis atrófica, la mitad de los casos de metaplasia intestinal, todos los casos de displasia y 20% de gastritis no atrófica.
Los criterios para hacer el diagnóstico de atrofia fueron la disminución en el número de glándulas en biopsias que presentan muscularis mucosae y en zonas sin folículos linfoides.15 En el diagnóstico de displasia se utilizó la clasificación internacional de Padua. En la atrofia y la displasia se incluyeron tres categorías: ausente, indefinida y presente. La atrofia se clasificó como indefinida cuando la biopsia mostró disminución aparente en el número de glándulas pero carecía de muscularis mucosae. La displasia se catalogó como indefinida cuando se observaron atipias celulares en las glándulas pero el epitelio foveolar no mostró esta lesión.16
El diagnóstico global de la gastritis se estableció por la presencia de la lesión más avanzada, independientemente de su extensión; por ejemplo, en un caso con extensa atrofia y un foco pequeño de metaplasia intestinal el diagnóstico fue gastritis crónica con metaplasia intestinal. El diagnóstico global se clasificó en las siguientes categorías: 1. Gastritis crónica superficial; 2. Gastritis antral difusa; 3. Gastritis atrófica multifocal; 4. Metaplasia intestinal; 5. Displasia y 6. Cáncer.
Los casos diagnosticados inicialmente por los observadores A fueron revisados posteriormente por los observadores B. La concordancia fue calificada como pobre cuando el índice kappa (k) fue menor de 0.5, buena entre 0.5 y 0.75 y excelente mayor de 0.75.17
Resultados
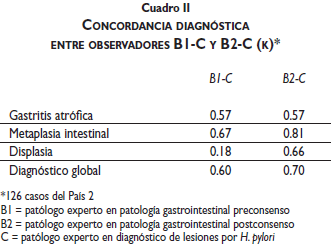
En el cuadro I se señala la concordancia diagnóstica entre los observadores A1 y B2 de los casos de Colombia (país 1) y México (país 2), y la concordancia entre los observadores A2 y B2 de los casos de Paraguay (país 3). El cuadro II muestra la concordancia diagnóstica de los casos del país 2 entre patólogos expertos, antes y después de la reunión de consenso (observadores B1, B2 y C).

En el cuadro I se puede observar que la mayor discrepancia diagnóstica se presentó entre residentes o patólogos sin experiencia en lesiones gastrointestinales (A1) y patólogos expertos (B2); el valor de kappa varió de 0.04 a 0.12 en la gastritis atrófica, de 0.52 a 0.58 en la metaplasia intestinal y de 0.11 a 0.05 en la displasia. En contraste, la supervisión del residente o el patólogo sin experiencia por el experto (A2-B2) mejoró considerablemente la concordancia; fue buena en el diagnóstico de gastritis atrófica (k=0.65) y excelente en los diagnósticos de metaplasia intestinal y global (k=0.91 y 0.88, respectivamente); sin embargo, la concordancia en el diagnóstico de displasia fue pobre (k=0.28).
Al comparar la variabilidad diagnóstica de expertos en patología gastrointestinal con expertos que trabajan en centros de referencia internacional antes y después de la reunión de consenso (cuadro II) no hubo modificación en el diagnóstico de gastritis atrófica (k=0.57); varió de buena a excelente en el diagnóstico de metaplasia intestinal (k=0.67 y 0.81 respectivamente); mejoró notablemente en el diagnóstico de displasia (k=0.18 y 0.66), y en menor grado en el diagnóstico global (k=0.60 y 0.70, respectivamente).
En los cinco grupos de observadores la concordancia en el diagnóstico de metaplasia intestinal varió de buena a excelente (k=0.52 a 0.91). Las dos lesiones que muestran una menor concordancia diagnóstica son la gastritis atrófica y la displasia. Llama la atención que el valor de kappa en el diagnóstico de gastritis atrófica y metaplasia intestinal fue mayor entre los grupos A2-B2 (cuadro I) que entre los expertos B2-C (cuadro II).
Discusión
Entre las lesiones precursoras del carcinoma gástrico la mayor concordancia diagnóstica interobservador se presentó en la metaplasia intestinal, donde varió de buena a excelente; la concordancia diagnóstica de la gastritis crónica fue buena y la de la displasia varió de pobre a buena. Al revisar los factores de la pobre reproducibilidad diagnóstica de la gastritis atrófica entre patólogos inexpertos y expertos, se observó que en algunos casos se hizo el diagnóstico de atrofia en zonas de la mucosa gástrica con folículos linfoides o con abundante tejido linfoide, en biopsias con una orientación inadecuada de la mucosa o en especímenes que carecen de muscularis mucosae; en todos estos casos no es posible valorar correctamente la desaparición de las glándulas.
En relación con la displasia, la pobre concordancia antes de la reunión de consenso se explica por la diferencia de criterios diagnósticos, la confusión de lesiones regenerativas con lesiones displásicas y el diagnóstico erróneo de -œdisplasia leve- en lugar de -œindefinido para displasia-. El diagnóstico de displasia tradicionalmente ha representado un gran problema para el patólogo, independientemente del tipo de epitelio u órgano, por la ausencia de criterios histológicos bien definidos y por la dificultad para diferenciar en algunos casos la hiperplasia de la displasia leve. Es conveniente mencionar que la hiperplasia, la displasia leve y la displasia intensa comprenden un espectro de alteraciones celulares cuyas diferencias son poco precisas, lo que ha ocasionado la inclusión de la categoría -œindefinido para displasia- entre la hiperplasia y la displasia leve en lesiones del tubo digestivo.
Otra diferencia menor antes y después de la reunión de consenso se encontró en el diagnóstico global (k=0.60 y 0.70, respectivamente); ésta se debió a que no se tomó en consideración la presencia de la lesión más avanzada por ser pequeña.
En contra de lo esperado, la concordancia fue mayor en el diagnóstico de gastritis crónica atrófica y metaplasia intestinal entre los observadores A2-B2 que entre los observadores B2-C; este hecho se relacionó con el efecto de la supervisión de patólogos inexpertos y del entrenamiento de patólogos B por patólogos C.
Por los resultados del presente estudio se puede concluir que sólo por medio de un adiestramiento adecuado es posible diagnosticar correctamente las lesiones precursoras del adenocarcinoma gástrico de tipo intestinal. Además, como ocurre en otras áreas de la patología, el grado de concordancia diagnóstica depende de la estandarización de los criterios, la experiencia de los observadores y la lectura por consenso.18-20
Declaración de conflicto de intereses: Declaramos no tener conflicto de intereses.
Referencias
1. Parkin DM, Bray F, Ferlay J, Pisan P. Global cancer statistics, 2002. CA Cancer J Clin 2005;55:74-108. [ Links ]
2. IARC Monograph on the Evaluation of Carcinogenics Risks to Human. Vol. 61. Schistosomes, liver flukes and Helicobacter pylori. Lyon International Agency for Research on Cancer, l994. [ Links ]
3. Correa P, Cuello C, Duque E, Burbano LC, García FT, Bolaños O, et al. Gastric cancer in Colombia III: Natural history of precursor lesions. J Natl Cancer Inst 1976;57:1027-1035. [ Links ]
4. You WC, Zhang L, Gail MH, Li JY, Chang YS, Blot WJ, et al. Precancerous lesions in two counties of China with contrasting cancer risk. Int J Epidemiol 1998;27:945-948. [ Links ]
5. Naylor GM, Gotoda T, Dixon M, Shimoda T, Gatta L, Owen R, et al. Why does Japan have a high incidence of gastric cancer? Comparison of gastritis between UK and Japanese patients. Gut 2006;55:1545-1552. [ Links ]
6. Correa P. Helicobacter pylori and gastric carcinogenesis. Am J Surg Pathol 1995;19(suppl 1):S37-S43. [ Links ]
7. Dixon MF, Genta RM, Yardley JH, Correa P. Classification and grading of gastritis. The updated Sydney System. Am J Surg Pathol 1996;20:1161-1181. [ Links ]
8. Aydin O, Egilmez R, Karabacak T, Kanik A. Interobserver variation in histopathological assessment of Helicobacter pylori gastritis. World J Gastroenterol 2003;9:2232-2235. [ Links ]
9. Guarner J, Herrera-Goepfert R, Mohar A, Sánchez L, Halperin D, Ley C, et al. Interobserver variability in application of revised Sydney classification for gastritis. Hum Pathol 1999;30:1431-1434. [ Links ]
10. Andrew A, Wyatt JI, Dixon MF. Observer variation in the assessment of chronic gastritis according to the Sydney System. Histopathology 1994;25:17-22. [ Links ]
11. El-Zimaity HMT, Graham DY, Al-Assi MT, Malaty H, Karttunen TJ, Graham DP, et al. Interobserver variation in the histopathological assessment of Helicobacter pylori gastritis. Hum Pathol 1996;27:35-41. [ Links ]
12. Chen XY, van der Hulst RW, Bruno MJ, van der Ende A, Xiao SD, Tygat GN, et al. Interobserver variation in the histopathological scoring of Helicobacter pylori related gastritis. J Clin Pathol 1999;52:612-615. [ Links ]
13. Bravo LE, Bravo JC, Realpe JL, Zarama G, Piazuelo MB, Correa P. Fuentes de variabilidad en el diagnóstico de gastritis atrófica multifocal asociada con la infección por Helicobacter pylori. Colomb Med 2008;56:58-65. [ Links ]
14. Jass JR, Filipe MI. The mucin profiles of normal gastric mucosa, intestinal metaplasia and its variants and gastric carcinoma. Histochem J 1981;13:931-939. [ Links ]
15. Rugge M, Correa P, Dixon MF, Fiocca R, Hattori T, Lechago J, et al. Gastric mucosal atrophy: interobserver consistency using new criteria for classificaction and grading. Aliment Pharmacol Ther 2002;16:1249-1259. [ Links ]
16. Rugge M, Correa P, Dixon MF, Hattori T, Leandro G, Lewin K, et al. Gastric dysplasia. The Padova International Classificaction. Am J Surg Pathol 2000;24:167-176. [ Links ]
17. Landis JR, Koch GG. The measurement of observer agreement for categorical data. Biometrics 1977;33:159-174. [ Links ]
18. Montgomery E, Bronner MP, Goldblum JR, Greenson JK, Haber MM, Hart J, et al. Reproducibility of the diagnosis of dysplasia in Barrett's esophagus (BE). A reaffirmation. Hum Pathol 2001;32:368-378. [ Links ]
19. Rousselet M-C, Michalak S, Dupré F, Croué A, Bedossa P, Saint-André J-P, et al. Sources of variability in histological scoring of chronic viral hepatitis. Hepatology 2005;41:257-264. [ Links ]
20. Kaye PV, Haider SA, Ilyas M, James PD, Soomoro I, Faisal W, et al. Barrett's dysplasia and the Vienna classification: reproducibility, prediction of progression and impact of consensus reporting and p53 immunohistochemistry. Histopathology 2009;54:699-712. [ Links ]
Dirección de sobretiros: Elena Kasamatsu, MD. Instituto de Investigaciones en Ciencias de la Salud, UNA. Río de la Plata y Lagerenza. Asunción, Paraguay.
Correo electrónico: ekasabalbo@gmail.com
Fecha de recibido: 29 de junio de 2009 • Fecha de aceptado: 17 de junio de 2010














