Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Salud Pública de México
versión impresa ISSN 0036-3634
Salud pública Méx vol.51 no.4 Cuernavaca jul./ago. 2009
NOTICIAS DE SALUD AMBIENTAL
Reacción visceral: Efectos ambientales sobre la microbiota humana*
Melissa Lee Phillips
En cada uno de nosotros -en nuestra piel, en nuestras mucosas y en nuestro tracto gastrointestinal (GI)- viven microorganismos al lado de los cuales el número de nuestras propias células y genes se ve empequeñecido. Si bien algunos de estos microbios son patógenos, la mayoría de ellos son inofensivos o incluso benéficos. La gran variedad de microorganismos del cuerpo, colectivamente denominados la microbiota, es similar a un órgano en el sentido de que lleva a cabo funciones esenciales para nuestra supervivencia. Algunos microbios producen vitaminas y otros nutrientes esenciales. Muchos metabolizan alimentos que no podemos digerir por nosotros mismos. También descomponen fármacos y toxinas y regulan múltiples aspectos de la inmunidad innata y adquirida, protegiendo al organismo huésped de infecciones y de inflamación crónica, y también, posiblemente, de muchos trastornos de base immunológica. Así como ocurre con el corazón o los pulmones, cuando un agente ambiental altera la función de la microbiota, el resultado puede ser una enfermedad.
La mayor parte de las investigaciones sobre la relación entre el ambiente y la microbiota se han enfocado en los intestinos, donde habitan alrededor de 100 trillones de microorganismos, la gran mayoría de nuestra gama de microbios. Los cambios en las especies de microbios que residen en nuestros intestinos han sido asociados con una larga lista de patologías, desde alergias y enfermedades autoinmunes hasta la obesidad y el cáncer. Algunos investigadores incluso sospechan que la microbiota puede desempeñar un papel en los trastornos del espectro autista (en inglés, ASD).
Cada uno de nosotros es portador de miles de especies de bacterias en nuestros intestinos, junto con unas cuantas especies de otros tipos de organismos. Si bien los seres humanos tienen una microbiota extremadamente similar, no hay dos personas que tengan exactamente la misma composición de especies de bacterias en sus intestinos -de hecho, el consorcio de microbios de cada individuo puede resultar tan único como una huella dactilar-. Sin embargo, un estudio publicado en el número de Nature del 22 de enero de 2009 informa que, si bien las especies individuales de bacterias pueden diferir ampliamente de una persona a otra, todas tienden a codificar las mismas vías metabólicas, dice la coautora Ruth Ley, profesora adjunta de microbiología de la Universidad Cornell. "Encontramos las mismas funciones genéticas, sin importar qué conjunto de bacterias se halle presente", señala Ley.
Las influencias externas tales como el uso de antibióticos, la alimentación y el estrés psicológico han demostrado tener una fuerte correlación con aquello que vive dentro de nuestro cuerpo, y los investigadores apenas están comenzando a entender cómo estos factores ambientales pueden afectar nuestra salud. Los avances recientes en las tecnologías de secuenciación genómica han dado impulso a este campo. Mientras que anteriormente los científicos sólo podían estudiar aquellos microorganismos que se cultivan fácilmente en el laboratorio y los cuales excluyen a la mayoría de los microbios anaeróbicos de los intestinos, hoy en día pueden secuenciar todo el conjunto de ADN en una muestra de microbios e identificar la especie integrante. Este enfoque, denominado metagenómica, ha sido clave para muchos avances recientes en la comprensión de la relación entre nuestra microbiota y nuestra salud.
Nuestros compañeros microbianos
El tracto intestinal de los bebés es colonizado por microorganismos mediante un complejo proceso que se inicia durante el nacimiento y que se cree depende en parte de la genética del organismo huésped y en parte de los microbios que se encuentren en el ambiente del niño. Los bebés que nacen por cesárea muestran perfiles de microbios diferentes de aquellos que nacen por vía vaginal: mientras que los bebés que nacen por vía vaginal son colonizados primero por bacterias fecales y vaginales de la madre, los bebés nacidos por cesárea inicialmente se ven expuestos a bacterias que se originan del ambiente hospitalario y del personal de atención médica. Una investigación realizada por Giacomo Biasucci y colaboradores y publicada en el número del Journal of Nutrition de septiembre de 2008, demostró que la microbiota intestinal después del nacimiento por cesárea se caracterizaba por una ausencia de especies Bifidobacteria, que se considera importante para el desarrollo postnatal del sistema inmune, mientras que los recién nacidos por vía vaginal mostraban un predominio de estas especies. En general, los niños nacidos por cesárea también tienden a experimentar una demora en el acceso a la leche materna, la cual ejerce una poderosa influencia sobre la microbiota intestinal. [Para más información, véase "Contaminants in human milk: weighing the risks against the benefits of breastfeeding," EHP 2008;116:A426-A434.]
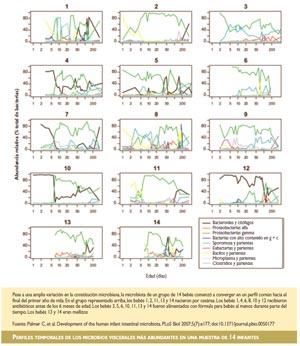
Durante el primer año de vida, la constitución de la microbiota de los intestinos de los bebés puede variar ampliamente y se sigue basando en gran medida en las cepas de bacterias de los cuerpos de sus madres, así como en las del ambiente inmediato. Una investigación publicada por Chana Palmer y colaboradores en la edición de PLoS Biology del 26 de junio de 2007 demostró que, a la edad de un año, los bebés comienzan a converger hacia un perfil de microbiota que se asemeja más al del tracto GI de los adultos, en particular cuando comienzan a comer alimentos sólidos. Se considera que, una vez que se ha desarrollado plenamente en la edad adulta, la microbiota intestinal permanece bastante estable durante meses o años.
Mucho de lo que sabemos sobre la influencia de los microbios en nuestra biología proviene del estudio de roedores "libres de gérmenes" que nacen y crecen en ambientes estériles. Debido a que estos animales carecen de microbiota, los investigadores pueden deducir qué aspectos de la biología y la fisiología de los mamíferos dependen normalmente de estos simbiontes. También pueden inocular entonces a los animales libres de gérmenes con diversas bacterias para ver cómo los afecta la colonización (al animal resultante se le denomina "gnotobiótico"). Estos estudios han demostrado que la microbiota intestinal es esencial para el desarrollo y el funcionamiento normales tanto del tracto GI como del sistema inmune.
"Los trabajos realizados en las últimas dos décadas vinculan la microbiota muy estrechamente con muchos parámetros de la biología del organismo huésped tanto en la salud como en la enfermedad", dice Justin Sonnenburg, profesor adjunto de microbiología e inmunología de la Universidad Stanford. Sin embargo, en la mayoría de los casos la conexión entre la microbiota y la enfermedad sigue siendo simplemente una correlación; aún no está claro si realmente los cambios microbiales causan la enfermedad o si sencillamente son un reflejo de un estado enfermo. Es más, con frecuencia no está claro cómo o por qué nuestro equilibrio de microorganismos cambia en una dirección poco saludable, una condición conocida como disbiosis.
Según un informe de Mohamed Othman y colegas suyos publicado en el número de Current Opinion in Gastroenterology de enero de 2008, muchos problemas relacionados con la disbiosis pueden ser en realidad manifestaciones de una condición llamada sobrecrecimiento bacteriano en el intestino delgado (en inglés SIBO). Se supone que la mayoría de los microbios de los intestinos se encuentran en el colon, y que hay relativamente pocos en el intestino delgado. Con el tiempo, con los cambios en la anatomía intestinal, con la motilidad intestinal y la secreción de ácidos gástricos, los microbios pueden emigrar del colon al intestino delgado, lo que da como resultado el SIBO. El SIBO es más común en la gente mayor, si bien los reportes sobre su prevalencia varían ampliamente. Entre los síntomas del SIBO se incluyen diarrea, dolor abdominal y pérdida de peso en gran medida como resultado de la absorción deficiente de los micronutrientes.
La hipótesis de la higiene
A lo largo de las últimas décadas, la creciente incidencia de varias enfermedades atópicas y autoinmunes en los países desarrollados ha dado lugar a la llamada hipótesis de la higiene. Esta idea es que los bebés en desarrollo necesitan verse expuestos a suficientes microorganismos tanto patogénicos como comensales para que sus sistemas inmunes se desarrollen y funcionen adecuadamente. Según la hipótesis de la higiene, en aquellos países que tienen niveles muy altos de higiene (como se refleja por el uso de la refrigeración, la pasteurización, el tratamiento del agua y el procesamiento de los alimentos para impedir el crecimiento bacteriano), los niños no se ven expuestos a suficientes de estos microbios. "En esencia, andamos por ahí con una microbiota parcialmente mermada", dice Sonnenburg.
Varios estudios han informado sobre una fuerte correlación entre la alteración de la composición microbiana y las alergias y el asma. Los bebés con eczema atópico tenían una menor diversidad microbiana en sus intestinos y menos especies de Bifidobacteria, en comparación con los bebés sanos, según un estudio realizado por Mei Wang y colaboradores y publicado en el número del Journal of Allergy and Clinical Immunology de enero de 2008. En un estudio prospectivo llevado a cabo por Stijn L. Verhulst y sus colegas y publicado en el número del Journal of Asthma de noviembre de 2008, se encontró que había una correlación entre el incremento en las concentraciones de bacterias anaeróbicas en las heces de los bebés de tres semanas de edad y una mayor probabilidad de resollar durante el primer año de vida -un síntoma que puede asociarse con el asma o con otros problemas pulmonares más adelante en la vida-, si bien las bacterias Clostridium parecen ser protectoras.
También se ha observado disbiosis en la enfermedad inflamatoria intestinal (EII), un grupo de trastornos intestinales que incluye la colitis ulcerativa y la enfermedad de Crohn. Algunas cepas microbianas -en especial de las especies Bacteroides y Clostridia- pueden producir enterotoxinas o poseer propiedades degradadoras de las proteínas que aumentan la permeabilidad de las mucosas y la captación bacteriana. En el número de Gut de enero de 2004 Cyrus Tamboli y sus colegas escribieron que estas cepas pueden colonizar la mucosa intestinal y cruzar la barrera epitelial, con lo cual interactúan con los macrófagos residentes y provocan la síntesis de citocinas proinflamatorias por parte de las células epiteliales infectadas y los macrófagos. En otros casos, los pacientes con EII parecen tener una respuesta inmune proinflamatoria anormal a las bacterias comensales normales, según informan H. Matsuda y colaboradores en el número del Journal of Gastroenterology and Hepatology de enero de 2000.
La amplia utilización de los antibióticos también puede estar afectando a la microbiota entre aquellas personas que viven en países desarrollados. Estudios realizados tanto en humanos como en animales han demostrado que incluso un tratamiento con una dosis única de antibióticos puede dar lugar a una disminución de las bacterias que suelen considerarse benéficas, como las bifidobacterias y los lactobacilos, así como a un incremento de los patógenos potenciales, tales como el Clostridium difficile y la levadura Candida albicans. A corto plazo, estos cambios en la microbiota pueden provocar infecciones por levaduras y síntomas GI que incluyen hinchazón, dolor abdominal y diarrea, pero un trabajo reciente sugiere que las consecuencias pueden ser mucho más duraderas y graves.
Un estudio realizado por Les Dethlefsen y colaboradores y publicado en el número de PLoS Biology del 18 de noviembre de 2008 reportó que la mayoría de los tipos de bacterias intestinales regresaban a sus niveles previos al tratamiento a las cuatro semanas de concluir un ciclo de cinco días de ciprofloxacina, un antibiótico de amplio espectro de uso extendido. Sin embargo unos cuantos tipos de bacterias no se habían recuperado aun seis meses después. Un estudio publicado en el número del ISME [International Society for Microbial Ecology] Journal de mayo de 2007 encontró que los niveles de algunos tipos de bacterias intestinales permanecían afectados hasta dos años después de un ciclo de siete días de clindamicina, el fármaco predilecto para tratar infecciones por Bacteroides.
De acuerdo con Janet Jansson, científica decana del equipo del Departamento de Ciencias de la Tierra del Laboratorio Nacional Lawrence Berkeley y primera autora del estudio del ISME Journal, es posible que estos cambios a largo plazo no tengan consecuencias reales para la salud: "Tal vez pierdas algunas especies o cepas, pero obtienes otras que asumen sus funciones", dice. "No sabemos si tiene o no importancia."
No obstante, el estudio de Jansson también reveló un incremento "drástico y persistente" en niveles de genes de resistencia específicos en los Bacteroides después del uso de la clindamicina. En las personas a quienes examinaron, en un principio los niveles de los genes de resistencia eran insignificantes, pero "se elevaron exponencialmente y permanecieron en ese nivel durante dos años", apunta Jansson. "Esos genes realmente persisten."
Quizás el ejemplo clásico de cómo la higiene ha alterado las microbiotas es el del Helicobacter pylori. En los años ochenta los investigadores aislaron por primera vez el microbio entonces conocido como Campylobacter pylori, si bien actualmente se cree que este microbio ha estado presente en la mayoría de los intestinos humanos durante milenios. Hoy en día, sin embargo, el incremento en la salubridad, la higiene y el uso de antibióticos ha diezmado las poblaciones intestinales de este microbio antes omnipresente. "En los países desarrollados", escribió Martin J. Blaser en el número de octubre de 2006 de EMBO [siglas en inglés de la Organización Europea de Biología Molecular] Reports, "las nuevas generaciones están creciendo sin nuestro antiguo compañero, H. pylori, para orquestar sus hormonas gástricas".
Si bien se ha demostrado que el H. pylori contribuye a la formación de adenocarcinoma y linfoma gástricos, así como de úlceras, investigaciones recientes han revelado otro aspecto de este microbio: en el número del Journal of the National Cancer Institute del 3 de marzo de 2004 Weimin Ye y sus colegas confirmaron que el H. pylori estaba asociado a una reducción considerable del riesgo de adenocarcinoma en el esófago bajo. Actualmente se considera también que el H. pylori modula funciones inmunológicas, endocrinas y fisiológicas en el estómago. En el número de Seminars in Radiation Oncology de enero de 2007, Rebecca S. Holmes y Thomas L. Vaughan escribieron: "La incidencia de infección [por H. pylori] ha ido disminuyendo en Estados Unidos y en otros países desarrollados, lo cual puede contribuir a la mayor incidencia de [adenocarcinoma esofágico]."
Debido a que otros factores además de las condiciones sanitarias pueden confundir los estudios epidemiológicos, los investigadores también han recurrido a los modelos animales en busca de conexiones entre la microbiota y diversas enfermedades. En el caso de los trastornos autoinmunes, Li Wen y colaboradores reportaron, en el número de Nature del 23 de octubre de 2008, que privar de microbiota a ratones condujo a la aparición más rápida de enfermedades más graves en un modelo de ratón con diabetes tipo I. Un reporte anterior de S. Brugman y colaboradores, publicado en el número de Diabetologia de septiembre de 2006 utilizó un modelo de rata para la diabetes tipo I. Los autores observaron que las ratas que llegado un momento desarrollaron la enfermedad tenían una cantidad menor de bacterias Bacteroides que las ratas que no desarrollaron la enfermedad. Más aún, el tratamiento con antibióticos disminuyó la incidencia y retrasó la aparición de la diabetes, mientras que una combinación de tratamiento con antibióticos y una alimentación protectora especial evitó por completo la enfermedad en esta rata con tendencia a la diabetes.
La alimentación y la obesidad
Muchas de las especies de microbios que viven en los intestinos metabolizan los alimentos y extraen calorías, y algunos microbios son más eficientes para hacerlo que otros. Debido a que los individuos poseen consorcios de bacterias ligeramente diferentes, es probable que los microbios de algunas personas utilicen más calorías, provocando quizá que este grupo tienda más al sobrepeso.
En el número de Proceedings of the National Academy of Sciences del 2 de agosto de 2005, Ley y otros investigadores encabezados por Jeffrey Gordon, director del Centro de Ciencias Genómicas de la Universidad de Washington, descubrieron que la microbiota intestinal de los ratones genéticamente obesos contenía un elevado porcentaje de bacterias del phylum FirmicutesSir, mientras que sus compañeros de camada delgados tenían más bacterias del phylum Bacteriodetes. En el número de Nature del 21/28 de diciembre de 2006, Ley reportó la misma observación en voluntarios humanos obesos y delgados. También descubrió que la microbiota de las personas obesas que perdieron peso por medio de una dieta baja en calorías cambiaron a un aspecto más similar al de las personas más delgadas.
Es difícil decir qué vino primero en algunos de estos estudios: la obesidad o la microbiota alterada. En otro estudio del mismo laboratorio de la Universidad Washington, publicado igualmente en el número de Nature del 21/28 de diciembre de 2006, los ratones libres de gérmenes fueron colonizados por la microbiota de ratones obesos, o bien, de ratones delgados. Los ratones que recibieron la microbiota de ratones obesos acumularon un porcentaje más alto de grasa corporal que los ratones que recibieron la microbiota de ratones delgados (47.0% contra 0.86%), lo que sugiere que los cambios de microbiota pueden contribuir a la aparición de la obesidad. Los investigadores también encontraron que al parecer la microbiota de los ratones obesos, que contenía más genes que participan en la descomposición de los azúcares, utilizaba de hecho más energía de la misma alimentación que la microbiota de ratones delgados. Los experimentos con trasplantes proporcionaron evidencias funcionales de que esta diferencia puede ser biológicamente relevante.
Junto con la observación de que los diferentes microbios y las distintas combinaciones microbianas pueden influir de maneras diferentes en el peso corporal, se están definiendo otros efectos con respecto a los cambios en el metabolismo humano. Por ejemplo, se ha identificado la disbiosis como factores inflamatorios que promueven la resistencia a la insulina y el aumento de peso, como lo señalaron Yolanda Sanz y colaboradores en una reseña publicada en línea el 3 de diciembre de 2008 antes de su publicación en letra impresa en Interdisciplinary Perspectives on Infectious Diseases.
Aun cuando no se relacionen con la obesidad, las diferencias de alimentación parecen influir en nuestra microbiota, si bien el modo como lo hacen sigue siendo hasta cierto punto un misterio, dice Nita Salzman, profesora adjunta de pediatría del Colegio de Medicina de Wisconsin. Los bebés amamantados tienden a tener en sus intestinos más bifidobacterias y lactobacilos que los bebés alimentados con fórmula. En un estudio reportado por Johan Dicksved y colaboradores en el número de Applied and Environmental Microbiology de abril de 2007, los niños criados de acuerdo con el estilo de vida "antroposófico" promovido por el filósofo Rudolf Steiner -con antibióticos restringidos y gran cantidad de alimentos fermentados ricos en microbios- demostraron tener una mayor diversidad microbiana que los niños criados en granjas, cuyas alimentaciones incluían más productos animales producidos en la granja.
"Definitivamente la alimentación puede ejercer un impacto sobre la composición [microbiana]", dice Ley. También es probable que los conservadores y otras sustancias químicas en nuestros alimentos, así como los antibióticos y sustancias químicas que damos a ingerir a nuestro ganado, influyan en nuestra microbiota, dice Salzman. "Probablemente todas estas cosas tienen un impacto sobre nuestra colonización", señala. Pero las implicaciones exactas de estos cambios para la salud siguen siendo oscuras.
La conexión entre el cerebro y los intestinos
Algunas investigaciones sugieren que la microbiota también puede estar implicada en ciertos padecimientos neurológicos. "Hay múltiples puntos de contacto en los que la microbiota podría ejercer impacto sobre nuestro sistema nervioso", dice Sonnenburg. Las neuronas entéricas inervan los intestinos y transmiten señales de éstos al sistema nervioso. La microbiota también produce metabolitos que son absorbidos al torrente sanguíneo, y algunos de estos metabolitos pueden cruzar la barrera entre la sangre y el cerebro. Pero otros estudios no han podido encontrar evidencias de una conexión entre la microbiota y los problemas neurológicos, y aún son escasos los detalles de los mecanismos potenciales. "Existe una buena base teórica para afirmar que la microbiota ejerce un impacto sobre nuestro sistema nervioso y, potencialmente, sobre la cognición", dice Sonnenburg. "Pero nos encontramos en las primerísimas etapas [de estudio]."
Al parecer el estrés psicológico reduce los números de especies de lactobacilos en los intestinos humanos, mientras que incrementa el crecimiento de los patógenos tales como las especies Escherichia coli y Pseudomona, según informan Femke Lutgendorff y colaboradores en el número de Current Molecular Medicine de junio de 2008. En el trabajo realizado en animales y publicado por Siobhain M. O'Mahoney sus colegas en el número de Biological Psychiatry de febrero de 2009, se sometió a crías de ratas a estrés separándolas de sus madres durante tres horas al día entre los días postnatales 2 a 12 (las crías seguían recibiendo leche materna). En comparación con los controles, las crías estresadas mostraron una microbiota fecal notablemente alterada. Se han reportado hallazgos similares en bebés de monos Rhesus separados de sus madres y en ratas adultas expuestas a estrés psicológico crónico.
Las patologías secundarias derivadas de los cambios inducidos por el estrés aún no están claras, pero la literatura científica contiene algunas posibilidades intrigantes. Se ha reportado que el estrés psicológico exacerba tanto la EII como otro trastorno intestinal, el síndrome de intestino irritable (SII), que se caracteriza por una variedad de síntomas intestinales tales como el dolor abdominal, hinchazón y estreñimiento. Múltiples estudios -incluyendo el trabajo de Anna Kassinen y colaboradores, publicado en el número de Gastroenterology de julio de 2007, y el de Mazen Issa, publicado en el número de Inflammatory Bowel Diseases de octubre de 2008- han identificado asimismo una microbiota intestinal anormal en las personas que padecen estos trastornos. Aun así, como lo señalan Sunny Singh y sus colegas en una reseña publicada el 31 de marzo de 2009 antes de la versión impresa en el American Journal of Gastroenterology, los estudios sobre el vínculo entre el estrés y el trastorno intestinal están limitados por la naturaleza subjetiva de la documentación del estrés psicológico.
Otras investigaciones han sugerido que los trastornos del espectro autista (ASD) pueden estar relacionados con una microbiota alterada. Helena Parracho y sus colegas reportan, en el número del Journal of Medical Microbiology de octubre de 2005, que 91.4% de 58 niños autistas estudiados padecían un trastorno GI, en comparación con 25% de los hermanos de los niños con ASD, que estaban sanos en otros sentidos, y ningún miembro de un grupo de niños sanos sin parentesco alguno con ellos. La biota fecal de los niños con ASD contenía consistentemente especies de clostridios diferentes de las de los niños sanos, así como un incremento estadísticamente significativo del total de especies de clostridios, lo cual sugiere que los factores ambientales y la genética pueden afectar las poblaciones intestinales de estas especies. Los investigadores señalan que las especies de clostridios producen no sólo enterotoxinas que dan lugar a problemas GI sino también neurotoxinas que, según su hipótesis, podrían dar lugar a signos característicos de los ASD.
En otra conexión potencial entre los intestinos y los ASD, se ha demostrado que el uso de antibióticos en ratas altera la microbiota intestinal de estos animales al grado de inhibir casi completamente la excreción de mercurio. Dado que la toxicidad debida al mercurio es una de las principales causas sospechadas de los ASD, algunos investigadores tienen la hipótesis de que el alto uso de antibióticos puede asimismo inhibir la capacidad de los niños de excretar el metal, incrementando el riesgo de padecer estos trastornos. "Específicamente", escribieron James B. Adams y sus colegas en el Journal of Toxicology and Environmental Health, Parte A, volumen 70, número 12 (2007), "los antibióticos orales reducen la cantidad de flora intestinal normal (que desmetilan el metilmercurio) y pueden incrementar la cantidad de levadura y E. coli (que metilan el mercurio inorgánico), dando como resultado una mayor absorción y una menor excreción de mercurio."
En busca de tratamientos
A medida que se revelan las conexiones entre la microbiota y las enfermedades, muchos investigadores tienen esperanzas de que resulte posible encontrar nuevos tratamientos para estos padecimientos centrándose en nuestras bacterias. Se están haciendo cada vez más intentos de tratar las enfermedades asociadas a la microbiota con probióticos y prebióticos. Los alimentos y suplementos alimenticios probióticos introducen microorganismos vivos que se establecen en los intestinos y se piensa que son benéficos para la salud. Generalmente contienen especies de lactobacilos o bifidobacterias; si bien algunos incluyen cepas no patógenas de estreptococos, E. coli, y parásitos nematodos. Los prebióticos se hacen con ingredientes tales como inulina, oligosacáridos, lactulosa, y el almidón resistente, que generalmente se piensa que estimulan el crecimiento de lactobacilos y bifidobacterias, si bien pueden estimular asimismo otras especies bacterianas, incluyendo las especies menos deseables de clostridios, como lo señala Yanbo Wang en una reseña publicada en el número de Food Research International de enero de 2009.
Entre las evidencias a favor de los probióticos que cuentan con mayor apoyo se encuentra la de que éstos producen mejorías en las diarreas virales infantiles, señala Sonnenburg. "Estas [evidencias] son muy sólidas y, creo, ampliamente aceptadas", añade. También existen investigaciones convincentes que demuestran que después del tratamiento con antibióticos los probióticos pueden ayudar a la microbiota a regresar rápidamente a una composición normal y a la vez reducir los movimientos intestinales de tipo diarreico, según lo demostraron Catherina J. M. Koning y colaboradores en el número de American Journal of Gastroenterology de enero de 2008.
Muchos estudios han proporcionado evidencias sobre la eficacia de los probióticos para padecimientos tales como el desarrollo de alergias, colitis ulcerativas y enfermedad de Crohn. En los ratones, se ha demostrado que los lactobacilos tienen efectos antidiabéticos y antitumorales. En su reseña Interdisciplinary Perspectives on Infectous Diseases, Sanz y sus colegas describieron las evidencias preliminares de que los probióticos y prebióticos con propiedades antiinflamatorias podían ser eficaces contra la obesidad, la diabetes y otros trastornos asociados. Por ejemplo, la suministración de un probiótico ejerció un efecto preventivo contra la diabetes tipo 1 en un modelo de ratones diabéticos no obesos mediante mecanismos inmunomoduladores, según se reportó en el número de Diabetologia de agosto de 2005.
No obstante, los hallazgos de las investigaciones sobre la eficacia de los probióticos no son siempre consistentes, dice Sonnenburg. "Hay algunos excelentes estudios sugerentes en los que vemos un impacto de los probióticos, pero hay otros tantos o más en los que no hay tal impacto", dice.
Una reseña de Darren M. Brenner y sus colegas, publicada en el número de abril de 2009 del American Journal of Gastroenterology, determinó que una cepa particular de Bifidobacterium infantis fue el único probiótico estudiado en 16 pruebas aleatorizadas controladas que consistentemente mostró evidencias de mejorar los síntomas del SII. Sin embargo, los autores escribieron que la mayoría de las pruebas no utilizaron un estudio de diseño apropiado, o bien no reportaron suficientemente los sucesos adversos, de modo que fue imposible evaluar la eficacia de otros probióticos. Brenner y sus colegas escribieron que los estudios futuros sobre los probióticos deberían utilizar criterios de diagnóstico estandarizados para poder obtener una evaluación apropiada de la eficacia de los probióticos. "Estamos en buena medida en pañales en este campo", dice Ley. "Hay mucho que aún no entendemos."
Aun así, el tratamiento de enfermedades con probióticos o prebióticos es una de las fronteras más prometedoras en la investigación de la microbiota, señala Mélanie Gareau, becaria de postdoctorado en el Hospital de Niños Enfermos de Toronto. Su trabajo, publicado en el número de noviembre de 2007 de Gut, ha demostrado que el tratamiento de las anormalidades intestinales inducidas por estrés mediante probióticos a base de lactobacilos no sólo restableció la función intestinal y el comportamiento bacteriano normales sino también redujo los niveles de hormonas de estrés. "Definitivamente, el papel de los probióticos en el mantenimiento de la microbiota del colon es un aspecto interesante de este emocionante campo que está avanzando rápidamente", apunta.
Exploración del metagenoma
Entre otros aspectos prometedores de la investigación sobre la microbiota se incluyen los avances en las tecnología de secuenciación que permiten estudiar a un enorme número de seres humanos y sus microbios, dice Ley. Las encuestas globales sobre la microbiota humana, por ejemplo, pueden comenzar a abordar cuestiones sobre el modo en que la geografía, la historia, la alimentación y la cultura intervienen en la determinación de la estructura y la función de la microbiota. También se han proyectado estudios de asociación genómica para examinar cómo las variaciones genéticas del genoma humano predicen la composición de la microbiota. Ley dice que para estudiar estas cuestiones de una manera confiable los investigadores necesitan obtener el perfil de las microbiotas de grandes cantidades de personas.
A fin de proporcionar una base que permita responder algunas de estas preguntas, los Institutos Nacionales de Salud de EUA lanzaron el Proyecto del Microbioma Humano a fines de 2007. Se calcula que el proyecto distribuirá 115 millones de dólares a lo largo de cinco años para determinar qué partes de la microbiota son similares en todos los seres humanos y qué partes son diferentes, y cómo estas diferencias pueden relacionarse con la enfermedad. La Comisión Europea está financiando un esfuerzo paralelo, llamado Metagenómica del Tracto Intestinal Humano, y en octubre de 2008 los científicos de todo el mundo formaron el Consorcio Internacional del Microbioma Humano para compartir datos sobre el metagenoma humano -que comprende los genomas de todos nuestros microorganismos comensales- entre los investigadores de todo el mundo.
Según Sonnenburg, es probable que el poder secuenciar fácil y rápidamente miles de microbios abra un nuevo campo: la consideración de la microbiota del individuo en el desarrollo de la medicina personalizada. Las diferencias ente las microbiotas de cada persona influirán no sólo en sus riesgos para la salud sino también en el modo en que responden a las intervenciones que incluyen el tratamiento con probióticos y los cambios alimentarios, dice. "Debemos pensar que las diferencias entre nuestras microbiotas son análogas a las diferencias genéticas que determinan nuestras diversas respuestas.", dice.
El solo saber cuáles son los componentes de nuestras microbiotas no bastará para alcanzar esta meta, según Salzman. Aun cuando podamos determinar toda la microbiota a nivel de las especies y todos los genes del metagenoma, "sigue siendo difícil decir cuál de estas cosas es realmente importante para determinar la salud o la enfermedad". Por ello actualmente los esfuerzos para proporcionar este tipo de comprensión no se están enfocando en las secuencias genómicas de las bacterias residentes sino en las proteínas que éstas producen."
En el número del ISME Journal de febrero de 2009, el grupo de Jansson publicó un análisis del proteoma bacteriano humano -los miles de proteínas bacterianas que se expresan en nuestros cuerpos. "El proteoma... [te dice] lo que realmente está pasando en los intestinos", dice. Ella y sus colegas descubrieron que las proteínas que intervienen en el metabolismo de los carbohidratos y en la utilización de los alimentos tenían una expresión muy elevada, mientras que otras proteínas, como las que participan en la motilidad, se encontraban casi ausentes. Actualmente están trabajando en el análisis de los proteomas microbianos de personas con enfermedad de Crohn.
Otra manera de analizar la función microbiana relevante consiste en examinar los metabolitos producidos por los microbios; esto revela no sólo lo que las bacterias están expresando sino lo que el cuerpo está absorbiendo de hecho, señala Salzman. Un estudio realizado por William R. Wikof y colaboradores, publicado en el número del 10 de marzo de 2009 de Proceedings of the National Academy of Sciences demuestra que muchos aspectos del metabolismo de los mamíferos dependen de la microbiota. En ausencia de una microbiota, los metabolitos que se encuentran en la sangre de los ratones se modificaron de manera significativa, lo cual sugiere que probablemente la capacidad de un animal de metabolizar los fármacos -y por extensión muchas otras sustancias químicas- depende en parte de su comunidad de microbios.
Combinar los inventarios genómicos de las especies microbianas que habitan dentro de nosotros con el análisis funcional de las proteínas que expresan y de los metabolitos que absorbemos hará que "este campo avance significativamente en lo que se refiere a comprender qué está pasando y cómo esto se relaciona con la enfermedad", señala Salzman. "Los avances tecnológicos han impulsado profundamente este campo, pero sigo pensando que probablemente estamos apenas en el comienzo."
* Publicado originalmente en Environmental Health Perspectives, volumen 117, número 5, mayo 2009, páginas A198-A205