Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Salud Pública de México
versión impresa ISSN 0036-3634
Salud pública Méx vol.50 no.2 Cuernavaca mar./abr. 2008
ARTÍCULOS ORIGINALES
Factores pronósticos relacionados con la supervivencia del cáncer de mama
Prognostic factors related to breast cancer survival
Lourdes Flores-Luna, Dr ScI; Eduardo Salazar-Martínez, MD, Dr ScI, II; Reyna Margarita Duarte-Torres, MDIII; Gabriela Torres-Mejía, MD, Dr ScI; Patricia Alonso-Ruiz, MDIII; Eduardo Lazcano-Ponce, MD, Dr Sc.I
ICentro de Investigación en Salud Pública, Instituto Nacional de Salud Pública. Cuernavaca, Morelos, México
IIInstituto Mexicano del Seguro Social. Cuernavaca, Morelos, México
IIIUnidad de Patología del Hospital General de México. México, DF
RESUMEN
OBJETIVO: Evaluar los factores pronósticos del cáncer de mama en mujeres mexicanas.
MATERIAL Y MÉTODOS: Se incluyó a 432 mujeres con cáncer de mama admitidas de 1990 a 1999 en el Hospital General de México para evaluar la supervivencia mediante las técnicas de Kaplan-Meier y los métodos de riesgos proporcionales de Cox.
RESULTADOS: La supervivencia global a cinco años fue de 58.9%. La menor supervivencia corresponde a los estadios clínicos IIIB (47.5%), IIIA (44.2%) y IV(15%), la metástasis hematógena fue de 21.4% y el tumor positivo en bordes quirúrgicos de 12.5%. La invasión linfovascular (RR= 1.9; IC95% 1.3-2.8), el estadio clínico IV (RR= 14.8; IC95% 5.5-39.7) y el tumor en bordes quirúrgicos (RR= 2.4; IC95% 1.2-4.8) fueron los principales factores pronósticos.
CONCLUSIONES: Estos resultados dan consistencia a los criterios de diagnóstico y tratamiento de las mujeres con cáncer de mama atendidas en México y toman en consideración las condiciones de la tumoración, como extensión de la malformación, etapa clínica y estado de los ganglios linfáticos antes de decidir la conducta terapéutica inicial.
Palabras clave: supervivencia; cáncer de mama; factores pronósticos; estadio clínico; México
ABSTRACT
OBJECTIVE: To evaluate prognostic factors for breast cancer in Mexican women.
MATERIAL AND METHODS: Four hundred and thirty two women with breast cancer, admitted from 1990 to 1999 to the General Hospital of Mexico, were included to evaluate their survival using the Kaplan-Meier technique and Cox proportional hazard method.
RESULTS: Overall 5-year survival was 58.9%. The shortest survival rate corresponds to the clinical stage (IIIB, 47.5%; IIIA, 44.2%; and IV, 15%), the haematological metastasis (21.4%) and surgical edges with positive tumor (12.5%). Lymph node-positive (RR, 1.9; IC95%, 1.3-2.8), clinical stage IV (RR, 14.8; IC95%, 5.5-39.7) and surgical edges with positive tumor (RR, 2.4; IC95%, 1.2-4.8) were the central prognostic factors.
CONCLUSIONS: These results give consistency to diagnostic and therapeutic criteria for women with breast cancer who receive medical attention in Mexico, taking into consideration the characteristics of the tumor –such as extension, clinical stage and status of the lymph nodes– before making a decision as to the initial therapy.
Key words: survival; breast cancer; prognostic factors; clinical stage; Mexico
Desde hace varias décadas, el cáncer de mama (CM) se ha incrementado en grado notable alrededor del mundo, sobre todo en países occidentales1 y este crecimiento permanece, a pesar de que existen mejores instrumentos de diagnóstico, diversos programas de detección temprana, mejores tratamientos y mayor conocimiento de los factores de riesgo. En México, el CM también ha mostrado un aumento en los indicadores de salud. La incidencia calculada es de 38.4 por 100000 mujeres y la mortalidad estandarizada se ha duplicado en los últimos 20 años (12.2 muertes por 100000 mujeres). Los factores de riesgo identificados en la población incluyen edad tardía al primer embarazo, disminución de la duración de la lactancia, sedentarismo2 y elevado consumo de carbohidratos,3 combinado con un incremento de la obesidad y un gran consumo de carbohidratos en la población general.4 Por otro lado, el estudio de factores relacionados con el pronóstico de la enfermedad ha enfatizado la importancia de las características celulares y demográficas en la supervivencia y mortalidad de las mujeres con CM. Las características celulares notificadas con más frecuencia incluyen la estirpe histológica, la cual es un excelente indicador de supervivencia debido a su comportamiento biológico (p. ej., los subtipos tubulolobular, tubular, cribiforme y mucinoso puro presentan una supervivencia mayor de 80%).5-7 Otra característica celular es el grado histológico de diferenciación, que gracias a sus cambios morfológicos (tamaño, hipercromasia, pleomorfismo) permite establecer criterios de proliferación tumoral; en consecuencia, tumores apenas diferenciados representan menor supervivencia y mayor recurrencia que los bien diferenciados8-11 y su importancia se extiende para decidir su tratamiento con terapia adyuvante de acuerdo con resultados de biopsia o espécimen quirúrgico.12-16 De manera adicional, se ha señalado que la infiltración tumoral ganglionar es un factor pronóstico aislado y la causa más común de muerte en mujeres con CM.17,18 Otros factores notificados con la supervivencia son la edad, la raza, la presencia de receptores hormonales y algunos marcadores de proliferación celular (HER 2/neu, p53, nm23, Bcl-2.).18-20 A pesar de estas publicaciones internacionales mostradas, en México los informes son escasos; por consiguiente, en este estudio se evalúan la supervivencia y sus factores pronósticos en una muestra de mujeres mexicanas con CM.
Material y métodos
Se analizó una cohorte histórica con 10 años de se-guimiento, que incluyó a 2 070 mujeres durante el periodo de 1990 a 1999 en el servicio de Oncología del Hospital General de la Ciudad de México. Del total de mujeres atendidas en el periodo, se eligió a 432 con características sociodemográficas homogéneas con los siguientes criterios de inclusión: a) mujeres con biopsia aspiración con agua fina (BAAF) positivo a cáncer de mama, corroborado con estudio anatomopatológico y b) mujeres con tratamiento recibido en el hospital. No se incluyó en el protocolo a las personas con BAAF positivo a CM sin corroboración anatomopatológica, o quienes se sometieron a tratamiento en otro hospital, así como las mujeres que no contaran con la laminilla de la BAAF para determinar el grado nuclear. Asimismo, se excluyó a las pacientes con material de mala calidad y las sometidas a tratamiento adyuvante de quimioterapia o radioterapia.
Para la evaluación del grado nuclear se utilizó el esquema de estadificación de Fisher modificado por Black. El estadio clínico y el tamaño del tumor se basaron en la clasificación TNM.21 Dichas actividades de clasificación, estadificación y etapificación las llevaron a cabo patólogos del Hospital General, los cuales están certificados y cuentan con amplia experiencia. De forma adicional, el jefe del Servicio de Patología revisó la totalidad de los casos. Todas las mujeres correspondieron a la misma cohorte y su inclusión en el estudio dependió de modo exclusivo del diagnóstico, cualquiera que fuera su fecha.
La información se obtuvo a través de un formato estructurado diseñado de manera específica para el estudio y como fuente de información se tomaron los expedientes clínicos de la Unidad de Oncología del mismo hospital. En el formato se incluyeron las siguientes secciones: a) datos de identificación de la mujer; b) características sociodemográficas; c) antecedentes ginecoobstétricos; d) antecedentes de utilización de métodos de planificación familiar; e) características del diagnóstico (fecha, etapa clínica, rastreo óseo, rastreo hepático); f) tratamiento (resección, radioterapia, quimioterapia); y g) características morfológicas (ganglios por región, metástasis, límites del tumor). El llenado del formato estructurado lo efectuaron dos patólogos adiestrados de modo conveniente para el vaciado de la información. El Comité de Ética del Hospital General de México estudió y avaló el protocolo de estudio.
La variable de respuesta se construyó con base en el tiempo transcurrido entre el momento del diagnóstico de CM realizado por BAAF y la ocurrencia de la muerte. La variable de censura se definió a partir de las mujeres que sobrevivieron durante el periodo de estudio y como mecanismo de censura se utilizaron los siguientes criterios: a) todas las mujeres que permanecieron vivas hasta el final del periodo del estudio, b) pérdida durante el seguimiento (cambio de domicilio no notificado, falta de seguimiento del tratamiento) y c) muerte por otra causa diferente del CM.
Análisis estadístico
Supervivencia
Se realizó un análisis mediante la técnica de Kaplan-Meier,22 la cual toma en cuenta tanto la información que proporcionan las mujeres que murieron como la de aquellas que se censuraron por alguna de las causas ya descritas, además de la supervivencia por grado nuclear, la etapa clínica y el tipo de síntomas. La supervivencia se determinó a los cinco años para cada variable. En el análisis estratificado se utilizó la prueba de Log-Rank23 para evaluar las diferencias entre las curvas de supervivencia.
Factores pronósticos
Se efectuó un análisis multivariado de aquellas variables significativas en el análisis estratificado y otras biológicamente plausibles mediante el modelo de riesgos proporcionales de Cox.24 El estimador puntual empleado fue la razón de riesgos (RR), con intervalos de confianza al 95%. La evaluación del modelo se llevó a cabo a través del supuesto de riesgos proporcionales con los residuos de Schoenfeld, que el modelo construido satisfizo. El ajuste del modelo se verificó a través de los residuos de Cox-Snell y la linealidad de los regresores se evaluó a través de los residuos de Martingalas.25-27 Se usó para el análisis estadístico el paquete estadístico Stata v-9.*
Resultados
Análisis descriptivo
La distribución de la edad mostró que el grupo de mujeres de 35 a 44 años correspondió a 28.5%, el de 45 a 54 años a 24.5%, el de 55 a 64 años a 76%, el de mayores de 65 años a 22.8% y, por último, el grupo de menores de 29 años registró la menor frecuencia (6.7%).
Al final del periodo de seguimiento, 166 mujeres fallecieron por CM (38.4%). De las 432 mujeres dentro el estudio, 42 correspondieron al estadio clínico I (9.7%), 98 al estadio clínico IIA (22.7%), 129 al estadio clínico IIB (29.9%), 71 al estadio clínico IIIA (16.5%), 79 al estadio clínico IIIB (18.3%) y sólo 12 a la etapa clínica IV (2.8%).
El grado nuclear 2 fue el más frecuente con 78.5%, mientras que el tipo histológico más común fue el canalicular infiltrante típico con 94.9% (n=409).
Supervivencia
La supervivencia global a los cinco años fue de 59.9% (figura 1). Se halló que las mujeres con estadio clínicoI presentaron la mayor supervivencia (82%), seguidas por aquellas con estadios IIB (70.4%), IIA (65.3%), IIIB (47.5%), IIIA (44.2%) y al final aquellas con estadio IV (15%); la diferencia de las curvas de supervivencia fue estadísticamente significativa (p<0.01). El efecto de mayor infiltración metastásica fue notorio en las mujeres con metástasis hematógenas, quienes mostraron la menor supervivencia (21.4%; p<0.01). Las mujeres que recibieron quimioterapia y radioterapia tuvieron la menor supervivencia (52%) aunque esta diferencia no fue significativa (p=0.36). En las mujeres que no tuvieron persistencia del CM, la supervivencia fue de 72.3%, a diferencia de aquellas que sí la presentaron, en las cuales se identificó una supervivencia de 12.6% (p<0.01)(cuadro I).


La evaluación de la estirpe histológica, el tamaño del tumor y la invasión linfovascular no evidenciaron diferencias significativas entre los grupos. En las mujeres que registraron más de 10 ganglios linfáticos con metástasis la supervivencia fue menor (45.4%) respecto de las mujeres que tuvieron cuatro a nueve ganglios (51.5%) y uno a tres ganglios positivos (63.50%), si bien esta diferencia fue limítrofe (p=0.06). Sin embargo, todas las características morfológicas celulares no fueron estadísticamente diferentes con los grupos de comparación (cuadro II).

Factores pronósticos para la supervivencia
Se reconoció una menor supervivencia en relación con el estadio clínico IIIA (RR = 4.2; IC95% 1.9-9.2), el estadio clínico IIIB (RR = 4.0; IC95% 1.8-8.9), el estadio IV (RR = 14.8; IC95% 5.5-39.7), la presencia de invasión linfovascular (RR = 1.9; IC95% 1.3-2.8) y la presencia de tumor en bordes quirúrgicos (RR = 2.4; IC95% 1.2-4.8) (cuadro III).
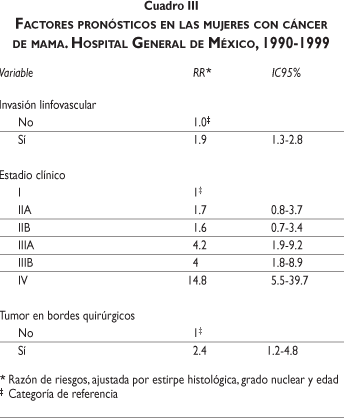
Otros factores sin valor pronóstico para la supervivencia fueron la edad de la menarca,28 edad de inicio de la vida sexual, número de partos, uso de hormonales,29 tipo de tratamiento y bordes infiltrantes (datos no mostrados en los cuadros).
Discusión
La presencia de metástasis ganglionar mostró ser un predictor importante en la recurrencia y supervivencia en esta muestra de las mujeres. Las metástasis ganglionares redujeron la supervivencia a cinco años en cerca de 40%, cuando se compara con pacientes que no tienen enfermedad ganglionar metastásica. El número de ganglios linfáticos con metástasis también tiene relevancia pronóstica y el conocimiento del estado ganglionar de las pacientes con tumores mayores de 1.0 cm puede cambiar el tipo de tratamiento indicado.30
La invasión linfovascular es un factor pronóstico en el presente trabajo. La presencia de invasión vascular es un predictor de recurrencia temprana31 y es un factor histológico de supervivencia, vinculado además con un pobre pronóstico de supervivencia, independiente de otros factores clínicos y celulares.32 Las mujeres con invasión linfovascular poseen un riesgo mayor de 70% de recurrencia temprana (dos años). La invasión linfovacular también es un marcador pronóstico en mujeres premenopáusicas y posmenopáusicas con CM. En un estudio realizado en Estados Unidos,33 55% de las mujeres premenopáusicas y perimenopáusicas con invasión vascular tuvo recurrencia a los dos años, en comparación con 21% de recurrencia en mujeres sin invasión vascular. En mujeres posmenopáusicas, 36% de las que presentaron invasión vascular sufrió recurrencia, respecto de 11% de las que no tuvieron invasión vascular. En este mismo estudio, 23% de las mujeres en estadio clínico I mostró invasión vascular, en comparación con 48% en las mujeres con estadio clínico IV.
En este estudio se halló que la presencia de tumor en los bordes quirúrgicos reduce la supervivencia de mujeres con CM. La escisión amplia del tumor primario es necesaria para obtener un óptimo control local del tumor. Los procedimientos quirúrgicos como la biopsia incisional, antes de la radioterapia, proporcionan límites muy altos e inaceptables de recurrencia. En términos ideales, el procedimiento quirúrgico debe ser lo suficientemente amplio para asegurar un alto porcentaje de control local, pero no tan grande que comprometa el resultado cosmético. La mastografía, al proveer información esencial sobre la extensión de la enfermedad, puede ser útil como guía para determinar la extensión de la resección quirúrgica. Una evaluación anatomopatológica correcta provee información útil para determinar la extensión tumoral en la glándula mamaria y en pacientes con bordes quirúrgicos no evaluados, por deficiencia del espécimen, la extensión del componente intraductal ha demostrado ser el mayor predictor de recurrencia. Pueden existir varias dificultades técnicas en la evaluación microscópica de los bordes quirúrgicos en los especímenes de resección mamaria; una de ellas es la falta de orientación del espécimen por el cirujano, otra es la tendencia del marcaje con tinta china de introducirse dentro de la tumoración a través de defectos en su superficie y una más el hecho de que la superficie de las piezas es con frecuencia compleja e irregular y difícil de evaluar de modo apropiado.34 El riesgo de recurrencias tumorales ipsolaterales en pacientes sometidas a resecciones conservadoras es significativamente más alto que el riesgo de recurrencias locales después de una mastectomía, por lo que es necesario un tratamiento local radical para asegurar adecuados márgenes quirúrgicos y, de esta forma, minimizar las recurrencias tumorales. Además, la radiación posterior a la mastectomía ha mostrado reducir en dos tercios las recurrencias locales y aumentar la supervivencia en pacientes con metástasis ganglionares.35,36
El estadio clínico ha sido un factor pronóstico que se ha relacionado con el CM; un estadio avanzado implica una menor supervivencia y un riesgo mayor de morir a causa del CM;37,38 en este estudio se observó dicho efecto.
El presente estudio no mostró nexo entre el grado nuclear, la estirpe histológica y el tamaño del tumor con la supervivencia de las mujeres con CM, los cuales son tres de los factores pronósticos más importantes mencionados en la bibliografía.7,8,12,16 Esto se debió, con toda probabilidad, al número de censuras informado. El tamaño del tumor y el grado nuclear son variables independientes para la supervivencia, pero sólo en mujeres con ganglios linfáticos negativos39 y, en el presente estudio, sólo 9.7% de las pacientes se encontró en el estadio clínico I.
Con respecto al tamaño del tumor y la extensión a los ganglios linfáticos axilares, éstos se consideran dos de los indicadores pronósticos más importantes. La supervivencia varía de 45.5% en tumores iguales o mayores de 5 cm con ganglios linfáticos positivos a 96.3% en tumores menores de 2 cm, con o sin metástasis ganglionares. El tamaño del tumor y el estado de los ganglios linfáticos actúan como indicadores pronósticos independientes, pero aditivos. Al incrementarse el tamaño de la malformación, la supervivencia decrece, cualquiera que sea el estado ganglionar, y al aumentar el número de ganglios positivos la supervivencia también disminuye, al margen del tamaño de la tumoración. Diversos estudios16,40,41 notifican que el tamaño del tumor es directamente proporcional a la supervivencia, pero sólo en los casos con ganglios linfáticos positivos, por lo que el tamaño del tumor, por sí mismo y en forma aislada, no tiene consecuencias en la supervivencia de las pacientes, como se mostró en este estudio.
La edad temprana se ha vinculado con una menor supervivencia en mujeres con CM;42,43 sin embargo, en este protocolo no se reconoció diferencia en las curvas de supervivencia a pesar de que las mujeres más jóvenes tuvieron menor supervivencia que las personas mayores de 65 años de edad.
Dentro de las limitaciones del estudio puede mencionarse que se trata de una cohorte histórica con criterios de selección bien definidos, que permite calcular la supervivencia de las mujeres con CM en una muestra de mujeres que acuden al Hospital General de México para su atención y que su validez depende de la calidad de los registros utilizados. Esta cohorte inició con población seleccionada con información completa, por lo que no se representaron pérdidas. Pese a ello, el tamaño de la muestra limitó la evaluación de aquellas variables que se estratificaron, tal y como sucedió con la edad, el tipo de tratamiento recibido o la estirpe histológica. Se requieren estudios posteriores que cuenten con mayor potencia estadística para evaluar estas características.
Por último, es posible concluir que los estadios clínicos tardíos, la presencia de metástasis y la persistencia del CM tuvieron una menor supervivencia a cinco años en esta población de mujeres y que los factores pronósticos que determinan esta supervivencia fueron la invasión linfovascular, los estadios III y IV y la presencia de tumor en los bordes quirúrgicos. Estos resultados confieren consistencia a los criterios de diagnóstico y tratamiento de mujeres con cáncer mamario atendidas en México y toman en consideración las condiciones de la tumoración, por ejemplo la extensión del tumor, la etapa clínica y el estado de los ganglios linfáticos antes de decidir la conducta terapéutica inicial.
Agradecimientos
Los autores se muestran agradecidos con las citotecnólogas Sandra Robles Sánchez, Clemencia Sosa Cazarín y Lourdes Munguía Richardson del Hospital General de México por su valiosa cooperación en la obtención de los datos, además de la CP María de Lourdes Jiménez Mendoza por su gran ayuda en la captura de datos y el Dr. Humberto Cruz Ortiz por sus agudos comentarios.
Este trabajo sirvió de tesis para obtener el diplomado del curso de subespecialidad de citopatología a la Dra. Norma Jiménez. El material quirúrgico evaluado pertenece a la sección de Patología Quirúrgica del Hospital General de México, OD.
Referencias
1. McPherson K, Steel CM, Dixon JM. ABC of breast diseases. Breast cancer-epidemiology, risk factors, and genetics. Bmj 2000;321(7261):624-628. [ Links ]
2. López-Ríos O, Lazcano-Ponce EC, Tovar-Guzman V, Hernández-Avila M. Epidemiology of cancer of the breast in Mexico. Consequences of demography transition. Salud Publica Mex 1997;39(4):259-265. [ Links ]
3. Romieu I, Lazcano-Ponce E, Sanchez-Zamorano LM, Willett W, Hernández-Avila M. Carbohydrates and the risk of breast cancer among Mexican women. Cancer Epidemiol Biomarkers Prev 2004;13(8):1283-1289. [ Links ]
4. Rivera DJ SL, Villalpando HS, González CT, Hernández PB. Encuesta Nacional de nutrición 1999. Estado nutricional de niños y mujeres en México. Cuernavaca: Instituto Nacional de Salud Pública, 2001. [ Links ]
5. Simpson JF, Page DL. Status of breast cancer prognostication based on histopathologic data. Am J Clin Pathol 1994;102(4 suppl 1):S3-S8. [ Links ]
6. Pereira H, Pinder SE, Sibbering DM, Galea MH, Elston CW, Blamey RW, et al. Pathological prognostic factors in breast cancer. IV: should you be a typer or a grader? A comparative study of two histological prognostic features in operable breast carcinoma. Histopathology 1995;27(3):219-226. [ Links ]
7. Ellis IO, Galea M, Broughton N, Locker A, Blamey RW, Elston CW. Pathological prognostic factors in breast cancer. II. Histological type. Relationship with survival in a large study with long-term follow-up. Histopathology 1992;20(6):479-489. [ Links ]
8. Elston CW, Ellis IO. Pathological prognostic factors in breast cancer. I. The value of histological grade in breast cancer: experience from a large study with long-term follow-up. Histopathology 1991;19(5):403-410. [ Links ]
9. NIH consensus conference. Treatment of early-stage breast cancer. JAMA 1991;265(3):391-395. [ Links ]
10. Dabbs DJ, Silverman JF. Prognostic factors from the fine-needle aspirate: breast carcinoma nuclear grade. Diagn Cytopathol 1994;10(3):203-208. [ Links ]
11. Masood S. Prognostic factors in breast cancer: use of cytologic preparations. Diagn Cytopathol 1995;13(5):388-395. [ Links ]
12. Fisher ER, Redmond C, Fisher B, Bass G. Pathologic findings from the National Surgical Adjuvant Breast and Bowel Projects (NSABP). Prognostic discriminants for 8-year survival for node-negative invasive breast cancer patients. Cancer 1990;65(9 suppl):2121-2128. [ Links ]
13. Hortobagyi GN, Ames FC, Buzdar AU, Kau SW, McNeese MD, Paulus D, et al. Management of stage III primary breast cancer with primary chemotherapy, surgery, and radiation therapy. Cancer 1988;62(12): 2507-2516. [ Links ]
14. Ciatto S, Bonardi R, Herd-Smith A, Cariaggi P, Confortini M, Bulgaresi P. Prognostic value of breast cancer cytologic grading: a retrospective study of 213 cases. Diagn Cytopathol 1993;9(2):160-163. [ Links ]
15. Dabbs DJ. Role of nuclear grading of breast carcinomas in fine needle aspiration specimens. Acta Cytol 1993;37(3):361-366. [ Links ]
16. Carter CL, Allen C, Henson DE. Relation of tumor size, lymph node status, and survival in 24,740 breast cancer cases. Cancer 1989;63(1): 181-187. [ Links ]
17. Price JE. The biology of metastatic breast cancer. Cancer 1990;66 (6 suppl):1313-1320. [ Links ]
18. Lage A, Rodriguez M, Pascual MR, Diaz JW, Fernandez L. Factors associated with prognosis in human breast cancer. I. Predictors for rate of evolution and relapse. Neoplasma 1983;30(4):475-483. [ Links ]
19. Schaefer G, Rosen PP, Lesser ML, Kinne DW, Beattie EJ, Jr. Breast carcinoma in elderly women: pathology, prognosis, and survival. Pathol Annu 1984;19(Pt 1):195-219. [ Links ]
20. Young JL Jr, Ries LG, Pollack ES. Cancer patient survival among ethnic groups in the United States. J Natl Cancer Inst 1984;73(2):341-352. [ Links ]
21. Sobin LH, Fleming ID. TNM Classification of Malignant Tumors, fifth edition (1997). Union Internationale Contre le Cancer and the American Joint Committee on Cancer. Cancer 1997;80(9):1803-1804. [ Links ]
22. Kaplan MP. Nonparametric estimation from incompleteobservations. J Am Scat Assoc 1958;53:457-481. [ Links ]
23. Mantel N. Evaluation of survival data and two new rank orden statistics arising in this consideration. Cancer Chemother Resp 1966;50:163-170. [ Links ]
24. Cox DR. Regression models and life tables. J R Statist Soc 1972;74(B):197-220. [ Links ]
25. Cox DR, Snell EJ. A general definition of residuals. J R Statist Soc 1968;30(A):248-275. [ Links ]
26. Schoenfeld D. Chi-squared goodness of fit test for the proportional hazards regression model. Biometrika 1980;67:145-153. [ Links ]
27. Schoenfeld D. Patial residuals for the proportional hazards regreession model. Biometrika 1982;69:239-241. [ Links ]
28. Garfinkel L, Boring CC, Heath CW Jr. Changing trends. An overview of breast cancer incidence and mortality. Cancer 1994;74(1 suppl):222-227. [ Links ]
29. Armstrong K, Eisen A, Weber B. Assessing the risk of breast cancer. N Engl J Med 2000;342(8):564-571. [ Links ]
30. McMasters KM, Giuliano AE, Ross MI, Reintgen DS, Hunt KK, Byrd DR, et al. Sentinel-lymph-node biopsy for breast cancer—not yet the standard of care. N Engl J Med 1998;339(14):990-995. [ Links ]
31. Davis BW, Gelber RD, Goldhirsch A, Hartmann WH, Locher GW, Reed R, et al. Prognostic significance of tumor grade in clinical trials of adjuvant therapy for breast cancer with axillary lymph node metastasis. Cancer 1986;58(12):2662-2670. [ Links ]
32. Fisher ER, Anderson S, Tan-Chiu E, Fisher B, Eaton L, Wolmark N. Fifteen-year prognostic discriminants for invasive breast carcinoma: National Surgical Adjuvant Breast and Bowel Project Protocol-06. Cancer 2001;91(8 suppl):1679-1687. [ Links ]
33. Weigand RA, Isenberg WM, Russo J, Brennan MJ, Rich MA. Blood vessel invasion and axillary lymph node involvement as prognostic indicators for human breast cancer. Cancer 1982;50(5):962-969. [ Links ]
34. Connolly JL, Boyages J, Nixon AJ, Peiro G, Gage I, Silver B, et al. Predictors of breast recurrence after conservative surgery and radiation therapy for invasive breast cancer. Mod Pathol 1998;11(2):134-139. [ Links ]
35. Meric F, Mirza NQ, Vlastos G, Buchholz TA, Kuerer HM, Babiera GV, et al. Positive surgical margins and ipsilateral breast tumor recurrence predict disease-specific survival after breast-conserving therapy. Cancer 2003;97(4):926-933. [ Links ]
36. Veronesi U. How important is the assessment of resection margins in conservative surgery for breast cancer? Cancer 1994;74(6):1660-1661. [ Links ]
37. Shavers VL, Harlan LC, Stevens JL. Racial/ethnic variation in clinical presentation, treatment, and survival among breast cancer patients under age 35. Cancer 2003;97(1):134-147. [ Links ]
38. Jmor S, Al-Sayer H, Heys SD, Payne S, Miller I, Ah-See A, et al. Breast cancer in women aged 35 and under: prognosis and survival. J R Coll Surg Edinb 2002;47(5):693-699. [ Links ]
39. Fisher ER, Anderson S, Redmond C, Fisher B. Pathologic findings from the National Surgical Adjuvant Breast Project protocol B-06. 10-year pathologic and clinical prognostic discriminants. Cancer 1993;71(8): 2507-2514. [ Links ]
40. Henson DE, Ries L, Freedman LS, Carriaga M. Relationship among outcome, stage of disease, and histologic grade for 22,616 cases of breast cancer. The basis for a prognostic index. Cancer 1991;68(10):2142-2149. [ Links ]
41. Abner AL, Collins L, Peiro G, Recht A, Come S, Shulman LN, et al. Correlation of tumor size and axillary lymph node involvement with prognosis in patients with T1 breast carcinoma. Cancer 1998;83(12): 2502-2508. [ Links ]
42. Adami HO, Malker B, Holmberg L, Persson I, Stone B. The relation between survival and age at diagnosis in breast cancer. N Engl J Med 1986;315(9):559-563. [ Links ]
43. El Saghir NS, Seoud M, Khalil MK, Charafeddine M, Salem ZK, Geara FB, et al. Effects of young age at presentation on survival in breast cancer. BMC Cancer 2006;6:194. [ Links ]
Fecha de recibido: 18 de enero de 2007
Fecha de aceptado: 26 de octubre de 2007
Solicitud de sobretiros: Dr. Eduardo Salazar Martínez. Instituto Nacional de Salud Pública. Av. Universidad 655, col. Santa María Ahuacatitlán. 62508 Cuernavaca, Morelos, México. Correo electrónico: esalazar@correo.insp.mx
* Stata, V-9. Stata Corporation. 4905 Lakeway Drive. College Station, Texas 77845 Usa;www.stata.com.














