Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Salud Pública de México
versión impresa ISSN 0036-3634
Salud pública Méx vol.48 no.5 Cuernavaca sep./oct. 2006
ARTÍCULO DE REVISIÓN
Linfocitos T citotóxicos CD8+ en la leishmaniasis cutánea
CD8+ cytotoxic lymphocytes in cutaneous leishmaniasis
Joselín Hernández-Ruiz, M en C; Ingeborg Becker, Dra en Inmunol.
Departamento de Medicina Experimental, Facultad de Medicina, Universidad Nacional Autónoma de México. México, D.F., México
RESUMEN
OBJETIVO: Examinar la bibliografía relacionada con la participación de los linfocitos T CD8+ en la reacción inmunitaria a especies de Leishmania causantes de leishmaniasis cutánea. En esta enfermedad se ha resaltado la intervención de macrófagos, células dendríticas, NK y células T CD4+; sin embargo, es poco lo que se conoce de las células T CD8+. Los trabajos en modelos murinos señalan que la participación de las células CD8+ sucede a través de la producción de IFN-gamma, aunque su capacidad citotóxica puede desempeñar una función importante, como lo demuestran los hallazgos en seres humanos. La forma como se activan las células citotóxicas CD8+ es un enigma. Es posible que las células dendríticas realicen esa labor a través de mecanismos que incluyen transpresentación de antígenos. Comprender la contribución de este subtipo celular en la respuesta inmunitaria a Leishmania aportará novedosos conocimientos sobre la fisiopatogenia de la leishmaniasis, lo cual hará posible desarrollar nuevos enfoques terapéuticos para esta parasitosis.
Palabras clave: leishmaniasis cutánea; linfocitos T CD8+; reacción inmunitaria; citotoxicidad; apoptosis
ABSTRACT
OBJECTIVE: Review of the literature on the role of CD8+ T cell in the immune response against Leishmania species that cause cutaneous leishmaniasis. The role of macrophages, dendritic cells, CD4 T cells and NK cells has been extensively analyzed in leishmaniasis, yet very little knowledge has been gained on CD8+ T cells in this disease. Murine models of leishmaniasis suggest that CD8+ T cells participate through IFNg production, yet their cytotoxic capacity may also play a crucial role, as has been found in human disease. It is an enigma what mechanisms underlie the CD8+ T cell activation. It is possible that dendritic cells activate CD8+ T cells through mechanisms that include antigen traspresentation. A better understanding of CD8+ T cells in the immune response against Leishmania will undoubtedly provide new insights into the physiopathogenesis of the disease that could lead to new therapeutic approaches against leishmaniasis.
Keywords: cutaneous leishmaniasis; T CD8+ lymphocytes; immune response; cytotoxicity; apoptosis
La leishmaniasis es una zoonosis parasitaria multi- facética secundaria a la infección por un protozoo del género Leishmania que puede afectar a los seres humanos y otras especies de mamíferos.1 La Organización Mundial de la Salud la considera la cuarta enfermedad más importante en el trópico.2 Casi 350 millones de personas viven en áreas endémicas y se calcula que 12 millones de individuos están infectados con el parásito, de los cuales 1.5 millones son casos notificados en fecha reciente.2,3
Aunque se han realizado progresos en el diagnóstico y se ha desarrollado una variedad de inmunoterapias y quimioterapias para el tratamiento de esta enfermedad, en los últimos años se ha observado un incremento de la incidencia de leishmaniasis en América Latina y existen nuevos informes en zonas no endémicas que constituyen un problema creciente.4 La ausencia de medidas de control de la enfermedad, además del surgimiento de resistencia a los fármacos Pentostam y Glucantime,5-7,3 sumado al alto costo que supone la institución de medidas de control de los vectores que transmiten estos parásitos y el riesgo ecológico que ello conlleva, exigen esfuerzos dirigidos a desarrollar un conocimiento más profundo de la relación hospedero–parásito para idear posibles conductas de control.
La forma promastigote del parásito se transmite por la saliva de dípteros del género Lutzomyia para el nuevo mundo y Phlebotomus para el viejo mundo, los cuales inoculan los parásitos al picar la piel de los mamíferos. En el hospedero vertebrado, las especies de Leishmania son parásitos intracelulares obligados y viven y se multiplican dentro de un compartimiento fagolisosómico de macrófagos. Para sobrevivir en este espacio ácido, la forma amastigote debe: a) resistir la digestión por múltiples hidrolasas y peptidasas activas, b) asegurar la consecución de nutrientes y c) eludir el sistema inmunitario.8 De acuerdo con la especie, el parásito o el macrófago parasitado pueden extenderse y llevar la infección a distintos órganos, lo que induce varias entidades clínicas (cutánea localizada, cutánea difusa, mucocutánea y visceral).1
La leishmaniasis cutánea es el resultado de la multiplicación de Leishmania en los fagocitos de la piel. Se debe sobre todo a los miembros del complejo L. mexicana: L. (L.) mexicana, L. (L.) amazonensis y L. (L.) venezuelensis y los del complejo de L. braziliensis: L. (V.) braziliensis, L. (V.) panamensis y L. (V.) guyanensis en el nuevo mundo, y L. tropica, L. major y L. aethiopica en el viejo mundo.9
La leishmaniasis cutánea por L. mexicana, L. amazonensis y L. aethiopica puede presentarse en forma bipolar y las consecuencias son las formas cutánea localizada (LCL) y cutánea difusa (LCD). La primera se considera la forma benigna y se caracteriza por una ulceración pequeña y única (según sea el número de picaduras del vector) que tiende a la curación espontánea; el polo opuesto lo representan los pacientes con LCD, en la cual el parásito se disemina por vía linfática y crea múltiples nódulos;10 es la forma más grave y progresiva de la anormalidad. Al parecer, el contraste de los cuadros clínicos radica en diferencias de la respuesta inmunitaria precipitada en el hospedero. L. braziliensis también puede ocasionar una LCL, con úlceras que no siempre son pequeñas y únicas y puede, de forma adicional, causar una tercera forma de leishmaniasis denominada mucocutánea (LMC), la cual provoca lesiones metastásicas graves en las membranas mucosas del rostro.
Reacción inmunitaria en la leishmaniasis
El traumatismo secundario a la picadura del vector induce en el hospedero una respuesta inflamatoria que supone la migración de diferentes células, en especial macrófagos y linfocitos, hacia el sitio de la lesión con el fin de reorganizar el tejido dañado e iniciar el proceso de cicatrización. Por lo general, la infección por Leishmania induce una reacción inmunitaria muy compleja que varía de acuerdo con los diferentes factores. Según sean la especie de Leishmania que interviene en el proceso infeccioso, la forma clínica de la enfermedad y su cronicidad, se observa un espectro de respuestas inmunitarias, desde mecanismos de inmunidad innata hasta mecanismos de inmunidad específica a través de células y anticuerpos. La respuesta de las células T se ha evidenciado a través de reacciones de hipersensibilidad tardía y proliferación de linfocitos in vitro en presencia de antígenos de Leishmania. En términos generales, se ha identificado una intensa reacción mediada por células T para la forma LCL y ausencia de ella en la forma LCD,11 aunque ambos padecimientos desarrollan una respuesta de anticuerpos desde una etapa temprana de la infección y se mantiene durante el curso del trastorno y desaparece sólo después de la eliminación de la mayoría de los parásitos.
Luego del contacto con los antígenos del parásito, expresados en la membrana del macrófago infectado, y según sean el tipo de célula presentadora de antígeno (CPA), los niveles de citocinas endógenas y la naturaleza del antígeno reconocido, las células T CD4+ y CD8+ proliferan y secretan un patrón de citocinas definidas con funciones efectoras diferentes.12,13 Las citocinas de tipo Th1, como IFN-gamma y TNF-alfa, participan en la regulación del granuloma y la activación de macrófagos para aumentar su capacidad microbicida, además de inducir una respuesta humoral con los isotipos IgG1 e IgG3 en seres humanos (IgG2a en ratones), mientras que las citocinas de tipo Th2, como IL-4, IL-5, IL-6 e IL-13, regulan la producción de IgE por los linfocitos B que participan en la activación de reacciones de hipersensibilidad inmediata.14
En la leishmaniasis, la eliminación del parásito parece depender de la activación de la célula hospedera y se ha observado que la producción de citocinas activadoras de macrófagos se correlaciona con la curación, en tanto que las citocinas que desactivan al macrófago se correlacionan con la afección.15 Tal vez por esa razón se piensa que el mecanismo por el cual se activa una respuesta Th1 o Th2 es de vital importancia para dirigir la reacción inmunitaria hacia la protección y curación o susceptibilidad y patogenia (figura 1). Por otro lado, en la LMC se ha descrito el patrón de citocinas como una mezcla de los tipos Th1 y Th2 con buenos niveles séricos de IL-2, IFN-gamma, TNF-alfa e IL-5.11 Se ha señalado que el padecimiento se presenta en realidad por una sobreactivación de la respuesta inmunitaria al presentar bajos niveles de IL-10 y que la curación depende más de la relación entre las citocinas producidas y menos de la mera presencia o ausencia de citocinas en particular.11

En este sentido, la participación de las células de la reacción inmunitaria innata, como células dendríticas (DC), NK y macrófagos, es motivo de ardua investigación. Se sabe que la producción de IFN-gamma, IL-12, IL-10 y TGF-b por estas células en respuesta a Leishmania puede modificar en grado notable la respuesta inmunitaria.16
Linfocitos T citotóxicos CD8+
Los linfocitos T citotóxicos CD8+ cumplen un papel central en la defensa inmunitaria, en particular contra células infectadas por virus, bacterias y protozoos;17 además, se han relacionado con la eliminación de algunas células tumorales y células con MHC I incompatible en trasplantes. De manera adicional, las células T CD8+ participan en la patogenia de una amplia variedad de enfermedades.18 Su función efectora se realiza a través de dos mecanismos básicos: citotoxicidad y liberación de citocinas. Para lograr su función citotóxica, las células T CD8+ emplean dos mecanismos complementarios, uno mediado por la exocitosis de gránulos líticos que contienen moléculas como perforina, la cual es capaz de insertarse en la membrana lipídica y formar poros, lo que resulta en el colapso del potencial de membrana; sin embargo, su papel más importante tal vez sea servir de paso a otras moléculas de los gránulos líticos de la familia de las catepsinas; una de ellas, la granzima B, activa directamente la cascada de señalización de apoptosis mediada por caspasas. La expresión en membrana de FasL/CD95L media el otro mecanismo citotóxico e induce la trimerización de su receptor Fas/CD95 en las células blanco para inducir apoptosis a través de la activación de la caspasa 8.19
Aunque en menor magnitud de lo que ocurre con los linfocitos T CD4+, otro mecanismo de participación de las células T CD8+ es la liberación de citocinas, como IFNg, IL-2, IL-4, IL-5 e IL-10.20 El patrón de citocinas, así como las diferencias en la capacidad migratoria, han señalado la existencia de dos tipos de linfocitos T CD8+: Tc1 y Tc2, tal y como se ha observado en los linfocitos T CD4+ Th1 y Th2.21 Además, se reconoce la existencia de linfocitos T CD8+ supresores, los cuales intervienen en la regulación de la reacción inmunitaria.22
La respuesta específica de las células T CD8+ contra un patógeno se inicia a través del reconocimiento de antígenos presentados de modo adecuado por moléculas MHC I y señales derivadas de coestimulación, sobre todo a través de CD40.23,24 Cada una de estas células tiene más de 15 divisiones para producir una progenie de más de 104 en siete días de estimulación antigénica.25 Pese a ello, esta respuesta no es del todo independiente de otros tipos celulares. Las células T CD4+ y las DC se han referido en una adecuada respuesta de las células T CD8+, aunque su participación no se ha entendido por completo.26 Si bien sólo las CPA especializadas pueden efectuar una adecuada coestimulación a la célula T CD8+, en la mayoría de los casos el blanco final no son siempre estas mismas CPA.24 De esta manera, es preciso un mecanismo que permita activar a las células T CD8+ para inducir su expansión clonal, el desarrollo de su función efectora y la generación de memoria. Para ello se ha señalado que existe un proceso regulado de cooperación entre las células T CD8+, CD4+ y DC.
El modelo planteado hasta el momento sobre la participación de DC en la activación de células T CD8+ señala que las DC capturan el antígeno por varias vías y pueden fagocitarlo directamente si se encuentra libre en el medio extracelular o bien adquirirlo de células apoptóticas o necróticas. Con posterioridad lo procesan y presentan a través de MHC II a las células T CD4+, las cuales sobrerregulan la expresión de CD40L y, mediante la interacción con CD40, activan o inducen a las DC para estimular la respuesta de células T CD8+ vírgenes que reconocen el antígeno MHC I en las DC (figura 2).27-29

Es posible que algunas células apoptóticas posean CD40L y de esta manera puedan activar de forma directa a las DC sin la presencia de células CD4+. De esta forma, las DC tendrían la capacidad de activar las células T CD8+ específicas para los antígenos presentados. Estas células apoptóticas pueden provenir de células T CD40L+ recién activadas que sufren apoptosis una vez que han ejercido su función efectora en un tejido inflamado, o también bajo infección con virus proapoptóticos como el VIH.30 Por el contrario, si estas células apoptóticas son CD40L- y no existe otra célula que provea esta señal, la DC se halla en un estado semimaduro, en el cual la presentación de antígeno crea estados de tolerancia como deleción clonal, anergia o células regulatorias.31 Este mecanismo participa en la tolerancia hacia autoantígenos y quizá también en la baja respuesta hacia antígenos de parásitos que evaden la reacción inmunitaria y regulan en sentido negativo la respuesta de los linfocitos T CD8+.17
Participación de las células CD8+ en la leishmaniasis
Algunas evidencias sugieren un papel importante de las células T CD8+ en la respuesta inmunitaria a los parásitos, por acción directa de mecanismos citotóxicos o a través de la producción de IFN-gamma y TNF-alfa, que son citocinas activadoras de macrófagos y favorecen por tanto la muerte de parásitos intracelulares.17,32-34
En la leishmaniasis, la activación de células T CD8+ se ha relacionado con la remisión. De modo inicial se pensó que su participación se restringía a la reinfección, ya que los ratones C57BL/6 (de cepa resistente) deficientes en microglobulina b2 o CD8 mantienen su capacidad para resolver la infección,35 al igual que los ratones tratados con anticuerpos anti-CD8.36 Sin embargo, cuando se inocula el parásito en dosis bajas (~100 promastigotes) y por vía intradérmica, como en la infección natural, se requieren las células CD8+ para el control de la infección primaria con L. major37 y su función parece intervenir en un cambio de respuesta temprana, de Th2 a Th1.38 En todo caso, se reconoce que la infección por cualquier vía lleva a la activación de clonas específicas de linfocitos T CD8+39 y, de manera notable, en respuesta a antígenos de Leishmania que inducen inmunidad protectora.40,41
En los seres humanos se piensa que los linfocitos T CD8+ juegan un papel crucial en la infección. Se ha notificado un elevado número de células T CD8+ en lesiones y sangre periférica durante la fase aguda de la infección y el proceso de eliminación de L. major42-45 y L. mexicana.46 Los pacientes infectados con L. braziliensis presentan una mayor proporción de células T CD4+, en comparación con las CD8+, durante la infección activa y en el proceso curativo esta relación cambia hasta casi llegar al equilibrio al incrementarse el número de linfocitos T CD8+.43 En otro estudio se reconoció que las lesiones de individuos con LCL también infectados con L. braziliensis exhiben un gran porcentaje de linfocitos T en apoptosis, y con mayor frecuencia en linfocitos T CD8+ que en linfocitos T CD4+. Por el contrario, las lesiones de personas con curación espontánea mostraron muy bajo porcentaje de células T CD8+ en apoptosis.47 De manera adicional, se describió un alto porcentaje de linfocitos T CD8+ reactivos a Leishmania en los infiltrados inflamatorios y bajo porcentaje en sangre.44 De modo conjunto, estos hallazgos demuestran que los linfocitos T CD8+ participan de forma activa y promueven la curación. Sin embargo, en el caso de la infección por L. braziliensis, la cronicidad de la infección parece definirse por la exacerbación de la respuesta celular.48,49 Al parecer, los linfocitos T CD8+ participan en la regulación de la reacción al correlacionar la elevada frecuencia de linfocitos T CD8+CD69+ con el tamaño reducido de la lesión generada por el test de Montenegro.50
Experimentos recientes realizados con células mononucleares de sangre periférica humana han demostrado que la infección por L. major se correlaciona con la producción de IFNg apoyado por IL-12, lo cual precipita una respuesta Th1. IL-10 se presenta en baja cantidad y al parecer regula la producción de IFNg.45,51,52 El porcentaje de células T CD8+ no se altera luego de siete días de exposición a Leishmania, si bien la proliferación celular así como la producción de INFg disminuyen en gran proporción cuando se bloquea la presentación de antígeno por HLA-I.52 Esto señalaría que la activación de linfocitos T CD8+ es vital en la producción de INFg. Este modelo también demuestra la participación de los linfocitos T CD8+, aunque falta por confirmar su proliferación frente a antígenos de Leishmania y determinar los mecanismos efectores que desarrollan.
La información disponible describe la activación de clonas específicas de linfocitos T CD8+ y evidencia su participación en las respuestas que conducen a la curación, sea en ratones o en seres humanos. Si se piensa en la capacidad heterogénea de los linfocitos T CD8+, es posible que también intervengan en la cronicidad de la infección, no sólo al exacerbar el daño en el tejido, como en el caso de la LMC por L. braziliensis, sino al originar citocinas inhibidoras como IL-10 o TGFb (figura 5), que podrían generar un estado anérgico ante grandes cantidades de antígeno, como se ha sugerido en el caso de la LCD.85 Se han descrito varios subtipos de linfocitos T que expresan el marcador CD8+ y cuentan con características inhibidoras dependientes e independientes de anticuerpo,22 si bien estos subtipos de linfocitos T CD8+ aún no se han estudiado en la leishmaniasis, pero es plausible esperar que desempeñen un papel sustancial. Existen comunicaciones que describen algunos procesos desempeñados por células T reguladoras CD4+CD25+. Estos procesos son complejos y están relacionados con la contención de respuestas patogénicas generadas por exacerbación de la respuesta celular a través de IFNg.

Vías de activación de las células T CD8+ en la leishmaniasis
Uno de los puntos de discusión sobre la participación de las células CD8+ en la leishmaniasis se sitúa en la forma de activación de este subtipo celular. Dado que es necesaria la presentación de antígenos por la vía de MHC I para la activación de linfocitos T CD8+, se ha pensado que esta vía interviene en la infección por Leishmania. El macrófago es la célula hospedera por excelencia y es allí donde la Leishmania se desarrolla y prolifera. Sin embargo, existe la duda sobre la vía de presentación de antígenos del parásito.
Leishmania se alberga dentro de la célula hospedera en un compartimiento fagolisosómico denominado vacuola parasitófora (VP).53,54 Aunque se desconoce si el contenido de la luz de la VP puede salir al citosol para degradarse y transportarse al retículo endoplásmico, y acoplarse a moléculas de MHC I, se ha descrito en DC y macrófagos una vía que permite la translocación de proteínas desde la luz del fagosoma al citosol, que depende de la proteína chaperona Sec61 (figura 3).55-57 Este fenómeno se denominó transpresentación y depende de la fusión del fagosoma naciente con el RE.58 A últimas fechas se sugirió este sistema de presentación como mecanismo de procesamiento de antígenos de bacterias albergados en macrófagos que permitiría la activación específica de linfocitos T CD4+ y T CD8+.59 Esta vía haría posible el paso de antígenos de Leishmania a través de la membrana de la VP para que luego los procesara el proteasoma. Hasta el momento, esto es controversial ya que un informe describe que los macrófagos infectados con Leishmania transfectada con el gen de OVA o la galactosidasa b son incapaces de presentar estos antígenos a líneas de linfocitos T CD8+ específicos de antígeno.60
Por otro lado, se ha descrito que una línea de linfocitos T CD8+ específicos contra el antígeno de superficie de Leishmania GP46/M-2 es capaz de reconocer macrófagos infectados con L. amazonensis, lo que sugiere que este antígeno se procesa en el citosol, ya que el efecto puede bloquearse con brefeldina A o inhibidores del proteasoma.61 Al parecer, sólo los antígenos externos de Leishmania pueden alcanzar el citosol del macrófago. Es posible que sean moléculas que el parásito secreta y no productos de la degradación fagolisosómica.
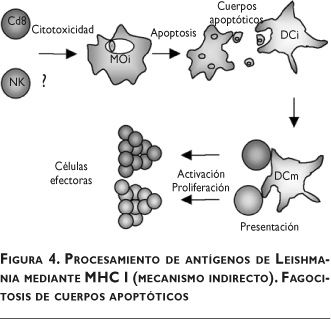
Otra vía de transpresentación de antígenos exógenos implica la fagocitosis de cuerpos apoptóticos de células infectadas por parte de las DC (figura 4). Luego de fagocitar cuerpos apoptóticos, las DC adquieren la capacidad de presentar los antígenos que se hallan en dichas células, algo que es detectable dos a cuatro horas después de la fagocitosis.62,63 Los antígenos deben ingresar al citosol para interceptar la vía convencional de MHC I, lo cual puede suceder por el mecanismo descrito en la figura 3. Este proceso se identificó en la infección por M. tuberculosis, en la cual se demostró que las DC pueden fagocitar apoptosomas de macrófagos infectados y presentar antígenos de Mycobacterium vía MHC I y CD1b.64 Se ha discutido además que la vacuna de M. bovis, BCG, no induce la apoptosis en los macrófagos y tal vez ésta sea la causa de la baja eficiencia de la vacunación con BCG.65,66 Dada la similitud de esta infección con la leishmaniasis, es posible que este mecanismo también forme parte de la respuesta inmunitaria de esta última anomalía. De igual modo, se sabe que son las células dendríticas, y no los macrófagos, las que tienen la capacidad de migrar a nódulos linfoides y presentar antígenos de manera eficiente.67
En lesiones de pacientes con la forma LCD se ha identificado un gran número de macrófagos parasitados, mientras que en sujetos con LCL el número de macrófagos disminuye. Ensayos preliminares del laboratorio de los autores señalan que los macrófagos en las lesiones de individuos con LCL se encuentran en apoptosis (resultados aún no publicados), lo cual concuerda con la idea de transpresentación de antígenos a través de apoptosomas. Es posible que la presentación cruzada de antígenos por esta vía determine un patrón de citocinas más favorable con la resolución de la infección. En tal caso, el fenómeno de inhibición de la apoptosis de macrófagos infectados con Leishmania68,69 constituiría un mecanismo del parásito para evitar la alerta inmunitaria además de garantizar la sobrevida de la célula hospedera.
Función efectora de las células T CD8+
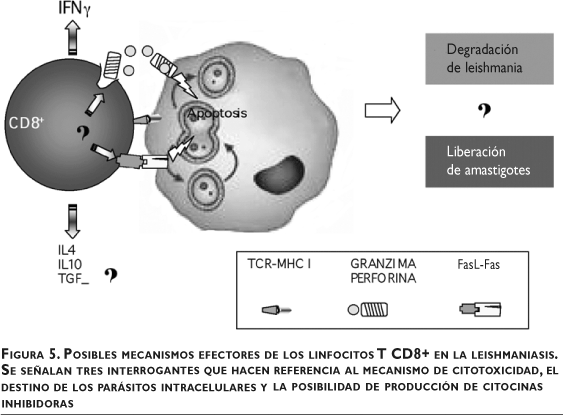
Se ha asumido que la principal función protectora de los linfocitos T CD8+ es contribuir a la producción de IFNg.16 Sin embargo, se desconoce si el IFNg que liberan los linfocitos CD8+ activados se requiere para controlar la infección por Leishmania. Dado que Leishmania es un parásito intracelular, es plausible pensar que la respuesta citotóxica de los linfocitos T CD8+ podría coadyuvar a controlar la infección a través de la lisis de macrófagos infectados por la vía de granzima/perforina o Fas/FasL,48,49,60,61,70-72 o ambas, (figura 5).
La participación de granzima y perforina en el fenómeno citotóxico está en duda debido a los informes contradictorios sobre el tema. Por un lado, el mecanismo citotóxico de granzima/perforina no parece tener una participación relevante en el modelo murino, dado que ratones C57BL/6 deficientes en granzima A o B, o ambas, resuelven la infección por L. major de igual forma que los ratones silvestres, tanto en el curso de la infección como en la producción y polarización de citocinas,73,74 aunque se había señalado que las células T activadas en la infección entre la cepa susceptible BALB/c y la resistente C57BL/6 no sólo diferían en el patrón de citocinas sino también en la expresión de granzima A.75,76 Por otro lado, el mecanismo de Fas/FasL tal vez intervenga de forma activa, y en paralelo con la activación de los macrófagos, en la resolución de la infección. Se ha demostrado que los ratones C57BL/6 deficientes en Fas y FasL acusan un comportamiento susceptible, a pesar de activar una reacción Th1 con producción de óxido nítrico.73,77,78 Además, constituye una paradoja para el modelo de Th1/Th2 en susceptibilidad y resistencia, ya que se pensó que la capacidad para resolver la infección recaía en la posibilidad de activar a los macrófagos. Este hallazgo señala que no es suficiente esta activación y tal vez es necesario eliminar los macrófagos infectados que ya no responden a la activación.
En la leishmaniasis humana son pocos los estudios enfocados en evaluar la citotoxicidad mediada por células y éstos han relacionado la citotoxicidad con daño tisular, no tanto con protección, ya que se ha identificado en pacientes con LMC y no en LC por L. braziliensis.48,49 También se ha descrito que es posible generar linfocitos T CD8+ específicos de Leishmania a partir de células T vírgenes estimuladas con macrófagos infectados con L. amazonensis y éstos son capaces de lisar macrófagos autólogos infectados.79 En las lesiones de pacientes con LC infectados con L. major se detectó sobreexpresión de FasL en macrófagos y linfocitos T activados, en nexo con expresión de Fas; empero, se vinculó con la formación de la úlcera, ya que se encontró un buen número de queratinocitos en apoptosis.80 También se ha informado una correlación entre la citotoxicidad in vitro de linfocitos de sangre periférica de pacientes con LC contra macrófagos infectados con L. major y la liberación de granzima B.72 Toda la evidencia señala la participación de la citotoxicidad en la reacción inmunitaria específica y parece relacionarse con la curación. Aún falta determinar la forma en que los linfocitos T CD8+ participan en la LCD, en particular si tienen capacidad citotóxica, y si producen algún tipo de citocina distinto del IFNg. También es necesario confirmar si los linfocitos T CD8 destruyen macrófagos infectados a través de granzima/perforina o Fas/FasL, o ambas, en ensayos de neutralización y si esta citotoxicidad sobre macrófagos infectados ayuda a controlar la infección.El estudio del papel de la citotoxicidad en la respuesta a M. tuberculosis ha revelado que la apoptosis de los macrófagos infectados a través de la liberación de gránulos líticos genera un decremento de la viabilidad de los parásitos.81
Comentarios y perspectivas
Aún falta definir si la citotoxicidad no sólo elimina a los macrófagos infectados, sino también los parásitos intracelulares (figura 5). Una de las primeras notificaciones que analiza la participación de los linfocitos T CD8+ en la respuesta a Leishmania señaló que la citotoxicidad sobre macrófagos infectados no afecta la viabilidad de los parásitos. Sin embargo, el método utilizado para evaluar la viabilidad sólo permite señalar que los parásitos pueden sobrevivir sin las células hospederas.70 Una posible vía de degradación de los parásitos intracelulares incluye a la granulisina, la cual se ha vinculado de forma directa con el control de M. tuberculosis.81-87
La degradación de material de Leishmania en episodios apoptóticos no sólo puede tener un papel en el control del número de parásitos, sino también representar una oportunidad para procesar antígenos de difícil obtención debido a la inhibición que causa el parásito sobre la célula hospedera. Pese a ello, es poco lo que se conoce sobre los mecanismos que permiten activar clonas específicas de linfocitos T CD8+. Dado que dicha activación parece estar relacionada con la resolución de la infección, es posible pensar en el diseño de vacunas que activen este tipo de respuesta y contribuyan de esa manera al control de la infección. Hoy en día se acepta que los linfocitos T CD8+ participan de modo positivo en el control de la infección por Leishmania a través de dos mecanismos, la liberación de IFNg y la citotoxicidad. Definir la importancia de estos dos mecanismos y la forma en que se activan ayudará a plantear mejores medidas en el diseño y la vigilancia de las vacunas.
Referencias
1. Mauël J. Macrophage-parasite interactions in Leishmania infections. J Leukoc Biol 1990;47:187-193. [ Links ]
2. Vieira L. pH and volume homeostasis in tripanosomatids: current views and perspectives. Biochim Biophys Acta 1998;1376:221-241. [ Links ]
3. Hepburn NC. Cutaneous leishmaniasis: current and future management. Expert Rev Anti Infect Ther 2003;1(4):563-570. [ Links ]
4. Olliaro PL, Bryceson A. Practical progress and new drugs for changing patterns of leishmaniasis. Parasitol Today 1993;9:323-328. [ Links ]
5. Dey S, Papadopoulou B, Haimeur A, Roy G, Grondin K, Dou D, et al. High level arsenite resistance in Leishmania tarentolae is mediated by an active extrusion system. Mol Biochem Parasitol 1994;67:49-57. [ Links ]
6. Montoya F, Restrepo M, Gómez M. Inmunidad humoral y celular en la leishmaniasis cutánea. Acta Med Colomb 1990;15:18-29. [ Links ]
7. Singh S, Sivakumar R. Challenges and new discoveries in the treatment of leishmaniasis. J Infect Chemother 2004;10(6):307-315. [ Links ]
8. Russell DG, Xu S, Chakraborty P. Intracellular trafficking and the parasitophorus vauole of Leishmania mexicana-infected macrophages. J Cell Sci 1992;10:1193-1210. [ Links ]
9. Berman J. Human leishmaniasis: clinical, diagnostic, and chemotherapeutic developments in the last 10 years. Clin Infect Dis 1997;24:684-703. [ Links ]
10. Velasco O. Leishmaniasis cutánea en voluntarios humanos. México: Memoria del Congreso Mexicano de Dermatología, 1970. [ Links ]
11. Agudelo S, Robledo S. Respuesta inmune en infecciones humanas por Leishmania spp. IATREIA 2000;13:167-178. [ Links ]
12. Scott P. IFN-gamma modulates the early development of Th1 and Th2 responses in a murine model of cutaneous leishmaniasis. J Immunol 1991;147:149-155. [ Links ]
13. Rossi-Bergmann B, Müller I, Godinho EB. Th1 and Th2 T-cell subsets are differentially activated by macrophages and B cell in murine leishmaniasis. Infect Immun 1993;61:266-269. [ Links ]
14. Cox F, Liew FY. T-cell subsets and cytokines in parasitic infections. Immunol Today 1992;13:445-448. [ Links ]
15. Kemp M, Hansen MB, Theander TG. Recognition of Leishmania antigens by T lymphocytes from non-exposed individuals. Infect Immun 1992;60:246-251. [ Links ]
16. Sacks D, Noben-Trauth N. The immunology of susceptibility and resistance to Leishmania major in mice. Nat Rev Immunol 2002;2:845-858. [ Links ]
17. Harty J, Tvinnereim A, White D. CD8+ T cell effectors mechanisms in resistance to infection. Annu Rev Immunol 2000;18:275-308. [ Links ]
18. Kägi D, Ledermann B, Bürki K, Zinkernagel RM, Hengartner H. Molecular mechanisms of lymphocyte-mediated cytotoxicity and their role in immunological protection and pathogenesis in vivo. Annu Rev Immunol 1996;14:207-232. [ Links ]
19. Trapani J, Smyth M. Functional significance of the perforin/granzyme cell death pathway. Nat Rev Immunol 2002;2:735-747. [ Links ]
20. Wooland D, Dutton R. Heterogeneity of CD4+ and CD8+ T cells. Curr Opin Immunol 2003;15:336-342. [ Links ]
21. Cerwenka A, Carter L, Reome J, et al. In vivo persistence of CD8 polarized T cell subsets producing type 1 or type 2 cytokines. J Immunol 1998;161:97-105. [ Links ]
22. Jiang H, Chess L. An integrated view of suppressor T cell subsets in immunoregulation. J Clin Invest 2004;114:1198-1208. [ Links ]
23. Bourgeois C, Rocha B, Tanchot C. A role for CD40 expression on CD8+ T cells in the generation of CD8+ T cell memory. Science 2002;297:2060-2063. [ Links ]
24. Schoenberger S, Toes R, van der Voort E, Offringa R, Melief CJM. T-cell help for cytotoxic T lymphocytes is mediated by CD40-CD40L interactions. Nat 1998;393:480-483. [ Links ]
25. Doherty P. The numbers game for virus-specific CD8+ T cells. Science 1998;280:227-233. [ Links ]
26. Melief C. Regulation of T lymphocyte responses by dendritic cells: peaceful coexistence of cross-priming and direct priming? Eur J Immunol 2003;33:2645-2654. [ Links ]
27. Ridge J, Di Rosa F, Matzinger P. A conditioned dendritic cell can be a temporal bridge between a CD4+ T-helper and T-killer cell. Nat 1998;393:474-478. [ Links ]
28. Hernandez J, Aung S, Marquardt K, Sherman L. Uncoupling of proliferative potential and gain of effector function by CD8+ T cells responding to self-antigens. J Exp Med 2002;196:323-332. [ Links ]
29. Smith C, Wilson NS, Waithman J, Villadangos JA, Carbone FR, Heath WR, et al. Cognate CD4+ T cell licensing of dendritic cells in CD8+ T cell immunity. Nat Immunol 2004;5:1143-1148. [ Links ]
30. Propato A, Cutrona G, Francavilla V. Apoptotic cells overexpress vinculin and induce vinculin-specific cytotoxic T-cell cross-priming. Nat Med 2001;7:807-813. [ Links ]
31. Accapezzato D, Francavilla V, Propato A, Paroli M, Barnaba V. Mechanisms inducing or controlling CD8+ T cell responses against self- or non-self-antigens. Ann NY Acad Sci 2003;987:99-106. [ Links ]
32. Roger PM, Bermudez LE. Infection of mice with Mycobacterium avium primes CD8+ lymphocytes for apoptosis upon exposure to macrophages. Clin Immunol 2001;99:378-386. [ Links ]
33. Fong T, Mosmann TR. Alloreactive murine CD8+ T cell clones secrete the Th1 pattern of cytokines. J Immunol 1990;144:744-752. [ Links ]
34. Müller I, Kropf P, Etges RJ, Louis JA. Gamma interferon response in secondary Leishmania major infection: role of CD8+ T cells. Infect Immun 1993;61:3730-3738. [ Links ]
35. Huber M, Timms E, Mak E, Röllinghoff M, Lohoff M. Effective and long lasting immunity against the parasite Leishmania major in CD8-deficient mice. Infect Immun 1998;66:3968-3970. [ Links ]
36. Titus R. Involvement of specific Liyt-2+ T cells in the immunological control of experimental induced murine cutaneous leishmaniosis. Eur J Immunol 1987;17:1429-1433. [ Links ]
37. Belkaid Y. CD8+ T cells are required for primary immunity in C57BL/6 mice following low-dose, intradermal challenge with Leishmania major. J Immunol 2002;168:3992-4000. [ Links ]
38. Uzonna J, Joyce K, Scout P. Low dose Leishmania major promotes a transient T helper cell type 2 response that is down-regulated by Interferon g –producing CD8+ T cells. J Exp Med 2004;199:1559-1566. [ Links ]
39. Conceição F, Perlaza B, Louis J, Romero P. Leishmania major infection in mice primes for specific major histocompatibility complex class-I restricted cytotoxic T cell responses. Eur J Immunol 1994;24:2813-2817. [ Links ]
40. Pinheiro R, Fonseca E, Correia J, et al. TGF-_-associated enhanced susceptibility to leishmaniasis following intramuscular vaccination of mice with Leishmania amazonensis antigens. Microbes Infect 2005;10:1016. [ Links ]
41. Farajnia S, Mahboudi F, Ajdari S, Reiner NE, Kariminia A, Alimohammadian MH. Mononuclear cells from patients recovered from cutaneous leishmaniasis respond to Leishmania major amastigote class I nuclease with a predominant Th1-like response. Clin Exp Immunol 2005;139:498-505. [ Links ]
42. Da-Cruz AM, Conceicao-Silva F, Bertho AL, et al. Leishmania-reactive CD4+ and CD8+ T cells associated with cure of human cutaneous leishmaniasis. Infect Immun 1994;62:2614-2618. [ Links ]
43. Da-Cruz A, Bittar R, Mattos M, Oliveira-Neto M, Nogueira R, Pinho-Ribeiro V, et al. T cell mediated immune responses in patients with cutaneous or mucosal leishmaniasis: Long term evaluation alter therapy. Clin Diagn Lab Immunol 2002;9:251-256. [ Links ]
44. Da-Cruz A, Bertho A, Oliveira-Neto M, Coutinho SG. Flow cytometric analysis of cellular infiltrate from american tegumentary leishmaniasis lesions. Brit J Dermatol 2005;153:537-543. [ Links ]
45. Gaafar A, Veress B, Permin H, Krarazmi A, Theander TG, El-Hassan AM. Characterization of the local and systemic immune response in patients with cutaneous leishmaniasis due to Leishmania major. Clin Immunol 1999;91:314-320. [ Links ]
46. Salaiza N, Volkow P, Perez R, Moll H, Gillitzer R, Pérez-Torres A, et al. Treatment of two patients with diffuse cutaneous leishmaniasis caused by Leishmania mexicana modifies the immunohistological profile but not the disease outcome. Trop Med Int Health 1999;4:801-811. [ Links ]
47. Bertho A, Santiago M, Da-Cruz A, Coutinho SG. Detection of early apoptosis and cell death in T CD4+ and CD8+ cells from lesions of patients with localized cutaneous leishmaniasis. Braz J Med Biol Res 2000;33:317-325. [ Links ]
48. Barral-Netto M, Barral A, Brodskyn C, Carvalho EM, Reed SG. Cytotoxicity in human mucosal and cutaneous leishmaniosis. Parasite Immunol 1995;17:21-28. [ Links ]
49. Brodskyn C, Barral A, Boaventura V, Carvalho E, Barral-Netto M. Parasite-driven in vitro human lymphocyte cytotoxicity against autologous infected macrophages from mucosal leishmaniasis. J Immunol 1997;159:4467-4473. [ Links ]
50. Antonelli L, Dutra W, Almeida R, Bacella O, Carvalho E, Gollob K. Activated inflamatory T cells correlate with lesion size in human cutaneous leishmaniasis. Immunol Lett 2005;10:1016. [ Links ]
51. Roger K, Titus R. The human cytokine response to Leishmania major early after exposure to the parasite in vitro. J Parasitol 2004;90:557-563. [ Links ]
52. Roger K, Titus R. Characterization of the early cellular immune response to Leishmania major using peripheral blood mononuclear cells from Leishmania-naïve humans. Am J Trop Med Hyg 2004;71:568-576. [ Links ]
53. Antoine J, Prina E, Lang T, Courret N. The biogenesis and properties of the parasitophorous vacuoles that harbour Leishmania in murine macrophages. Trends Microbiol 1998;6:392-401. [ Links ]
54. Courret N, Frehel C, Gouhier N, Pouchelet M, Prina E, Roux P. Biogenesis of Leishmania-harbouring parasitophorous vacuoles following phagocytosis of the metacyclic promastigote or amastigote stages of the parasites. J Cell Sci 2002;115:2303-2316. [ Links ]
55. Kovacsovics-Bankowski M, Rock K. A phagosome-to-cytosol pathway for exogenous antigens presented on MHC class I molecules. Science 1995;267:243-246. [ Links ]
56. Rodriguez A, Regnault A, Kleijmeer M, Ricciardi-Castagnoli P, Amigorena S. Selective transport of internalized antigens to the cytosol for MHC class I presentation in dendritic cells. Nat Cell Biol 1999;1:362-368. [ Links ]
57. Houde M, Bertholet S, Gagnon E, Brunet S, Goyette G, Laplante A, et al. Phagosomes are competent organelles for antigen cross-presentation. Nat 2003;425:402-406. [ Links ]
58. Guermonprez P, Saveanu L, Kleijmeer M, Davoust J, Van Endert P, Amigorena S. ER-phagosome fusion defines an MHC class I cross-presentation compartment in dendritic cells. Nat 2003;425:397-402. [ Links ]
59. Kaufmann S, Schaible U. Antigen presentation and recognition in bacterial infections. Curr Opin Immunol 2005;17:79-87. [ Links ]
60. Lopez J, Lebowitz J, Beverly S, Rammensee HG, Overath P. Leishmania mexicana promastigotes induce cytotoxic T lymphocytes in vivo that do not recognize infected macrophages. Eur J Immunol 1993;23:217-223. [ Links ]
61. Kima P, Ruddle N, McMahon-Pratt D. Presentation via the class I pathway by Leishmania amazonensis-infected macrophages of an endogenous leishmanial antigen to CD8 T cells. J Immunol 1997;159:1828-1834. [ Links ]
62. Fonteneau J, Kavanagh D, Lirvall M, Sanders C, Cover TL, Bhardwaj N, et al. Characterization of the MHC class I cross-presentation pathway for cell-associated antigens by human dendritic cells. Blood 2003;102:4448-4455. [ Links ]
63. Guermonprez P, Amigorena S. Pathways for antigen cross presentation. Springer Semin Immunopathol 2005;26:257-271. [ Links ]
64. Schaible U, Winau F, Sieling P, Fischer K, Collins HL, Hagens K, et al. Apoptosis facilitates antigen presentation to T lymphocytes through MHC-I and CD1 in tuberculosis. Nat Med 2003;9:1039-1046. [ Links ]
65. Kaufmann S. How can immunology contribute to the control of tuberculosis? Nat Rev Immunol 2001;1:20–30. [ Links ]
66. Winau F, Kaufmann S, Schaible U. Apoptosis paves the detour path for CD8 T cell activation against intracellular bacteria. Cell Microbiol 2004;6:599-607. [ Links ]
67. Banchereau J, Briere F, Caux C, Davoust J, Lebecque S, Liu YJ, et al. Immunobiology of dendritic cells. Annu Rev Immunol 2000;18:767-811. [ Links ]
68. Moore KJ, Matlashewski G. Intracellular infection by Leishmania donovani inhibits macrophage apoptosis. J Immunol 1994;152:2930-2937. [ Links ]
69. Moore KJ, Turco SJ, Matlashewski G. Leishmania donovani infection enhances macrophage viability in the absence of exogenous growth factor. J Leukoc Biol 1994;55:91-98. [ Links ]
70. Smith L, Rodrigues M, Russel D. The interaction between CD8+ cytotoxic T cells and Leishmania-infected macrophages. J Exp Med 1991;174:499-505. [ Links ]
71. Conceição F, Paes M, Modlin R, Tschopp J, Pirmez C. Is necrosis/apoptosis correlated with the evolution of cutaneous lesions in the American tegumentary leishmaniasis? Immunol Immunopathol 1998;93:101-110. [ Links ]
72. Bousoffara T, Louzir H, Salah B, Dellagi K. Analysis of granzyme B activity as a surrogate marker of Leishmania-specific cell-mediated cytotoxicity in zoonotic cutaneous leishmniasis. J Infect Dis 2004;189:1265-1273. [ Links ]
73. Conceição F, Hahne M, Schroter M, Louis J, Tschopp J. The resolution of lesions induced by Leishmania major requires a functional Fas (APO-1, CD95) pathway of cytotoxicity. Eur J Immunol 1998;28:237-245. [ Links ]
74. Eisert V, Münster U, Simon M, Moll H. The course of Leishmania major infection in mice lacking granzyme-mediated mechanisms. Immunobiology 2002;205:314-320. [ Links ]
75. Moll H, Müller C, Gillitzer R, Fuchs H, Röllinghoff M, Simon MM, et al. Expression of T-cell-associated serine proteinase 1 during murine Leishmania major infection correlates with susceptibility to disease. Infect Immun 1991;59:4701-4708. [ Links ]
76. Frischholz S, Röllinghoff M, Moll H. Cutaneous leishmaniasis: co-ordinate expression of granzyme A and lymphokines by CD4+ T cells from susceptible mice. Immunobiology 1994;82:255-261. [ Links ]
77. Alexander C, Kaye P, Engwerda C. CD95 is required for the early control of parasite burden in the liver of Leishmania donovani-infected mice. Eur J Immunol 2001;31:1199-1210. [ Links ]
78. Huang FP, Xu D, Esfandiari EO, Sands W, Wei XQ, Liew FY. Mice defective in Fas are highly susceptible to Leishmania major infection despite elevated IL-12 synthesis, strong Th1 responses, and enhanced nitric oxide production. J Immunol 1998;160:4143-4147. [ Links ]
79. Russo DM, Chakrabarti P, Higgins AY. Leishmania: naive human T cells sensitized with promastigote antigen and IL-12 develop into potent Th1 and CD8+ cytotoxic effectors. Exp Parasitol 1999;93:161-170. [ Links ]
80. Eidsmo L, Nylen S, Khamesipour A, Hedblad MA, Chiodi F, Akuffo H. The contribution of the Fas/Fasl apoptotic pathway in ulcer formation during Leishmania major-induced cutaneous leishmaniasis. Am J Pathol 2005;166:1099-1108. [ Links ]
81. Stenger S. Cytolytic T cells in the immune response to Mycobacterium tuberculosis. Scand J Infect Dis 2001;33:483-487. [ Links ]
82. Kumar J, Okada S, Clayberger C, Krensky AM. Granulysin: a novel antimicrobial. Expert Opin Investig Drugs 2001;10:321-329. [ Links ]
83. Hailu A, Frommel D. Leishmaniasis. In: Kloos H, Zein ZA, eds. The ecology of health and disease in Ethiopia. Boulder, San Francisco, Oxford: Westview press, 1993:375–388. [ Links ]
84. Convit J, Ulrich M, Fernandez C, Tapia FJ, Cáceres-Dittmar G, Castés M, et al. The clinical and immunological spectrum of American cutaneous leishmaniasis. Trans R Soc Trop Med Hyg 1993;87:444-448. [ Links ]
85. Salaiza-Suazo N, Volkow P, Tamayo R, Moll H, Gillitzer R, Pérez A, et al. Treatment of two patients with diffuse cutaneous leishmaniasis caused by Leishmania mexicana modifies the immunohistological profile but not the disease outcome. Trop Med Int Health 1999;4:801-811. [ Links ]
86. Ji J, Masterson J, Sun J, Soong L. CD4+CD25+ regulatory T cells restrain pathogenic responses during Leishmania amazonensis infection. J Immunol 2005;174:7147-7153. [ Links ]
87. Kariminia A, Bourreau E, Pascalis H, Couppié P, Sainte-Marie D, Tacchini-Cottier F, et al. Transforming growth factor beta 1 production by CD4+ CD25+ regulatory T cells in peripheral blood mononuclear cells from healthy subjects stimulated with Leishmania guyanensis. Infect Immun 2005;73:5908-5914. [ Links ]
Fecha de recibido: 3 de octubre de 2005
Fecha de aprobado: 12 de junio de 2006
Solicitud de sobretiros: Joselín Hernández Ruiz, Departamento de Medicina Experimental, Facultad de Medicina, UNAM, Hospital General de México. Dr. Balmis 148. 06726 México DF, México. Email: hernandezjoselin@yahoo.com.mx














