Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Salud Pública de México
versión impresa ISSN 0036-3634
Salud pública Méx vol.48 no.3 Cuernavaca may./jun. 2006
ARTÍCULO ORIGINAL
Hiperlipidemia e intolerancia a la glucosa en un grupo de pacientes infectados con VIH que reciben terapia antirretrovírica hiperactiva
Hyperlipidemia and glucose intolerance in patients with HIV infection receiving antiretroviral therapy
Carlos José Castro-Sansores, MCI; Adrián Santos-Rivero, MCII; Dora Lara-Perera, QfbI; Pedro González-Martínez, MCI; Gabriela Alonso-Salomón, QfbI; Renan A. Góngora-Biachi, MCI
ICentro de Investigaciones Regionales Dr. Hideyo Noguchi, Universidad Autónoma de Yucatán, México
IIHospital General Agustín O´Horán, Servicios de Salud del Estado de Yucatán, México
RESUMEN
OBJETIVO: Determinar la prevalencia de los efectos secundarios sobre el metabolismo de los lípidos y la glucosa provocados por la terapia antirretrovírica hiperactiva (TARHA), así como el impacto que el uso de los distintos esquemas de antirretrovíricos tiene sobre los lípidos y la glucosa en un grupo de pacientes de Yucatán, México.
MATERIAL Y MÉTODOS: Se realizó un estudio transversal. A cada paciente se le aplicó un cuestionario creado para este estudio y se le determinaron los valores de colesterol total, triglicéridos y glucosa en ayuno. Se determinó la prevalencia de hiperlipidemia y alteraciones de la glucosa y su relación con las variables de la encuesta
RESULTADOS: Se estudiaron 211 pacientes, 36 (17%) mujeres y 175 (83%) hombres; 92 (44%) tuvieron hiperlipidemia. De éstos, 43 (20%) presentaron hipercolesterolemia (HC) y 82 (39%) hipertrigliceridemia (HT). La presencia de HC e HT combinadas se verificó en 30 (14%) pacientes; además, 19 (9%) pacientes exhibieron alteraciones en la glucosa, seis (3%) presentaron diabetes mellitus y 13 (6%), intolerancia a la glucosa. Las variables que se vincularon con la presencia de hiperlipidemia fueron los números de linfocitos CD4 >350 células/µl [RM= 2.79 (1.08-7.27), p= 0.03], el género masculino [RM= 3.6 (1.4-9.12), p= 0.006] y el uso de nucleósidos inhibidores de la transcriptasa inversa (NITI) [RM= 3.1 (1.2-8.1), p= 0.01]
CONCLUSIONES: Los pacientes con la infección por el VIH que reciben terapia antirretroviral (TAR) tienen un riesgo aumentado de presentar dislipidemia. A diferencia de lo que informan la mayor parte las publicaciones, las alteraciones de los lípidos se asociaron con más frecuencia al uso de NITI, por lo que se concluye que la patogenia de estas alteraciones no es única y que resulta probable la existencia de un efecto sinérgico entre las distintas familias de fármacos antirretrovíricos y que otros factores del huésped participen en la génesis de estas alteraciones.
Palabras clave: hiperlipidemia; intolerancia a la glucosa; VIH; terapia antirretrovírica; México
ABSTRACT
OBJECTIVE: To determine the prevalence of secondary effects on lipid metabolism as a result of highly active antiretroviral therapy (HAART), as well as the impact of different types of antiretroviral regimens on lipids and glucose in a group of patients in Yucatan, Mexico
MATERIAL AND METHODS: A cross-sectional study was conducted. A questionnaire created for this study was administered to each patient and total cholesterol, triglycerides and fasting glucose values were determined. The presence of hyperlipidemia and alterations in glucose were determined as well as their relation to the epidemiological variables obtained from the questionnaire
RESULTS: A total of 211 subjects were studied [36 (17%) of which were women and 175 (83%) men]. Ninety-two patients (44%) were found to have hyperlipidemia. Of these, 43 (20%) had hypercholesterolemia (HC) and 82 (39%) hypertriglyceridaemia (HT). The presence of combined HC and HT was observed in 30 (14%) patients. Nineteen (9%) patients had alterations in glucose, six (3%) diabetes mellitus and 13 (6%) impaired glucose tolerance. The variables associated with the presence of hyperlipidemia were: levels of lymphocytes CD4>350 cells/µl (OR= 2.79 1.08-7.27, p= 0.03), male gender (OR= 3.6 1.4-9.12, p= 0.006) and the use of nucleoside-reverse transcriptase inhibitors (NRTI) (OR= 3.1 1.2-8.1, p=0.01)
CONCLUSIONS: Patients with HIV infection who receive HAART have an increased risk of presenting hyperlipidemia. In this group of patients the presence of hyperlipidemia and impaired glucose tolerance was significant. Unlike what has been indicated in most published reports, the alterations of lipids were associated more frequently with INTR use, for which it is concluded that the pathogeny of these alterations is not unique, that it is probable that concurrent effects exist between different antiretroviral drug families and that other host factors are involved in the pathogenic mechanism of these alterations.
Key words: hyperlipidemia; impaired glucose tolerance; HIV; antiretroviral therapy; Mexico
Las alteraciones en el metabolismo de los lípidos se reconocieron antes incluso del advenimiento de la terapia antirretrovírica hiperactiva (TARHA). El aumento de las concentraciones de los triglicéridos (TG) y la reducción de los valores de colesterol total (CT) se interpretaban como una consecuencia evolutiva avanzada de la infección por el virus de la inmunodeficiencia humana (VIH).1
Sin embargo, un patrón diferente de dislipidemia ha podido observarse desde que se inició el uso de la TARHA [aumento del CT, los TG y las lipoproteínas de baja densidad (LDL) con disminución de las lipoproteínas de alta densidad (HDL)], sobre todo relacionado con el uso de inhibidores de proteasas (IP).2
De manera paralela con las alteraciones de los lípidos, también se reconoce la resistencia a la insulina, que se manifiesta por elevaciones en los valores de glucosa, insulina y péptido C y una respuesta anormal en la prueba de tolerancia a la glucosa. Si bien estas alteraciones empezaron a difundirse tan pronto como se amplió el uso de la TARHA, el número de pacientes que desarrollan diabetes mellitus no parece ser significativo hasta este momento. No está claro aún cuál es el mecanismo por el que se presenta la resistencia a la insulina (RI).3,4
La importancia de estas alteraciones radica en la fuerte relación que existe entre las alteraciones metabólicas de lípidos, RI y la enfermedad cardiovascular en la población general.5
Aunque todavía permanece en discusión el efecto que estos trastornos tendrían en los pacientes con la infección por el VIH, no cabe esperar que resulten diferentes de lo que ocurre en la población general. Ya comienzan a circular algunos informes que parecen señalar el impacto que la dislipidemia y la RI pueden tener sobre la salud cardiovascular.6,7
La prevalencia comunicada de estas alteraciones ha sido variable. El estudio de Carr encontró una prevalencia de dislipidemia de 74% y de alteraciones en los carbohidratos de 23% (intolerancia a la glucosa en 16% y diabetes mellitus en 7%).8 En Francia se informa una prevalencia de hipertrigliceridemia de 53% y de resistencia a la insulina en 44%,9 mientras que en Alemania la hipertrigliceridemia fue de 71% y la resistencia a la insulina de 60%.10
En el presente estudio se busca encontrar el impacto que la TARHA ejerce sobre el metabolismo de los lípidos y de la glucosa. Para ello se determinó la prevalencia de las alteraciones en el perfil sérico de los lípidos y de la glucosa en un grupo de pacientes con la infección por VIH que se encuentra recibiendo TARHA, y se comparó la relación entre los esquemas terapéuticos empleados y el desarrollo de estas alteraciones.
Material y métodos
Previa autorización para la realización del estudio por parte del Comité de Ética del Centro de Investigaciones Regionales Dr. Hideyo Noguchi de la Universidad Autónoma de Yucatán y la autorización por escrito para participar en el estudio, se incluyó a los pacientes con la infección por el VIH que acudían a la consulta del Servicio Integral Especializado para el paciente con VIH/SIDA del Hospital General Agustín O´Horán de la Secretaría de Salud y al Laboratorio de Hematología del Centro de Investigaciones Regionales Dr. Hideyo Noguchi de la Universidad Autónoma de Yucatán. A cada paciente se le aplicó un cuestionario creado para este estudio en donde se obtuvieron los siguientes datos: identificación, edad, género, supervivencia con la infección por el VIH en meses, lugar de origen, estadio de la enfermedad, tipo de esquema antirretrovírico, linfocitos CD4 y CD8 y carga vírica. Se excluyeron pacientes 15 años, pacientes con antecedentes previos comprobables de dislipidemia y/o diabetes mellitus, pacientes con monoterapia y mujeres gestantes.
Determinación de laboratorio. Previo ayuno de 12 horas, mediante venopunción periférica, a cada individuo se le tomó una muestra sanguínea de 6 ml y de ésta se obtuvo el suero mediante la inducción de la retracción del coágulo a 37ºC durante 15 minutos y por centrifugación a 800 G por 10 minutos. Del suero obtenido se realizó la determinación de glucosa en ayunas, CT y TG a través de un test enzimático-colorimétrico de acuerdo con las especificaciones del fabricante (Spinreact, S.A., Sant Esteve de Bas, España y Concepta, Biosystems, S.A., Barcelona, España).
Definición de las alteraciones metabólicas. Las alteraciones en las variables metabólicas fueron definidas como:
- hipercolesterolemia (HC): pacientes con valores de colesterol sérico en ayuno > 200 mg/dl.
- hipertrigliceridemia (HT): pacientes con cifras de triglicéridos séricos en ayuno > 200 mg/dl.11
- Hiperglucemia (HG): pacientes con valores de glucosa sérica en ayuno entre 100 y 125 mg/dl.
- Diabetes mellitus (DM): pacientes con cifras de glucosa sérica en ayuno > 126 mg/dl.12
Definición de grupos. De acuerdo con los distintos esquemas de TAR, los pacientes se ordenaron para fines de asociación de resultados en tres grupos: a) pacientes que recibieron un esquema con tres nucleósidos inhibidores de transcriptasa inversa (NITI) (N); b) pacientes que recibieron dos NITI más un inhibidor de proteasas (N + IP), y c) pacientes que recibieron dos NITI más un inhibidor no nucleósido de la transcriptasa inversa (INNTI) (N + NN).
Análisis estadístico. Los datos demográficos recabados se analizaron en el programa estadístico Epi-info versión 6.02 del CDC. Se obtuvo la prevalencia de las alteraciones metabólicas en este grupo de pacientes y se determinó a través de análisis univariado la relación entre los trastornos metabólicos y los tres esquemas terapéuticos empleados mediante la prueba de la ji cuadrada, la prueba exacta de Fisher o la prueba de Anova. Se consideró estadísticamente significativo un valor de p< 0.05. Las variables que resultaron con una diferencia de significancia estadística se analizaron con regresión logística múltiple.
Resultados
Se estudiaron 211 pacientes, de los cuales 36 (17%) eran mujeres y 175 (83%) hombres, con un promedio de edad de 35.2 (19-67) años. Veintiséis (12%) pacientes recibieron tratamiento con N en esquemas de tres fármacos, 35 (17%) recibieron N + NN, y 150 (71%) recibieron N + IP. Los datos clínicos y de laboratorio de estos pacientes se describen en el cuadro I.
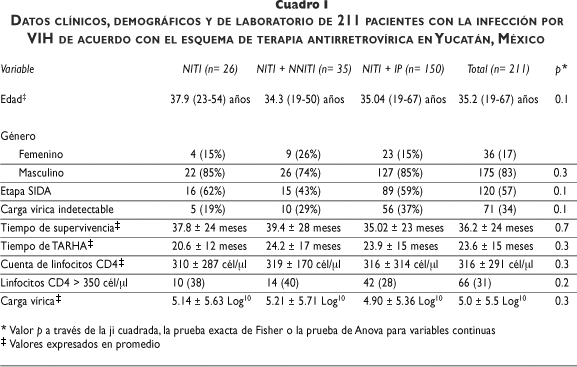
De todos los pacientes, 92 (44%) desarrollaron hiperlipidemia y 43 de éstos (20% del total) presentaron HC (promedio de CT de 263 ± 67 mg/dl); 82 (39%) cursaron con HT (promedio de TG de 420 ± 267 mg/dl). Sólo 16 (7.5%) pacientes tuvieron valores de TG mayores de 500 mg/dl. La presencia de HC e HT combinadas se observó en 30 (14%) pacientes.
Diecinueve (9%) pacientes acusaron alteraciones en la glucosa y de éstos en seis (3%) se diagnosticó diabetes mellitus (promedio de glucosa de 162 ± 25 mg/dl), mientras en 13 (6%) se comprobó intolerancia a la glucosa (promedio de glucosa de 115 ± 4 mg/dl).
El valor promedio de CT fue mayor en los pacientes que recibieron únicamente N comparados con los que recibieron N + NN y N + IP (205 ± 109 mg/dl, 174 ± 50 mg/dl y 162 ± 50 mg/dl, respectivamente); sin embargo, esta diferencia no tuvo significación estadística. En relación con los TG, presentaron valores más elevados en el grupo con N que en los otros dos grupos (354 ± 279 mg/dl, 276 ± 347 mg/dl y 215 ± 157 mg/dl, respectivamente, p= 0.03), con una diferencia de significación estadística.
En cuanto a la glucosa, se observaron valores más altos en el grupo que recibió N + NN que en los que recibieron N o N + IP (100 ± 37 mg/dl, 90 ± 11 mg/dl y 91 ± 12 mg/dl, respectivamente, p= 0.2), aunque la diferencia careció de significancia estadística.
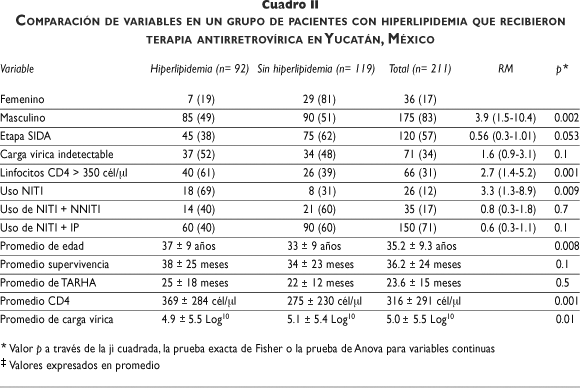
Al realizar un análisis multivariado, la hiperlipidemia estuvo asociada con mayor frecuencia al género masculino [49 vs. 19%, p= 0.002, RM= 3.9 (1.4-10.4)], al conteo de células CD4 mayor de 350/µl, [61 vs. 39%, p= 0.001, RM= 2.7 (1.4-5.2)], al promedio de edad (37 años vs. 33 años, p= 0.008), al menor promedio de carga vírica (4.9 Log10 vs. 5.1 Log10, p= 0.01) y al uso de un esquema de TARHA que contenía sólo N [69% vs. 31%, p= 0.009, RM= 3.3 (1.3-8.9)]. No se encontró relación con el tiempo de supervivencia, con los valores de carga vírica indetectables, con el tiempo de TARHA o con la etapa de la infección por el VIH (cuadro II).
La HC se observó con mayor frecuencia en quienes recibieron N (35%) que en los otros dos grupos de estudio (20% y 18%, respectivamente), aunque esta diferencia tampoco tuvo significado estadístico (p= 0.09). De igual forma, la HT se presentó con mayor frecuencia en los que recibieron N, a diferencia de los otros esquemas de tratamiento (65, 31 y 36%, respectivamente), aunque esta diferencia tuvo significación estadística (p= 0.005). La hiperlipidemia global también fue superior en el grupo con N de manera significativa (69, 40 y 40%, respectivamente) (p= 0.01).
No hubo diferencias en cuanto a la presencia de HG entre los tres grupos de tratamiento (9, 4 y 7%, respectivamente; p= 0.8). Tres pacientes desarrollaron DM, dos (6%) en el grupo de N + NN y uno (0.3%) en el grupo de N + IP, p= 0.06) (cuadro III).
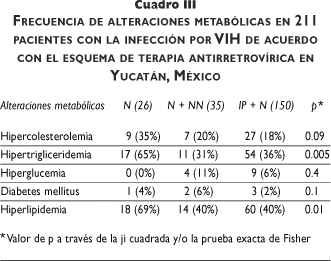
Cuando se analizaron los datos mediante el modelo de regresión logística múltiple, los datos que conservaron significación estadística en relación con la presencia de hiperlipidemia fueron los valores de linfocitos CD4 > 350 células/µl [RM= 2.79 (1.08-7.27); p= 0.03], el género masculino [RM= 3.6 (1.4-9.12); p= 0.006] y el uso de NITI [RM= 3.1 (1.2-8.1); p= 0.01]. No se observó mayor riesgo entre la presencia de hiperlipidemia y el uso de algún fármaco antirretrovírico específico.
Discusión
Los pacientes con la infección por VIH que reciben TAR tienen aumentado el riesgo de presentar hiperlipidemia. Los hallazgos presentes demostraron una prevalencia de hiperlipidemia de 44% en este grupo de pacientes, cifra que es inferior a la de los informes iniciales de Carr y otros grupos europeos,13,9,10 pero similar a la comunicada por Calza en Italia.14
Las alteraciones lipídicas en este grupo de pacientes son superiores a las que comunicó Aguilar-Salinas en población urbana de México (cuadro IV),15 y la prevalencia de HC en este grupo de pacientes es tres veces superior a la que reveló la Encuesta Nacional de Salud 2000.16 Por otro lado, también los valores promedio del CT y los TG en estos pacientes superan a los que encontró Aguilar-Salinas en la población general (208 mg/dl y 388 mg/dl vs. 175 mg/dl y 139 mg/dl, respectivamente)17 (cuadro IV). Este hecho evidencia el impacto que la infección por el VIH y la TAR tienen sobre el metabolismo de los lípidos y el riesgo futuro potencial en las enfermedades cardiovasculares.
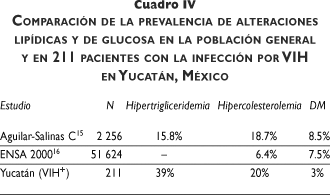
En este estudio, las alteraciones en el metabolismo de la glucosa tuvieron una prevalencia menor que la de los lípidos. La intolerancia a la glucosa y la diabetes mellitus se observaron como hechos menos frecuentes en relación con lo que se comunica en la literatura.8
La HT fue la hiperlipidemia más frecuente. Esta alteración se supone vinculada al efecto que los inhibidores de proteasa tienen sobre la región C-terminal de la proteína de unión del ácido retinoico citoplasmático (PUARC-1) y la proteína relacionada con el receptor de LBD (PRLBD) que guardan una homología de 58 y 63%, respectivamente, con la región catalítica de la proteasa del VIH.2
La inhibición de la PUARC reduce la diferenciación de los adipocitos e incrementa la apoptosis de éstos, lo que se traduce en una reducción de los depósitos de TG y un incremento compensatorio de la liberación de lípidos hacia la circulación, lo que arroja como resultado hiperlipidemia.18 Por otro lado, la PRLBD es un importante receptor que juega un papel esencial en la depuración de los quilomicrones. Al ser bloqueada, se inhibe la regulación de los quilomicrones y sus TG, de donde se incrementan sus concentraciones sanguíneas.3,18 Es factible que éste sea uno de los mecanismos que expliquen la hiperlipidemia en los pacientes que reciben TAR y la HT, en particular en este grupo estudiado.
A diferencia de algunos informes,19 en el de los autores la prevalencia de hiperlipidemia se asoció de manera significativa al género masculino. El hecho de que las mujeres desarrollaron menos hiperlipidemia puede atribuirse al efecto protector de los estrógenos, que se verifica sobre las subfracciones de lipoproteínas, efecto que está ausente en los hombres.20,21
Otro factor que se vinculó con la hiperlipidemia fue una cuenta de linfocitos T CD4 > 350 células/µl. Este resultado puede interpretarse como una satisfactoria reconstitución del sistema inmune como consecuencia de la TAR. Cuando este efecto se presenta, se sabe que ocurre un incremento en la producción de citocinas proinflamatorias del tipo del factor de necrosis tumoral alfa (FNT-a), la interleucina 12 (IL-12) o el interferón alfa (IFN-a).22 El FNT-a y la IL-12 se encuentran aumentados en pacientes que reciben TAR y que presentan el síndrome de lipodistrofia; también se sabe que contribuyen al aumento de la concentración sérica de ácidos grasos libres, que interfieren en la vía metabólica de la insulina e inducen resistencia a esta hormona.23 Por otro lado, el IFN-a aumenta de manera significativa los TG séricos cuando se usa con fines terapéuticos en pacientes con hepatitis C.24 Este efecto deviene de inhibir la actividad de la lipasa de lipoproteína, la lipasa hepática de TG y la proteína transportadora de ésteres de colesterol. El aumento de los valores sanguíneos de IFN-a en pacientes con TAR correlaciona de manera directa con un mayor tiempo en la depuración de los TG. Es probable que la recuperación del sistema inmune en este grupo de pacientes contribuya a la hiperlipidemia al incrementarse la producción de citocinas proinflamatorias.
Un hecho significativo del estudio presente fue la mayor prevalencia de hiperlipidemia en el grupo de pacientes que recibieron TARHA a base de N en comparación con los que recibieron IP + N, como se comprueba con amplitud en la literatura. A diferencia de lo descrito por Carr13 en sus estudios iniciales, en el grupo de pacientes de los autores el uso de IP dentro de los esquemas de TARHA utilizados no se reflejó en una mayor prevalencia de hiperlipidemia. Por el contrario, el uso de NITI como única familia de fármacos en la TARHA sí originó alteraciones de los lípidos significativas. Se ha postulado que el uso de NITI produce toxicidad mitocondrial al inhibir la polimerasa-g de DNA mitocondrial.25 Esta enzima resulta esencial para la replicación del DNA mitocondrial y su inhibición induce cambios en la constitución y redistribución de la grasa corporal. Es probable que estos cambios favorezcan una mayor liberación de ácidos grados al torrente sanguíneo y expliquen las alteraciones en el metabolismo de los lípidos que se observan en pacientes con TARHA a base de NITI pero sin IP. Por otra parte, en el estudio presente, el hecho de que los pacientes que recibieron sólo N hayan presentado hiperlipidemia mayor quizá se pueda atribuir a los fármacos empleados, ya que la estavudina y el abacavir (datos no mostrados) han sido señalados en diversos estudios como causantes de más trastornos lipídicos.26,27
En conclusión, en este grupo de pacientes estudiados la hiperlipidemia es un hecho frecuente. A diferencia de lo que informa la mayoría de las publicaciones, las alteraciones lipídicas representaron un efecto secundario frecuente del uso de NITI, por lo que el hecho apoya la idea de que la patogenia de estas alteraciones no es única y que es probable la existencia de un efecto sinérgico entre las distintas familias de fármacos antirretrovíricos, que actuarían en diversos niveles de la vía metabólica de los lípidos. Es posible que otros factores como la reconstitución del sistema inmunológico, el género o, incluso, la raza28 también contribuyan a la aparición de estas alteraciones.
Lo que resulta irrebatible es que la prevalencia supera a la de la población general y esto implica la probabilidad de un mayor riesgo de accidentes cardiovasculares futuros en este grupo de pacientes. De hecho, ya existen estudios en donde se demuestra una mayor incidencia de infarto al miocardio en pacientes que reciben TARHA.29,30 El papel que desempeñan estas alteraciones en la aterogénesis y sus implicaciones sobre el riesgo cardiovascular aún no se define; aparentemente, el riesgo de enfermedad coronaria es bajo. Empero, tocará a estudios prospectivos controlados a largo plazo definir mejor el perfil de lípidos en los pacientes con la infección por el VIH que reciben TARHA y responder a la interrogante de si a largo plazo estos cambios implican un mayor riesgo cardiovascular.
Referencias
1. Grunfeld C, Kotler DP, Hamadeh R, Tierney A, Wang J, Pierson RN. Hypertriglyceridemia in the acquired immunodeficiency síndrome. Am J Med 1989;86:27-31. [ Links ]
2. Carr A, Samaras K, Chisholm D, Cooper DA. Pathogenesis of HIV-1 protease inhibitor-associated peripheral lipodystrophy, hyperlipidemia, and insulin resistance. Lancet 1998;351:1881-1883. [ Links ]
3. Visnegarwala F, Krause KL, Musher DL. Severe diabetes associated with protease inhibitor therapy. Ann Intern Med 1997;127:947. [ Links ]
4. Eastone J, Decker C. New-onset diabetes mellitus associated with use of protease inhibitor [letter]. Ann Intern Med 1997;127:948. [ Links ]
5. Hoyert DL, Arias E, Smith BL, Murphy SL, Kochanek KD. Deaths: final data for 1999. Natl Vital Stat Rep 2001;49:1-134. [ Links ]
6. Klein D, Hurley L, Sorel M, Sidney S. Do protease inhibitors increase the risk for coronary heart disease among HIV positive patients-follow-up through June 2000. Program and abstracts of the 8th Conference on Retrovirus and Opportunistic Infections; 2001 feb 4-8; Chicago, Illinois. Abstract 655. [ Links ]
7. Mary-Krause M, Cotte L, Partisani M, Simon A, Costagliola D. Impact of treatment with protease inhibitor (PI) on myocardial infarction (MI) occurrence in HIV-infected. Program and abstracts of the 8th Conference on Retrovirus and Opportunistic Infections; 2001 feb 4-8; Chicago, Illinois. Abstract 657. [ Links ]
8. Carr A, Samaras K, Thorisdottir A, Kaufmann GR, Chisholm DJ, Cooper DA. Diagnosis, prediction and natural course of HIV-1 protease-inhibitor-associated lipodystrophy, hyperlipidaemia and diabetes mellitus: a cohort study. Lancet 1999;353:2093-2099. [ Links ]
9. Vigouroux C, Gharakhanian S, Salhi Y, Nguyen TH, Chevenne D, Capeau J et al. Diabetes, insulin resistance and dyslipidaemia in lipodystrophic HIV-infected patients on highly active antiretroviral therapy (HAART). Diabetes Metab 1999;25:225-232. [ Links ]
10. Behrens G, Dejam A, Schmidt H, Balks HJ, Brabant G, Korner T, et al. Impaired glucose tolerance, beta cell function and lipid metabolism in HIV patients under treatment with protease inhibitors. AIDS 1999;13:F63-F70. [ Links ]
11. Expert panel on Detection, Evaluation and Treatment of High Blood Cholesterol in Adults. Summary of the Second Report of the National Cholesterol Education Program (NCEP). JAMA 1993;269:3015-3023. [ Links ]
12. American Diabetes Association. Standards of Medical Care in Diabetes. Diabetes Care 2005;28:S4-S36. [ Links ]
13. Carr A, Samaras K, Burton S, Law M, Freund J, Chisholm DJ et al. A syndrome of peripheral lipodystrophy, hyperlipidaemia and insulin resistance in patients receiving HIV protease inhibitors. AIDS 1998;12:F51-F58. [ Links ]
14. Calza L, Manfredi R, Farneti B, Chiodo F. Incidence of hyperlipidaemia in a cohort of 212 HIV-infected receiving a protease inhibitor-based antiretroviral therapy. Int J Antimicrob Agents 2003;22:54-59. [ Links ]
15. Aguilar-Salinas CA, Olaiz G, Valles V, Ríos Torres JM, Gómez Pérez FJ, Rull JA, et al. High prevalence of low HDL cholesterol concentrations and mixed hyperlipidemia in a Mexican nationwide survey. J Lipid Res 2001;42:1298-1307. [ Links ]
16. Instituto Nacional de Salud Pública. Otras enfermedades crónicas. En: Sepúlveda J, Olaiz G, Rojas R, Barqueras S, Shamah T, Aguilar C et al, ed. Encuesta Nacional de Salud 2003. Cuernavaca, México: Instituto Nacional de Salud Pública, 2003;2:116-125. [ Links ]
17. Aguilar Salinas CA, Rojas R, Gómez-Pérez FJ, Valles V, Franco A, Olaiz G et al. Características de los casos de dislipidemias mixtas en un estudio de población: resultados de la Encuesta Nacional de Enfermedades Crónicas. Salud Publica Mex 2003;44:546-552. [ Links ]
18. Carr A. HIV protease inhibitor-related lipodystrophy syndrome. Clin Infect Dis 2000;30:S135-S142. [ Links ]
19. Pernerstorfer-Schoen H, Jilma B, Perschler A, Wichlas S, Schindl A, Rieger A et al. Sex differences in HAART-associated dyslipidaemia. AIDS 2001;15:725-734. [ Links ]
20. Bush TL, Barrett-Connor E, Cowan LD et al. Cardiovascular mortality and noncontraceptive use of estrogen in women: results from the Lipid research Clinics program Follow-up Study. Circulation 1987;75:1102-1109. [ Links ]
21. Stampfer MJ, Colditz GA. Estrogen replacement therapy and coronary heart disease: a quantitative assessment of the epidemiologic evidence. Prev Med 1991;20:47-63. [ Links ]
22. Smart EJ, Matveev S, Kincer J, Greenberg RN. Protease inhibitors up-regulate SR-BI and HDL-dependent cholesterol uptake in human macrophages: a mechanism that may enhance foam cell formation. Proccedings of the 8th Conference on Retrovirus and Opportunistc Infections; 2001 february 4-8; Chicago, Ill, USA. Abstract 662. [ Links ]
23. Ledru E, Christeff N, Patey O, deTrachis P, Melchior JC, Goregeon ML. Alteration of tumor necrosis factor-alpha T-cell homeostasis following potent anti-retroviral therapy: contribution to the development of insulin immunodeficiency virus–associated lipodystrophy syndrome. Blood 2000;95:3191-3198. [ Links ]
24. Naeem M, Bacon BR, Mistry B, Britton RS, Di Bisceglie AM. Changes in serum lipoprotein profile during interferon therapy in chronic hepatitis C. Am J Gastroenterol 2001;96:2468-2472. [ Links ]
25. Brinkman K, Smeitink JA, Romijn JA, Reiss P. Mitochondrial toxicity induced by nucleoside-analogue reverse-transcriptase inhibitors is a key factor in the pathogenesis of antiretroviral-therapy-related lipodystrophy. Lancet 1999;354:1112-1115. [ Links ]
26. Mauss S, Stechel J, Willers R, Schmutz G, Berger F, Richter W. Differentiating hyperlipidaemia associated with antiretroviral therapy. AIDS 2003;17:189-194. [ Links ]
27. Saves M, Raffi F, Capeau J, Rozenbaum W, Ragnaud JM, Perrone C et al. Factors related to lipodystrophy and metabolic alterations in patients with human immunodeficiency virus infection receiving highly active antiretroviral therapy. Clin Infect Dis 2002;32:1396-1405. [ Links ]
28. Chang KH, Kim JM, Song YG, Hong SK, Lee HC, Lim SK. Does race protect an oriental population from developing lipodystrophy in HIV-infected individuals on HAART? J Infect 2002;44:33-38. [ Links ]
29. Klein D, Hurley LB, Quesenberry CP, Sidney S. Do protease inhibitors increase the risk for coronary heart disease in patients with HIV-1 infection? J Acquir Immune Defic Syndr 2002;30:471-477. [ Links ]
30. Saves M, Chene G, Ducimetiere P, Leport C, Le Moal G, Amouyel P. Risk factors for coronary heart disease in patients treated for human immunodeficiency virus infection compared with the general population. Clin Infect Dis 2003;37:292-298. [ Links ]
Fecha de recibido: 25 de febrero de 2005
Fecha de aprobado: 6 de diciembre de 2005
Solicitud de sobretiros: Dr. Carlos J. Castro-Sansores. Av. Itzáes 490, col. Centro, 97000 Mérida, Yucatán, México. Correo electrónico: castros@tunku.uady.mx














