Serviços Personalizados
Journal
Artigo
Indicadores
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Salud Pública de México
versão impressa ISSN 0036-3634
Salud pública Méx vol.47 no.4 Cuernavaca Jul. 2005
ARTÍCULO ORIGINAL
Eficacia de una prueba rápida para el diagnóstico de Plasmodium vivax en pacientes sintomáticos de Chiapas, México
Eficacia de una prueba rápida para el diagnóstico de Plasmodium vivax en pacientes sintomáticos de Chiapas, México
Lilia González-Cerón, QBP, Dra en CI; Mario H Rodríguez, MC, Dr en FII; Angel F Betanzos, MC, MSPI; Acatl Abadía, QFB.I
ICentro de Investigación de Paludismo, Instituto Nacional de Salud Pública. Tapachula, Chiapas, México
IICentro de Investigaciones sobre Enfermedades Infecciosas, Instituto Nacional de Salud Pública. Cuernavaca, Morelos, México
RESUMEN
OBJETIVO: Evaluar en condiciones de laboratorio la sensibilidad y especificidad de una prueba rápida de diagnóstico (OptiMAL), basada en tiras inmunorreactivas para detectar Plasmodium vivax en pacientes febriles del sur de Chiapas, México.
MATERIAL Y MÉTODOS: Entre diciembre de 2000 a abril de 2002 se investigó la presencia de parásitos en muestras sanguíneas de 893 pacientes por examen microscópico de gotas gruesas teñidas con Giemsa (prueba de referencia). Otra gota de sangre de la misma punción fue empleada en las tiras inmunorreactivas para investigar la presencia de pLDH del parásito. Los resultados discordantes se resolvieron por PCR del gen de la subunidad ribosomal 18S del parásito para descartar infección.
RESULTADOS: OptiMAL mostró una sensibilidad de 93.3% y especificidad de 99.5%, con valores predictivo positivo y negativo de 96.5 y 98.9%, respectivamente. La intensidad de las reacciones en las tiras OptiMAL correlacionaron con la densidad parasitaria (r=0.601, p=0.0001).
CONCLUSIONES: La prueba rápida presentó sensibilidad y especificidad aceptables para detectar P. vivax en condiciones de laboratorio y podría ser útil para el diagnóstico de paludismo en operaciones de campo en México.
Palabras clave: Plasmodium vivax; diagnóstico; prueba rápida OptiMAL; gota gruesa de sangre; México
ABSTRACT
OBJECTIVE: To evaluate, under laboratory conditions, the sensitivity and specificity of a rapid diagnostic test (OptiMAL), based on immunoreactive strips, to detect Plasmodium vivax infection in febrile patients in Southern Chiapas, Mexico.
MATERIAL AND METHODS: The presence of parasites in blood samples of 893 patients was investigated by Giemsa-stained thick blood smear microscopic examination (gold standard). A blood drop from the same sample was smeared on immunoreactive strips to investigate the presence of the parasite pLDH. Discordant results were resolved by PCR amplification of the parasite's 18S SSU rRNA, to discard infection.
RESULTS: OptiMAL had an overall sensitivity of 93.3% and its specificity was 99.5%. Its positive and negative predictive values were 96.5% and 98.9%, respectively. Signal intensity in OptiMAL strips correlated well with the parasitemia density in the blood samples (r= 0.601, p= 0.0001).
CONCLUSIONS: This rapid test had acceptable sensitivity and specificity to detect P. vivax under laboratory conditions and could be useful for malaria diagnosis in field operations in Mexico.
Key words: Plasmodium vivax, diagnosis, rapid test, OptiMAL, thick blood smear; Mexico
El diagnóstico oportuno de los casos de paludismo es esencial para el tratamiento temprano de los pacientes, permite la conducción de una vigilancia epidemiológica adecuada y la aplicación pertinente de medidas de control.1 El examen microscópico de la sangre de pacientes en gota gruesa ha sido el método diagnóstico más empleado por los programas de control del paludismo, y es considerado como el estándar de oro de la sensibilidad y especificidad de otros métodos diagnósticos. Este método es económico y tiene una sensibilidad de aproximadamente 50-100 parásitos/ml de sangre.2,3 Las técnicas de amplificación de genes de los parásitos (Plasmodios) causantes de la enfermedad por medio de PCR ofrecen mayor sensibilidad (1-10 parásitos/µl) y especificidad de 100%. Estas pruebas se han utilizado para complementar el diagnóstico microscópico, sobre todo en regiones donde se transmite más de una especie de plasmodio.4-6 Sin embargo, para su aplicación, ambas requieren técnicos altamente especializados y condiciones de laboratorio que no están disponibles en la mayoría de las localidades afectadas con la enfermedad.
Las pruebas inmunocromatográficas en tiras reactivas eliminan la necesidad de la observación con microscopio y ofrecen la posibilidad de contar con pruebas diagnósticas del paludismo en lugares que no cuentan con servicios básicos de salud. Las pruebas ICTPf/Pv7 y OptiMAL8,9 pueden distinguir la infección producida por Plasmodium falciparum de otras especies de paludismo humano. La prueba OptiMAL, que utiliza anticuerpos específicos que detectan la enzima metabólica lactato deshidrogenada (pLDH) en parásitos vivos,8 ha mostrado ser más sensible que la prueba ICTPf/Pv.10-12 Los resultados de esta sensibilidad para detectar infecciones con P. vivax ha variado entre pacientes de distintas áreas geográficas del mundo, por ejemplo: 93% en Turquía,13 47.1% en Myanmar,14 73.7% en Vietnam,12 79% en Kuwait,11 100% en India15 y 61-76% en Pakistán.16 En las Américas se ha reportado una sensibilidad de 94% en Honduras 8 y de 97 a 100% en Colombia.17,18
En México, P. vivax causa más de 99% de casos de paludismo. El programa para la vigilancia, prevención y control del paludismo cuenta con una red de puestos de diagnóstico atendidos por promotores de salud voluntarios y de laboratorios en el ámbito jurisdiccional, estatal y federal con el fin de hacer el diagnóstico y seguimiento de los casos en las regiones del país donde existe transmisión, lo que permite al programa realizar las acciones preventivas y de control conducentes. Sin embargo, el diagnóstico de los casos, basado en el examen de gota gruesa, limita la oportunidad de la detección de casos por la necesidad del examen de las muestras en laboratorios regionales, lo que dificulta el monitoreo y el control de brotes de la enfermedad. Con el propósito de investigar la pertinencia de implementar una prueba rápida de diagnóstico para paludismo en las áreas afectadas, se investigó la sensibilidad y especificidad de la prueba OptiMAL para detectar infecciones con P. vivax en pacientes febriles que asistieron al Centro para la Investigación de Paludismo (CIP) en Tapachula, Chiapas, México.
Material y métodos
Población de estudio. El CIP proporciona diagnóstico de paludismo de forma rutinaria a individuos febriles mediante el análisis microscópico de la gota gruesa de sangre. En el estudio se incluyeron 893 muestras de sangre de pacientes hombres y mujeres (de seis meses a 89 años de edad) sintomáticos que acudieron al CIP en busca de diagnóstico de diciembre de 2000 a abril de 2002. La mayoría de los pacientes (81.5%) procedía del municipio de Tapachula y el resto de áreas vecinas. En estas áreas sólo se registraron casos con P. vivax durante el periodo de estudio (Programa local de registro de casos Juridicción VII, Tapachula, Chiapas).
Para este estudio, después del consentimiento informado se obtuvo sangre por punción de un dedo de la mano para preparar una gota gruesa y un extendido de sangre. Una gota adicional se utilizó en la prueba OptiMAL y, con otras gotas extras, se impregnó un círculo de 1 cm de papel filtro (Whatman No. 2). Estas muestras se utilizaron para ensayos de PCR, en el caso de obtener resultados discordantes entre la prueba OptiMAL y el examen microscópico de sangre. En cada caso se registró la edad, el sexo, el lugar de origen de los pacientes y la ingestión de medicamentos desde el inicio de los síntomas.
Las gotas gruesas y los extendidos de sangre se secaron al aire, el extendido se fijó con metanol y ambas muestras se tiñeron con colorante Giemsa a 2% diluido en amortiguador de fosfatos, pH 7.4.19 Después de lavar el exceso de colorante y secar, las muestras se examinaron usando un microscopio compuesto, con el objetivo 100X (Nikon SE). El diagnóstico microscópico de la gota gruesa lo hizo un microscopista con experiencia de 20 años empleando esta técnica, pero en algunas muestras discordantes con la prueba OptiMAL, se solicitó la opinión de un segundo microscopista. Para el diagnóstico, se observó un mínimo de 50 campos, pero en pruebas negativas se examinó el área completa de la gota gruesa antes de declararlas sin parásitos. A los individuos diagnosticados con infección con P. vivax por microscopía, se les proporcionó inmediatamente tratamiento a base de Cloroquina/primaquina.20
En las muestras positivas se estimó la parasitemia/µl de sangre. Para ello se examinaron campos microscópicos hasta completar una cuenta de 100-200 leucocitos y el número de parásitos se calculó asumiendo un promedio de 8 000 leucocitos/µl de sangre;19 del mismo modo se calcularon las proporciones de parásitos inmaduros (trofozoítos jóvenes).
La prueba rápida de diagnóstico OptiMAL (Flow Inc., Portland, Oregon, Estados Unidos de América EUA) se realizó simultáneamente con la preparación de las muestras para microscopía. La tira reactiva OptiMAL tiene tres bandas reactivas: la primera contiene un anticuerpo que reconoce la pLDH específica de P. falciparum, la segunda reconoce la pLDH común en todas las especies de Plasmodium que infectan humanos y la tercera corresponde al control positivo de la prueba (contiene un antisuero anti-inmunoglobulinas de ratón). Según la disponibilidad, a lo largo del estudio se utilizaron tres lotes distintos de OptiMAL: se inició con el lote X90630 con caducidad 08/01, luego el lote FLOW5/101 con la caducidad 12/02 y al final el lote 13100.35.11 con caducidad 01/03.
Las pruebas se procesaron conforme a las instrucciones del fabricante. Brevemente, se agregaron dos gotas de reactivo adicionado con un detergente a un vial precubierto con los anticuerpos específicos marcados con oro coloidal; después se adicionó una gota de aproximadamente 10 ml de sangre completa del paciente y se mezclaron para inducir lisis celular y permitir que la pLDH se una a los anticuerpos marcados (en el caso de una infección positiva). Se colocó una tira inmunorreactiva en el vial para permitir la migración de los complejos inmunes (10 min); al completar la impregnación del papel, la tira se transfirió a un nuevo vial de lavado para visualizar el color en las bandas reactivas.
Se detectaron tres intensidades de reactividad en los lotes X90630 y FLOW5/101: 1+ (pálido), 2+ (más que 1+ y menos de la banda control) y 3+ (tan fuerte como la banda control). En el lote 11.13100.35 el color de la banda control fue más débil que la máxima intensidad de las bandas para Plasmodium (3+). Los resultados al terminar la prueba fueron similares a las lecturas hechas cuando las tiras se habían secado (al próximo día). Si la banda control y la banda específica para las especies humanas de Plasmodium fueron visibles, la muestra se registró como positiva para P. vivax. Se identificaron como positivas aquellas bandas con color que cubrían toda la extensión de la banda de reacción.
Las muestras de gota gruesa que fueron negativas por microscopía pero que fueron débilmente positivas en las tiras reactivas fueron analizadas a ciegas por otro microscopista. Estas muestras también se examinaron por amplificación con PCR. A partir de un centímetro-diámetro de sangre seca impregnada en papel de filtro, se extrajo el ADN utilizando un kit de Qia-gen Qiagen (Hilden, Alemania) siguiendo las instrucciones del fabricante y se colectaron aproximadamente 50 µl de solución de ADN de cada muestra. La amplificación por PCR del gen de la sub-unidad ribosomal 18S de P. vivax y P. falciparum se llevó a cabo según Snounou y colaboradores.4 Se usaron 5 µl del ADN extraído como plantilla para la primera reacción de amplificación. Para la segunda amplificación se usaron 1-2 µl del primer producto de amplificación. Todas las amplificaciones se realizaron en un Termociclador 480 termal (Perkin Elmer, EUA). Los productos de PCR se separaron por electroforesis en geles de agarosa en 1%; después de incubar con el bromuro de etidio, las bandas se visualizaron en un transiluminator de UV.
Los resultados se analizaron respecto a la detección de P. vivax, de modo que si el resultado indicó P. falciparum en la prueba OptiMAL esto se interpretó como un verdadero negativo para P. vivax. Los resultados de cada prueba fueron clasificados como verdadero positivo, verdadero negativo, falso positivo y falso negativo. Se emplearon como referencia los resultados del examen microscópico de las gotas gruesas de sangre para calcular la sensibilidad, la especificidad, los valores predictivos positivo (VPP) y negativo (VPN).21 Los intervalos de confianza (IC) se calcularon al 95% de confiabilidad. Se calculó la correlación de Pearson para la parasitemia y la intensidad de reacción en las pruebas OptiMAL. Para estos análisis se utilizó un paquete estadístico (Stata statistical software, Release 7.0; Stata Corporation, College station, TX).
Resultados
El rango de parasitemias de las muestras examinadas por microscopía fue de 240 a 42 500 parásitos/µl de sangre con una media geométrica de 4 466/µl. Se encontraron gametocitos en la mayoría de las muestras de sangre cuya densidad varió de 1 a 20%. Los gametocitos fueron difíciles de observar en algunas muestras con parasitemias por debajo de 1 000/µl. Todas las muestras de sangre contenían distintos estadios asexuales y el porcentaje de estadios inmaduros varió entre 19 y 96%.
Setecientas sesenta y nueve muestras de sangre fueron negativas en ambas pruebas, gota gruesa de sangre y la prueba rápida OptiMAL, 112 fueron positivas a P. vivax en ambas pruebas, otras ocho fueron positivas sólo por microscopía y cuatro positivas únicamente en OptiMAL. La intensidad de la reacción en cada lote de OptiMAL varió en muestras con similares parasitemias (cuadro I). Casi todas las muestras con parasitemias por arriba de 10 000/µl produjeron reacciones intensas (3+). Las muestras con parasitemias entre 3 000 y 10 000/µl fueron todas positivas en OptiMAL y produjeron reacciones pálidas y fuertes. Una muestra con parasitemia estimada de 800/µl produjo una intensidad de reacción fuerte (cuadro I). No obstante, se encontró correlación significativa entre las parasitemias y las intensidades registradas en la prueba OptiMAL (Pearson r=0.601: p=0.0001). No se encontraron diferencias entre los lotes de OptiMAL.
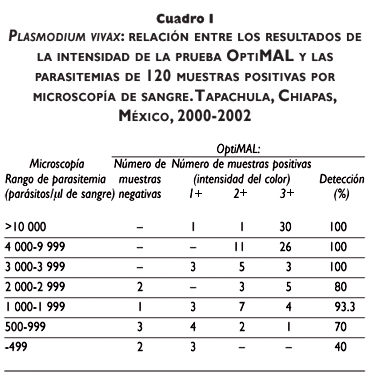
Las ocho muestras positivas en microscopía y negativas por OptiMAL mostraron parasitemias de 240, 240, 640, 720, 720, y 2 560/µl (del lote X90630) y 1 280 y 2 560 /ul (del lote FLOW5/101). De éstas, una provenía de un paciente con 2 560/µl que había ingerido antibióticos (los cuales no fueron especificados) y la muestra contenía abundantes estadios de anillo (90%). Otra muestra que se obtuvo de un paciente que había tomado cloroquina antes de la toma de la muestra y tenía una parasitemia de 1 280/µl con 78% de estadios de anillo. Las muestras con parasitemias por debajo de 3 000/µl correspondieron a 33.3% del total de muestras positivas y 20% de éstas fueron negativas en la prueba OptiMAL.
En general, 15.4% de pacientes sintomáticos aceptaron haber ingerido diferentes tipos de medicamentos. De 39 pacientes sintomáticos que habían ingerido drogas antipalúdicas (cloroquina o primaquina), nueve fueron positivos (con parasitemias de 480-16 000/µl) en OptiMAL.
Cuatro muestras de sangre diagnosticadas negativas por dos microscopistas fueron consideradas positivas a P. vivax en la prueba OptiMAL (tres del lote X90630 y uno del lote 13100-35.11), las intensidades de reacción fueron débiles (1+) en todos los casos. Estas muestras también resultaron negativas por amplificación del gen de la subunidad ribosomal 18S. Otras cuatro muestras que fueron consideradas positivas a P. falciparum por la prueba OptiMAL (dos del lote X90630 y otras dos del lote 13100.35.11), fueron también negativas a la microscopía de gota gruesa y la amplificación por PCR.
La prueba OptiMAL presentó una sensibilidad de 93.3% (88.8-97.8, IC 95%) y especificidad de 99.5% (98.9-99.9, IC 95%), con valor predictivo positivo de 96.5% (93.2-99.8, IC 95%) y valor predictivo negativo de 98.9% (98.2-99.6, IC 95%). La sensibilidad y especificidad varió entre los lotes utilizados para este estudio (cuadro II).

Discusión
En este estudio, la sensibilidad y especificidad de la prueba OptiMAL para detectar infecciones con P. vivax en pacientes sintomáticos del sureste de México concuerdan con las reportadas en otros países del continente americano.8,17,18,22 Aunque la sensibilidad entre los diferentes lotes de OptiMAL no se comparó con las mismas muestras de sangre, ésta varió y también se observaron variaciones en el fondo producido. Como se ha reportado en otros estudios, la baja parasitemia fue un factor que afectó el diagnóstico con esta prueba rápida. El umbral de detección de esta prueba ha variado en distintas regiones geográficas: en Vietnam, se detectaron todas las muestras con parasitemias por encima de 1 000/µl y sólo 33% por debajo de 1 000/µl,12 pero en India y América del Sur se han reportado sensibilidades mayores y detectado todas las infecciones de P. vivax con parasitemias mayores a 200/µl.9 En nuestro estudio, 12.5% de todas las muestras positivas por microscopía mostraron parasitemias por debajo de 1 000/µl, y 66% de éstas y 88% de aquéllas con parasitemias entre 1 000 y 3 000/µl fueron positivas en la prueba rápida.
Por otra parte, parasitemias bajas no fueron el único factor que determinó la reactividad de la prueba rápida y, por ejemplo, no se detectó una muestra con 2 560 parásitos/µl y otra con 16 960/µl produjo sólo una reacción débil. La proporción de estadios inmaduros del parásito (anillos) en las muestras o la ingestión de medicamentos antipalúdicos no explican estas reacciones negativas. Este tipo de problemas ha sido reportado en otros estudios en los que las tiras reactivas de OptiMAL no detectaron parasitemias de 2 000/µl,8 de 5 000/µl11 y de 5 300/µl.23 Otros14 han observado que solamente parasitemias altas de P. vivax produjeron una reacción intensa en esta prueba. Nuestros datos fueron ligeramente diferentes, ya que observamos que una gama amplia de parasitemias (800 a 42 000/µl) produjeron reacciones intensas. Estas variaciones en la detección de parásitos podrían ser explicadas por diferencias en la solubilización del antígeno pLDH del parásito presente en las muestras, pero también se han sugerido posibles polimorfismos en este antígeno14 que podrían afectar su reconocimiento por el anticuerpo empleado en las pruebas. No obstante, la presencia de polimorfismos en la pLDH del parásito aún requiere ser documentada.
En nuestro estudio, las muestras que fueron positivas solamente en las tiras reactivas produjeron señales débiles y fueron confirmadas negativas al rexaminar las gotas gruesas correspondientes y en las pruebas de PCR. Resultados similares han sido obtenidos en viajeros que regresaron a Inglaterra desde Papua-Nueva Guinea, Africa y el sureste de Asia.24 Estas muestras con reacciones débiles son de difícil interpretación, y lo mismo ocurre con el fondo producido como líneas tenues en las orillas de las bandas. En el caso de fondo uniforme, se ha sugerido aumentar el umbral para los verdaderos positivos, pero esto también podría afectar la sensibilidad de la prueba y no sería práctico.25 Las dificultades de interpretación de este tipo de reacciones en las tiras indican la necesidad de criterios en la interpretación que deben adaptarse a la variabilidad entre los lotes de la prueba. También indican que, a pesar de la sencillez de la prueba, es necesario proporcionar un mínimo entrenamiento a los técnicos del laboratorio y al personal de campo para familiarizarse con las características de la prueba, su aplicación e interpretación.
Las infecciones con P. falciparum sugeridas por la prueba OptiMAL en cuatro muestras se consideraron falsos positivos, puesto que no se detectaron estos parásitos ni P. vivax por microscopía y PCR y en las áreas de procedencia de estos pacientes no se reportaron casos de P. falciparum. Sin embargo, no se investigó la posibilidad de que en estas muestras estuvieran presentes anticuerpos de reactividad cruzada.26,27
Es importante señalar que la prueba rápida OptiMAL podría no ser apropiada en regiones con alta frecuencia de parasitemias bajas en los individuos afectados. No obstante, la conveniencia de utilizar esta prueba rápida debe evaluarse en cada área geográfica, ya que la prueba ha dado resultados diferentes en panoramas similares. Por ejemplo, en Tailandia, con un porcentaje alto de pacientes con parasitemias por debajo de 500/µl, el desempeño de la prueba fue pobre,28 mientras que en Turquía, OptiMAL produjo una sensibilidad de 91% en muestras con parasitemias por debajo de 500/µl.13 Nuestras observaciones indican que la sensibilidad y especificidad de OptiMAL son aceptables para el diagnóstico de P. vivax bajo condiciones de laboratorio en el sureste de México. La concordancia de nuestros resultados con los observados en otros estudios en la región (Centro y Suramérica), 8,17,18,22 indican que, previa corroboración de la sensibilidad y especificidad de esta prueba en otras áreas del país y el adecuado entrenamiento del personal operativo y correcta manipulación de las pruebas, podría aplicarse en condiciones de campo con resultados satisfactorios.
Agradecimientos
Agradecemos a Marco A Sandoval, César Abadía y Frida Santillán por su apoyo técnico durante la realización de este trabajo. Este trabajo se realizó en parte con financiamientos del Centro de Investigación de Desarrollo Internacional del Canadá (No. 100194) y del Consejo Nacional de Ciencia y Tecnología, (Conacyt No. 31464).
Referencias
1.World Health Organization. A global strategy for malaria control. Ginebra, Suiza: WHO; 1993. [ Links ]
2.Milne LM, Chiodini PL, Warhurst DC. Accuracy of routine laboratory diagnosis of malaria in the United Kingdom. J Clin Pathol 1994;4:740-742. [ Links ]
3.World Health Organization. New perspectives: Malaria diagnosis. Report of a joint WHO/USAD consultation, 25-27 october 1999. Ginebra, Suiza: WHO; 2000. [ Links ]
4.Snounou G, Viriyakosol S, Zhu XP, Jarra W, Pinheiro L, do Rosario VE et al. High sensitivity of detection of human malaria parasites by the use of nested polymerase chain reaction. Mol Biochem Parasitol 1993;61: 315-320. [ Links ]
5.Filisetti D, Bombard S, N'Guiri C, Dahan R, Molet B, Abou-Bacar A et al. Prospective assessment of a new polymerase chain reaction target (STEVOR) for imported Plasmodium falciparum malaria. Eur J Clin Microbiol Infect Dis 2002;21:679-681. [ Links ]
6.Patsoula E, Spanakos G, Sofianatou D, Parara M, Vakalis NC. A single-step, PCR-based method for the detection and differentiation of Plasmodium vivax and P. falciparum. Trop Med Parasitol 2003;97:15-21. [ Links ]
7.Tjitra E, Suprianto S, Dyer M, Currie BJ, Anstey NM. Field evaluation of the ICT malaria P.f/P.v immunochromatographic test for detection of Plasmodium falciparum and Plasmodium vivax in patients with a presumptive clinical diagnosis of malaria in eastern Indonesia. J Clin Microbiol 1999;37:2412-2417. [ Links ]
8.Palmer CJ, Lindo JF, Klaskala WI, Quesada JA, Kaminsky R, Baum MK et al. Evaluation of the OptiMAL test for rapid diagnosis of Plasmodium vivax and Plasmodium falciparum malaria. J Clin Microbiol 1998;36:203-206. [ Links ]
9. Piper R, Lebras J, Wentworth L, Hunt-Cooke A, Houze S, Chiodini P et al. Immunocapture dagnostic assays for malaria using Plasmodium lactate dehydrogenase (pLDH). Am J Trop Med Hyg 1999;60:109-118. [ Links ]
10. Cho D, Hee KK, Chul PS, Kee KY, No KL, Seung CL. Evaluation of rapid immunocapture assays for diagnosis of Plasmodium vivax in Korea. Parasitol Res 2001;87:445-448. [ Links ]
11. Iqbal J, Khalid N, Hira PR. Comparison of two commercial assays with expert microscopy for confirmation of symptomatically diagnosed malaria. J Clin Microbiol 2002;40:4675-4678. [ Links ]
12. Huong NM, Davis TME, Hewitt S, Huong NV, Uyen TT, Nhan DH et al. Comparison of three antigen detection methods for diagnosis and therapeutic monitoring of malaria: A field study from southern Vietnam. Trop Med Int Health 2002;7:304-308. [ Links ]
13. Aslan G, Ulukanligil M, Seyrek A. Erel O. Diagnostic performance characteristics of rapid dipstick test for Plasmodium vivax malaria. Mem Inst Oswaldo Cruz 2001;96:683-686. [ Links ]
14. Mason DP, Kawamoto F, Lin K, Laoboonchai A, Wongsrichanalai C. A comparison of two rapid field immunochromatographic tests to expert microscopy in the diagnosis of malaria. Acta Tropica 2002;82:51-59. [ Links ]
15. Singh N, Valecha N, Nagpal AC, Mishra SS, Varma HS, Subbarao SK. The hospital and field-based performance of the OptiMAL test, for malaria diagnosis and treatment monitoring in central India. Ann Trop Med Parasitol 2003;97:5-13. [ Links ]
16. Iqbal J, Muneer A, Khalid N, Ahmed MA. Performance of the OptiMAL test for malaria diagnosis among suspected malaria patients at the rural health centers. Am J Trop Med Hyg 2003;68:624-628. [ Links ]
17. Ferro BE, González IJ, Carvajal F, Palma GI, Saravia NG. Performance of OptiMAL in the diagnosis of Plasmodium vivax and Plasmodium falciparum infections in a malaria referral center in Colombia. Mem Inst Oswaldo Cruz 2002;97:731-735. [ Links ]
18. Londono B, Carmona J, Blair S. Comparison between OptiMAL and the tick smear tests for malaria diagnosis in an endemic area during a non-epidemic period. Biomedica 2002;22:466-475. [ Links ]
19. Warhurst DC, Williams JE. Laboratory diagnosis of malaria. J Clin Pathol 1996;49:533-538. [ Links ]
20. World Heatlh Organization. Chemotherapy of Malaria. World health Organ Tech Rep Ser 1967;375. [ Links ]
21. Fletcher RH, Fletcher SW, Wagner EH. Clinical Epidemiology: The essentials, 3rd ed. Baltimore: The William Wilkins Co, 1996;46-58. [ Links ]
22. Quintana M, Piper R, Bowling H-R, Makler M, Sherman C, Gill E et al. Malaria diagnosis by dipstick assay in a Honduran population with coendemic Plasmodium falciparum and Plasmodium vivax. Am J Trop Med Hyg 1998;59:868–871. [ Links ]
23. Playford EG, Walker J. Evaluation of the ICT Malaria P.f/P.v and the OptiMAL Rapid Diagnostic Test for Malaria in Febrile Returned Travellers. J Clin Microbiol 2002;40:4166-4171. [ Links ]
24. Playford EG, Walker J. Evaluation of the ICT Malaria P.f/P.v and the OptiMAL Rapid Diagnostic Test for Malaria in Febrile Returned Travellers. J Clin Microbiol 2002;4166-4171. [ Links ]
25. Coleman RE, Maneechai M, Ponlawat A, Kumpitak C, Rachapaew N, Miller RS et al. Short report: Failure of the OptiMAL rapid malaria test as a tool for the detection of asymptomatic malaria in an area of Thailand endemic for Plasmodium falciparum and P. vivax. Am J Trop Med Hyg 2002;67:563-565. [ Links ]
26. Grobusch MP, Jelinek T, Anscheid T. False positivity of rapid antigen detection tests for diagnosis of Plasmodium falciparum malaria: Issue appears to be more complicated than presented. J Clin Microbiol 1999;37:3781-3782. [ Links ]
27. Iqbal J, Sher A, Rab A. Plasmodium falciparum Histidine-Rich protein 2-based immunocapture diagnostic assay for malaria:Cross-reactivity with rheumatoid factors. J Clin Microbiol 2000;38:1184-1186. [ Links ]
28. Coleman RE, Maneechai N, Rachaphaew N, Kumpitak C, Millar RS, Soyseng V et al. Comparison of field and expert laboratory microscopy for active surveillance for asymptomatic Plasmodium falciparum and Plasmodium vivax in western Thailand. Am J Trop Med Hyg 2002;67:141-144. [ Links ]
Fecha de recibido: 11 de agosto de 2004
Fecha de aprobado: 8 de abril de 2005
Solicitud de sobretiros: Dra. Lilia González-Cerón. Centro de Investigación en Paludismo, Instituto Nacional de Salud Pública. 4 Avenida Norte y 19 calle Poniente, 30700 Tapachula, Chiapas, México. Correo electrónico: lgonzal@insp.mx














