Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Salud Pública de México
versión impresa ISSN 0036-3634
Salud pública Méx vol.47 no.4 Cuernavaca jul. 2005
ARTÍCULO ORIGINAL
Serotipos prevalentes de Streptococcus pneumoniae colonizadores de nasofaringe, en niños del Distrito Federal
Prevalence of Streptococcus pneumoniae serotypes on nasopharyngeal colonization in children of Mexico City
Fortino Solórzano-Santos, MCI; Laura Alicia Ortiz-Ocampo, QFBII; Ma Guadalupe Miranda-Novales, MCI; Gabriela Echániz-Avilés, M en CIII; Araceli Soto-Noguerón, BiólIII; Héctor Guiscafré-Gallardo, M en C.I
IDepartamento de Infectología, Hospital de Pediatría, Centro Médico Nacional Siglo XXI, Instituto Mexicano del Seguro Social (IMSS)
IIUnidad de Investigación en Epidemiología, IMSS
IIICentro de Investigación sobre Enfermedades Infecciosas, Instituto Nacional de Salud Pública, Secretaría de Salud
IVUnidad de Investigación en Epidemiología Hospitalaria, Centro Médico Nacional Siglo XXI, IMSS
RESUMEN
OBJETIVO: Determinar frecuencia, serotipos y susceptibilidad a ocho antimicrobianos en Streptococcus pneumoniae aislados de la nasofaringe de una muestra representativa de niños menores de cinco años de edad residentes en el Distrito Federal.
MATERIAL Y MÉTODOS: Estudio transversal, hecho de febrero de 2002 a enero de 2003. Se incluyeron niños de 2 meses a 5 años. A los seleccionados se les tomó una muestra de exudado faríngeo con hisopo de alginato de calcio. Bajo técnicas ya establecidas se realizó identificación, tipificación y susceptibilidad a ocho antimicrobianos de los aislamientos de S. pneumoniae. Se utilizó estadística descriptiva, prueba de Ji cuadrada y razón de momios (IC 95%) para los factores de riesgo.
RESULTADOS: Se estudiaron 573 niños. En 122/573 (21.4%) niños se aisló S. pneumoniae. Los serotipos más frecuentes fueron el 23F, 35, 19F, 11A y 15A; 46% de los serotipos encontrados no son cubiertos con la vacuna heptavalente. Se encontró 12% de susceptibilidad reducida a la penicilina, con 3% de cepas con alta resistencia; la resistencia a eritromicina fue >30% y para trimetoprim-sulfametoxazol (TMP/SMX) >40%. No hubo cepas resistentes a vancomicina, cefotaxima, amoxicilina-clavulanato, cloranfenicol o ampicilina.
CONCLUSIONES: El porcentaje de serotipos de S. pneumoniae en portadores nasofaríngeos no cubiertos por la vacuna heptavalente es alto, y la resistencia a macrólidos y TMP/SMX es elevada, lo que debe alertar al grupo médico.
Palabras clave: Streptococcus pneumoniae; colonización nasofaríngea; serotipos capsulares
ABSTRACT
OBJECTIVE: To determine the frequency, serotypes and susceptibility profiles to eight antimicrobials in Streptococcus pneumoniae nasopharyngeal isolates from a representative sample of children under 5 years of age, residents of Mexico City.
PATIENTS AND METHODS: A cross-sectional survey was conducted in 573 children aged 2 months to 5 years. A nasopharyngeal sample was taken. S. pneumoniae identification, capsular serotyping and antimicrobial susceptibility to eight antimicrobials were performed according to standardized methods
RESULTS: S. pneumoniae was isolated in 122/573 (21.4%) children. The most frequent capsular serotypes were 23F, 35, 19F, 11A and 15A; 46% of isolates corresponded to serotypes not included in the heptavalent vaccine. Low penicillin susceptibility was found in 12% of strains with 3% of highly resistant penicillin strains; erythromycin resistance was >30% and trimethoprim-sulfamethoxazole resistance >40%. None of the isolates was resistant to vancomycin, cefotaxime, amoxacillin-clavulanate, chloramphenicol or ampicillin.
CONCLUSIONS: Several S. pneumoniae serotypes from nasopharyngeal carriers are not included in the heptavalent vaccine. Resistance to trimethoprim-sulfamethoxazole and macrolides is high. The medical community should be aware of these results.
Key words: Streptococcus pneumoniae; nasopharyngeal colonization; capsular serotypes
En México, las infecciones de vías respiratorias continúan siendo una de las 10 primeras causas de morbilidad y mortalidad en los menores de cinco años de edad. En las infecciones de origen comunitario los principales agentes etiológicos son virus y bacterias. Dentro de las bacterias, Haemophilus influenzae, Streptococcus pneumoniae y Moraxella catharralis son las que se aíslan con mayor frecuencia.1-4 En niños menores de cinco años, S. pneumoniae causa infecciones como otitis media, sinusitis o neumonía, que pueden ir acompañadas de otras enfermedades invasoras como meningitis y bacteriemia.4-7
S. pneumoniae habita la faringe y nasofaringe de sujetos sanos. La frecuencia de portadores es variable pero se estima entre 5 a 75%.6 La colonización inicia en la etapa de lactancia y la proporción de portadores disminuye en forma inversamente proporcional a la edad; se encuentra de 38 a 45% en menores de cinco años, de 29 a 39% en niños de 5 a 9 años y de 9 a 25% en niños de 9 a 14 años.6-9
Los estudios de colonización nasofaríngea han sido utilizados para conocer, desde el punto de vista epidemiológico, tanto la frecuencia como los serotipos predominantes en una población. Se ha reconocido que existe variación de los serotipos en cada país. De acuerdo con estos resultados, se han planeado estrategias de intervención, como la introducción de vacunas. Existen 90 serotipos de S. pneumoniae, de los cuales casi la mitad han sido implicados en distintas enfermedades, lo que ha complicado el desarrollo de una vacuna con cobertura total de los serotipos.10
Recientemente en diversos países del mundo y en México se está utilizando una vacuna conjugada, que contiene siete serotipos de S. pneumoniae de mayor predominio en enfermedad invasora (meningitis, neumonía, bacteriemia) y otitis media aguda en Estados Unidos de América (EUA), Canadá y algunos países europeos. Considerando la dificultad de contar con muestras suficientes de enfermedad invasora que permitan ir evaluando el comportamiento de los serotipos, se ha propuesto como alternativa la vigilancia epidemiológica a través de estudios de colonización nasofaríngea. Por lo anterior, se consideró conveniente llevar a cabo un estudio que permitiera conocer los serotipos prevalentes de S. pneumoniae que colonizan la nasofaringe en la población susceptible de beneficiarse con esta vacuna, para lo cual se obtuvo una muestra representativa de niños menores de cinco años de edad, residentes en el Distrito Federal. En las cepas aisladas se determinaron los serotipos así como la susceptibilidad a los antimicrobianos de uso más común en las infecciones causadas por este microrganismo.
Material y métodos
Se realizó un estudio transversal, en el cual se incluyeron niños de dos meses a cinco años de edad residentes en el Distrito Federal, cuyos padres aceptaron la participación en el estudio. Para el cálculo del tamaño muestral representativo de las 16 delegaciones políticas del Distrito Federal, se consideró la información del Consejo Nacional de Población, que notificaba para el año 2000 una población total de 901 702 menores de cinco años de edad . Se estimó que se requería visitar 1 300 viviendas para obtener una muestra de 590 niños. La selección se hizo a partir del marco muestral maestro del Distrito Federal, mediante muestreo probabilístico multietápico. Se realizó una asignación proporcional de las viviendas requeridas por delegación política y se efectuaron visitas casa por casa.
A todos los niños seleccionados se les tomó una muestra de exudado faríngeo con un hisopo de alginato de calcio, el cual fue depositado en medio de transporte Cary-Blair hasta su llegada al laboratorio clínico. La muestra fue sembrada en medios de gelosa chocolate enriquecida y gelosa sangre de carnero a 5%, y se incubó en atmósfera parcial de CO2 (5-10%) a 35 ºC durante 18-24 horas. La identificación del S. pneumoniae se llevó a cabo mediante morfología colonial, observación de hemólisis parcial, solubilidad en bilis, sensibilidad a la optoquina y tinción de Gram.
La tipificación se realizó por reacción capsular con un pool de antisueros y posteriormente antisueros para grupo, tipo y sueros de factores para diferenciar tipos dentro de los grupos (Statens Seruminstitut, Copenhague, Dinamarca).
Se investigaron algunos factores de riesgo que han sido asociados con mayor riesgo de colonización, incluyendo el nivel socioeconómico. Para establecer el índice de nivel socioeconómico se construyeron los indicadores con base en la metodología descrita por Bronfman y colaboradores.11
Se realizó susceptibilidad a ocho antimicrobianos por el método de dilución en agar de acuerdo con los criterios del National Committee for Clinical Laboratory Standards.12
Los resultados se muestran mediante estadística descriptiva, prueba de ji cuadrada y razón de momios con intervalos a 95% para los factores de riesgo.
Este estudio fue aprobado por el Comité de Etica e Investigación de la Coordinación en Salud Pública. Por las características del estudio sólo se requirió consentimiento verbal de los padres.
Resultados
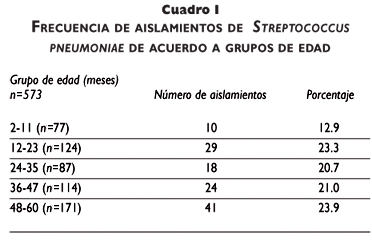
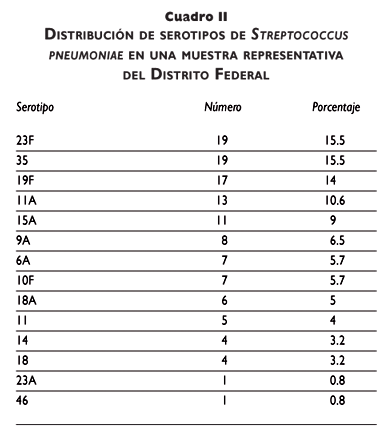
Se visitaron 1 315 viviendas y se localizó a 604 niños de dos meses a cinco años de edad: 31 no fueron incluidos, y quedó una muestra final de 573 niños, 274 de género masculino (47.8%) y 299 de género femenino (52.2%). De acuerdo con su edad, se distribuyeron de 2-11 meses, 13.5%; de 12-23 meses, 21.6%; de 24-35 meses, 15.2%;, de 36 a 47 meses, 19.9%; y de 48 a 60 meses, 29.8%. En 122/573 (21.4%) niños se aisló S. pneumoniae, con una variación de acuerdo al grupo de edad de 12.9 a 23.6% (cuadro I). Al momento de la toma de la muestra 201/573 (35%) niños cursaban con un episodio de infección respiratoria aguda leve; de ellos, estuvieron colonizados por S. pneumoniae 57/201 (28.3%) vs. 65/372 (17.4%) que no tuvieron infección respiratoria (p<0.01). Los serotipos aislados con mayor frecuencia fueron el 23F, 35, 19F, 11A y 15A (cuadro II).
Los factores de riesgo para mayor colonización se describen en el cuadro III. De acuerdo con las características socioeconómicas, existía hacinamiento en 36% de las viviendas; semihacinamiento en 52% y en 12% no había hacinamiento. De las viviendas, 65% tenían piso de cemento; 21% piso de otro recubrimiento y 14% piso de tierra. Se consideró un nivel socioeconómico bueno en 20.9%, regular en 46.4% y malo en 32.6%.

Respecto de la susceptibilidad a antimicrobianos se encontró un bajo porcentaje de susceptibilidad reducida a la penicilina (12%), con sólo 3% de cepas con alta resistencia; la resistencia a eritromicina fue mayor a 40% y para trimetoprim sulfametoxazol superior a 45%: no se encontraron cepas resistentes a vancomicina, cefotaxima, amoxicilina-clavulanato, cloranfenicol o ampicilina (cuadro IV).

Discusión
En el presente estudio se logró realizar un muestreo representativo de las 16 delegaciones del Distrito Federal sobre la colonización nasofaríngea por S. pneumoniae en niños de dos meses a cinco años de edad. Este trabajo podrá ser considerado como un estudio basal para investigaciones futuras cuyo propósito sea evaluar el efecto de campañas extensivas de vacunación con vacunas conjugadas contra S. pneumoniae. El porcentaje de colonización nasofaríngea fue cercano a 20%, lo que corresponde a un nivel intermedio comparado con otros reportes de la literatura. La colonización fue discretamente menor (12.9%) en el grupo de menores de 11 meses, con una frecuencia de alrededor de 20% en los otros grupos de edad. El porcentaje de colonización más bajo en los menores de un año es semejante a lo encontrado en un estudio en niños de Costa Rica13 en los que hay un incremento paulatino en la colonización nasofaríngea conforme aumenta la edad. La colonización puede ser permanente o transitoria; sin embargo, se ha encontrado que alrededor de 80% de los niños menores de dos años han estado colonizados al menos una vez en esa fase de la vida,6,13 por lo que se ha considerado conveniente erradicar aquellos serotipos que han demostrado periodos de colonización más prolongados (por ejemplo 23F, 14, 6B), que además se asocian con mayor frecuencia a enfermedad invasora y que habitualmente tienen más resistencia antimicrobiana. Este objetivo puede conseguirse con la administración de vacunas a los susceptibles. El impacto de la utilización de vacunas conjugadas se ha evaluado en algunos países donde se ha realizado una aplicación generalizada y se ha encontrado disminución de 10 veces la frecuencia de casos de neumonía y 100 veces la frecuencia de otitis media en los vacunados.14 Existen estudios de seguimiento en los que se ha observado una franca disminución de los casos de enfermedad invasora en los niños vacunados con un efecto indirecto en la disminución de casos en adultos15 y de casos de enfermedad asociada a serotipos con resistencia a antimicrobianos.
Dentro de los factores de riesgo que favorecen un mayor grado de colonización se encontraron, en esta muestra, el asistir a la guardería, tal y como ha sido observado en estudios previos,16 así como el contacto con algún compañero que tuviera una infección respiratoria aguda. Por otra parte, cabe destacar que el porcentaje de niños colonizados era mayor cuando las madres trabajan fuera del hogar; esto se relaciona probablemente con el hecho de que los hijos de este grupo de madres habitualmente son quienes asisten a las guarderías. El conocimiento de factores de riesgo semejantes ha favorecido que grupos como el Comité Público de Higiene de Francia recomienden aplicar la vacuna a todos los menores de dos años de edad que asisten a guardería, aspecto que debe ser considerado por los pediatras para la recomendación de las vacunas conjugadas.
El porcentaje de colonización por S. pneumoniae fue más frecuente en los niños con infección respiratoria aguda alta y en aquellos en contacto con niños con infección respiratoria aguda. Se conoce que las infecciones virales, especialmente las causadas por el virus de la influenza17,18 facilitan la capacidad invasora y tienen una estrecha relación en la patogenia de la neumonía por S. pneumoniae. Sin embargo, de ninguna manera está justificada la prescripción de antimicrobianos cuando un niño cursa con alguna infección respiratoria aguda para "evitar la colonización por S. pneumoniae". Por el contrario, deben promoverse acciones como la vacunación contra H. influenzae tipo b y de vacunas contra S. pneumoniae que ayudarán a disminuir el número de portadores asintomático.
El desarrollo de una vacuna con adecuada cobertura se ha visto complicada por la existencia de 90 serotipos diferentes de S. pneumoniae.10 En 1977 fue liberada para su uso una vacuna que contenía 14 serotipos y que proporcionaba una cobertura de 80% de los serotipos causantes de enfermedad invasora; en 1983 se añadieron nueve serotipos más obteniéndose así una vacuna con 23 serotipos y una cobertura de 90%. Esta vacuna es de utilidad en los mayores de dos años de edad; sin embargo, no es inmunoprotectora en los menores de dicha edad.19-21 Con el objeto de lograr una estimulación inmunogénica adecuada, se están desarrollando diversas vacunas conjugadas, que acoplan en forma covalente diferentes antígenos capsulares de S. pneumoniae a proteínas acarreadoras inmunogénicas.22-24 Sólo una ha sido aprobada para su uso en menores de dos años de edad y fue desarrollada considerando los serotipos más frecuentes que causan enfermedad en EUA y Canadá; contiene los serotipos 4, 6B, 9V,14,18C, 19F y 23F , los cuales se considera cubren 65 a 88% de los casos de enfermedad invasora por neumococo. Debido a su alto costo, su aplicación en nuestro país aún es limitada. No obstante, se debe buscar ampliar la cobertura para todos los niños susceptibles, incluyendo a los de áreas marginadas. Al tomar en cuenta la información acumulada en México sobre los serotipos participantes en enfermedad invasora y no invasora, se considera que esta vacuna heptavalente cubriría alrededor de 65-70% de los casos.4,15,25,26 De acuerdo con los hallazgos en este estudio, en portadores asintomáticos se alcanzaría una cobertura de 54% en el Distrito Federal. Es inquietante que exista al menos 46% de serotipos que no son cubiertos por la vacuna, que potencialmente podrían, en el mediano plazo, remplazar a los serotipos vacunales. Este fenómeno ha empezado a observarse en aquellos países donde se está utilizando en forma regular la vacuna.27,28 Hasta el momento no hay evidencias de un incremento importante en los casos de enfermedad invasora por serotipos no incluidos en la vacuna heptavalente. Sin embargo, existen algunos modelos teóricos que consideran los riesgos potenciales en el corto y largo plazos, en los que se estima que se producirá un efecto inicial de disminución rápida y paralela de los serotipos causantes de enfermedad invasora y con características de alta resistencia a penicilina y de los no incluidos en la vacuna, pero en el mediano plazo se producirá un incremento en los serotipos no incluidos en la vacuna con selección de aquellos serotipos con mayor resistencia.29 Por lo anterior, es necesario montar sistemas de vigilancia que permitan detectar oportunamente estos cambios. Los estudios de colonización nasofaríngea y el aislamiento de las cepas causantes de enfermedad son dos de los métodos recomendados para la vigilancia en estudios transversales y de largo plazo.
Al igual que en estudios anteriores,7,8 se observó que las cepas que colonizan la nasofaringe tienen mayor susceptibilidad a penicilina y otros antibióticos en comparación a lo notificado con cepas que causan enfermedad.26 Sin embargo los porcentajes de resistencia a macrólidos y trimetoprim-sulfametoxazol son muy elevados, con un comportamiento semejante a lo observado en otras ciudades de México y en diversos países del mundo.8,30-32 Las cepas sensibles son las que pueden eliminarse con mayor facilidad con el uso de antimicrobianos, incluso cuando se prescriben en forma innecesaria, lo que brinda la oportunidad a las cepas resistentes para ocupar estos nichos ecológicos y, eventualmente, causar enfermedad. Es importante destacar que entre los serotipos cubiertos por la vacuna heptavalente en los portadores, están incluidos aquellos como el 23F, 14 y 19F, que generalmente presentan resistencia antimicrobiana a diversos agentes. La introducción de las vacunas conjugadas ha logrado reducir la adquisición y el estado de portador de neumococos resistentes a los antimicrobianos; en áreas de alta prevalencia de neumococos resistentes este efecto ha sido más evidente.33 A pesar de la disponibilidad de una vacuna conjugada para la prevención de enfermedades invasoras por S. pneumoniae, el control de las cepas multirresistentes va mucho más allá de la sola administración de la vacuna.27 El uso prudente de los antimicrobianos, evitando la sobreprescripción en infecciones respiratorias de etiología viral, se convierte en un auxiliar esencial para disminuir la morbilidad y mortalidad asociada con infecciones por S. pneumoniae.
Persiste el reto de desarrollar nuevas vacunas que superen las debilidades que en la actualidad pudieran encontrarse en la vacuna heptavalente. En diversas partes del mundo ya han sido evaluadas vacunas que incluyen nueve y 11 serotipos, vacunas con nuevos acarreadores, inclusión de proteínas de membrana, etcétera, y se espera que, en el mediano plazo, puedan utilizarse en la población infantil. Por el momento, pueden aprovecharse las ventajas de la vacuna heptavalente.
Referencias
1. Mulholland K. Magnitude of the problem of childhood pneumonia. Lancet 1999;354:590-592. [ Links ]
2. Dagan R, Fraser D, Greif Z, Séller N, Kaufstein M, Shazberg G et al. A nationwide prospective surveillance study in Israel to document pediatric invasive infections, with emphasis on Haemophilus influenzae type b infections. Israeli Pediatric Bacteremia and Meningitis Group. Pediatr Infect Dis J 1998;17(Suppl):S198-S203. [ Links ]
3. Miranda NMG, Solórzano SF, Velázquez AR, Leaños MB, Villasis KMA, Guiscafré GH. Características de los aislamientos de Haemophilus influenzae de portadores asintomáticos en edad pediátrica y su relación con resistencia a antimicrobianos. Bol Med Hosp Infant Mex 1995;52:148-153. [ Links ]
4. Echániz AG, Velázquez MM, Carnalla BMN, Soto NA, Solórzano SF, Pérez MA et al. Antimicrobial susceptibilities and capsular types of invasive Streptococcus pneumoniae isolated in children in Mexico City. Microb Drug Resist 1997;3:153-157. [ Links ]
5. Kertesz DA, DiFabio JL, Cunto BMC, Castañeda E, Echániz-Avilés G, Heitmann I et al. PAHO Pneumococcal Surveillance Study Group. Invasive Streptococcus pneumoniae infection in Latin American children: Results of the Pan American Health Organization Surveillance Study. Clin Infect Dis 1998; 26:1355-1361. [ Links ]
6. Gray BM, Converse GM,Dillon HC. Epidemiologic studies of Streptococcus pneumoniae in infants: Acquisition, carriage, and infection during the first 24 first months of life. J Infect Dis 1980; 142:923-933. [ Links ]
7. Faden H, Duffy L, Wasielewski R, Wolf J, Krystofik D, Tung Y. Relation between nasopharyngeal colonization and the development of otitis media in children. J Infect Dis 1997; 175:1440-1445. [ Links ]
8. Miranda NMG, Solórzano SF, Guiscafré GH, Leaños MB, Echániz AG, Carnalla BMN et al. Streptococcus pneumoniae: low frequency of penicillin resistance and high resistance to thrimetoprim-sulfamethoxazole in nasopharyngeal isolates from children in a rural area in Mexico. Arch Med Res 1997;28:559-563. [ Links ]
9. Leiberman A, Dagan R, Leibovitz E, Yagupsky P, Fliss DM. The bacteriology of the nasopharynx in childhood. Int J Pediatr Otorhinolaryngol 1999;49(Suppl 1):S151- S153. [ Links ]
10. Henrichsen J. Six newly recognized types of Streptococcus pneumoniae. J Clin Microb 1995;33:2759-2762. [ Links ]
11. Bronfman M, Guiscafré H, Castro V, Castro R, Gutiérrez G. La medición de la desigualdad. Una estrategia metodológica, análisis de las características socioeconómicas de la muestra. Arch Invest Med 1988;19:351-360. [ Links ]
12. National Committee for Clinical Laboratory Standards. Antimicrobial susceptibility test for bacteria that grow aerobically: Approved Standard. 5th ed. Wayne (PA): National Committee for Clinical Laboratory Standards, 2000; NCCLS document M7-A5. [ Links ]
13. Vives M, García ME, Sáenz P, Mora MA, Mata L, Sabharwal H et al. Nasopharyngeal colonization in Costa Rican children during the first year of life. Pediatr Infect Dis J 1997;16:852-858. [ Links ]
14. Poehling KA, Lafleur BJ, Szilagyi PG, Edwards KM, Mitchel E, Barth R et al. Population-based impact of pneumococcal conjugate vaccine in young children. Pediatrics 2004;114:755-761. [ Links ]
15. Whitney CG, Farley MM, Hadler J, Harrison LH, Bennett NM, Lynfield R, et al. Active Bacterial Core Surveillance of the Emerging Infections Program Network. Decline in invasive pneumococcal disease after the introduction of protein-polysaccharide conjugate vaccine. N Engl J Med 2003;348:1737-1746. [ Links ]
16. Echániz AG, Carnalla BN, Velázquez MME, Soto NA, Espinoza MLE, Solórzano SF. Capsular types of Streptococcus pneumoniae causing disease in children from Mexico City. Pediatr Infect Dis J 1995;14:907-908. [ Links ]
17. Tong HH, Weiser JN, James MA, DeMaria TF. Effect of influenza A virus infection on nasopharyngeal colonization and otitis media induced by transparent or opaque phenotype variants of Streptococcus pneumoniae in the chinchilla model. Infect Immun 2001; 69:602-606. [ Links ]
18. Madhi SA, Klugman KP. Vaccine Trialist Group. A role for Streptococcus pneumoniae in virus-associated pneumonia. Nat Med 2004;10:811-813. [ Links ]
19. Leinonen M, Sakkinen A, Kalliokoski R, et al. Antibody response to 14-valent pneumococcal capsular polysaccharide vaccine in pre-school age children. Pediatr Infect Dis 1986;5:39-44. [ Links ]
20. Robbins JB, Austrian R, Lee CJ, Rastogi SC, Schiffman G, Henrichsen J et al. Considerations for formulating the second-generation pneumococcal capsular polysaccharide vaccine with emphasis on the cross reactive types within groups. J Infect Dis 1983;148:1136-1159. [ Links ]
21. Shapiro ED, Berg AT, Austrian R, Schroeder D, Paracells V, Margolis A et al. The protective efficacy of polyvalent pneumococcal polysaccharide vaccine. N Engl J Med 1991;325:1452-1460. [ Links ]
22. Rennels MB, Edwards KM, Keyserling HL, Reisinger KS, Hogerman DA, Madore DV et al. Safety and immunogenicity of heptavalent pneumococcal vaccine conjugated to CRM197 in United States infants. Pediatrics 1998;101:604-611. [ Links ]
23. Shinefield HR, Black S, Ray P, Chang I, Lewis N, Fireman B et al. Safety and immunogenicity of heptavalent pneumococcal CRM197 conjugated vaccine in infants and toddlers. Pediatr Infect Dis J 1999;18:757-763. [ Links ]
24. Black S, Shinefield HR, Fireman B, Lewis E, Ray P, Hansen JR et al. Efficacy, safety and immunogenicity of heptavalent pneumococcal conjugated vaccine in children. Northern California Kaiser Permanent Vaccine Study Center Group. Pediatr Infect Dis J 2000;106:367-376. [ Links ]
25. Echániz-Avilés IG, Solórzano-Santos F. Meeting the challenge: Prevention of pneumococcal disease with conjugate vaccines. Salud Publica Mex 2001;43:352-367. [ Links ]
26. Calderón JE, Echániz AG, Conde GC, Rivera SR, Barriga AG, Solórzano SF et al. Resistencia y serotipificación de 83 cepas de Streptococcus pneumoniae aislados de portadores y niños enfermos. Bol Med Hosp Infant Mex 1993;50:854-860. [ Links ]
27. Finkelstein JA, Huang SS, Daniel J, Rifas-Shiman SL, Kleinman K, Goldmann D et al. Antibiotic-resistant Streptococcus pneumoniae in the heptavalent pneumococcal conjugate vaccine era: Predictors of carriage in a multicommunity sample. Pediatrics 2003;12:862-9. [ Links ]
28. Pelton SI, Loughlin AM, Marchant CD. Seven valent pneumococcal conjugate vaccine immunization in two Boston communities: Changes in serotypes and antimicrobial susceptibility among Streptococcus pneumoniae isolates. Pediatr Infect Dis J 2004;23:1015-1022. [ Links ]
29. Temime L, Guillemot D, Boelle PY. Short- and long-term effects of pneumococcal conjugate vaccination of children on penicillin resistance. Antmicrob Agents Chemother 2004;48:2206-2213. [ Links ]
30. Mónaco M, Camilli R, D'Ambrosio F, Del Grosso M, Pantosti A. Evolution of erythromycin resistance in Streptococcus pneumoniae in Italy. J Antimicrob Chemother 2005;55:256-259. [ Links ]
31. Oteo J, Lázaro E, De Abajo FJ, Baquero F, Campos J. Spanish Members of the European Antimicrobial Resistance Surveillance System. Trends in antimicrobial resistance in 1 968 invasive Streptococcus pneumoniae strains isolated in Spanish hospitals (2001 to 2003): decreasing penicillin resistance in children's isolates. J Clin Microbiol 2004;42:5571557-7. [ Links ]
32. Brown SD, Farrell DJ. Antibacterial susceptibility among Streptococcus pneumoniae isolated from paediatric and adult patients as part of the PROTEKT US study in 2001-2002. J Antimicrob Chemother 2004;54(Suppl 1):23-29. [ Links ]
33. Moore MR, Hyde TB, Hennessy TW, Parks DJ, Reasonover AL, Harker-Jones M et al. Impact of a conjugate vaccine on community-wide carriage of nonsusceptible Streptococcus pneumoniae in Alaska. J Infect Dis 2004;190:2031-2038. [ Links ]
Fecha de recibido: 2 de diciembre de 2004
Fecha de aprobado: 11 de mayo de 2005
Solicitud de sobretiros: Dr. Fortino Solórzano Santos. Hospital de Pediatría Centro Médico Nacional Siglo XXI, Instituto Mexicano del Seguro Social. Avenida Cuauhtémoc 330, Segundo piso, colonia Doctores, 06720 México, DF. Correo electrónico: forsosa@starmedia.com














