Introducción
La enfermedad de Kawasaki (EK) fue descrita por Tomisaku Kawasaki en 1961 y, en la actualidad, se reconoce como la principal causa de cardiopatía adquirida de países desarrollados. En la mayoría de los casos es una condición autolimitada. No se conoce su etiología, pero se cree que pueda ser de causa infecciosa, autoinmune o por susceptibilidad genética. Generalmente afecta a vasos de mediano y pequeño calibre.1,2 Es un padecimiento endémico de los países asiáticos, y predomina en niños menores de cinco años, siendo su mayor incidencia entre los 18 y 24 meses de edad.3,4 Se estima que afecta de 10-15/100,000 niños que viven en países desarrollados.5
La complicación más temida de la EK es el desarrollo de aneurismas en arterias coronarias. Como los lactantes tienen más probabilidades de presentar manifestaciones atípicas de la EK, puede retrasar su diagnóstico, lo que favorece el desarrollo de complicaciones.4,6 Los aneurismas ocurren hasta en el 25% de los casos de EK no tratados; mientras que el 50% desarrolla dilatación transitoria de las arterias coronarias, y el 1% puede presentar aneurismas gigantes. Aproximadamente, la mitad de los aneurismas se resuelven entre uno y dos años después de la fase aguda.5 El tratamiento con inmunoglobulina humana disminuye el riesgo de desarrollar aneurismas.3,7
En este artículo reportamos el caso de un lactante de dos meses, en quien hubo retraso en el diagnóstico de EK, lo cual muy probablemente favoreció el desarrollo de aneurismas coronarios.
Presentación del caso
Se trata de paciente masculino de 45 días de edad, sin antecedentes perinatales, heredofamiliares o patológicos de importancia. Esquema de vacunación completo.
El padecimiento inició con fiebre de difícil control. A los cinco días de iniciada la fiebre, acude a médico particular, quien diagnostica faringoamigdalitis y prescribe amoxicilina/ácido clavulánico por dos días y dicloxacilina por cinco días, además de paracetamol, pero no presenta mejoría.
A los diez días de evolución se agregó hiperemia conjuntival, exantema maculopapular generalizado, aumento de volumen de ganglios cervicales y edema en miembros inferiores, por lo cual lo llevan a urgencias del hospital del ISSSTE, Morelia, Michoacán. Se toman exámenes de laboratorio (Tabla 1, columna A) los cuales muestran leucocitosis, neutrofilia, proteína C reactiva elevada (18.7 ng/mL) y examen general de orina anormal. Se decide emplear ceftriaxona; a las 48 horas se reporta urocultivo con E. coli y BLEE positivo, cambiando a meropenem. Para el día 20 del padecimiento, se observó descamación en plantas y presencia de fisuras en comisuras de los labios. Se decide agregar vancomicina y fluconazol.
Tabla 1: Evolución de los exámenes de laboratorio.
| Examen | A | B | C |
|---|---|---|---|
| Hemoglobina (g/dL) | 9.4-11.2 | 8.2 | 11.3 |
| Hematocrito (%) | 28-35 | 25.9 | 33.9 |
| Plaquetas (cel.(3)/mL) | 150-350 | 407.00 | 652.00 |
| Leucocitos (cel.(3)/mL) | 5-17.5 | 42.52 | 33.50 |
| Linfocitos (cel.(3)/mL) | 2-7.3 | 14.10 | 11.19 |
| Neutrófilos (cel.(3)/mL) | 1.05-8.5 | 23.35 | 15.80 |
| Monocitos (cel.(3)/mL) | 0.6-5.0 | 11.71 | 3.38 |
| Basófilos (cel.(3)/mL) | 0.2-4.0 | 2.22 | 0.14 |
| Eosinófilos (cel.(3)/mL) | 1.50 | 0.65 | 2.66 |
| VSG (mm/h) | 0-10 | 24 | 50 |
| Procalcitonina (ng/mL) | – | 1.47 | 0.2 |
| PCR (ng/mL) | 18.7 | 137 | 0.5 |
A: día 10 de evolución. B: día 30 de evolución. C: después del tratamiento con inmunoglobulina.
VSG = velocidad de sedimentación globular, PCR = proteína C reactiva.
Tras 30 días del padecimiento y por la persistencia de la fiebre, se decide traslado a nuestro hospital. A su ingreso se corrobora fiebre, se ausculta soplo cardiaco holosistólico en mesocardio grado II/VI y soplo sistólico regurgitante en foco tricuspídeo grado II/VI, pero sin repercusión hemodinámica. Se decide continuar con antibióticos, iniciando protocolo de estudio de fiebre de origen a determinar. En nuevos exámenes de laboratorio (Tabla 1, columna B), se determina leucocitosis, neutrofilia, trombocitosis e hipoalbuminemia. Radiografía de tórax, ultrasonido abdominal y tomografía computarizada de cráneo fueron normales. En electrocardiograma se observó crecimiento de cavidades izquierdas, sospechando endocarditis, por lo que se realiza ecocardiograma transtorácico (ECT), con los siguientes hallazgos: persistencia de conducto arterioso; en arteria coronaria izquierda (Figura 1) se observa aneurisma sacular que mide 4.6 mm de ancho y 5.2 mm de longitud (z-score +9.2), así como imagen sugestiva de trombo en su interior. En coronaria derecha (Figura 2), origen: 4.2 mm (z-score +8.6), se observan dos aneurismas fusiformes en la porción proximal, uno mide 9.9 × 53.9 mm (z-score + 7.7), y otro más en la porción distal que mide 7.6 × 3.2 mm (z-score +7.1). Además, se detectó derrame pericárdico laminar y función sistólica ventricular conservada.
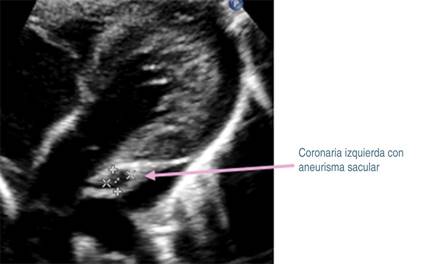
Figura 1: Ecocardiograma: vista subcostal eje largo en la cual se observa coronaria izquierda con aneurisma sacular de 4.6 × 5.2 mm (z-score +9.2), con presunción de trombo en su interior.
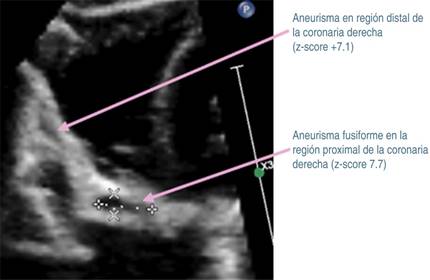
Figura 2: Ecocardiograma: vista subcostal eje largo, evidenciando trayecto de la coronaria derecha con dos aneurismas fusiformes.
Los datos previos orientaron a que se trataba de EK, por lo que se inicia inmunoglobulina intravenosa (IGIV) humana a dosis de 2 g/kg/día, ácido acetilsalicílico (ASA) a dosis de 80 mg/kg/día, clopidogrel (0.5 mg/kg/día) y enoxaparina (1 mg/kg/dosis). La fiebre cede en las primeras 24 horas, presentando mejoría del estado general. Cinco días después, en ECT de control, el tronco coronario izquierdo medía 3.9 mm (z-score +7.05), sin evidencia de trombo en su interior. Mientras que en la coronaria derecha hay regresión de aneurismas fusiformes a aneurismas pequeños, midiendo 2.4 × 5.4 mm en porción proximal (z-score + 3.16), y de 1.9 × 4.5 mm en porción distal (z-score + 2.75) (Figura 3). En el tronco coronario izquierdo medía de 3.9 (z-score + 7.05), sin evidencia de trombo (Figura 4).

Figura 3: Ecocardiograma: en vista paraesternal, eje corto a nivel de la válvula aórtica 10 días posterior a la inmunoglobulina, se observa tronco coronario izquierdo de 3.9 (z-score + 7.05), sin evidencia de trombo en su interior.
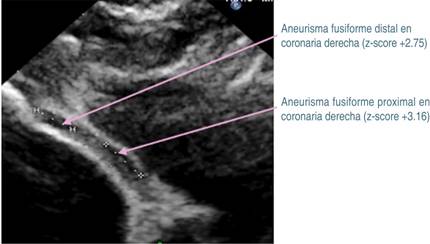
Figura 4: Imagen ecocardiográfica de control 10 días posterior a la aplicación de inmunoglobulina. Se observa trayecto de la coronaria derecha con regresión de aneurismas fusiformes a aneurismas pequeños.
Debido a la mejoría, tanto clínica como en los exámenes de laboratorio (Tabla 1, columna C), es egresado con ASA (3 mg/kg/día) y clopidogrel (0.5 mg/kg/día), manteniendo control en consulta externa de Cardiología e Infectología. En la revisión a los 15 días del alta, el paciente se encontraba clínicamente bien y ganaba peso. Se planea realizar angiografía coronaria para documentar el grado de afectación.
Discusión
El desafío para establecer diagnóstico de EK en el paciente que presentamos, en gran parte, fue por su edad; ya que menos de 2% de los casos de EK ocurren en esta etapa.7 Sin embargo, es importante destacar que para llegar al diagnóstico fueron determinantes los hallazgos por ecocardiografía, al evidenciar aneurismas coronarios y derrame pericárdico. Ante esta situación, se ha sugerido que el ecocardiograma forme parte del protocolo de estudio de lactantes con fiebre persistente, de más de siete días de duración, sin una clara etiología.8-11 Se debe recordar que la ecocardiografía es la técnica de elección para la detección y vigilancia de aneurismas coronarios en niños con EK; además de que puede detectar ectasia vascular, derrame pericárdico, insuficiencia valvular y disfunción miocárdica.7,12,13
Los aneurismas de las arterias coronarias (AAC) son las complicaciones más importantes de la EK. Se describen dos diferentes tipos de aneurismas, los saculares y fusiformes. Los primeros se caracterizan por presentar lesión en la íntima, media y elástica; la adventicia puede romperse o formar trombos, o bien se organiza, calcifica y origina estenosis. En el caso de los fusiformes, su característica es preservar la trombosis y desencadenar estenosis mural progresiva. Ambos tipos de aneurismas se encontraron en nuestro paciente, los cuales son extremadamente raros en niños menores de tres meses de edad; por su dimensión, no se consideraron gigantes, ya que el z-score no fue mayor a 8 mm. Los aneurismas gigantes se consideran de mal pronóstico, ya que pueden conducir a trombosis coronaria, estenosis o infarto de miocardio, lo cual ocurre hasta en el 73% de los pacientes durante el primer año de la enfermedad.7
El diagnóstico temprano de la EK puede disminuir la incidencia de aneurismas, al aplicar IGIV de manera oportuna, es decir, dentro de los primeros 10 días de haber iniciado el cuadro clínico. El tratamiento estándar recomendado es de IGIV dosis de 2 g/kg/día en infusión de 12 horas, el cual debe estar asociado a ASA a dosis de 80-100 mg/kg/día. Este último no debe mantenerse más allá de 48 a 72 h después que la fiebre desaparece.7 En pacientes clasificados de alto riesgo, como el paciente que presentamos, el uso de corticoesteroides reduce aún más el riesgo del desarrollo de AAC, hasta en 76%.14,15
En caso de resistencia a IGIV, existen alternativas terapéuticas como infliximab, ciclosporina, anakinra, ciclofosfamida y plasmaférisis.7 En el caso que nos ocupa, también se utilizó clopidogrel y enoxaparina por su efecto antiagregante plaquetario, antiinflamatorio y antiangiogénico, ya que se detectó ectasia vascular, la cual puede desencadenar infarto del miocardio.7











 nueva página del texto (beta)
nueva página del texto (beta)


