Introducción
La esclerosis múltiple es una enfermedad desmielinizante crónica que afecta al sistema nervioso central (SNC). Se caracteriza por la tríada de inflamación, desmielinización y gliosis, y constituye una causa importante de discapacidad no traumática en adultos jóvenes. Fue descrita por Jean-Martin Charcot, en el año 1868.1
Con base en el curso clínico, se clasifica en los siguientes subtipos: remitente-recurrente, secundariamente progresiva, primariamente progresiva, progresiva recurrente. El subtipo remitente-recurrente es el más frecuente, hasta en 85% de los casos.2
Es un padecimiento poco frecuente en pediatría. Del total de casos, alrededor del 3 al 5% ocurre en menores de 15 años. Es más común en el sexo femenino, en una relación de 3:1.3,4 Los factores de riesgo asociados al desarrollo de esclerosis múltiple son: infecciones (predominantemente virales), sexo femenino, deficiencia de vitamina D, tabaquismo, antecedentes familiares.5 La etiología es desconocida, pero se involucran causas infecciosas (herpes virus) y causas autoinmunes.6
Para el diagnóstico se han utilizado los criterios de McDonald, los cuales han presentado diversas modificaciones, la más reciente es del año 2017 (Tabla 1).7 Dado que existen otras enfermedades con síntomas similares, es necesario un abordaje sistemático para confirmar el diagnóstico,8 como el estudio de líquido cefalorraquídeo (LCR), en específico las bandas oligoclonales.9,10 Mientras que la resonancia magnética (IRM) permanece como el método más efectivo para identificar lesiones desmielinizantes en el SNC, pues define sus características anatómicas y el número de lesiones. Los potenciales auditivos y visuales también constituyen apoyo.11,12
Tabla 1: Criterios de McDonald 2017 para el diagnóstico de esclerosis múltiple.
| Presentación clínica | Número de lesiones con evidencia clínica objetiva | Hallazgos adicionales necesarios para el diagnóstico de múltiples esclerosis |
|---|---|---|
| ≥ 2 brotes clínicos | ≥ 2 | Ninguno* |
| ≥ 2 brotes clínicos | 1 (así como evidencia clara histórica de un anterior ataque con una lesión en una posición anatómica distante) | Ninguno* |
| ≥ 2 | 1 | Diseminación en el espacio debe demostrarse mediante un ataque clínico adicional implicando un área diferente del SNC o mediante IRM |
| Un ataque clínico | ≥ 2 | Diseminación en tiempo debe demostrarse mediante un ataque clínico adicional o mediante IRM o demostración de bandas oligoclonales específicas en LCR |
| Un ataque clínico | 1 | Diseminación en el espacio debe demostrarse mediante un ataque clínico adicional implicando un área diferente del SNC o mediante IRM y diseminación en tiempo debe demostrarse mediante un ataque clínico adicional o mediante IRM o demostración de bandas oligoclonales específicas en LCR |
SNC = sistema nervioso central, IRM = imagen de resonancia magnética, LCR = líquido cefalorraquídeo.
* Se debe realizar LCR e IRM en casos de duda. Cuando ambos son negativos, se debe ampliar la búsqueda a diagnósticos distintos.
La terapia puede ser de tres tipos: tratamiento modificador, tratamiento del brote y sintomático. El primero tiene como objetivo reducir la frecuencia y severidad de los brotes, disminuyendo la probabilidad de formación de nuevas lesiones del cerebro y la médula espinal. La atención al brote acelera la reducción de los síntomas después de la recaída, pero no modifica la evolución de la enfermedad. Con el sintomático se trata de disminuir los síntomas y mejorar la calidad de vida.13
En México hay pocos casos reportados de esclerosis múltiple en la edad pediátrica, por lo que presentamos dos casos de pacientes adolescentes.
Presentación de los casos
Primer caso
Paciente femenino de 14 años y tres meses, originaria de la Ciudad de México y residente del Estado de México. Sobrepeso (IMC 25.1 kg/m2). Esquema de vacunación completa para la edad, sin referir vacunación reciente.
Inicia su padecimiento 30 días previos a valoración, con sensación de mareo y vértigo intermitente, agravado a la deambulación y disminuido al decúbito, en la última semana fue diario. Diez días después se agregó cefalea temporo-occipital, punzante, irradiada a región frontal, intermitente, que remitía con paracetamol. En la misma fecha se añade parestesias en miembros inferiores y, tres días previos al ingreso, diplopía, visión borrosa, bradilalia y lenguaje escandido.
A la exploración física (EF): consciente, cooperadora, pero con marcha atáxica, lateropulsión indistinta, dismetría de predominio izquierdo, nistagmo vertical y horizontal. Se decide su ingreso hospitalario. Se solicitó biometría hemática: hemoglobina 15 g/L, hematocrito 43.8, leucocitos 8,500 cel/mL, neutrófilos 63%, linfocitos 30%, monocitos 6%, plaquetas 320,000. Tomografía computarizada de cráneo (TCC) normal. Las pruebas vestibulares, electronistagmografía y pruebas térmicas con datos indicativos de disfunción vestibular central, con componente periférico. LCR: cloruros 120 nmol/L, proteínas 28 mg/dL, 83 células: leucocitos (50%), mononucleares (40%), polimorfonucleares (10%), eritrocitos negativos. IgG 5.3 mg/dL. Cultivo sin desarrollo. Bandas oligoclonales, policlonales y monoclonal, no detectables. Potenciales evocados auditivos: defecto de la vía auditiva rostral a la porción inferior del puente. Potenciales visuales: defecto en la conducción de la vía visual bilateral. IRM de cráneo con áreas de desmielinización (Figuras 1 a 4).
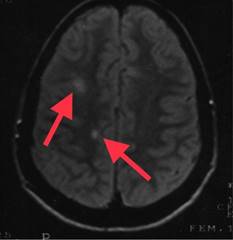
Figura 1: Resonancia magnética de cráneo secuencia en T2. Imagen axial en donde se puede observar una lesión ovoidea hiperintensa yuxtacortical (flechas).
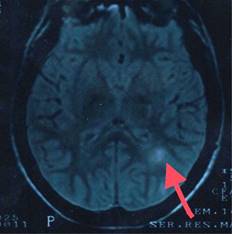
Figura 2: Resonancia magnética de cráneo secuencia en T2. Imagen axial en donde es posible observar dos lesiones ovoideas yuxtacorticales (flecha).
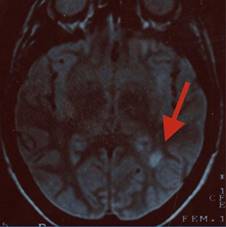
Figura 3: Resonancia magnética de cráneo secuencia en T2. Imagen coronal en donde es viable observar lesiones hiperintensas, ovoideas yuxtacorticales (flecha).
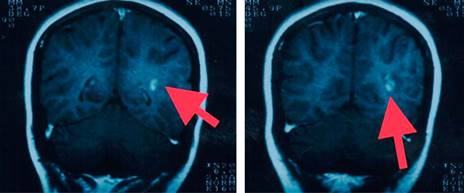
Figura 4: Resonancia magnética de cráneo secuencia en T2. Imagen axial en donde se puede observar una lesión hiperintensa yuxtacortical (flecha).
El diagnóstico de esclerosis múltiple se realizó con base en los criterios de McDonald (Tabla 1): un ataque, evidencia clínica objetiva de dos o más lesiones desmielinizantes en IRM, y hallazgos anormales en potenciales visuales y auditivos.
Se inició tratamiento con metilprednisolona, 1 g cada 24 h, por cinco días, además de interferón beta-1a, 6’000,000 UI. Días después se egresó por mejoría clínica, al remitir cefalea y las hipoestesias en extremidades. El lenguaje se encontraba fluido sin separación evidente de las sílabas. Persistía el nistagmo horizontal y marcha atáxica pero en menor intensidad.
A la edad de 15 años, en un nuevo evento presenta cefalea, salivación profusa, diplopía, debilidad generalizada, así como parestesias en miembros inferiores. Se da tratamiento con esteroides, acetato de glatirámero (20 mg subcutáneo cada 24 h) y terapia de rehabilitación, con lo cual hay mejoría importante en tono y fuerza de extremidades. No se reportan nuevos eventos hasta los 21 años, el cual fue de las mismas características al evento anterior. Al parecer, este último, se relacionó a la suspensión voluntaria de medicamentos.
Segundo caso
Paciente femenino de 13 años de edad, originaria y residente de Ciudad de México, con obesidad (IMC 31 kg/m2). Esquema de vacunación completa dada la edad, no refiere vacunación reciente. Inicia su padecimiento 36 horas previo a valoración, al presentar caída de propia altura al subir escaleras, así como incontinencia vesical. Se agregó pérdida gradual en fuerza de brazo izquierdo y extremidad inferior ipsilateral, así como dolor en la misma área, hasta impedir bipedestación y deambulación. Se decide su ingreso hospitalario.
EF: hemiparesia izquierda, de predominio torácico. Tono muscular en miembros torácicos y pélvicos 2/5, hiperreflexia. Estudios de ingreso: biometría hemática con hemoglobina 15.1 g/L, hematocrito 39.8, leucocitos 7,300 cel/mL, monocitos 11%, linfocitos 36%, eosinófilos 2%, neutrófilos 51%, plaquetas 250,000, glucosa 98 mg/dL, colesterol 146 mg/dL, tiempos de coagulación y electrólitos séricos normales. En TCC: hipodensidad a nivel del brazo posterior de cápsula interna derecha y subcortical en la región parietal, sugestiva de infarto isquémico en territorio de la arteria cerebral media derecha. En ecocardiograma: corazón estructuralmente sano. Anticuerpos anticardiolipina, lúpico, anti-DNA y antinucleares negativos. Serología negativa para toxoplasmosis, rubéola, citomegalovirus y hepatitis.
Se practica una angiorresonancia, sin observarse algún trastorno vascular. IRM de cráneo y columna cervical, con áreas de desmielinización (Figuras 5 a 7). Potenciales visuales con defecto en la conducción de ojo izquierdo, y en potenciales auditivos de tallo con alteración bilateral.
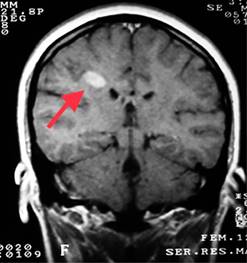
Figura 5: Resonancia magnética de cráneo secuencia en T2. Imagen coronal en donde es posible observar una lesión desmielinizante yuxtacortical (flecha).
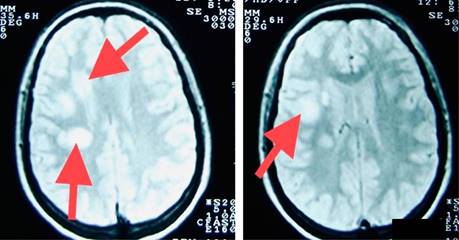
Figura 6: Resonancia magnética de cráneo secuencia en T2. Imágenes axiales en donde es posible observar lesiones hiperintensas, ovoideas yuxtacorticales y parenquimatosas (flechas).
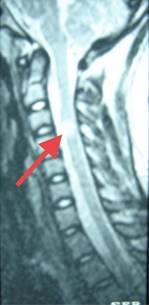
Figura 7: Resonancia magnética de médula espinal corte sagital en T2, se observa placa desmielinizante medular en el nivel de C3-C4 de aproximadamente 10 mm de diámetro (flecha).
LCR: glucosa 59 mg/dL, proteínas 20 mg/dL, pH 7.6, cloruros 118 nmol/L; células: 1 y eritrocitos negativos. Bandas oligoclonales, monoclonales y policlonales no detectables, proteínas básicas de mielina 2.5 ng/dL.
El diagnóstico de esclerosis múltiple se estableció con base en los criterios de McDonald: síndrome clínico aislado, alteraciones en potenciales evocados auditivos y visuales, y hallazgos de IRM de dos o más lesiones desmielinizantes (Tabla 1). Se inició tratamiento con metilprednisolona 1 g cada 24 h, por cinco días, así como terapia física. Al tercer día hay mejoría, al desaparecer la incontinencia vesical, cese de hiperreflexia y mejoría del tono muscular en cuatro extremidades. Se egresa al terminar quinta dosis de metilprednisolona, posteriormente se indica interferón beta-1a, 6’000,000 UI semanal, de manera ambulatoria.
Un nuevo episodio de esclerosis múltiple ocurrió dos meses después, caracterizado por hemiparesia izquierda que requirió hospitalización. Se inició nuevo ciclo de cinco días con metilprednisolona. A los 21 años de edad se reporta un nuevo evento de características similares, por lo que se administró tratamiento a base de esteroides. En la actualidad, continúa manejo con interferón beta, sin nuevos eventos.
Discusión
La esclerosis múltiple es un padecimiento considerado predominantemente de la etapa adulta, sin embargo, puede ocurrir en la edad pediátrica. El 10% de adultos con esta enfermedad tuvieron su primera manifestación clínica antes de los 18 años.13
En México, en reportes previos, se señala que la esclerosis múltiple ocurre más frecuentemente en mujeres.14,15 En concordancia, en el presente documento describimos dos pacientes adolescentes femeninos, quienes tuvieron un cuadro clínico caracterizado por múltiples síntomas y signos que hicieron difícil llegar al diagnóstico. El cuadro clínico presentado incluyó: afección ocular (descrito en 14-35% como síntoma inicial en niños), motora, sensitiva y síndrome cerebeloso, por lo que en el abordaje se buscaron otras causas, como infecciones por citomegalovirus o virus Epstein Barr, vasculopatías, neoplasias, intoxicaciones, además de otras enfermedades autoinmunes (Tabla 2).16
Tabla 2: Diagnóstico diferencial de esclerosis múltiple.
| Tipo de enfermedades | |
|---|---|
| Genéticas | Malformación cerebrovascular, vasculopatía cerebrovascular hereditaria, paraparesia espástica hereditaria, degeneración espinocerebelosa, enfermedad por depósitos lisosomales, enfermedad mitocondrial, deficiencia nutricional, acidemia orgánica, enfermedad de los peroxisomas, enfermedad de Wilson |
| Infecciosas | Infecciones por virus: polio, rubéola, VIH y herpes |
| Infecciones bacterianas, abarcando Brucella y espiroquetas | |
| Inflamatorias | Enfermedad de Behcet, enfermedad colágeno-vascular, miastenia gravis, sarcoidosis del sistema nervioso |
| Metabólicas | Deficiencia de vitamina B12, deficiencia de ácido fólico, deficiencia de vitamina E |
| Neoplásicas | Linfoma intravascular, cáncer metastásico, síndrome paraneoplásico, tumor cerebral primario |
| Estructurales | Quiste aracnoideo, aracnoiditis, malformación de Arnold-Chiari, espondilosis o hernia de disco, malformación vascular, siringomielia |
| Vasculares | Síndrome antifosfolípido, arteriopatía cerebral autonómica dominante con infartos subcorticales y leucoencefalopatía, enfermedad de Eales, enfermedad cerebrovascular, vasculopatía retrococlear de Susa, migraña, vasculitis |
| Intoxicaciones | Óxido nitroso, mielinólisis pontina central, leucoencefalopatía postquimioterapia, neuropatía por radiación, toxicidad por clioquinol con mielopatía subaguda y neuritis óptica, tricloroetileno |
| Misceláneas | Síndrome de fatiga crónica, leucoencefalopatía con desvanecimiento de materia blanca, neuritis sensitiva migratoria, neurorretinitis, neuropatía periférica, desorden de los plexos braquial o lumbosacro, histiocitosis sistémica |
En los dos casos reportados fueron de mucha utilidad los potenciales evocados, ya que ambas presentaron anormalidades en dichos estudios y permitieron, además, determinar las vías afectadas correspondientes al área de lesión. En pacientes con esclerosis múltiple se encuentran alteraciones hasta de 95% de los casos.17
La IRM sigue siendo pilar para establecer el diagnóstico. Las lesiones de la esclerosis múltiple afectan la sustancia blanca periventricular predominantemente, pero también cuerpo calloso, lóbulos temporales, tallo cerebral, cerebelo y médula espinal. Estas lesiones suelen ser redondeadas o de forma ovoide, con sentido perpendicular al sistema ventricular. Mientras que las lesiones en médula espinal son habitualmente laterales o posteriores, sin incluir más de dos cuerpos vertebrales.17 En los dos casos que presentamos hubo lesiones desmielinizantes en IRM de cráneo y, en el segundo caso, una lesión a nivel cervical.
La importancia de llegar más rápido al diagnóstico es para iniciar lo más pronto posible el tratamiento y evitar las discapacidades. Sin embargo, no existe algún tratamiento que modifique los efectos sobre las lesiones ya establecidas. El daño neurológico causado por las áreas de desmielinización ocasiona afectación de la calidad de vida, según la magnitud del daño. Estos pacientes requieren manejo multidisciplinario, procurando combatir la espasticidad, fatiga, dolor, disfunción vesical, ataxia y los temblores.
El tratamiento durante el evento agudo depende de la gravedad del cuadro; los casos leves pueden remitir espontáneamente. En los cuadros graves o persistentes se recomiendan corticosteroides a dosis altas; la metilprednisolona es el de elección, a dosis de 20 a 30 mg/kg/día en pacientes con peso hasta de 30 kg. Con mayor peso, la dosis es de 1 g/día durante tres a cinco días. El tratamiento debe continuar con prednisona, a dosis de 1 mg/kg/día, de dos a cuatro semanas, sobre todo en casos que no remita la sintomatología. Cuando no hay repuesta apropiada a esteroides, se utiliza inmunoglobulina intravenosa (1 g/kg/día, en dos dosis). En pacientes con encefalopatía grave y tetraplejía se recomienda usar plasmaféresis; con lo cual se ha documentado mejoría hasta en el 42% de los pacientes (nivel de evidencia I).18
El pronóstico en general no es bueno, ya que la mayoría de estos pacientes tendrán nuevos episodios o recaídas (0.38 a 1.2% por año), como ocurrió en las pacientes que describimos en este reporte. En la edad pediátrica, el cuadro clínico es menos grave que en adultos. Una presentación progresiva con síntomas motores y cerebelosos permanentes, los brotes frecuentes en los menores de seis años y el sexo masculino son factores considerados de mal pronóstico.18











 nueva página del texto (beta)
nueva página del texto (beta)


