Introducción
El síndrome de Patau es una entidad poco frecuente que afecta a 1/20,000 recién nacidos (RN) vivos.1 En la mayoría de los casos ocurre por trisomía del cromosoma 13, aunque en 20% se debe a translocación y hasta en un 6% a mosaicismo. Las principales manifestaciones clínicas incluyen holoprosencefalia, retraso del desarrollo psicomotor, anomalías cardiacas y renales.2 Para su diagnóstico se requiere realizar cariotipo para identificar la trisomía o translocación; en casos de mosaicismo se debe demostrar la presencia de células con 46 y 47 cromosomas mediante el análisis de fibroblastos o en linfocitos.3 La mortalidad es > 90% en el primer año de vida, principalmente por la morbilidad cardiovascular.4
Caso clínico
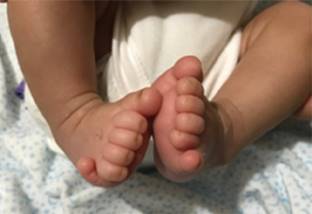
Presentamos el caso de un varón RN, pretérmino de 34 semanas de gestación. Fue el primogénito de padres jóvenes sanos, no consanguíneos. La madre había presentado cuatro abortos espontáneos previos. El embarazo cursó sin complicaciones; sin embargo, requirió cesárea urgente porque se detectó por ultrasonido retraso en el crecimiento intrauterino tipo II. Al nacimiento presentó distrés respiratorio que requirió soporte con ventilación. A la exploración física destacaba facies dismórfica (Figura 1), hipertelorismo, raíz nasal ancha, pabellones auriculares de implantación límite, labio superior fino, anquiloglosia, cuello corto con pliegue nucal redundante, hipotonía axial, criptorquidia bilateral y polidactilia en ambos pies (Figura 2). En fondo de ojo, papilas con gran excavación y zona central con coloboma en ojo derecho.
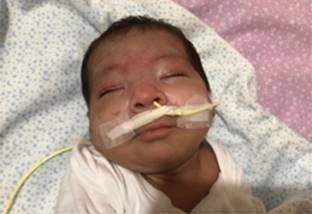
Figura 1: Facies dismórfica, hipertelorismo, raíz nasal ancha, labio superior fino, cuello corto, orejas de implantación límite. Porta sonda nasogástrica, necesaria para la nutrición.
En ecografía craneal había signos de vasculopatía mineralizante bilateral; en ecocardiograma se detectó conducto arterioso permeable e hipertensión pulmonar grave. A nivel abdominal, por ecografía se detectó que los riñones tenían mala diferenciación corticomedular y microquistes bilaterales, ectasia piélica derecha leve, testículo derecho intraabdominal, sin visualizar el izquierdo. Posteriormente, se confirmó reflujo vesicoureteral izquierdo grado II-III.
Durante su estancia presentó ictericia y un episodio de crisis convulsivas en hemicuerpo izquierdo de escasa duración; en el EEG se objetivó lentificación de la actividad de base, focalizado a región temporo-frontal bilateral ocasional, por lo que se inició tratamiento con fenobarbital.
Ante los hallazgos clínicos, se realizó cariotipo en sangre periférica mediante técnica de bandas GTG. Tras el estudio de 20 metafases, con una resolución cromosómica de 500 bandas, se obtuvo la fórmula cromosómica 46,XY,der(10)t(10;13)(q26.3;q13). En el estudio citogenético se detectó la presencia de un cromosoma 10 derivativo, originado por una translocación recíproca entre los cromosomas 10 y 13 (Figura 3), producida por una reorganización desequilibrada, lo que produce una trisomía casi completa del cromosoma 13 y una monosomía 10q terminal.
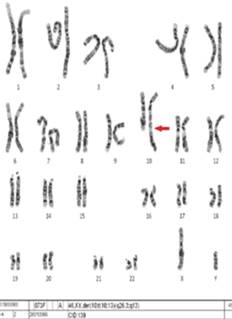
Figura 3: Se aprecian 46 cromosomas, y en el cromosoma 10 podemos observar cómo hay adherido un fragmento adicional de material genético, procedente del cromosoma 13.
Se realizó cariotipo a los progenitores para determinar si la alteración era heredada o mutación de novo. En el cariotipo paterno se obtuvo una fórmula cromosómica normal, en cambio, en el materno se detectó la misma translocación balanceada a la del neonato, indicando que la alteración detectada en el paciente se debe a la presencia de la translocación materna. Lo anterior podría explicar los abortos espontáneos de repetición.
Hubo asesoramiento genético ante la posibilidad de nuevo embarazo, recomendándose diagnóstico genético preimplantacional o diagnóstico prenatal. En la actualidad, nuestro paciente tiene 20 meses y presenta retraso psicomotor grave, epilepsia sintomática, así como atrofia óptica con papilas pseudocolobomatosas y cataratas parciales bilaterales.
Discusión
La detección de este tipo de variantes de un síndrome considerado letal hace replantearnos la manera en que se debe actuar ante situaciones de riesgo vital, ya que siempre se ha determinado la adecuación del esfuerzo terapéutico en estos pacientes.5-7 Supone para el médico un dilema ético importante, ya que las recomendaciones a los padres incluyen desde interrumpir el embarazo hasta continuarlo, o dar opciones para prolongar la vida.8
La variante detectada en nuestro caso no está descrita en la literatura, por lo que más allá del consejo genético a los padres no podemos aventurar el pronóstico del niño. Hay pocos casos publicados en la literatura y, dentro de éstos, hay heterogeneidad en las alteraciones que presentan en el cromosoma 13, con evolución variable. Como datos comunes, predomina un retraso psicomotor grave y un pronóstico diferente al síndrome de Patau clásico.9-12











 nueva página del texto (beta)
nueva página del texto (beta)