Introducción
Transfundir con concentrado eritrocitario (CE) a neonatos críticamente enfermos con o sin anemia ha sido una conducta aceptada para incrementar el contenido arterial de oxígeno (CaO2) y con ello mejorar la oxigenación tisular. Por lo anterior, se considera que el CaO2 es un dato confiable y accesible para inferir la oxigenación tisular 1-5
La trasfusión de CE no está exenta de riesgos, tal como la modificación de la hemodinámica cardiovascular. A diferencia de la incorporación de volúmenes de líquidos, el aporte de CE mantiene un volumen intravascular por mayor tiempo, por lo que esta sobrecarga de volumen puede modificar la estabilidad hemodinámica del paciente.6,7
En neonatos el CaO2 se puede modificar por diferentes factores. Uno es la hemoglobina fetal (HbF); durante situaciones de hipoxia, la concentración de HbF reduce el riesgo de daño tisular al transportar mayor cantidad de oxígeno, pero con la transfusión de CE con sangre de adultos se disminuye la concentración de HbF.2,3,8 Otro factor es la sepsis, pero sobre todo el choque séptico que afecta la función capilar con extravasación de líquidos y baja perfusión tisular, lo que altera la distribución de líquidos y sangre. Por lo anterior, la transfusión de CE pudiera no modificar el aporte de oxígeno a los tejidos cuando hay infección grave.9,10
Hasta donde sabemos no hay estudios que hayan evaluado el efecto de la transfusión de CE en neonatos con o sin sepsis en el CaO2.
Material y métodos
Diseño de estudio. Cohorte retrospectiva, observacional, con análisis antes y después.
Participantes. Se incluyeron recién nacidos transfundidos con CE durante su estancia en una Unidad de Cuidados Intensivos Neonatales (UCIN) de un hospital privado en la Ciudad de México durante el periodo de enero de 2011 a diciembre de 2015. Para este estudio, sólo analizamos la primera transfusión de CE (calculada de 10 a 20 mL/kg) de todo paciente que tuviera la medición de los gases sanguíneos arteriales, antes y después de una transfusión. Se excluyeron pacientes a quienes se les realizó exanguinotransfusión y pacientes con cardiopatía cianógena. Cabe señalar que la decisión sobre la transfusión fue individualizada según las necesidades del paciente y a criterio del médico tratante.
Mediciones. De cada paciente se obtuvo edad gestacional, peso, la edad en horas al momento de la transfusión de CE, los niveles de hemoglobina antes y después de la transfusión. Para calcular el CaO2 recabamos los datos gasométricos de presión arterial de oxígeno (PaO2) y porcentaje de saturación (SaO2), usando la siguiente fórmula:
Se consideró el valor CaO2 en tres momentos: uno antes de la transfusión (< 24 horas) y dos después de la transfusión de CE, el primero dentro de las primeras seis horas, y el segundo entre seis y 24 horas posteriores.
Se decidió utilizar un corte a las seis horas debido a que estudios descritos del TRALI (lesión pulmonar aguda producida por transfusión) señalan que en este periodo es cuando se manifiesta inicialmente dicha complicación, mientras que en el otro periodo dentro de las primeras 24 horas se pueden observar otros efectos adversos incluido el TACO (sobrecarga circulatoria por transfusión).11 En este punto es conveniente señalar que ningún paciente tuvo alguna complicación secundaria a la transfusión sanguínea.
Además, al momento de la transfusión se tomó en cuenta la condición clínica de los pacientes para agruparlos en tres: 1) sin sepsis, 2) con sepsis, y 3) con choque séptico, es decir, pacientes con inestabilidad hemodinámica por sepsis. Estos tres grupos estuvieron de acuerdo con las definiciones del Consenso Internacional de Sepsis de Pediatría.12-14
Análisis estadístico. Los resultados se resumieron por grupos, según su condición clínica al momento de la transfusión de CE. Las variables cualitativas se presentan con frecuencias simples y porcentajes. En el caso de las cuantitativas con promedio y desviación estándar cuando tuvieron distribución normal; en caso contrario, con mediana e intervalos intercuartílicos (Q1, Q3). La comparación entre variables cualitativas se realizó con prueba de χ2. Para la comparación entre grupos de las variables cuantitativas se utilizó análisis de varianza (ANOVA) o prueba de Kruskal-Wallis. Se consideró un nivel de significancia estadística con un valor de p < 0.05.
Los diferentes análisis se realizaron con el paquete estadístico SPSS versión 24®.
Aspectos éticos. El proyecto fue aprobado por el Comité de Investigación y Ética de nuestro hospital, en cumplimiento del Reglamento en Materia de Investigación en Seres Humanos de la Ley General de Salud y en apego a las recomendaciones de la Declaración de Helsinki. Al ser revisión de expedientes, se consideró un estudio sin riesgo, por lo que no requirió de carta de consentimiento informado.
Resultados
De un total de 1,120 pacientes ingresados en el periodo de estudio, 311 fueron transfundidos, de los cuales sólo se incluyeron 110 neonatos que cumplieron con los criterios de selección. La distribución por grupo fue: 58 (52.7%) pacientes sin sepsis, 38 (34.5%) pacientes con sepsis, y 14 (12.7%) pacientes con inestabilidad hemodinámica secundaria a sepsis. Como se observa en la Tabla 1, no encontramos diferencias entre los grupos con respecto a la distribución por sexo, semanas de edad gestacional y el peso al momento de la transfusión.
Tabla 1: Comparación entre neonatos con sepsis, sin sepsis y choque séptico en el día anterior a transfusión de concentrado eritrocitario.
| Sin sepsis (n = 58) | Con sepsis (n = 38) | Choque séptico (n = 14) | |||||
|---|---|---|---|---|---|---|---|
| Datos | n (%) | n (%) | n (%) | p | |||
| Sexo | |||||||
| Masculino | 36 (62.1) | 22 (57.7) | 8 (57.1) | 0.89* | |||
| Femenino | 22 (37.9) | 16 (42.1) | 6 (42.8) | ||||
| Promedio ± DE | Promedio ± DE | Promedio ± DE | |||||
| SEGC | 31.5 ± 3 | 31.3 ± 4 | 31 ± 3.5 | 0.37** | |||
| Peso en gramos | 1,738 ± 659 | 1,550 ± 672 | 1,409 ± 731 | 0.17** | |||
| Temperatur °C | 37 ± 0.1 | 37 ± 0.1 | 36.6 ± 1.3 | 0.24** | |||
| FC, latidos/min | 157 ± 16 | 160 ± 14 | 166 ± 21 | 0.16** | |||
| TAM, mmHg | 43.8 ± 8.4 | 41.2 ± 10.2 | 39.8 ± 12.3 | 0.92** | |||
| Hemoglobina g/dL | 10.2 ± 1.2 | 9.8 ± 1.4 | 9.8 ± 3.3 | 0.13** | |||
| Mediana | Q1-Q3 | Mediana | Q1-Q3 | Mediana | Q1-Q3 | ||
| Hematocrito % | 30.8 | 30.8-33.5 | 30.3 | 28.3-33.5 | 29.6 | 27.5-31.7 | 0.48*** |
| SatO2 % | 96.2 | 93.3-98.2 | 95.8 | 92.9-97.7 | 96.2 | 92-98 | 0.67*** |
| HbF % | 93 | 89-97 | 93 | 85.75-97.5 | 90 | 31.3-97 | 0.03*** |
DE = desviación estándar; SEGC = semanas de edad gestacional corregida; FC = frecuencia cardiaca; HF = hemoglobina fetal; TAM = presión arterial media.
* χ2 con corrección de Yates.
** ANOVA.
*** Kruskal-Wallis.
La edad al momento de la transfusión varió de uno a 19 días de vida, con promedio de siete días de vida. 100 pacientes se transfundieron a una dosis de 20 mL/kg/dosis, cinco a 10 mL/kg/dosis, y cinco pacientes a 15 mL/kg/dosis. Con relación a los valores promedio de hemoglobina pretransfusional tampoco encontramos diferencias entre los grupos. La mayor diferencia se observó en el porcentaje de hemoglobina fetal pretransfusional, los pacientes con inestabilidad hemodinámica tuvieron el menor nivel (90% contra 93% en los otros dos grupos), lo cual fue estadísticamente significativo (p = 0.03).
Después de la transfusión, en los tres grupos hubo un incremento de los niveles de hemoglobina, y con discreta reducción a las 24 horas. Sin embargo, este incremento fue mayor en los neonatos sin sepsis y en aquéllos con sepsis (Hb g/dL; sin sepsis pre = 10.2 ± 1.2, <6 h = 13.9 ± 1.2, 6 - 24 h 13.9 ± 1.3; sepsis pre = 9.8 ± 1.4, <6 h 14.1 ± 1.6, 6 - 24 h 13.4 ± 1.9), en comparación con el grupo con choque séptico (pre = 9.8 ± 3.4, <6 h 12.5 ± 2.4, 6 - 24 h 11.8 ± 2.3). Esta diferencia fue estadísticamente significativa (ANOVA intragrupo F = 194, 2 gL p < 0.0001; intergrupo F = 5.3 2 gL, p = 0.006; Figura 1).
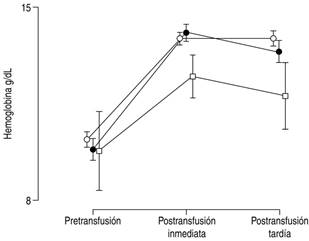
Figura 1: Distribución de niveles de hemoglobina tomadas antes y después de la transfusión de concentrado eritrocitario. Círculos blancos = pacientes sin sepsis; círculos negros = pacientes con sepsis; cuadrados blancos = pacientes con choque séptico. Las marcas muestran los valores promedio por grupo, y las líneas verticales el intervalo de confianza al 95%.
Con respecto al CaO2 (Tabla 2 y Figura 2) después de la transfusión también se observó incremento en todos los grupos, pero fue un poco mayor en los neonatos sin sepsis y con sepsis que en el grupo con choque séptico. Esta diferencia fue estadísticamente significativa; sin embargo, se tiene que considerar que el grupo de choque séptico durante los tres momentos mantuvo valores más bajos que los otros dos grupos, y que los niveles de Hb no aumentaron de la misma forma.
Tabla 2: Efecto de la transfusión en el contenido arterial de oxígeno (CaO2), antes y después de 6 a 24 horas de la transfusión según condición de sepsis.
| Contenido arterial de oxígeno (mL/dL) | |||
|---|---|---|---|
| Pretransfusión | 6 - horas postransfusión | 6 - 24 horas postransfusión | |
| Grupo | Promedio ± DE | Promedio ± DE | Promedio ± DE |
| Sin sepsis (n = 32) | 13.2 ± 2.1 | 18.6 ± 2.09 | 18.2 ± 2.02 |
| Con sepsis (n = 28) | 12.6 ± 2.05 | 18.4 ± 2.7 | 17.3 ± 2.8 |
| Con choque séptico (n = 9) | 11.9 ± 3.6 | 16.8 ± 2.6 | 15.3 ± 3.6 |
DE: desviación estándar. ANOVA, Efecto momento F = 150.2 2gl, p < 0.001; grupos F = 2.9 2gl, p = 0.60 (post-Hoc sin sepsis diferente de sepsis severa-choque séptico); grupo *F = 1.84 4gl p = 0.12
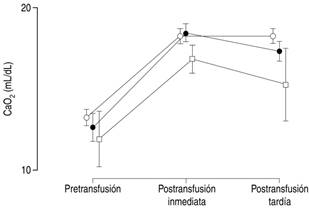
Figura 2: Distribución del contenido arterial de oxígeno (CaO2) antes y después de la transfusión de concentrados eritrocitarios. Círculos blancos = pacientes sin sepsis; círculos negros = pacientes con sepsis; cuadrados blancos = pacientes con choque séptico. Las marcas muestran los valores promedio por grupo, y las líneas verticales el intervalo de confianza al 95%.
Como se muestra en las Figuras 3 y 4, no hubo diferencia entre los grupos en cuanto a la presión arterial y la saturación de oxígeno.
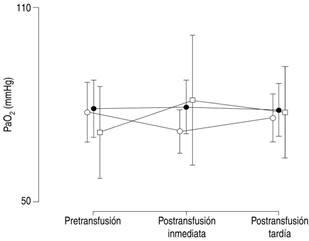
Figura 3: Distribución de los niveles de presión arterial de oxígeno (PaO2) tomadas antes y después de la transfusión de concentrado eritrocitario. Círculos blancos = pacientes sin sepsis; círculos negros = pacientes con sepsis; cuadrados blancos = pacientes con choque séptico. Las marcas muestran los valores promedio por grupo, y las líneas verticales el intervalo de confianza al 95%.
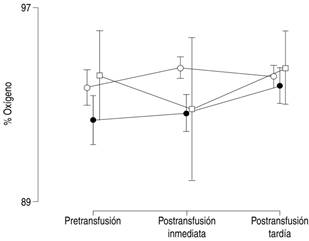
Figura 4: Distribución de la saturación arterial de oxígeno antes y después de la transfusión de concentrados eritrocitarios. Círculos blancos = pacientes sin sepsis; círculos negros = pacientes con sepsis; cuadrados blancos = pacientes con choque séptico. Las marcas muestran los valores promedio por grupo, y las líneas verticales el intervalo de confianza al 95%.
Discusión
Una disyuntiva en el manejo de neonatos críticamente enfermos, surgida en años recientes, ha sido la decisión de transfundir o no concentrado eritrocitario,13 por supuesto en condiciones diferentes a una anemia grave, particularmente durante sepsis. En este estudio, los datos apoyan el beneficio en el incremento del CaO2 después de la transfusión de CE, pero observando que cuando hay choque séptico, es probable que no se llegue a valores normales, es decir, niveles superiores a 15 mL/dL de CaO2.15
Es posible que los efectos observados del comportamiento de menor CaO2 en neonatos con choque séptico sean consecuencia de varios factores. El primero lo constituyen los niveles de hemoglobina después de la transfusión de CE que fueron menores en los neonatos sin sepsis. Otra posible explicación pudiera ser porque en sepsis se presenta redistribución de flujos y atrapamiento eritrocitario, hemólisis o sangrados, sobre todo cuando hay síndrome de coagulación intravascular diseminada. 16-18
Por lo anterior, deberemos tomar con reserva que después de la transfusión de CE en neonatos realmente exista menor incremento en el CaO2 cuando hay choque séptico, lo cual lleva a reflexionar si en estos pacientes se deben transfundir más CE para alcanzar los niveles óptimos de CaO2, pero con riesgo de sobrecarga hídrica, o bien, realizar otras acciones para mejorar la hemodinámica del paciente. Esta situación deberá analizarse en futuros estudios.
Además de lo comentado, otra limitación importante de nuestro estudio es el número de pacientes; como se observa en la Tabla 2, la cantidad de neonatos que tuvieron las tres mediciones de CaO2 fue mucho menor que los pacientes descritos en la Tabla 1. De esta forma, se requieren estudios prospectivos para poder determinar si efectivamente los neonatos con choque séptico tienen un comportamiento diferente del CaO2 tras la transfusión de CE.











 nova página do texto(beta)
nova página do texto(beta)


