Introducción
El síndrome de Guillain-Barré (SGB) es una polirradiculoneuropatía desmielinizante aguda, de origen autoinmune que presenta diversas variantes clínicas.1 En la mayoría de los casos del SGB existe un cuadro infeccioso previo a las manifestaciones clínicas, las cuales se caracterizan por parálisis aguda, debilidad progresiva de extremidades e incapacidad para la deambulación.1,2
En 1857, Landry describió los primeros casos del SGB. En 1916, Guillain-Barré y Strol demostraron que estos pacientes presentaban déficit motor y arreflexia, pero sin afección sensitiva y con disociación albúmino-citológica.3,4 Mientras que, en 1990, Asbury y Comblath establecieron los criterios electrodiagnósticos del SGB, que se caracterizan por retraso en la velocidad de conducción de dos o más nervios motores.5
En la actualidad, el SGB es la causa más frecuente de parálisis flácida en niños previamente sanos.6 A nivel mundial la incidencia anual es de 0.6 a 2.4 casos por 100,000 habitantes. En cualquier grupo etario afecta a ambos géneros con una relación H/M 1.5:1.6 Se ha asociado con infección por C. jejuni, citomegalovirus, virus Epstein-Barr, virus influenza A, Mycoplasma pneumoniae y Haemophilus influenzae.7
Existen distintas formas de presentación del SGB: el SGB clásico, la debilidad faringo-cérvico-braquial, SGB paraparético y la debilidad facial bilateral con parestesias. Mientras que, del síndrome de Miller Fisher (SMF), también puede distinguirse el SMF incompleto y la encefalitis de Bickerstaff. En el año 2014, The GBS Classification Group describió los criterios para su identificación. 8,9
En cuanto al tratamiento, desde hace años se conoce la efectividad de la inmunoglobulina intravenosa (IgIV) y la plasmaféresis. En pacientes pediátricos, la IgIV se puede aplicar de dos maneras: en la primera (más efectiva), la dosis es 1 g/Kg de peso por día, en dos días. La segunda, la dosis es de 0.4 g/Kg de peso, administrada en cinco días.2,10
El síndrome de Guillain-Barré recurrente (RGBS, por sus siglas en inglés), ocurre entre 1 y 6% de los pacientes; se ha informado que se presenta de varios meses a años a partir del primer episodio de SGB hasta en 10% de los pacientes tras un periodo de estar asintomático.11,12 Entre los factores de riesgo de RGBS se encuentran: edad menor de 30 años y presentación previa de síndrome de Miller Fisher.12 En general, hay pocos casos reportados de RGBS en niños.11-13
Se presenta el caso de una niña de siete años con RGBS después de cinco años de haber presentado el primer episodio de SGB, con énfasis en la evolución clínica progresiva, afección neurológica y en las complicaciones.
Presentación del caso
Primer evento de SGB
Paciente de dos años de edad que acudió a urgencias debido a que, después de un proceso infeccioso de vías respiratorias superiores, y una semana previa a su ingreso se agregaron síntomas clínicos del SGB, caracterizados por debilidad en ambas extremidades inferiores.
A su ingreso se observaron signos vitales normales: FC 116/minuto, FR 30/minuto, Temp 36o C, saturación de oxígeno 93%. Exploración física: femenino de edad aparente similar a la cronológica, adecuada hidratación, cráneo normocéfalo, cavidad oral con hipertrofia amigdalina grado II y faringe hiperémica, cuello sin megalias, cardiopulmonar sin compromiso, abdomen blando sin megalias ni irritación peritoneal, extremidades superiores con fuerza conservada 5/5 en escala de Daniels, reflejos osteotendinosos conservados, retiro al dolor y sensibilidad conservada. En las extremidades inferiores se identificó disminución de la fuerza 3/5 en escala de Daniels, arreflexia bilateral; pero había retiro de las mismas al dolor y la sensibilidad estaba conservada. Neurológico: despierta y reactiva a estímulos externos, marcha no valorable, pares craneales conservados, signos meníngeos ausentes y sin disautonomías.
Evolución clínica hospitalaria
Día 1. Exámenes de laboratorio: biometría hemática: leucocitos 6,800 leu/μL, neutrófilos 27%, linfocitos 62%, monocitos 8%, hemoglobina 13.6%, hematocrito 40.3%, plaquetas 482 mil, PCR 0 mg/dL. Electrolitos séricos: sodio 138 meq/L, potasio 4.9 meq/L, cloro 105 meq/L, calcio 11.1 mg/dL, fósforo 6.2 mg/dL, magnesio 2.3 mg/dL. Glucosa 70 mg/dL, BUN 22 mg/dL, urea 47 mg/dL, creatinina 0.3 mg/dL. CPK 737 U/L (valores normales en niñas entre dos y tres años: 10-120 U/L)
Características del líquido cefalorraquídeo (LCR): claro, incoloro, transparente, células 1: monocitos 100%, eritrocitos negativos, glucosa 43 mg/dL, cloruro 118.3 meq/L, proteínas 57 mg/dL, Pandy positivo (+), pH 7.6, lactato 1.6. No se observan bacterias; coaglutinación negativa.
Se inició tratamiento médico con inmunoglobulina intravenosa (IgIV) a dosis de 1 g/Kg, por tres días.
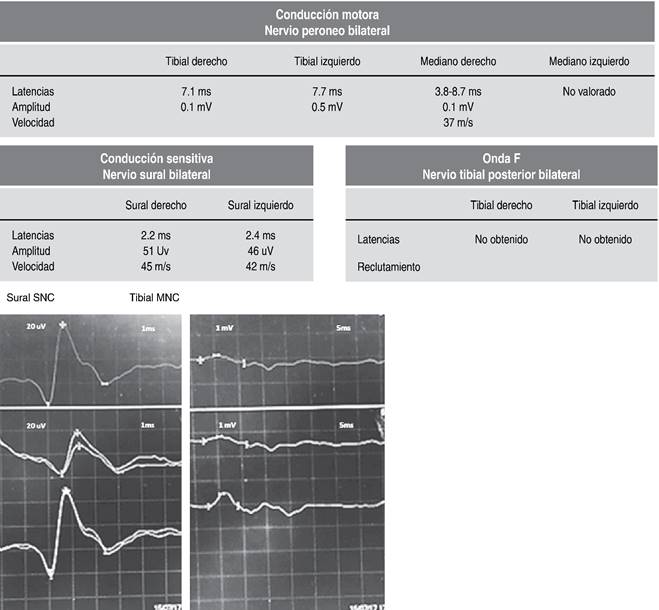
Día 2. Estudio de neuroconducción: SGB variante desmielinizante inflamatoria aguda (Figura 1).
Interpretación. Estudio de neuroconducción con respuesta anormal, nervio periférico distal y proximal con retraso en la conducción compatible con SGB variante desmielinizante inflamatoria aguda.
Día 3. Cultivo de líquido cefalorraquídeo negativo. Hemocultivo periférico negativo.
Día 6. Durante su estancia hospitalaria presentó adecuada evolución, sin complicaciones secundarias, adecuada tolerancia a la vía oral, sin dificultad respiratoria y sin ameritar apoyo ventilatorio. Además, hubo mejoría paulatina en la movilidad de extremidades inferiores: fuerza 4/5, arreflexia bilateral, sensibilidad conservada. Se decidió su egreso con apoyo de silla de ruedas y envío a rehabilitación pediátrica por seis meses.
Segundo evento de SGB
Femenino de siete años de edad. El padecimiento actual consistió en un cuadro de infección de vías aéreas superiores de tres días de evolución. Se agregaron parestesias de miembros inferiores, las cuales fueron ascendentes, progresivas y simétricas, llegando hasta extremidades superiores. Además, se observó mal manejo de secreciones bronquiales, por lo cual fue llevada al servicio de urgencias para su valoración.
A su ingreso los signos vitales fueron: FC 95/minuto, FR 14/minuto, saturación de oxígeno 93%, temperatura 36.5o C. Exploración física: adecuado estado hídrico, ruidos cardiacos normales al igual que la auscultación pulmonar; el abdomen sin megalias ni datos de irritación peritoneal. Las extremidades superiores con fuerza disminuida 2/5 en escala de Daniels, reflejos osteotendinosos abolidos y sensibilidad conservada. En las extremidades inferiores también hubo disminución de la fuerza 0/5 en escala de Daniels, arreflexia bilateral, no se retiraban al dolor, pero la sensibilidad se conservó. La paciente se observaba despierta y reactiva a estímulos externos, sin ptosis palpebral, pupilas isocóricas y reflejos a la luz normales; fondo de ojo normal, pares craneales sin alteraciones, funciones mentales superiores conservadas, marcha no valorable, signos meníngeos ausentes y sin disautonomías.
Se diagnosticó SGB, por lo cual se decidió hospitalizar.
Evolución clínica hospitalaria
Semana 1 (días 1-7). Durante sus primeras horas en el servicio de urgencias presentó dificultad respiratoria, por lo cual se decidió manejo avanzado de la vía aérea e ingreso al servicio de terapia intensiva. Por la rápida progresión del cuadro neurológico se decidió inicio de IgIV a dosis de 1 g/kg por dos días. Se mantuvo con apoyo mecánico ventilatorio con intubación orotraqueal, manteniendo sedación con midazolam; ante la falta de mejoría clínica y ausencia de movimientos respiratorios espontáneos se realizó traqueostomía.
Exámenes de laboratorio. Biometría hemática: leucocitos 14,140 leu/μL, neutrófilos 59.6%, linfocitos 29.7%, hemoglobina 14.8%, hematocrito 44.2%, plaquetas 434,000, VSG 20 mm/h, procalcitonina 0 ng/mL. CPK 1236 U/L (valores normales: 50-145 U/L).
Se llevó a cabo evaluación por el servicio de neurología pediátrica; en su nota señalan que la paciente se encuentra bajo efecto de sedación, las pupilas isocóricas hiporrefléxicas, con tendencia a la miosis. Simetría facial. La fuerza en extremidades superiores proximal 2/5 y distal 1/5; extremidades inferiores, fuerza proximal y distal 0/5. Reflejos tricipital y bicipital disminuidos; mientras que los reflejos patelar y aquíleo están ausentes de manera bilateral. Respuesta plantar flexora, no clonus, sensibilidad conservada, retiro al dolor.
Se decidió realización de punción lumbar; el resultado de LCR fue: líquido claro, incoloro, transparente, dos células (monocitos), eritrocitos negativos, glucosa 54 mg/dL, cloruro 110 meq/L, proteínas 103 mg/dL, Pandy positivo (+), pH 7.6, lactato 1.4, no se observan bacterias, y la coaglutinación es negativa.
TAC de cráneo simple y contrastada: sin alteraciones estructurales y/o reforzamientos anormales.
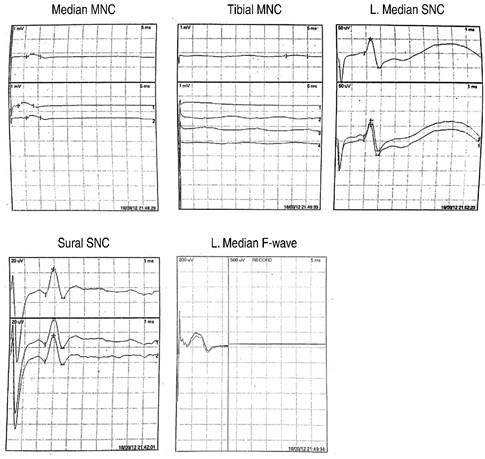
Se solicitó realización de estudio de neuroconducción. Reporte de estudio: anormal sugestivo de SGB, con componente axonal (Figura 2).
Semana 2 (días 8-14). Se retiró sedación. La paciente tuvo comunicación verbal escasa y se inició aporte vía oral basado en líquidos claros con adecuada tolerancia. Reflejo tusígeno ausente.
Semana 3 (días 15-21). Progresión de alimentación con dieta polimérica y posteriormente dieta blanda con adecuada tolerancia.
Semana 4 (días 22-28). Inicio de dieta normal. Evolución de forma paulatina con mejoría clínica en la movilidad de la extremidad superior derecha y cintura escapular.
Semana 5 (días 29-35). Incremento de movilidad de ambas manos, y pies en dorsiflexión realiza prono-supinación. Incremento en la movilidad de la cintura escapular bilateral y cadera.
Semana 6 (días 36-42). Se retiró ventilación asistida y hubo apoyo de oxígeno suplementario; sin datos de dificultad respiratoria.
Semana 7 (día 43). Exploración neurológica: evolución favorable, fuerza 3/5 en escala de Daniels en extremidades superiores; en extremidades inferiores la fuerza 1/5 en escala de Daniels (se clasifica en escala de Hughes IV, paciente confinado en cama o silla sin capacidad de realizar marcha). No se detectó compromiso respiratorio y los reflejos de tallo cerebral están conservados.
La paciente es egresada con manejo externo en rehabilitación.
Cuatro meses. En la consulta de seguimiento de neurología pediátrica se observó recuperación gradual del SGB, obteniendo una calificación de escala de Hughes III, dado a que posee capacidad de caminar al menos 5 metros con ayuda de caminador y asistida por sus padres. Se decide continuar con tratamiento médico y sesiones de rehabilitación.
Discusión
La RGBS es una entidad rara que se presenta hasta en 6% de todos los pacientes con SBG.14 Sólo hay algunas publicaciones que incluyen niños con RGBS.11,12 En estas series los pacientes mostraron presentaciones diversas y, en un buen número, se ha observado recuperación rápida en comparación al caso que describimos.
En nuestro caso de RGBS se observaron características diferentes a las descritas en otros estudios: (1) el patrón inusual de debilidad en la nueva presentación, (2) fenotipo neuropático motor axonal en el estudio de neuroconducción, (3) respuesta lenta y progresiva posterior a la administración de inmunoglobulina intravenosa requiriendo asistencia a la ventilación por semanas. Esta forma de presentación se parece a un caso reportado en el año 2013 en Estados Unidos de Norteamérica.11 En otro caso en Honduras se describe el comportamiento de un adolescente en tres episodios de SGB. 15











 nueva página del texto (beta)
nueva página del texto (beta)