1. Introducción
Investigaciones recientes han revelado la existencia de nanopartículas en varios sitios urbanos, entornos acuáticos, terrestres y atmosféricos, producidas por combustión de fuentes estacionarias y móviles, así como las provenientes de origen natural [1, 2]. También, las nanopartículas empleadas en productos de consumo generalizado se incorporan a los diversos entornos ambientales, donde su destino y comportamiento final son en gran parte desconocidos [3]. En consecuencia, la presencia de material nanoparticulado (< 100 nm en diámetro) en el medio ambiente, ha generado preocupación por los efectos adversos que pueden tener en los ecosistemas y en la salud del ser humano [1]. Particularmente, la eliminación de contaminantes del aire es muy difícil en comparación con la descontaminación de los alimentos, el suelo y el agua. La vegetación con su follaje puede usarse como un filtro biológico de elementos traza, partículas gruesas, finas y ultrafinas, provenientes del suelo y del aire contaminado. No obstante, cuando las partículas son depositadas en las hojas de las plantas pueden cambiar sus propiedades ópticas, provocando una alteración importante en las velocidades de la transpiración, el balance térmico y el proceso fotosintético [3-5]. También, se ha demostrado que cuando partículas ultrafinas son aplicadas en las hojas de las plantas, pueden ser absorbidas a través de la apertura de los estomas, un punto de entrada de material nanoparticulado poco conocido [6].
Algunas partículas pueden ser absorbidas por las hojas a través de sus estomas, aunque la mayoría de ellas se conservan en la superficie. El proceso de filtración de partículas dependen del tricoma (pelos de la hoja), la cutícula (formada por cutina y cera), área foliar específica y densidad de estomas [2]. En particular, la cutícula tiene un papel termorregulador en la interacción de las plantas con el ambiente y las protege contra rayos UV. También, reduce la perdida de agua y difusión de gases, actúa como una eficaz barrera física protectora de polvo y provee soporte mecánico [7]. La cutícula es una membrana permeable, tanto a compuestos polares como no polares y su composición química comprende ácidos grasos hidroxilados de cadena media y glicerol. La cutina es el principal componente de la cutícula constituyendo del 40 al 80% en peso y cuyo grosor varía de 1 a 10 µm o mas [7]. Las ceras cuticulares reducen la permeabilidad de agua y regulan la capacidad de la superficie para la transpiración, además de que reflejan luz evitando el recalentamiento. Las ceras consisten de una mezcla compleja de compuestos alifáticos de cadenas lineales con una variedad de grupos funcionales sustituidos. También se han identificado esteres, alcoholes, aldehídos, cetonas, ácidos grasos de cadena larga en ceras epicuticulares y ácidos grasos de cadena corta en ceras intercuticulares [7]. Entre las ceras se han identificado algunos metabolitos secundarios como flavonoides, polisacáridos (celulosa y pectina) y algunos polipéptidos [7]. Por otra parte, las propiedades de filtrado de partículas ultrafinas, están determinadas por el diámetro de poro de la pared celular que varía de 5 a 20 nm. Por consiguiente, solo partículas menores a este intervalo de tamaño podrían pasar y acceder a la membrana plasmática [5]. Las alteraciones en los procesos fisiológicos de las hojas provocados por nanopartículas, dependen de varios factores, tales como la morfología y el tamaño de la partícula, el estado de aglomeración y su área superficial.
En los últimos años, el estudio de las características biológicas, químicas y físicas de hojas de las plantas ha sido de gran relevancia para la toma de decisiones. En lo que respecta a la absorbancia y reflectancia de las hojas, se relacionan con la cantidad de agua, los pigmentos fotosintéticos, la composición de la cutícula, la estructura interna de la hoja, así como la extensión del da no causado a las plantas sometidas a estrés [8]. Por consiguiente, llevando a cabo un análisis e interpretación de las propiedades ópticas de hojas de las plantas contaminadas con material particulado, se podría conocer su estado fisiológico. Por ejemplo, la detección espectral de danos a plantas bajo estrés por contaminación del aire, los cuales se manifiestan por una pigmentación de color pardo de las hojas y necrosis, pueden ser estimados como un aumento en la absorción óptica en la región de 780 a 900 nm [9-10].
Las características de las hojas determinan sus propiedades ópticas, ya que tienen superficies irregulares y espacios intercelulares ocupados con aire, esparcidos entre las células rellenas de citoplasma con paredes de celulosa húmedas [11-12]. En general, las hojas verdes de las plantas reflejan muy poca luz en la region visible (400-700 nm), debido a que sus pigmentos absorben luz en este intervalo de longitud de onda. La luz azul (490 nm) y roja (660 nm) es de fundamental importancia para llevar a cabo el proceso de fotosíntesis, mientras que la luz verde no es absorbida, proporcionando el color característico de las hojas frescas [11]. La absorción óptica en la región UV (210-350 nm) es debido a la presencia de polipeptidos, quininas y flavonoides [13]. En el intervalo de 800 a 1100 nm, la reflectancia puede alcanzar valores tan altos como 96% [12]. La alta reflectancia en el IR está relacionada con la reflectancia difusa de celulosa (1075 nm) y bandas de agua (1273 nm). La presencia de agua en las hojas tiene impacto en varios procesos de transferencia radiativa, puesto que el agua es uno de los mejores absorbedores de radiación solar en hojas de plantas [14]. Es claro que la presencia de material nanoparticulado en la superficie de las hojas o incorporado en los tejidos, afectaran los parámetros bioquímicos y las propiedades ópticas.
Por otra parte, es muy común utilizar diferentes combinaciones de bandas de reflectancia o índices de vegetación, como indicadores de estrés de hojas de las plantas. Los índices están basados en conocimientos empíricos sobre variaciones del espectro de reflectancia con el contenido de componentes bioquímicos de las hojas [11]. Un índice muy utilizado por su fuerte dependencia con el contenido de clorofila es el límite rojo (red edge), que corresponde a la longitud de onda λ red en la que se produce un cambio brusco en la reflectancia de la hoja entre el mínimo en el rojo (asociado a clorofila) y el máximo en el infrarrojo cercano (asociado a la estructura interna de la hoja). La alta absorción de clorofila en la región del rojo ocasiona que la penetración de la luz en estas longitudes de onda en la hoja sea muy baja y el fuerte esparcimiento originado en su estructura interna causa alta reflectancia en la region del infrarrojo cercano. Entre ambas regiones espectrales existe un punto de inflexión, que en la primera derivada de la reflectancia con respecto a la longitud de onda dR/dλ aparece como un máximo λ red. En otro ejemplo, el índice de reflectancia fotoquímico (PRI, por sus siglas en ingles photochemical reflectance index) compara la reflectancia relativa en la región del azul (zona de absorción de clorofila y carotenoides) con la reflectancia del rojo (absorción de clorofila solamente) y se define como PRI = (R531−R570)/(R531+R570), donde R531 y R570 se refieren a los valores de la reflectancia en 531 y 570 nm, respectivamente. Este índice está relacionado con la proporción carotenoide/clorofila y por lo tanto, con la eficiencia del proceso fotosintético y la remoción del exceso de energía radiante en forma de calor [11]. Otros índices para estimar antocianinas, carotenoides, y oscurecimiento (browning) en hojas han sido informados en la literatura [10-11].
Pocos estudios han sido llevados a cabo en relación al efecto de partículas de plata depositadas sobre hojas de las plantas [15-16]. Se ha informado de sitios de permeabilidad selectiva de la cutícula a iones y sales precursoras de metales de plata en presencia de agentes humectantes y luz. Al respecto, se demostró por microscopía de campo brillante, que las partículas de plata son depositadas preferencialmente en salientes cuticulares y células protectoras que rodean a los estomas. Más plata se acumuló en presencia de luz que en la oscuridad y también se incrementó el número de precipitados en salientes cuticulares, estomas y paredes anticlinales, cuando se utilizó el agente humectante Tween-20 [15].
El propósito de esta investigación es estudiar el efecto de nanopartículas de plata en las propiedades de absorbancia y reflectancia de hojas de Ficus benjamina en su cara adaxial e inferir danos en la superficie de la hoja y su estructura interna, bajo condiciones de exceso o déficit de agua.
2. Procedimiento Experimental
Las partículas de plata coloidal fueron obtenidas por reducción química de 0.016 mmol de AgNO3 con 0.03 mmol de borohidruro de sodio, disueltos en 100 ml de agua desionizada. La concentración molar de la solución con nano partículas de plata fue de 0.16 mM. La solución coloidal presentó un color amarillo en pocos minutos y fue anejada por 24 horas a temperatura ambiente, sin agitación y protegida de la luz. En este periodo, fueron registrados ligeros cambios colorimétricos con un espectrofotómetro UV-Vis Cary 300, para inferir la estabilidad morfológica de las nanopartículas. El diámetro hidrodinámico y la distribución del tamaño de partícula fue determinado por dispersión de luz dinámica con un equipo Malvern Instruments y la medida del potencial ζ fue determinado con el mismo equipo. La estimación de la morfología de las nanopartículas de plata dispersas en fase acuosa fueron obtenidas por microscopia electrónica de transmisión con un equipo JEOL 2100F, operando a 200 KV.
Para el estudio de las propiedades ópticas se seleccionaron hojas verdes de la especie Ficus benjamina, las cuales se lavaron varias veces con agua destilada y se secaron con papel absorbente. El grosor de las hojas seleccionadas fue muy uniforme del orden de 0.30 a 0.35 mm. Luego de registrar los espectros de absorbancia y reflectancia de las hojas control (sin contaminar) en su cara adaxial, se sumergieron en la solución acuosa de nanopartículas de plata por 18 horas, sin agitación y protegidas de la luz. Posteriormente, las hojas fueron secadas a temperatura ambiente e inmediatamente después, se midieron de nuevo sus propiedades ópticas en la misma superficie adaxial. Adicionalmente, se sumergieron hojas de Ficus en la solución coloidal por 18 h y posteriormente se secaron a 35 oC por 24 horas para investigar oscurecimiento termoquímico. Las propiedades ópticas de las hojas fueron evaluadas por medio de un espectrofotómetro UV-Vis- NIR Shimadzu UV-3600 equipado con una esfera de integración. Para ajustar el 100% de reflectancia se utilizó sulfato de bario como referencia. Con la finalidad de observar la morfología y distribución de tamaño de las nanopartículas sobre la superficie adaxial de las hojas, fueron obtenidas imágenes de microscopía electrónica de barrido con un microscopio JEOL 7800 F. También, se estimó el espectro infrarrojo de hojas por espectrometría infrarroja con transformada de Fourier (FTIR), utilizando un equipo Varian 660 con accesorio de reflectancia total atenuada (ATR).
3. Resultados y Discusión
3.1. Síntesis y caracterización de las nanopartículas
La absorción óptica de nanopartículas de plata dispersas en agua, recién preparadas y en función del tiempo de añejamiento, se muestra en la Fig. 1a. El espectro óptico de la muestra recién preparada es ligeramente asimétrico, con ancho de banda a media altura de 67 nm, un mínimo en 369 nm y posición del pico localizado en 388 nm. Las características del espectro óptico son típicas de una resonancia plasmonica dipolar, provenientes de nanopartículas de plata de forma esférica con amplia distribución de tamaño [17]. El potencial ζ fue cercano a 28 mV y predice una relativa estabilidad de la solución coloidal. De hecho, el espectro óptico de esta solución exhibió solamente un ligero incremento en su intensidad y un desplazamiento al rojo (en 400 nm), después de 2 horas de añejamiento a temperatura ambiente (23oC). El incremento en la absorbancia y desplazamiento al rojo, así como la forma asimétrica del espectro sugieren un incremento en el tamaño de partícula y presencia de estados de agregación, respectivamente [17]. La forma del espectro fue muy similar para 24 h de añejamiento (Fig. 1a). Por consiguiente, ya no ocurren cambios morfológicos importantes de las nanopartículas en la fase acuosa en el intervalo de 2 y hasta 24 h de añejamiento. Según el análisis de dispersión de luz dinámica se encontró una distribución bimodal en el tamaño de las partículas con valor promedio de 1.8 y 44 nm, respectivamente (Fig. 1b).
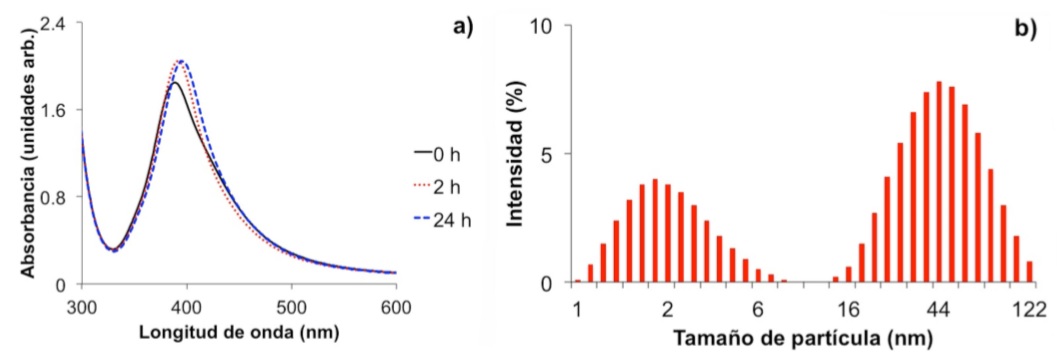
FIGURA 1 Espectros de absorción de nanopartículas de plata preparadas en agua en función del tiempo de añejamiento (a). Distribución de tamaño de las nanopartículas de plata para 24 h de añejamiento (b).
En la Fig. 2, se muestra una imagen de microscopía electrónica de transmisión de las nanopartículas preparadas en agua para 24 h de añejamiento. En la imagen se observan nanopartículas individuales esféricas y cuasi-esféricas, con diámetro desde 7 y hasta 30 nm así como agregados de gran tamaño, en acuerdo con el análisis de distribución del tamaño de partícula efectuado por dispersión de luz dinámica.
3.2 Propiedades ópticas de las hojas antes del proceso de inmersión
Las propiedades ópticas de las hojas dependen principalmente de la concentración de clorofila y otros compuestos bioquímicos, contenido de agua y estructura de la hoja [18]. Las principales longitudes de onda asociadas a máximos de absorción de diversos compuestos de la hoja se han registrado en la Fig. 3 y las asignaciones correspondientes se enlistan en la Tabla I. En la región del ultravioleta (200-380 nm) las absorciones ópticas corresponden a péptidos, quininas, residuos de proteínas y flavonoides [13,19]. En particular, los flavonoides son compuestos fenólicos no nitrogenados, cuyas absorciones se encuentran en el intervalo de 260-270 nm y 350-380 nm, que protegen a las plantas de danos por radiación UV-A y UV-B [10]. En la región del visible, la luz fuertemente absorbida en el azul (490 nm) y en el rojo (676 nm) se atribuye a los pigmentos fotosintéticos, mientras que la luz verde que no es absorbida tiene un mínimo en 554 nm. Otros pigmentos como los carotenoides (xantofilas y carotenos) absorben luz en la región del azul (400-500 nm) al igual que la clorofila. Su función es evitar el daño a las plantas por flujos excesivos de radiación visible y además permiten el atrapamiento de luz [10]. La hoja no contiene compuestos que absorban fuertemente en la región de 700-1300 [18]. Las absorciones localizadas en 970, 1194, 1458 y 1940 nm son sobretonos de absorciones fundamentales de agua [18]. Ya que los pigmentos fotosintéticos y el agua absorben luz fuertemente en la región visible e infrarrojo respectivamente, estos compuestos determinan en gran parte el espectro de absorbancia en la región de 400-2000 nm. En general, el 70% de la radiación solar incidente absorbida por las plantas es convertida en calor y usada para mantener la temperatura adecuada de la planta y para transpiración [18].
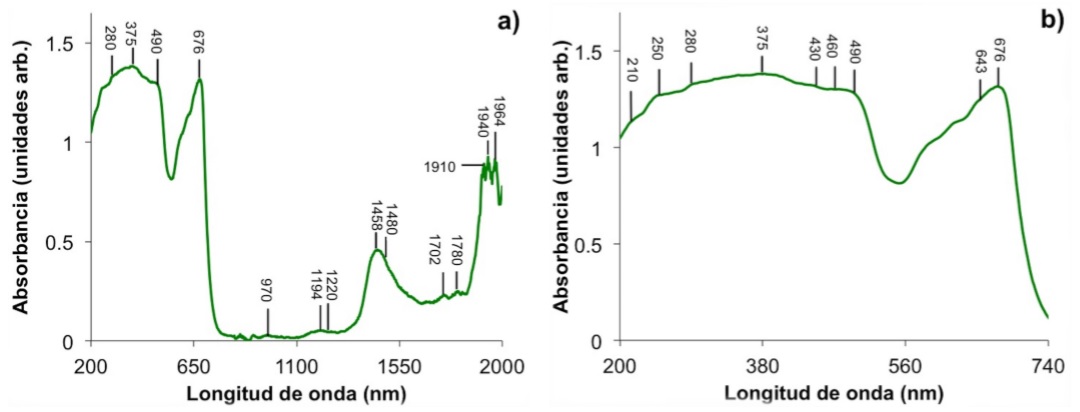
FIGURA 3 Absorbancia de una hoja de Ficus en su superficie adaxial para las regiones de 200 a 2000 nm (a) y de 200 a 740 nm (b).
TABLA I Asignaciones de los principales máximos de absorción de compuestos en hojas de plantas.
| λ(nm) | Asignación | Referencia |
| 210 | Péptidos | [13] |
| 250 | Quininas | [13] |
| 260-270 | Flavonoides | [19] |
| 280 | Residuos de protéınas | [13] |
| 350-380 | Flavonoides | [19] |
| 400-500 | Carotenoides | [11] |
| 430, 490, 676 | Clorofila a | [20] |
| 460, 643 | Clorofila b | [18] |
| 970, 1194, 1458, 1940 | Agua | [18] |
| 1702, 1780, 1910, 1964 | Almidón | [18] |
| 1220, 1480, 1930 | Celulosa | [18] |
Por otra parte, la reflectancia de una hoja de Ficus se han registrado en la Fig. 4a para el intervalo de 200 a 2000 nm. Los mínimos de reflectancia corresponden a los máximos de absorción. Algunas absorciones para pigmentos fotosintéticos (490, 676 nm), celulosa (1220 y 1930) y agua (970, 1194 y 1458 nm) se han registrado en esta Figura. También, las principales longitudes de onda para estimar índices de reflectancia se han registrado en la Figura 4b. Estos índices se pueden obtener de forma inmediata sin destruir la muestra y proporcionan información de variaciones de clorofila, carotenoides, agua y otros compuestos. A partir de estos datos se puede inferir sobre la eficiencia del proceso fotosintético y la disipación de energía radiante en forma de calor [11,21].

FIGURA 4 Reflectancia de una hoja de Ficus en su superficie adaxial para las regiones de 200 a 2000 nm (a) y de 400-1200 nm (b).
La reflectancia en el intervalo de 200 a 470 nm es muy baja (< 10%), debido a que la cutícula y la epidermis de la hoja son casi transparentes en este intervalo de longitud de onda (Fig. 4a). Similarmente, predomina la baja reflectancia en la región de la absorción de pigmentos fotosintéticos. El máximo de reflectancia en la región del visible localizado en 554 nm, está asociado con el color observado en la hoja. La reflectancia aumenta bruscamente a partir de 684 nm (4% de reflectancia) alcanzando una reflectancia máxima de 99% en 1078 nm (débil absorbancia de la radiación solar en esta región), para luego disminuir a longitudes de onda más largas (Fig. 4a). Específicamente, en el intervalo de 700-1300 nm donde la absorción es muy baja, la magnitud de la reflectancia está gobernada por discontinuidades estructurales encontradas en la hoja [21]. En este caso, las diferencias en el índice refractivo de los componentes de la hoja contribuyen a múltiples reflexiones. Por consiguiente, cambios inducidos o causados de forma natural que disminuyan las discontinuidades en el índice de refracción causar a una alteración de la reflectancia [18]. La alta reflectancia (∼90%) en el IR está relacionada con la estructura interna (celulosa) de la hoja y con el contenido de agua. En particular, los máximos de reflectancia debido a agua se identifican a longitudes de onda mayores a 1230 nm [18]. La reflectancia es muy útil para estimar las propiedades de la superficie de la hoja, identificación y cuantificación de algunos compuestos y conocer características de la estructura interna de la hoja [18].
3.3. Propiedades ópticas de las hojas después del proceso de inmersión
Las hojas de Ficus se sumergieron en la solución coloidal conteniendo nanopartículas de plata, originalmente de tamaño promedio de 1.8 y 44 nm. La finalidad de esta metodología es atrapar nanopartículas de plata sobre las hojas de Ficus e investigar las propiedades ópticas en su cara adaxial. En la Fig. 5a, podemos observar que la absorción óptica de la hoja disminuyo en la región del UV. En esta región las absorciones son típicas de péptidos, quininas y flavonoides extraídas en hojas de Ficus en medio acuoso a pH acido básico [13]. En nuestro caso, la inmersión de las hojas en la solución coloidal podría extraer fragmentos de proteínas y los metabolitos mencionados, debido a la solubilidad de estos compuestos en agua. Un análisis FTIR de las bandas de absorción en la región de 1670-1575 cm −1 donde predominan aminas, amidas y aromáticos [22-28], mostró que estas absorciones se atenuaron y se desplazaron a baja frecuencia después de la inmersión (Fig. 5b). Las absorciones en 1654, 1648, corresponden a vibraciones de flexión C=N en grupos amino [22] y vibraciones de flexión asimétrica C=O en amidas [23], respectivamente. Mientras que las absorciones en 1635, 1627 y 1608 cm−1 corresponden a aromáticos principalmente formados por compuestos fenólicos (flavonoides, ácidos cinámicos y derivados) provenientes de la cutícula [25]. Las bandas en 1654, 1648, 1635, 1627 y 1608 cm−1 disminuyeron y se desplazaron a 1652, 1644, 1633, 1621 y 1602 cm−1, respectivamente. El desplazamiento, se relaciona con reactividad química del grupo carbonilo proveniente de aminas, amidas y flavonoides [13, 26]. Por ejemplo, el grupo de polifenoles (donde los flavonoides están incluidos) pueden oxidarse originando quinonas [28] cuya absorción en el espectro FTIR se localiza en 1642 cm−1 [29]. También, residuos de aminoácidos y péptidos tienden a ligarse con metales [13]. La banda de absorción localizada en 1617 cm −1 corresponde a agua [30-31]. La atenuación de las bandas de absorción indica una disminución de compuestos aromáticos y residuos de proteínas solubles.

FIGURA 5 Espectro de Absorbancia en la región de 200 a 2000 nm (a) y espectro FTIR en la región de 1575-1670 cm-1 (b) para una hoja de Ficus en el área adaxial, antes (....) y después (—) de sumergirla en la solución acuosa de nanopartículas de plata. Espectro UV-Vis de la solución coloidal después de la inmersión de la hoja de Ficus por 18 h (—) y espectro de agua para comparación (. . . ). Espectro de absorbancia antes (. . . ) y después (—) de oscurecimiento termoquímico de la hoja (d).
Adicionalmente, en la Fig. 5c se muestra el espectro de absorbancia de la fase liquida después de impregnar la hoja con la solución coloidal por 18 h. En este caso, la absorbancia exhibió un hombro localizado en 275 nm asociado principalmente a flavonoides (máximo de absorción entre 260-270 nm), los cuales pueden combinarse con proteínas (máximo de absorción en 280 nm) mediante puente de hidrógeno. La extracción de compuestos de hojas de las plantas por infiltración en agua caliente o disolventes orgánicos es un procedimiento común informado en la literatura [20, 26-27]. En nuestro caso, la temperatura ambiental promedio del experimento fue de 32 oC, por lo que esta condición favoreció la extracción. Sin embargo, para una menor temperatura ambiente el proceso de extracción de compuestos no fue posible de identificar para 18 h de inmersión.
En la región del visible, relacionada con la absorción de los pigmentos fotosintéticos, no se observaron cambios en la absorbancia o en la longitud de onda del máximo de absorción localizado en 676 nm (Fig. 5a). En el intervalo de 730 a 780 nm aparece un débil aumento de la absorción, que sugiere un incipiente cambio de coloración de la hoja producido por la presencia de las nanopartículas de plata (Fig. 5d). El efecto óptico fue muy notable cuando la misma hoja se secó a temperatura ambiente por 12 h. En este intervalo de tiempo, la temperatura ambiente tuvo un valor máximo de hasta 37 oC y es de esperarse que las hojas comiencen a perder agua por efecto de la temperatura. Bajo estas circunstancias, las propiedades ópticas de las hojas contaminadas fueron afectadas notablemente, resaltando el incremento de absorción óptica en el intervalo de 730-780 nm. Este efecto ha sido relacionado con oscurecimiento termoquímico que conduce a un incremento de la reflectancia en el visible cuando el contenido de humedad disminuye [32, 33]. Una serie de medidas adicionales UV-Vis-NIR y FTIR, se efectuaron para investigar este efecto en hojas contaminadas tratadas a una temperatura constante de 35oC por varias horas (ver Sec. 3.5).
La absorción óptica en el infrarrojo para bandas de agua (970, 1194, 1458, 1940 nm) se incrementó respecto a la hoja control (Fig. 5a), confirmando que el agua fue infiltrada en el tejido vegetal. La absorción de radiación por agua en la hoja es el efecto más importante en la disminución de la reflectancia difusa en la región del cercano infrarrojo [18]. También, el incremento en el contenido de agua infiltrada en las hojas no solamente aumenta la absorción de bandas de agua, sino que también causar a aumento de absorción en otras regiones del espectro [18], por ejemplo en 1910 y 1930 nm para almidón y celulosa, respectivamente.
En términos generales, la reflectancia disminuyó para casi todas las longitudes de onda con respecto a la hoja sin contaminar (Fig. 6a). Por ejemplo, en el intervalo de 200 a 470 nm, la reflectancia en la cara adaxial fue ligeramente menor que en la hoja control (Fig. 6b). La hoja contaminada refleja menor cantidad de radiación UV a consecuencia de la pérdida de material soluble (residuos de proteínas y flavonoides, principalmente), procedente de la membrana cuticular. En consecuencia, la protección UV y el papel termorregulador de la cutícula son alterados. Similarmente, se ha informado de una disminución de la reflectancia en la región de 270-480 nm en hojas sumergidas en cloroformo, debido a perdida de cera epicuticular [34]. El máximo de reflectancia localizado en 554 nm, también disminuyó un poco con la presencia de las nanopartículas (Fig. 6a). Al respecto, se ha informado que los espectros de reflectancia de las plantas presentan este tipo de cambios durante el proceso de pigmentación parda del tejido y necrosis, debido a acumulación de productos provenientes de la oxidación de polifenoles [10]. Como ya se comentó antes, el espectro FTIR en la región de 1650-1500 cm −1 proporciono evidencia de la identificación de este proceso de oxidación en hojas inmersas en la solución coloidal por 18 h. No obstante, muchos compuestos fenólicos pueden encontrarse en el citoplasma, en las vacuolas, en las paredes celulares o dispersos en los tejidos en células especializadas [35]. Por tal razón, la sensibilidad para identificar procesos de oxidación por espectroscopia FTIR en la estructura interna, esta limitada a que la profundidad de penetración de la reluctancia total atenuada en hojas va de 0.3 µm a 4000 cm−1 hasta 0.7 µm a 700 cm−1 [36], es decir, el haz incidente penetra una corta distancia en la hoja y los procesos que ocurren en la subsuperficie no son identificados claramente. Mientras que la técnica de reluctancia difusa ha sido reconocida por muchos años de ser capaz de identificar procesos ópticos en la subsuperficie, incluyendo oscurecimiento oxidativo [10,33].
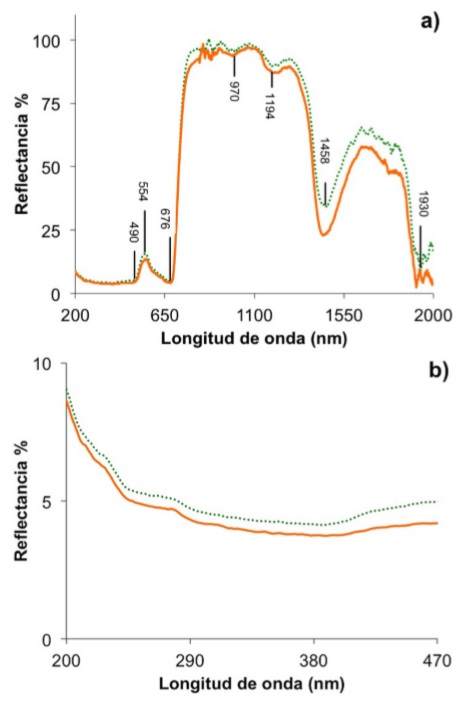
FIGURA 6 Reflectancia de una hoja de Ficus en su superficie adaxial para las regiones de 200-2000 nm (a) y de 200-470 nm (b), antes (...) y despues ( - ) de sumergirla en la solución acuosa de nanopartículas de plata.
El daño causado a la hoja por el estrés inducido fue más evidente en el espectro de reflectancia en el intervalo de 730 a 820 nm, el cual se identifica por una diminución de la reflectancia de hasta el 5% (a 780 nm) respecto al valor de la reflectancia de la hoja control (Fig. 6a). La baja reflectancia de la hoja en la región del IR comparado con la hoja control, está asociada a que la infiltración de agua llena los huecos de aire y las discontinuidades del índice refractivo son disminuidas [11,18,32]. Consecuentemente, disminuye la reflexión interna en interfaces dentro del tejido de la hoja [18]. En condiciones normales de radiación incidente, una hoja puede obtener calor a través de convección, si la temperatura de la hoja es más baja que la del aire, manteniendo un proceso de transpiración optimo. Para una hoja conteniendo exceso de agua se requerirá mayor energía para el proceso de transpiración, pero si la superficie de la hoja está contaminada y en particular los estomas, la eficacia del proceso podría ser afectada.
3.4 Morfología de las nanopartículas en la superficie de las hojas
En la Fig. 7a, se muestra una imagen de microscopía electrónica de barrido de las partículas de plata depositadas sobre la hoja de Ficus en su lado adaxial. En la imagen se observan muchos agregados de gran tamaño (> 1µm) y partículas de forma esférica con diámetros de ∼200 nm. Probablemente, las propiedades fisicoquímicas de la membrana cuticular, tales como la masa, solubilidad, composición química e intersticios favorecen estados agregados. Una explicación de cómo ocurre este proceso se presenta a continuación: Se ha informado que la masa por unidad de área de la membrana cuticular en una hoja de Ficus es de 458 µg/cm2, y de esta masa el 75% (343 µg/cm2) es insoluble para la cara adaxial [37]. El material insoluble es principalmente cutina, la cual está constituida de ácidos grasos saturados, predominantemente en la longitud de cadena C16 y C18, portando grupos -OH y epoxido en la mitad de la cadena o en el extremo opuesto. Ya que la cadena es apolar y es mucho más grande que el grupo polar proveniente del hidroxilo o epóxido, las moléculas de cadena larga no se disuelven fácilmente en agua. Consecuentemente, las nanopartículas de plata difícilmente podrían distribuirse homogéneamente sobre la cutícula, no obstante, algunas partículas podrían quedar atrapadas en la cera cuticular, tal y como se ha informado para otros metales depositados en hojas de plantas [38]. Por otra parte, la matriz cuticular no es homogénea y puede contener numerosos intersticios en diferentes proporciones, frecuentemente llenados con material granular grueso y depósitos de minerales de silicio [39]. Los intersticios pueden estar interconectados y son burdos en la cara adaxial. Entonces, el proceso de agregación inicia debido a que una pequeña partícula de plata sin protección de su superficie (como en nuestro caso), puede ser fácilmente absorbida sobre una partícula más grande (plata o mineral de silicio) previamente atrapada en los intersticios o en la cera cuticular, causando un proceso continuo de crecimiento y aglomeración de partículas. Es especialmente interesante informar que los estados aglomerados de partículas, también pueden ser promovidos por el material soluble de la cutícula. La aseveración se prueba indirectamente con base a que el tamaño de la nanopartículas dispersas en la solución acuosa, se incrementó notablemente después de 18 horas de estar en contacto con la hoja de Ficus (Fig. 7b). Adicionalmente, el ancho de banda de la resonancia plasmonica aumentó 38 nm con respecto a la resonancia original (67 nm) y se desplazó al rojo 5 nm. El resultado confirma que los compuestos extraídos de las hojas de Ficus promueven un incremento del tamaño de la nanopartícula en fase liquida. El ensanchamiento y desplazamiento al rojo fue muy notable para soluciones coloidales mantenidas en contacto con la hoja varios días, mientras que el espectro óptico de la solución coloidal de plata original, no sufrió cambios en el mismo periodo.

FIGURA 7 Imagen de microscopía electrónica de barrido de nanopartículas de plata depositadas en una hoja de Ficus en su cara adaxial (a). Distribución del tamaño de las nanopartículas de plata en agua después de la inmersión de las hojas de Ficus por 18 h (b).
Se deduce que las hojas de las plantas en presencia de agua poseen un mecanismo eficiente de aglomeración de nanopartículas en su superficie, evitando de esta manera que pasen a estructuras internas del tejido vegetal. En diferentes trabajos se ha informado que las partículas metálicas ultrafinas emitidas por fuentes industriales y móviles, presentan estados aglomerados en la superficie de hojas de plantas [38,40-41].
3.5. Oscurecimiento termoquímico
En la Fig. 8 se ha graficado el espectro FTIR de una hoja de Ficus impregnada con nanopartículas antes y después de secar por 24 h a 35 oC. Se observa una disminución de la absorbancia de muchos grupos funcionales asociados a compuestos orgánicos de naturaleza compleja, que indican daño a la superficie de la hoja. Por ejemplo, se puede observar la disminución de la banda ancha localizada en 3365 cm−1 para la hoja seca, relacionada al modo de vibración de tensión del grupo -OH que comprende alcoholes, agua y flavonoides [27,42]. También se observa la diminución de alifáticos que se encuentran en varias ceras de las plantas y se caracteriza por vibraciones de tensión de metileno localizado en 2917 y 2846 cm−1 [25,36], flexión en 1462 cm −1, además de las vibraciones de balanceo en 719 cm−1 [36]. Las absorciones en 1730 y 1157 cm−1 están asociadas a vibraciones de tensión C=O en aldehídos alifáticos [36] y a vibraciones de tensión C-H, C-C en anillos aromáticos [27,36], respectivamente. Otras absorciones predominantes que disminuyeron fueron observadas en 1612, 1244 y 1105 cm−1 debido a agua [30], aminas aromáticas [43] y vibraciones C=S [22].
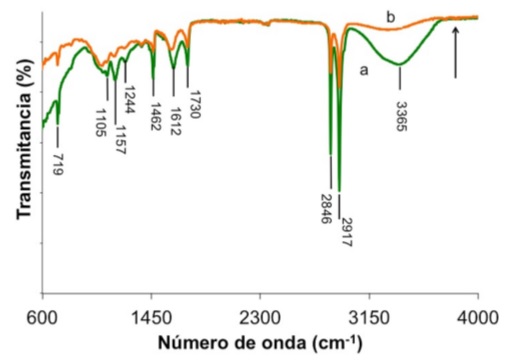
FIGURA 8 Espectro FTIR en la region de 600-4000 cm −1 de una hoja de Ficus impregnada con nanopartículas a) y posteriormente secada a 35oC por 24 h b). La flecha indica la evolucion espectroscopica correspondiente.
En la Fig. 9 se muestran las propiedades ópticas en el intervalo de 200-2000 nm correspondientes a la hoja contaminada antes y después de secado. La absorbancia en la región UV-Vis debido a proteínas, flavonoides, carotenoides y clorofila (210-676 nm), así como la absorbancia en la región del infrarrojo (1106-2000 nm) donde predomina agua, disminuyo respecto a la hoja impregnada (Fig. 9a). Este efecto confirma la degradación de proteínas y compuestos aromáticos inducida por efecto de la temperatura, la cual se relaciona con pérdida de agua. También, puede distinguirse la aparición de una fuerte absorción óptica en la región de 714 a 1106 nm para la hoja contaminada y calentada por 24 h (Fig. 9a). Para hojas de tabaco que sufren oscurecimiento enzimático o termoquímico exhiben un incremento de la absorción óptica en la región de 500-1380 nm [33]. Con respecto al espectro de reflectancia, también se observaron varios cambios importantes (Fig. 9b). La tendencia general en la región UV-Vis es un incremento en la reflectancia. Por ejemplo, la reflectancia en 676 nm para la hoja seca fue mayor que en la hoja impregnada y sin secar, sugiriendo una disminución en la concentración de clorofila. También, ha sido informado que cuando la concentración de pigmentos fotosintéticos disminuye el espectro de reluctancia se ensancha [44] y ocurren desplazamientos al azul del máximo de reflectancia del límite rojo [45]. De hecho, el limite rojo λ red, se desplazó de 715 nm en la hoja antes de secar a 703 nm para la hoja calentada 24 h. El análisis del índice PRI paso de un valor de 0.068 para la hoja impregnada con nanopartículas a 0.023 para la misma hoja calentada por 24 h. Ya que este índice esta relacionado con la proporción carotenoide/clorofila, se sugiere que la concentración de carotenoide también disminuye. Dado que la función de los carotenoides es la de evitar daños a las hojas por flujos excesivos de radiación visible, su disminución altera el balance térmico y compromete la eficiencia del proceso fotosintético. Adicionalmente, se puede afirmar que el daño causado a los pigmentos de la hoja secada y contaminada por nanopartículas compromete un proceso eficaz de disipación de calor.

FIGURA 9 Absorbancia (a) y Reflectancia (b) en la region de 200-2000 nm para una hoja de Ficus en el area adaxial, impregnada con la solucion coloidal (...) y después de secarla a 35 oC por 24 h (-).
Por otra parte, ya que la radiación es difundida y esparcida a través de la cutícula y epidermis, hacia las células del mesofilo y cavidades de aire en el interior de una hoja sana, la radiación sufre múltiples reflexiones que causan alta reflectancia en el intervalo de 800-1200 nm. Sin embargo, la reflectancia de la hoja calentada y contaminada disminuyo hasta 34% a 810 nm con respecto a la hoja contaminada sin calentar (Fig. 9b). El resultado sugiere una alteración en la interfase pared celular-aire causada por la solución coloidal de partículas metálicas. El índice de oscurecimiento (browning index) definido como BI = (1/R550-R700)/R800 paso de 0.55 para la hoja contaminada y sin tratamiento térmico a 0.93 después del secado, indicando que el proceso de oscurecimiento se incrementó, de manera similar al proceso de oscurecimiento informado para una fruta envejecida por varios meses [46].
Resumiendo, los resultados de las hojas contaminadas con nanopartículas y sometidas a un tratamiento térmico, se deduce que la falta de agua provoca degradación de compuestos aromáticos, da no en la superficie de la hoja, oscurecimiento termoquímico y alteración de su estructura interna. En consecuencia, se predice que en hojas de los arboles contaminadas con partículas metálicas ultrafinas y sometidas a déficit hídrico, comprometen la transpiración, incrementan la temperatura de la hoja y alteran el proceso fotosintético.
4. Conclusiones
En este trabajo, se informa que la cutícula de la hoja de Ficus benjamina, favorece la agregación de nanopartículas en su superficie, evitando de esta manera que partículas de tamaño nanométrico (menor al tamaño del diámetro de poro de la pared celular), se incorporen a la membrana plasmática. La alta absorción de radiación de las hojas de Ficus en la cara adaxial, disminuye en la región UV después de sumergirlas en la solución coloidal, sugiriendo perdida de material soluble proveniente de la cutícula (flavonoides y residuos de proteínas, principalmente). El estudio de FTIR de las hojas antes y después de la inmersión, proporción o evidencia de la extracción de diversas especies químicas presentes en la hoja, que modifican sensiblemente sus propiedades ópticas. Compuestos alifáticos, aromáticos y residuos de proteínas, explican la interacción peculiar entre nanoparticulas sedimentadas en las hojas de Ficus benjamina y la estructura cuticular analizada en este estudio. La actual metodología empleada en este trabajo, permite vislumbrar del potencial contaminante de las zona urbanas, y que las plantas son las primeras especies vivientes en intentar mitigar, a través de diferentes procesos de filtración. El mecanismo de protección por agregación de material nanoparticulado en la superficie de las hojas, está comprometido por déficit de agua y pude ser una explicación de los notorios danos de las especie vegetales, ante el estrés ambiental por partículas metálicas.











 text new page (beta)
text new page (beta)



