PACS: 82.47.Ed; 72.80.Tm; 85.30. z
1. Introducción
La estructura básica de una celda SOFC está compuesta de dos electrodos (ánodo-cátodo) separados por un electrolito, el cual normalmente es un conductor iónico, tal como se ilustra en la Fig. 1 donde, son notables las diferencias en los mecanismos de transporte iónico en el electrolito. En la actualidad, existe una gran diversidad de tecnologías de celdas de combustible, que funcionan en una gama de temperaturas desde temperatura ambiente hasta más de 1000°C y a partir de distintos materiales. A pesar de que la celda SOFC fue inventada hace varias décadas y se ha utilizado más ampliamente en los últimos años, su comercialización se ha visto restringida debido a la alta temperatura de funcionamiento y la inconveniencia de utilizar hidrógeno(H2). Para bajar la temperatura de trabajo y utilizar los otros combustibles, como el gas natural, es imperativo fabricar nuevos y eficaces materiales anódicos. Las celdas SOFCs, son una atractiva opción principalmente en aplicaciones estacionarias debido a su alta eficiencia eléctrica, baja emisión de gases contaminantes, funcionamiento silencioso y gran flexibilidad en el tipo de combustible utilizado. Adicionalmente, debido a que las celdas SOFC producen una gran cantidad de calor cuando generan electricidad, son especialmente interesantes al utilizarse en sistemas de co-generación particularmente en el entorno de uso doméstico e industrial. Debido a la variedad de celdas de combustible y su modularidad, estos dispositivos tienen la capacidad de cubrir una amplia gama de aplicaciones en la construcción desde un hogar familiar hasta todo un hospital 1.
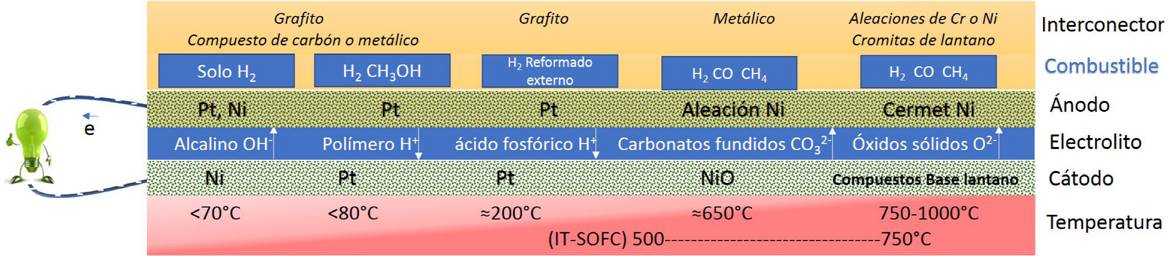
Figura 1. Clasificación de celdas de combustible de acuerdo a los materiales que la conforman y temperatura de funcionamiento.
Hoy en día, los avances en el desarrollo de las celdas SOFCs, dependen principalmente del tipo y estructura de los materiales que conforman al ánodo (oxidación del combustible), electrolito (conducción iónica), cátodo (reducción de oxígeno), interconectores y sellos. Respecto al electrodo anódico, el material fabricado a partir de zirconia estabilizada con itrio (YSZ) y níquel (30%Ni) 2,3, es uno de los materiales más estudiados y sugeridos para su aplicación como ánodo. Otros materiales que se han destacado con el uso del níquel son los compuestos Ni-YSZ/YDC 4,5, Ni/SDC 6,7, Ni-Co/GDC, Ni-Fe/GDC 8,9 y BaO/Ni [Y10]. Sin embargo, debido a la elevada actividad catalítica del Ni, se forman depósitos de carbón en la superficie que reducen el rendimiento del electrodo anódico e importantes propiedades como la conductividad. Otra manera de evitar la formación de depósitos de carbón en la superficie del ánodo junto con el compuesto YSZ, es sustituir al Ni por otro metal como el cobre, que permite una menor actividad catalítica, menos depósitos de carbón, mayor estabilidad y conductividad 11. Sin embargo, el cobre presenta problemas en la oxidación del hidrocarburo y por lo tanto la reducción en el rendimiento final de una SOFC 12. Investigaciones recientes, han demostrado que la oxidación electroquímica directa de etanol, mejora la tolerancia al carbón al utilizar pequeñas cantidades de estaño (Sn) con Ni13. Otro material donde se ha considerado el cobre además del cerio (Ce), sin observar depósitos de carbono utilizando hidrógeno 14 y metano 15, es el cermet Cu-CeO2-YSZ demostrando mejor rendimiento y eficiencia en la oxidación electroquímica del combustible en comparación al compuesto Ni-YSZ. Algunos autores han optado por utilizar Ce dopado con samario (SDC). En este caso la incorporación del cobre a una matriz porosa tipo Ni/SDC, ha demostrado buenos resultados en densidad de corriente (Pmax = 317 mW.cm-2) en una atmósfera con metano a 600°C. En algunas investigaciones se ha considerado agregar entre 3 - 5% de Rutenio (Ru) al ánodo NiO-SDC, obteniendo una densidad Pmax = de 750 mW.cm-2 a 600°C en una atmósfera de metano 17. También se ha demostrado que mediante la impregnación del 1% en peso de paladio (Pd) sobre cerio, se obtiene un incremento en densidad de 20 a 280 mW.cm-2 a 700°C con metano 18.
Para una celda SOFC en funcionamiento, los requerimientos básicos que debe cumplir el ánodo son: alta estabilidad química (ambiente reductor) y mecánica, debe ser poroso para permitir el paso del gas reactivo hasta la triple frontera de fase (electrolito + ánodo + gas), elevada conductividad electrónica en un amplio rango de presiones parciales de oxígeno (PO2), aceptable compatibilidad térmica con el electrolito y los interconectores, alta cinética para el intercambio superficial de oxígeno, así como aceptables propiedades catalíticas para las reacciones anódicas 19,20. En este sentido y en la búsqueda de mejores propiedades anódicas, una alternativa al tradicional material Ni-YSZ y que ha sido ampliamente estudiada en las últimas décadas, son los óxidos mixtos de estructura perovskita 21. De hecho, algunos de los ánodos más relevantes sugeridos por diversos investigadores, pertenecen a este tipo estructural incluyendo manganitas de cromo 22,23,24, titanatos 25,26,27,28,29,30,31,32, y dobles perovskitas como el material
2. La estructura perovskita
La estructura perovskita ideal es cúbica y pertenece al grupo espacial Pm3m-O h 35. Estos materiales poseen una estequiometria general formada por cationes tipo ABO3 (ver Fig. 2). Forman una gran familia de compuestos óxidos y se han utilizado ampliamente como catalizadores en reacciones de oxidación 36. En la Fig. 2, se observan varios octaedros ubicados en las esquinas del cubo, el cual forma el esqueleto de la estructura y donde la posición central se encuentra ocupada por el catión A. Alternativamente, en el centro de cada octaedro se observa al catión B. Por lo tanto, esta es una súper-estructura con un armazón tipo ReO3 (trióxido de renio), construida por la incorporación de cationes tipo A, rodeados por octaedros de la forma BO6. La estructura tipo ReO3, ha sido de gran importancia como estructura huésped de donde se han derivado numerosos óxidos metálicos 37. Hoy en día se conocen diversas desviaciones de la perovskite ideal con simetría ortorrómbica, romboedral, tetragonal, monoclínica y triclínica. De estas, las últimas tres son relativamente escasas y han sido poco caracterizadas en comparación38. La estructura distorsionada puede existir a temperatura ambiente, pero se transforma a una estructura cúbica en alta temperatura. Esta transición puede ocurrir en varias etapas a través de fases intermedias. Las desviaciones de la estructura cúbica, pueden proceder de una simple distorsión de la celda cúbica unitaria, o de un aumento en la celda, o puede ser una combinación de ambas.
Hoy en día, existen una gran variedad de elementos químicos (ver Fig. 3), que pueden acomodarse en la estructura perovskita, y dependiendo del radio iónico de cada catión (A,B), puede variar el grupo cristalino, así como su estabilidad. De hecho, la estructura dependerá no solo del tamaño sino también de la naturaleza de los átomos A y B 39. En estos materiales, están comprendidas tres especies iónicas diferentes, cada una con su propia concentración de defectos en equilibrio debido a tres diferentes energías de activación para la formación de defectos, los cuales, combinados con su electroneutralidad, constituyen características químicas potencialmente útiles, sobre todo cuando se consideran ciertos parámetros como la conducción iónica, electrónica o vacancias en diversas atmósferas con diferentes presiones parciales de oxígeno. Además, al utilizar materiales de conductividad mixta (iónica-electrónica) en electrodos de una celda SOFC, se puede mejorar en gran medida el funcionamiento de la triple frontera de fase tal como se aprecia en la Fig. 4. Los óxidos perovskita también exhiben excelente estabilidad térmica y mecánica tanto en atmosferas reductoras como oxidativas (redox) en temperaturas elevadas 41,42. Es bien conocido que los óxidos tipo perovskita, exhiben alta actividad catalítica respecto a varias reacciones, en particular, en reacciones de oxidación. En la Tabla I, se muestran algunos ejemplos de las propiedades típicas de las perovskitas 43.
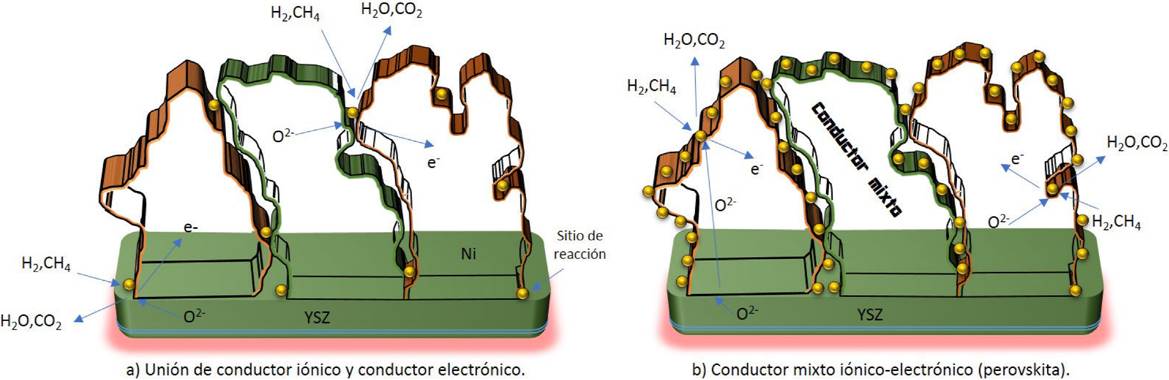
Figura 4. Mejoramiento de la triple frontera de fase en un ánodo de celda SOFC a través de materiales mixtos iónicos-electrónicos.
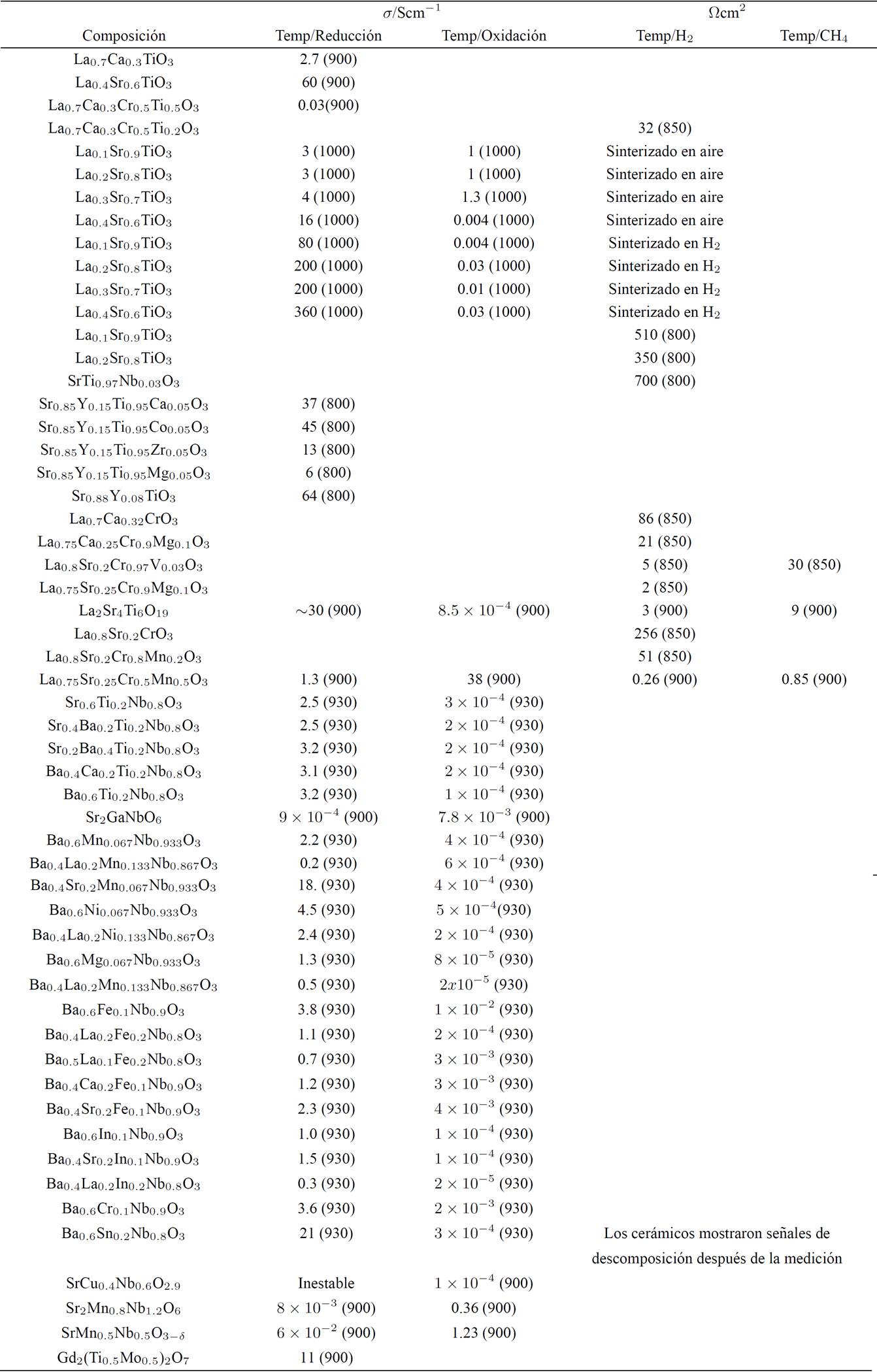
Debido a que la estructura perovskita es estable en altas temperaturas (1000°C), el grado de calentamiento que requiere una celda SOFC para su correcto funcionamiento no es un problema. A diferencia del níquel (Ni), esta condición es importante debido al peligro que representa este elemento al sinterizarse y aglomerarse. Además, como se mencionó antes, es importante que el ánodo sea compatible física y mec ánicamente con la densa capa del electrolito normalmente fabricado de zirconia estabilizada con itrio (YSZ). Actualmente, diversos investigadores afirman tal compatibilidad a partir de los materiales tipo perovskita al evaluar los diferentes parámetros de una celda SOFC en operación, así como el coeficiente de expansión térmico (TEC), de los electrodos compatible con electrolitos. Las perovskitas que contienen metales de transición (Fig. 3), son de particular interés debido a la disponibilidad de los múltiples estados de oxidación, lo cual facilita los procesos electrocatalíticos, además de proporcionar el adecuado mecanismo para la conductividad electrónica. En este sentido se pueden mencionar ciertos elementos que cumplen con características redox como: Cr3+/4+, Ti3+/4+, Mn3+/4+, Ce3+/4+, Mo3+/4+, V3+/4+/5+, Nb4+/5+, etc. Los óxidos anódicos para celdas SOFC, se clasifican de acuerdo a su estructura cristalina y propiedades en fluoritas (base zirconia y cerio), rutilos, bronces-tungsteno, pirocloros, perovskitas y dobles perovskitas (ver Tabla II) 21. Cabe mencionar que, en atmósferas reductoras, los iones metálicos de transición cambian a estados de oxidación más bajos, liberando electrones de manera más efectiva para el paso de corriente.
Tabla II. Conductividad eléctrica y resistencia a la polarización de óxidos anódicos de estructura perovskita y doble perovskita. Se indica entre paréntesis la temperatura en grados Celsius 21.
3. Análisis de cromitas de lantano de estructura perovskita
Los óxidos de estructura perovskita pueden acomodar gran cantidad de vacancias de oxígeno, de esta manera, algunas perovskitas son excelentes conductores iónicos (oxígeno). El pequeño sitio B (Fig. 2), en la perovskita permite introducir en la red cristalina diversos elementos de transición de la primera fila de la tabla periódica (Fig. 3). Tales elementos son multivalentes bajo ciertas condiciones y pueden ser una buena fuente de mejora para la conductividad eléctrica. De este modo, varias perovskitas presentan aceptable conductividad iónica y mixta. Tal conductividad es benéfica para el correcto desempeño del electrodo. Las perovskitas tipo-p son ampliamente consideradas para celdas SOFC y otras aplicaciones 44. Dentro de los materiales más prometedores para electrodos anódicos se encuentran las cromitas, manganitas, vanadatos y los titanatos 45,46. Las perovskitas del grupo de los lantánidos de la tabla periódica se han investigado en la catálisis de combustión de gases como CO y CH4. De tales óxidos, los materiales LnMnO3, LnFeO3, LnCoO3 y LnNiO3 poseen interesantes propiedades oxidativas en condiciones de reacción con CH4-O2, mientras que el material LnCrO3 es el menos activo (Ln = lantánido) 47. De las perovskitas anteriores, el material LaCrO3 fue el más estable a 1000°C en muy baja presión parcial de oxígeno (
Inicialmente dentro de las cromitas de lantano, se estudió al compuesto LaCrO3 como material anódico debido a su alta estabilidad en ambientes redox y conductividad electrónica en altas temperaturas. Sin embargo, varios estudios han demostrado que el dopaje del compuesto LaCrO3 en los sitios A o B, puede influenciar significativamente sus propiedades electroquímicas. A pesar de que la sustitución de Ca y Sr en el sitio A demostró mejorar la conductividad eléctrica y actividad catalítica del material LaCrO3, una mejor estrategia para potenciar la actividad catalítica y conductividad iónica de oxígeno es el co-dopaje adicional del sitio B 49. Las vacancias de oxígeno se pueden generar en alta temperatura y atmósfera reductora cuando se utilizan ciertos metales (V, Ni, Fe, Co, Mn o Cu) de transición en el sitio B.
3.1. Comportamiento de cromitas frente al azufre
Una de las consideraciones más importante hasta el momento para una celda SOFC, es la mayor fiabilidad como generador de energía. Para este propósito, el desarrollo de un ánodo que resista la deposición de carbono, la re-oxidación y el envenenamiento por azufre, es altamente deseable. La tolerancia al azufre, es otra de las propiedades que presentan los óxidos anódicos de estructura perovskita al utilizar un combustible hidrocarburo 50. Tal es el caso del material La
x
Sr
1-x
Cr
y
Mn
1-y
O3 (LSCM) con sus diversas variaciones en el dopaje (x, y), ha demostrado un importante avance en investigación y desarrollo de perovskitas 51. Por ejemplo, el compuesto La0.75Sr0.25Cr0.5Mn0.5O3 examinado en una atmósfera de metano, donde los resultados indican que este ánodo es estable tanto en aire como en combustible, mostrando aceptable actividad catalítica en la oxidación electroquímica. La densidad de potencia alcanzó los 200 mWcm-2 a 900°C22. Sin embargo, en otra investigación y al realizar más experimentos sobre el material La0.75Sr0.25Cr
1-x
Mn
x
O3 (x = 0.4, 0.5, 0.6) como potencial ánodo para celdas SOFC y bajo atmósfera de hidrógeno (H2) y ácido sulfhídrico (H2S), se observó baja resistencia al azufre y baja conductividad electrónica. La conductividad aumentó al incrementar el contenido de Mn en todo el rango de temperatura (500-900°C). La estructura cristalina cambió 1% en volumen de hexagonal (aire) a ortorrómbica (H2) en todas las composiciones. Se obtuvo resistencia de polarización anódica relativamente baja de solo 0.17
3.2. Cromitas con cerio (Ce), hierro (Fe), cobalto (Co), cobre (Cu), platino (Pt), paladio (Pd), rutenio (Ru), calcio (Ca) y titanio (Ti)
La primera fila de los metales de transición como Fe, Mn, Co y Ni tienen la capacidad de formar pares redox y vacancias de oxígeno que facilitan la transferencia de iones y electrones. Tal es el caso de la perovskita ortorrómbica La0.9Sr0.1Cr0.85Fe0.05Co0.05Ni0.05O3 que demostró ser eficiente en la oxidación de metano (56). Se han realizado otros esfuerzos para mejorar la conductividad electrónica. Por ejemplo, se ha empleado un compuesto de estructura perovskita conformado por Ce0.6Mn0.3Fe0.1O2 y La0.6Sr0.4Fe0.9Mn0.1O3 (CMF-LSFM) como ánodo para una celda SOFC que utilizó propano y butano como combustible, la cual proporcionó una densidad de potencia aproximada a 1 Wcm-2 a 800°C 57. Tal densidad se obtuvo como resultado de la reducción del sobrepotencial y resistencia en el ánodo. Además, luego de 50 horas de exposición y a partir de espectroscopia Raman, no se observó la formación de carbón sobre el ánodo al utilizar propano y butano como combustibles. Las pruebas de conductividad eléctrica se realizaron en aire y H2. Los resultados mostraron una mayor conductividad al utilizar aire
Algunos autores han trabajado perovskitas con rutenio (Ru) debido a que es un buen candidato para la catálisis del reformado y el cracking de hidrocarburos. Sin embargo, existe la posibilidad de sublimación del óxido RuO2. Para evitar pérdida de Ru, puede usarse la sinterización instantánea por microondas, tal es el caso del material La
1-x
Sr
x
Cr
1-y
Ru
y
O3-
Dentro de los materiales tipo perovskita con cromo, también se ha estudiado la adición de Ca y Ti, por ejemplo, el material La0.7Ca0.3Cr0.5Ti0.5O3. Uno de los aspectos más importantes en materiales para celdas SOFC es la compatibilidad de los componentes de la celda con el coeficiente de expansión térmico (TEC). Después de mediciones por dilatometría, se ha demostrado que el material La0.7Ca0.3Cr0.5Ti0.5O3 fue estable en ambientes redox. El TEC de los materiales La0.7Ca0.3Cr0.5Ti0.5O3 La0.7Ca0.3Cr0.5Ti0.5O3 y La0.7Ca0.3Cr0.8Ti0.2O3 fue de 10.1 × 10-6 K-1 y 11.1 × 10-6 K-1 respectivamente. En este caso la sustitución de cromo por titanio mantiene la estabilidad química, pero compromete la conductividad eléctrica. La conductividad eléctrica del compuesto La0.7Ca0.3Cr0.5Ti0.5O3 tuvo una variación de 2 × 10-4 a 2 × 10-2 S/cm, que es mucho menor a 0.1 S/cm, lo cual es requerido para un electrodo de celda SOFC 67. Existe una extensa variedad de materiales perovskita con titanio denominados titanatos, que, en este caso, los autores hemos considerado para publicaciones futuras.
3.3. Cromita La
x
Sr
1-x
Cr
y
Mn
1-y
Debido a las propiedades redox del par catiónico Mn+3/Mn+4 y a la cinética de reacción electroquímica, se considera que el manganeso (Mn), es un dopante más efectivo que el hierro (Fe), cobalto (Co) y níquel (Ni). Se ha comprobado un excelente rendimiento anódico al incrementar el dopado con Mn hasta en un 50%, tal es el caso del material La0.8Sr0.2Cr0.5Mn0.5
También se ha reportado que la densidad de potencia para el ánodo (La0.75Sr0.25) 0.9Cr0.5Mn0.5O3 en contacto con metano hidratado es de 0.2 Wcm-2 utilizando un voltaje de 0.5 V en 900°C 23. Este material de estructura romboédrica, mostró un valor de densidad de potencia mayor en hidrógeno hidratado comparado con 5%H2, con valores de 0.47 Wcm-2 y de 0.29 Wcm-2 a 900°C 22. En otro estudio, se reportó para el material anódico La0.75Sr0.25Cr0.5Mn0.5O3/YSZ que la adición de la fase YSZ mejoró notablemente la adhesión en el material y redujo la resistencia de polarización entre 2-3
Actualmente se ha demostrado la posibilidad de usar la perovskita (La0.75Sr0.25)0.9Cr0.5Mn0.5O3 directamente como ánodo y como cátodo, siendo un eficiente y estable material en condiciones redox. Con esta propiedad en particular, fue posible la fabricación de una SOFC simétrica utilizando la perovskita en ambos electrodos y lograr un buen rendimiento. El material LSCM es estable y conductor tanto en atmósfera reductora como oxidante, por lo tanto, la celda SOFC puede utilizarse de manera reversible. En este caso se alcanzó una densidad de potencia de hasta 230 mWcm-2 en una atmósfera de 5%H2, H2 hidratado y metano hidratado 73. En otra investigación también se comprobó que, de hecho, las celdas SOFC en base a perovskitas tipo La0.75Sr0.25Cr0.5Mn0.5
Sin embargo, a pesar de las buenas propiedades antes mencionadas, uno de los principales inconvenientes que presenta la perovskita LSCM, es su comportamiento tipo-p y la baja conductividad electrónica que presenta en el rango de 25.3-28.8 S cm-1 y hasta 1 S cm-1 en aire e hidrógeno (10%H2/N2) respectivamente, en un rango de temperatura de 300-800°C. Cabe resaltar que su energía de activación se encuentra entre 26.1 y 67.8 en aire e hidrógeno (10%H2/N2) respectivamente 74. Lo anterior implica que en estas condiciones el colector de corriente es un problema para una SOFC utilizando este tipo de ánodo. Para tratar de mitigar este problema, se ha impregnado la perovskita LSCM con Cu75, Ni75, Cu-Ni77 y Cu con Pt pulverizado en el material y así mejorar el colector de corriente 56. En este último caso la impregnación de Cu, para mejorar la conductividad del ánodo, así como el uso de una pequeña cantidad de platino sobre la superficie para incrementar la quimisorción, mejoró significativamente la densidad de potencia desde 450 mWcm-2 a 800°C hasta 520 mW cm-2 a 850°C, utilizando metano como combustible. Además, no se observó la deposición de carbono sobre la superficie. Sin embargo, la densidad de potencia se redujo drásticamente por debajo de los 750°C debido a la reducción del voltaje de circuito abierto (OCV). Con hidrógeno como combustible, se obtuvo una densidad de potencia de 525 mWcm-2 a 800°C y de 840 mWcm-2 a 850°C. A pesar de que tales pruebas confirman que el material puede utilizarse como conductor mixto iónico-electrónico en una celda SOFC, es necesario identificar un óxido que posea una cinética mayor respecto a la oxidación del combustible.
Cabe mencionar que la impregnación de pequeñas cantidades de paladio (Pd: 0.10-0.36 mg/cm2) en el ánodo La0.75Sr0.25Cr0.5Mn0.5
4. Conclusión
En este artículo se revisa el avance en el conocimiento de las cromitas de lantano de estructura perovskita como ánodos y con potencial aplicación en celdas de combustible de óxido sólido (SOFC). En términos generales, todavía hay mucho trabajo por hacer en el mejoramiento de propiedades, algunas tan importantes como la conductividad electrónica, densidad de potencia, coeficiente de expansión térmico (TEC) y la estabilidad en ambientes redox. A pesar de que la perovskita La
x
Sr
1-x
Cr
y
Mn
1-y
O











 text new page (beta)
text new page (beta)





