PACS: 81.07.-b; 81.16.Hc
1. Introducción
Los catalizadores ambientales desempeñan un papel cada vez más importante, debido al impacto que causan las emisiones de monóxido de carbono al aire. Por consiguiente, durante décadas se han desarrollado diferentes tecnologías para reducir las emisiones contaminantes con la finalidad de contribuir a la calidad de vida y lograr que estas sean económicamente rentables. La oxidación catalítica de CO a bajas temperaturas ha despertado un gran interés, debido a amplias aplicaciones, entre ellas, la limpieza de aire en interiores, la eliminación de trazas de CO, sensores de gas de CO, control de emisiones del automóvil, etc.,1,2,3,4.
El catalizador de paladio soportado se ha propuesto como una alternativa al tradicional convertidor catalítico de tres vías (TWC), ya que muestra una excelente actividad a temperaturas bajas en la reacción de oxidación de CO e hidrocarburos. Además, se caracteriza por tener resistencia a la sinterización térmica en comparación con los catalizadores de Pt y Rh soportados. Adicionalmente, el paladio tiene grandes ventajas económicas comparado con algunos metales nobles 5,6,7. Se han reportado varias investigaciones de paladio soportado en diferentes óxidos (CeO2, ZrO2, SiO2, Al2O3), obteniendo buenas conversiones de CO8,9,10,11. Esto se debe al tamaño de partícula del Pd, la morfología de superficie y la interacción de paladio-soporte; que promueven sitios activos en la interfaz (metal y óxido). Por otro lado, se ha reportado que el estado químico y la actividad de los catalizadores de paladio soportados, depende del tipo de soporte de óxido metálico y el proceso de preparación12. De esta manera, el soporte juega un rol importante al proporcionar un almacenamiento de oxígeno13,14,15,16,17.
El dióxido de titanio es considerado uno de los materiales más populares, por tener un rango amplio de aplicaciones en fotocatálisis, celdas solares, sensores, catálisis heterogénea, etc.,18. Es bien conocido que el TiO2 se encuentra en la naturaleza en tres formas cristalinas, las cuales son: anatasa (tetragonal), rutilo (tetragonal) y brookita (ortorrómbica). Cada estructura exhibe diferentes propiedades físicas y químicas19. Además, el TiO2 es conocido como un óxido metálico reducible que tiene fuertes interacciones con los metales nobles comparado con óxidos metálicos como SiO2, Al2O3 y MgO20,21. Sin embargo, las fases anatasa y rutilo del dióxido de titanio son ampliamente utilizadas por sus propiedades estructurales, físicas, químicas y superficiales, tales como: estabilidad térmica, densidad y la brecha energética22. Por lo tanto, los metales nobles soportados en dióxido de titanio, presentan excelentes propiedades físico-químicas y propiedades catalíticas, en sus diferentes formas cristalinas y tamaños de cristal, lo que los hace atractivos para la aplicación en muchas reacciones23,24,25,26.
En este trabajo se plantea el desarrollo de catalizadores de paladio en un soporte modificado de TiO2, utilizando baja carga de metal, tratando de tener estabilidad, desplazando la temperatura y evaluando la actividad catalítica por medio de la reacción de oxidación de CO a CO2. De igual forma, se realizó la caracterización por medio de XRD y TEM del catalizador que presentó el mejor desempeño con base en los resultados obtenidos en la evaluación catalítica.
2. Experimental
2.1. Preparación de los catalizadores
2.1.1. Preparación de los soportes de TiO2
En la preparación de los soportes, se utilizó la técnica de impregnación con cationes (butóxido de titanio (IV)) para generar rompimiento de enlaces en la superficie y la generación de posibles sitios vacantes. Suspendiendo 1.6 g de soporte (Aeroxide Degussa P-25, área superficial 50-15 m2/g, pH= 4.5) en 20 mL de agua desionizada. Se le agregó, lentamente, el 20% de precursor butóxido de titanio (IV) (97% Sigma-Aldrich), durante 12 - 14 horas con fuerte agitación y temperatura constante. Posteriormente, se dejó reposar durante 24 horas e inmediatamente se secó a 100°C por 12 horas.
2.1.2. Preparación de los catalizadores de paladio
Para la impregnación Pd en los soportes, previamente se preparó una disolución de Pd (NO3)2 .6H2O (Sigma-Aldrich) con una concentración de 4.2 x 10-3 M y 0.42 M de urea. Para obtener las concentraciones deseadas de ambas soluciones fue necesario disolver en agua desionizada la cantidad de Pd (NO3)2 6H2O y urea. El método de DPU consistió en colocar 0.3 g del soporte en una solución que contenía al precursor de Pd (Pd (NO3)2 6H2O y urea). La mezcla se sometió a agitación durante 20 horas. Después se separó el sólido por centrifugación, se secó a 150°C por 8 horas y se almacenó sin cuidados especiales.
2.2. Reacción de oxidación CO
La actividad catalítica en la reacción de oxidación de CO a CO2 se evaluó en un microreactor de lecho catalítico de cuarzo (
La prueba consistió en alimentar al microreactor un flujo de 20 mL/min una mezcla de concentración certificada (Praxair) al 1% de CO y 1% de O2 en balance con nitrógeno (v:v). El porcentaje de conversión en función de la temperatura de reacción se determinó según la Ec. (1):
Dónde:
%Conv co = porcentaje de conversión de CO a la temperatura de reacción T.
A 0= área cromatográfica del CO en ausencia de catalizador correspondiente a la concentración inicial.
A T = área cromatográfica del CO a la temperatura T en presencia de catalizador.
2.3. Caracterización
Las mediciones de difracción de Rayos X (XRD) fueron llevadas a cabo en un difractómetro de Rayos X, Bruker 08 Advance con un detector de ojo de lince. Las condiciones de operación que se utilizaron fueron: una radiación Cu-K
Las imágenes de microscopía electrónica de transmisión (TEM) se realizaron en un microscopio JEOL JEM-2010F FasTEM con un voltaje de aceleración de 200 kV y una resolución punto a punto de 0.19.
3. Resultados y discusión
3.1. Actividad catalítica
La actividad catalítica se realizó con la medición de la reacción de oxidación de CO a CO2 utilizando los catalizadores con diferentes cargas de paladio (1%, 1.5%, 2%, 2.5% y 3%). Los materiales se activaron en presencia de hidrógeno a 300°C en un lapso de 2 horas, como se mencionó anteriormente, en donde se llevó a cabo el proceso de reducción del precursor de paladio a paladio metálico, realizando, inmediatamente, las pruebas de actividad catalítica. En la Fig. 1, se observa el efecto de la actividad catalítica con las diferentes cargas de Pd, teniendo una conversión de CO a CO2 aproximadamente del 100% a temperaturas menores de los 160°C. Examinando la temperatura de conversión de CO al 50%, el orden de actividad de las diferentes cargas de paladio fue de la siguiente manera: 2% Pd
Los materiales con 2% y 2.5% de paladio mostraron una buena conversión y estabilidad, debido a que lograron desplazar la temperatura de conversión de monóxido de carbono, aproximadamente en su totalidad, a una temperatura de 110°C. Mientras que Li et al.27 reportaron una conversión del 100% de CO a la temperatura de 119°C con una carga de Pd 10% soportada en grafito, sin mostrar conversión a temperatura ambiente. Se le dio un seguimiento a estos dos catalizadores, midiendo la actividad catalítica cuatro veces más y dejando por periodos reposar el catalizador sin realizarle cuidados especiales. En la Fig. 2, muestra que se tiene una conversión de CO a CO2 a temperatura ambiente en los cuatro ciclos catalíticos de ambos materiales y conforme transcurre el tiempo, la actividad catalítica va disminuyendo. Se observa en el segundo ciclo catalítico de 2% de Pd que disminuye totalmente su actividad, teniendo una conversión del 50% de CO a una temperatura de 110°C y el 100% a los 137°C. Durante el tercer ciclo catalítico, se exhibe una mejoría en la respuesta, con una conversión del 50% a los 85°C y el 100% a los 125°C; el cuarto ciclo catalítico tuvo el 100% de conversión a esa misma temperatura. En cuanto al 2.5% de paladio nos muestra una buena estabilidad por días y la actividad catalítica va disminuyendo poco a poco. Como se observa en la Fig. 2, la conversión del 100% de CO a CO2 en el primero, segundo y tercer ciclo catalítico va de 123°C, 110 y 115°C, respectivamente. Hasta el cuarto ciclo catalítico el desplazamiento de temperatura es muy notorio con una conversión de CO de 50% a 112°C y el 93% a los 149°C, las causas posibles son por el desgaste del material o la sinterización térmica.
Se continuó el estudio al material de 2% de paladio y su respectiva caracterización estructural, por tener menor carga de metal y exhibir buena actividad catalítica. El primer día y a los cuarenta y siete días las curvas se sobreponen al 30% de CO (Fig. 3), teniendo el mismo comportamiento en la curva hasta la conversión total de CO a los 110°C. Como se mencionó anteriormente, el segundo ciclo catalítico muestra una caída en la actividad y una mejoría en el tercer ciclo catalítico, teniendo una diferencia de temperaturas de 12°C al 100% de CO. Una explicación es que las moléculas de CO se quimisorben en la superficie metálica para dar paso a la formación de las moléculas de CO2. Al formarse los enlaces químicos no se puede llevar a cabo la desorción, por lo que hasta realizar varias corridas de oxidación de CO, el catalizador muestra mejoría. Sin embargo,a los cuarenta y nueve días la conversión de CO al 100% es de 134°C, disminuye la actividad catalítica de esta manera. Como se observó la conversión total de CO a CO2 se lleva a cabo en un intervalo de 110°C a 137°C dentro de los 49 días, mostrando en todos los materiales respuesta de conversión a temperatura ambiente.
3.2. Caracterización XRD
El patrón de difracción obtenido de Pd/TiO2 con carga de 2% de paladio, muestra dos fases cristalinas del dióxido de titanio. En la Fig. 4 del catalizador Pd/TiO2, se observan los picos en
Los picos característicos del Pd no se observan en el patrón, de acuerdo con Li et al., los picos se pueden ver débilmente hasta una carga del 6% y son claros a partir de 10% de paladio, apareciendo en
3.3. TEM
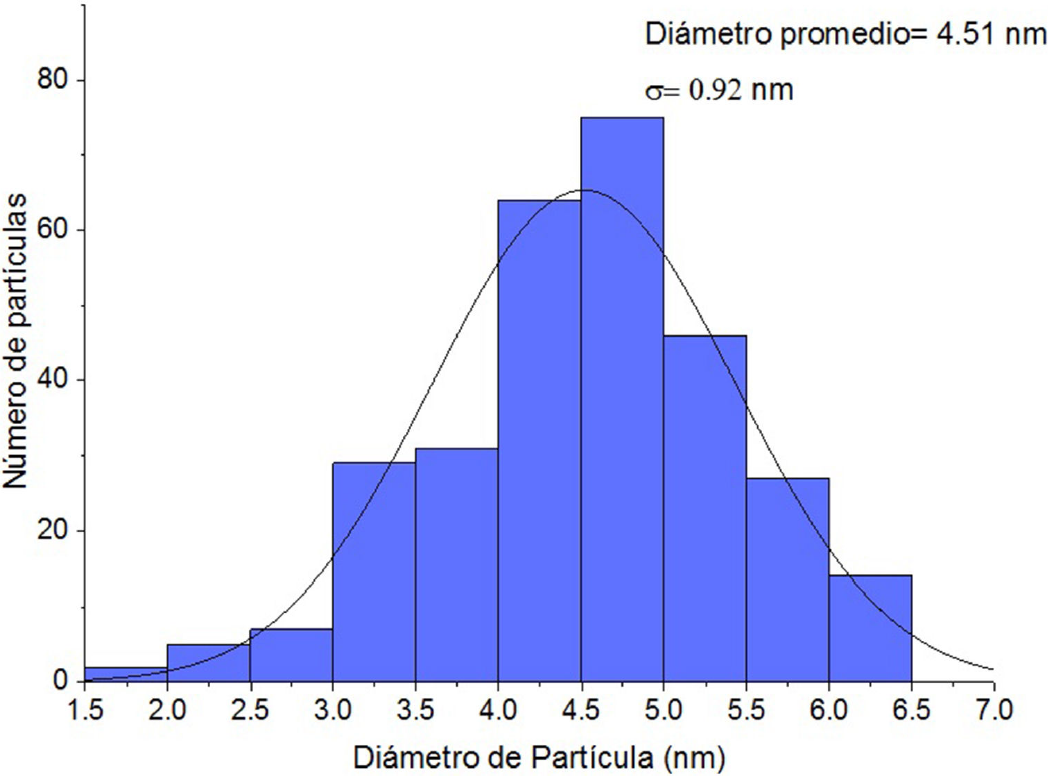
Las Figs. 6 a) y b) muestran las imágenes de TEM en contraste Z del catalizador de Pd/TiO2 con carga de 2% de Paladio, el cual fue activado con hidrógeno a 300°C. En las imágenes se muestra claramente que las especies de paladio presentan una morfología esférica. El diámetro promedio de las nanopartículas de paladio y la desviación estándar se determinó contando 300 partículas de paladio de diversas imágenes TEM como las representadas en las Figs. 6 a) y b). El diámetro promedio de las nanopartículas es de como lo indica la Fig. 7.
3.4. Influencia del soporte y contenido de paladio en la actividad
Ha sido documentado que el tamaño de las partículas metálicas es uno de los factores más importantes para determinar la actividad. Además, se ha reportado en diferentes investigaciones que el soporte afecta a la actividad catalítica de los catalizadores soportados. Como resultado, se ha señalado que la actividad de los catalizadores soportados depende críticamente de ambos29 y, con esto, se busca diseñar catalizadores con alto rendimiento, teniendo en cuenta la contribución significativa de los soportes30. De esta manera, los resultados obtenidos de la actividad catalítica de los soportes de Pd/TiO2, fueron favorables para la oxidación de CO y las diferentes cargas de metal presentan efectos en la actividad catalítica. En particular, el catalizador con 2% de paladio, como lo muestran los resultados de XRD y TEM, se encuentra en mayor proporción la fase anatasa y con nanopartículas de paladio de
Finalmente, para tener una explicación más detallada sobre el comportamiento de las especies en la superficie que se involucran en la reacción de oxidación de CO, se plantea realizar espectroscopía fotoelectrónica de rayos X (XPS); con el fin de conocer la variación de los estados de valencia de las especies de paladio en la superficie durante los diferentes pasos de las reacciones involucradas y así determinar las especies activas en la reacción de oxidación de CO. Sin embargo, se ha sostenido por varios investigadores que la especie activa del Pd es el paladio metálico y la reacción sigue el mecanismo de Langmuir-Hinshelwood31,32,33. Por otro lado, Luo y Zheng34 demostraron que el PdO es una especie activa del Pd para la oxidación de CO, a través de la observación del comportamiento redox de las especies de Pd en el catalizador PdO/Ce0.5Zr0.5O2. Aunque, otros investigadores sugieren el Pd y PdO son especies activas de Pd en la superficie35,36,37 y, Kulshreshtha y Gadgil38 señalaron que la formación de una cierta cantidad de especies PdOx no estequiométrica durante la reacción es útil para la oxidación de la reacción CO.
4. Conclusiones
La modificación del soporte comercial (Aeroxide Degussa P-25) y las bajas cargas de paladio con la técnica DPU, crean una fuerte afinidad en la interfase nanopartícula-soporte. En la evaluación de la actividad catalítica, mediante la reacción de oxidación de CO a CO2, los catalizadores mostraron excelentes resultados desplazando la temperatura en la que el convertidor catalítico de tres vías lleva a cabo por completo la reacción de oxidación de CO. Además, de que los cinco materiales presentaron actividad a temperatura ambiente. El catalizador con mejor desempeño catalítico y estabilidad fue el de 2% de paladio en un periodo de cuarenta y nueve días, con una conversión de CO al 100% a la temperatura de 110°C, mostrando que partículas pequeñas de metal aumentan el área superficial y, como consecuencia, hay una mejor dispersión del paladio en el soporte, evitando especies de mayor tamaño39. En los materiales de 2% y 2.5% se llegó a la saturación de la superficie del soporte, con esto el intercambio entre las moléculas adsorbidas y desorbidas es mínimo, haciendo que la curva de conversión de CO se mantenga constante. En el catalizador con 2.5% de paladio, se observó que con el paso del tiempo su actividad catalítica cae, encontrando como posibles explicaciones el desgaste de material o sinterización térmica que sufre el material.











 nueva página del texto (beta)
nueva página del texto (beta)