Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de investigación clínica
versión On-line ISSN 2564-8896versión impresa ISSN 0034-8376
Rev. invest. clín. vol.59 no.1 Ciudad de México ene./feb. 2007
Artículo original
Evaluación del sistema antioxidante en el semen normal
Evaluation of antioxidant system in normal semen
Juan M. Gallardo*
* Unidad de Investigación Médica en Enfermedades Nefrológicas. UMAE–Hospital de Especialidades. Centro Médico Nacional Siglo XXI, IMSS
Reimpresos:
Dr. Juan Manuel Gallardo–Montoya
Calle Barranquilla 139–303
Col. Lindavista,
07300, México, D.F.
Tel. y facsímil: (01 55) 5627–6900 Ext. 21371 (Laboratorio) Tel. celular: 044 55 1648–9902
Correo electrónico: jmgallardo@salud.gob.mx
Recibido: el 5 de junio de 2006.
Aceptado: el 12 de octubre de 2006.
ABSTRACT
Background. Reactive oxygen species (ROS) formation have the ability to alter reversibly or irreversibly the cellular function in humans. It has been proposed that the ROS alters the biochemistry and the physiology of the sperm. On the other hand, the antioxidative mechanisms could protect the sperms from the damage produced by free radicals.
Aim. To determine the normal values for superoxide dismutase (SOD), glutathione peroxidase (GPx), malondialdehyde (MDA) and nitric oxide (NOx) in the seminal liquid of healthy humans.
Procedures. Semen samples from 45 healthy men (22 to 47 years of age) were studied. The samples were obtained by masturbation and were collected in conical sterile tubes. Once centrifuged at 4 °C they were divided in aliquots to measure the concentration of SOD, GPx, MDA, and NOx. The analysis of the samples was realized in conformity with biochemical widely accepted methods.
Results. The concentrations of SOD and MDA both in the seminal liquid and in the spermatozoids were similar, SOD 0.43 ± 0.09 U/mg prot. in the seminal liquid and 0.45 ± 0.07 U/ mg prot. in spermatozoids, and MDA 0.33 ± 0.07 nmoles/mg prot. and 0.37 ± 0.10 nmoles/mg prot. in the seminal liquid and spermatozoids respectively. With regard to GPx it increased almost 13 times more in the spermatozoids (2547.77 ± 48.59 U/mg prot.) than in the seminal liquid (197.54 ± 25.21 U/mg prot.). The NOx also increased lightly in the spermatozoids (4.45 ± 0.43 \imol) when compared with the seminal liquid (3.91 ± 0.16 \imol).
Conclusions. The measurement of the antioxidative and oxidative agents could serve to evaluate human infertility in those cases where the result of the spematobioscopy appears normal.
Key words. Semen. Spermatozoa. Oxidative stress. Antioxidants. Healthy humans.
RESUMEN
Antecedentes. Las especies reactivas del oxígeno (ERO), tienen la capacidad de alterar reversible o irreversiblemente la función celular. Se ha propuesto que las ERO modifican la bioquímica y la fisiología del espermatozoide. Por otro lado, los mecanismos antioxidativos pudieran proteger a los espermatozoides del daño producido por las ERO.
Objetivo. Determinar los valores normales para el superóxido dismutasa (SOD), glutatión peroxidasa (GPx), malondialdehído (MDA) y óxido nítrico (NOx) en el líquido seminal y espermatozoides de humanos sanos.
Procedimientos. Se estudiaron 45 muestras de semen de sujetos aparentemente sanos. Las muestras se obtuvieron por masturbación y se colectaron en tubos estériles. Una vez centrifugadas, se fraccionaron en alícuotas para medir la concentración de SOD, GPx, MDA y NOx. El análisis de las muestras se realizó conforme a métodos bioquímicos ampliamente aceptados.
Resultados. Las concentraciones de SOD y MDA en el líquido seminal como en los espermatozoides fueron similares (SOD 0.43 ± 0.09 en semen y 0.45 ± .07 U/mg prot. en espermatozoides, y MDA 0.33 ± .07 y 0.37 ± 0.10 nmoles/mg prot. en líquido seminal y espermatozoides, respectivamente. Con respecto a la GPx, está aumentada casi 13 veces más en los espermatozoides (2547.77 ± 48.59 U/mg prot.) que en el líquido seminal (197.54 ± 25.21 U/mg prot.), el NOx también se incrementa ligeramente en los espermatozoides (4.45 ± 0.43 µmol) cuando se compara con el líquido seminal (3.91 ± 0.16 µmol).
Conclusiones. La medición de los antioxidantes y oxidantes pudieran servir para evaluar la infertilidad humana en aquellos casos donde los resultados de la espermatobioscopia aparezcan como normales.
Palabras clave. Semen. Espermatozoides. Estrés oxidativo. Antioxidantes. Humanos sanos.
INTRODUCCIÓN
El medio en que se desenvuelven los espermatozoides es vital para su supervivencia permitiendo mantener un pH óptimo, aportándoles nutrientes y regulando la homeostasis seminal. Sin embargo, cuando ese ambiente es alterado se presentan cambios en su capacidad para fecundar. Se ha propuesto que en los pacientes con infertilidad primaria o secundaria, en presencia de espermatozoides anatómicamente normales, pudieran existir alteraciones bioquímicas en el líquido seminal.1 Entre los factores que podrían afectar a las células germinativas están las especies reactivas de oxígeno (ERO) que pueden alterar, reversible o irreversiblemente, al espermatozoide.
El incremento en el estrés oxidativo es un desbalance entre la producción y la remoción de las ERO, que conduce a un aumento en la concentración de radicales libres (RL) y en consecuencia al aumento en el daño celular. Algunos autores2,3 han demostrado la asociación entre el estrés oxidativo y la función espermática. Las ERO en el semen completo son generadas en parte por el espermatozoide.1,4 Aunque las ERO desempeñan un papel importante en la capacitación espermática,5 lo que es reforzado por los mecanismos de defensa enzimáticos y no enzimáticos, se ha propuesto que la infertilidad pudiera ser el resultado del incremento en la producción de las ERO o del decremento en las defensas.6,7 Es por ello que se vuelve importante conocer cuáles son los valores que se utilizarán como referencia para cada población en los agentes antioxidantes y oxidantes que actúan sobre los espermatozoides. Los espermatozoides, como casi todas las células del organismo, experimentan daño en presencia de las ERO con un posible efecto en la disminución de la movilidad, lo que explica una hipofertilidad primaria masculina.8
El propósito de este trabajo es el de conocer los valores en sujetos aparentemente sanos para superóxido dismutasa (SOD), glutatión peroxidasa (GPx), malondialdehído (MDA) y óxido nítrico (NOx) en las células espermáticas y en el líquido seminal.
PARTICIPANTES Y MÉTODOS
Cuarenta y cinco sujetos aparentemente sanos, con paternidad probada, de edades entre 23 y 47 (33.4 ± 6.6 DE) años de edad, accedieron a participar voluntariamente (firmando una carta de aceptación de participación en este estudio). Las características sociodemográficas de todos ellos fueron similares. Todos los participantes se encontraban en buen estado de salud, no fumadores o bebedores consuetudinarios, sin consumo de ninguna clase de medicamento en los dos últimos meses ni padecimiento de enfermedades metabólicas agudas o crónicas. Asimismo negaron tener o haber tenido infecciones urogenitales al menos desde la adolescencia y hasta el momento de obtener las muestras. Todos eran padres de al menos un hijo también aparentemente sano.
Sus signos vitales (frecuencia y ritmo cardiaco, temperatura y presión arterial) medidas el mismo día y antes de la obtención de la muestra, se encontraban dentro de rangos normales.
Con el propósito de evitar variaciones circadianas se les solicitó a los participantes que donaran una muestra de semen obtenida entre las 8 y 10 de mañana. La muestra de semen se obtuvo mediante masturbación sin el empleo de ningún tipo de lubricante y con al menos tres días de abstinencia eyaculatoria. Fue recolectada en un tubo cónico estéril de polipropileno de 50 mL para centrifugación de boca ancha (Continental Lab Products, San Diego, CA. USA). Las muestras con parámetros anormales (licuefacción tardía, presencia de eritrocitos o leucocitos mayores a 1 x 106) fueron descartadas.
Una vez obtenida la muestra de semen se fraccionó en dos partes, una para la realización del espermiograma y otra para la medición de las pruebas bioquímicas. El espermiograma se efectuó conforme a los criterios de la OMS,8 fue normal en todos los sujetos estudiados con dos excepciones (uno con anormalidades en el espermiograma [hipospermia]), y el segundo por presentar hematospermia microscópica.
La muestra de semen para las determinaciones bioquímicas se mantuvo a 4 °C, y posteriormente se centrifugó a 100 x g, durante 15 min. Se corroboró la pureza del sobrenadante y la concentración del precipitado mediante microscopía de luz. Tanto el sobrenadante (líquido seminal) como el precipitado (espermatozoides) se utilizaron para las determinaciones bioquímicas. Los espermatozoides fueron ho–mogeneizados utilizando un homogenizador manual eléctrico (Dremel) con un pistilo de teflón y mortero de cristal (Heaton). La solución amortiguadora de homogeneización contenía manitol, sacarosa y EDTA en PBS a pH 7.4 y al final se añadió Triton X–100 al 0.1% (todos los reactivos fueron de Sigma Chemicals, St. Louis, MO. USA, excepto cuando se indique otro origen) y tras una rápida centrifugación a 4 °C y 7000 x g se recuperó el sobrenadante. Una vez obtenidas las alícuotas de ambas fracciones se cuantificaron la superóxido dismutasa (SOD, E.C.I.15.1.1.), glutatión peroxidasa (GSH–Px, E.C.1.11.1.9), óxido nítrico (NOx), y malondialdehído (MDA).
Procedimientos de laboratorio
• Movilidad espermática. La movilidad espermática se basó en la clasificación sugerida por la OMS siendo el valor normal de 14 µm/s:8 Grado 1, espermatozoides estáticos; grado 2, movimiento lento; grado 3, movilidad mediana y grado 4, movilidad rápida. La proporción de movilidad se calculó sumando los grados 3 y 4.
• Vitalidad espermática. Con el propósito de determinar la vitalidad espermática se utilizó el método de la exclusión de la eosina descrito por Marmor y Grob–Menéndez9 utilizando la variante de eosina–nigrosina, para lo cual se añadieron 50 µL de esos colorantes a una dilución 1:2 de semen en PBS. Tras agitarse suavemente por unos segundos, se recuperaron 50 µL de la mezcla y se extendieron sobre un portaobjetos. Tras la incubación a 37 °C durante 30 min., se fijó la preparación y se cuantificaron los espermatozoides que excluían a la eosina. A éstos se les consideró vivos en el momento de la fijación. Los muertos exhiben una coloración rosada al no excluir a la eosina. Se contabilizaron 100 espermatozoides a lOOx.
• Determinación de leucocitos. La cuantificación de los leucocitos se midió utilizando el procedimiento para la cuantificación de células peroxidasa positivas10,11 el cual consiste en la utilización de una solución de benzidina (Sigma) al 0.012% y peróxido de hidrógeno (High Purity) al 0.038% diluidos en etanol (High Purity) al 50% en agua bidestilada. A 20 µL de la solución anterior se le añadieron 20 µL de semen, se colocaron en un hemocitómetro, y se contaron las células que adquirieron una tonalidad café oscuro (células peroxidasa positivas). El número de células peroxidasa positivas se expresa en mL de semen.
• Medición de la proteína total. La medición de las proteínas en el líquido seminal y espermatozoides se basó en el método de Bradford12 utilizando el azul de Coomassie G–250 (Amresco, Solon, OH. USA) como colorante. Para la curva de calibración se utilizó albúmina bovina fracción V (BSA) como estándar.
• Determinación de superóxido dismutasa (SOD). La SOD se determinó con base en el método de Marklund y Marklund.13 El radical anió–nico superóxido participa en la autoxidación del pirogalol. Para ello se preparó una solución de pirogalol en HC1 (JT Baker, Xalostoc, Mex. México) y se incubó a 40 °C. A 50 µL de muestra se le añadió 200 µL de una mezcla de Tris–EDTA–HC1 y se leyó a 420 nm en un espectrofotómetro DU 50 (Beckman, Palo Alto, CA. USA). Posteriormente se añadió la solución de pirogalol y se volvió a medir el incremento en la absorbencia cada 30 segundos durante 3 min. El blanco de reactivos se realizó de la misma manera pero en lugar de muestra se utilizó agua bidestilada. La actividad de la SOD se expresa en U/mg de proteína.
• Medición de la actividad de la glutatión peroxidasa (GSH–Px). La actividad de la glutatión peroxidasa se analizó mediante el método de Beutler, et al.14 GSH–Px se encarga de degradar al ter–butil–hidroperóxido (t–BOOH) en presencia de GSH que es consumido. El GSH remanente es medido con el 5,5' ditiobis–(2–ácido nitrobenzoico) (DTNB). La mezcla de reacción contiene 1 mL de GSH (Amresco) 2 mmol en PBS 400 mmol (pH 7.0), EDTA 4 mnol, 0.5% de azida de sodio 1 mmol, 250 µL de líquido seminal o espermatozoides y agua bidestilada para aforar a 4 mL. Tras la incubación a 37 °C durante cinco minutos, se añadió 1 mL de T–BOOH 1.25 mmol precalentado y se volvió a incubar por cuatro minutos más. Al final de ese periodo se recuperó 1 mL y se le añadieron 4 mL de ácido fosfórico (High Purity de México), se centrifugó a temperatura ambiente, y a 2000 x g durante 10 minutos. Se recuperaron 2 mL del sobrenadante y se le añadió 2 mL de Na2HPO4 400 mmol y 1 mL del reactivo de DTNB. La absorbencia se midió a 412 nm. Los blancos y los estándares se prepararon de manera similar. La actividad de GSH–Px se expresó como U/mg de proteína.
• Determinación de la producción de óxido nítrico (NOx). La medición de NOx se realizó mediante la determinación de la cantidad total de nitritos (NO2-), que son los productos estables del metabolismo de NO en el líquido seminal. Se utilizó el reactivo de Griess (solución acuosa de sulfanilamida al 1% y naftilenetilendiamina al 0.1% en H3PO4 (al 2.5%, JT Baker), el cual forma un cromóforo estable con NO2-, y que absorbe a 546 nm.15 La curva de calibración se hizo con diferentes concentraciones de nitrito de sodio disuelto en NaCl al 0.9%.
• Determinación de la peroxidación lipídica (MDA). El malondialdehído es el producto final de la peroxidación de los ácidos grasos y un marcador de la actividad de los radicales libres. Para la medición de la concentración de peroxidación lipídica en espermatozoides se utilizó el método del ácido tiobarbitúrico (TBA) descrito por Wade y van Rij.16 Aunque el TBA no sólo se limita a la medición del MDA, es el método más empleado para determinar la oxidación lipídica y por lo tanto el estrés oxidativo. En resumen, a 2 x 107 células espermáticas se les añadieron 200 µL de ácido tricloroacético al 25%, y se incubaron a 4 °C durante 15 minutos, posteriormente se centrifugó a 4 °C, 5000 x g durante 3 min, y el sobrenadante (100 µL) fue neutralizado con NaOH (JT Baker) 4 M. A 1 mL de la solución anterior se le adicionó 1 mL de TBA (Acros Organics, Bélgica) al 0.7 % y se incubó a 90 °C durante 60 min. La reacción de color se midió espectrofotométricamente (532 nm) en la fase orgánica (1–butanol). Se utilizó al tetrame–toxipropano como estándar. La concentración de MDA (medido como sustancias reactivas al ácido tiobarbitúrico, TBAR) se calculó como µmol/L.
• Análisis estadístico. El análisis estadístico, media, desviación estándar y prueba de t de Student se realizó utilizando el programa de cómputo Instat (V 2.03, GraphPad Software, San Diego, CA. USA). Se consideró como estadísticamente significativo al valor de P < 0.05.
RESULTADOS
En este estudio sólo se incluyeron las muestras seminales normales, con al menos un volumen de 2 mL, una concentración de 20 x 106 espermatozoides/mL o mayor, una movilidad de 50% o más, y aspecto morfológico normal del espermatozoide del 30% o más siguiendo los criterios de la OMS.8
En todas las muestras estudiadas, no se encontraron leucocitos (menos de 0.8 x 106) de tal forma que pudieran alterar las mediciones en los marcadores de oxidación o antioxidación.
En el cuadro 1 se muestran la media y la desviación estándar de las características de los sujetos que participaron en este estudio. Se observó homogeneidad entre edad, estatura, peso y presiones arteriales. En la exploración física todos los sujetos se encontraban en aparente buen estado de salud, bien hidratado y nutrido.

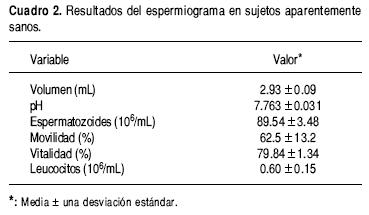
En el cuadro 2 se presentan la media y desviación estándar del volumen, pH, densidad, vitalidad y movilidad espermáticas. Los valores de tales mediciones se encuentran dentro de lo que se considera normal.8
Las concentraciones de SOD y MDA tanto en el líquido seminal como en los espermatozoides fueron similares, SOD 0.43 ± 0.09 U/mg prot. en líquido seminal y 0.45 ± 0.07 U/mg prot. en espermatozoides, y MDA 0.33 ± 0.07 nmoles/mg prot. y 0.37 ± 0.10 nmoles/mg prot. en líquido seminal y espermatozoides, respectivamente. Con respecto a la GPx, está aumentada casi 13 veces más en los espermatozoides (2547.77 ± 48.59 U/ mg prot.) que en el líquido seminal (197.54 ± 25.21 U/mg prot.). El NOx también se incrementa ligeramente en los espermatozoides (4.45 ± 0.43 µmol) cuando se compara con el líquido seminal (3.91 ± 0.16 µmol) (Cuadro 3).
DISCUSIÓN
Aunque existe una gran cantidad de estudios sobre el efecto de los pro y antioxidantes en el plasma de los humanos sanos, se ha explorado poco en otros fluidos biológicos. El papel de las ERO y los antioxidantes en el semen está en estudio por diversos investigadores, particularmente por los grupos dedicados al estudio de la fertilidad humana. Sin embargo, no encontré ningún estudio efectuado en humanos sanos en Latinoamérica.
En este trabajo se han examinado pacientes con fertilidad probada, varios investigadores20,21,23,24 durante los últimos años, han propuesto que el estrés oxidativo es uno de los mediadores responsables de la disfunción espermática debido a una elevada cantidad de leucocitos en el semen, en este trabajo ninguna de las muestras estudiadas presentó leucocitos en número tal que podría estar modificando los valores de los marcadores analizados.
Se ha demostrado que las células germinativas son capaces de producir por ellas mismas sustancias como el óxido nítrico, peróxido de hidrógeno, anión superóxido y radicales hidroxilos.17–19 También se ha propuesto que la infertilidad primaria, en algunos sujetos, se debe a cambios importantes en el balance oxidativo del semen. Iwasaki y Gagnon20 mencionan que las ERO se encuentran alteradas en 40% de los hombres con infertilidad en tanto que Agarwal, et al.3 señalan que es en 25%. Sin embargo, las ERO son también necesarias para mantener la homeostasis en el organismo. Las ERO son necesarias para conservar la fisiología normal del espermatozoide, tales como hiperactivación, capacitación y reacción acrosomal.21
En este trabajo se presentan los resultados de algunos marcadores de oxidación–antioxidación en el semen de sujetos aparentemente sanos. La justificación para este trabajo se basa en que, en condiciones normales, existe un equilibrio entre la producción de radicales libres y la producción de agentes antioxidantes en el tracto reproductivo del humano, lo que sugiere que tanto las sustancias oxidantes como antioxidantes juegan un papel importante en la función espermática como la capacitación, la reacción acrosomal y la fusión del espermatozoide con el óvulo.22 Se ha sugerido que las concentraciones elevadas de las ERO resultan en la destrucción de la capacidad antioxidativa de los espermatozoides y del líquido seminal, lo que causa el llamado estrés oxidativo.7 También se ha demostrado que el elevado contenido de ácidos grasos polinsaturados de las membranas plasmáticas de los espermatozoides es muy susceptible de sufrir lipoperoxidación.23,24
Existe evidencia experimental donde se demuestra que el daño oxidativo juega un importante papel en las membranas de los espermatozoides en animales de laboratorio y en el humano, y que pudiera ser causa o al menos ser parte de la infertilidad masculina. El malondialdehído (MDA) es un producto final estable de la peroxidación lipídica y por lo tanto puede ser utilizado como un marcador indirecto de la acumulación de peróxidos lipidíeos.25,26 Se ha demostrado que las ERO inducen apoptosis en los espermatozoides27,29 y aceleran la muerte por apoptosis en la criptorquidia.30
Con base en los antecedentes bibliográficos y con los resultados de este trabajo se puede justificar que se soliciten las mediciones de superóxido dismutasa, glutatión peroxidasa, malondialdehído y óxido nítrico en el semen de sujetos con hipofertilidad primaria o secundaria. Tal vez con una terapéutica antioxidante se mejore la capacidad fecundante del semen de los pacientes con este tipo de alteraciones.
AGRADECIMIENTOS
Agradezco al Dr. Edmundo Llamas Alba, de la Facultad de Medicina de la UASL, la revisión crítica del manuscrito, así como sus valiosos comentarios. Este trabajo se realizó parcialmente con el apoyo económico del Instituto Mexicano del Seguro Social (FP–2004/026).
REFERENCIAS
1. Zini A, DeLamirande E, Gagnon C. Reactive oxygen species in semen of infertile patients: levels of superoxide dismutase and catalase – like activities in seminal plasma and spermatozoa. Int J Androl 1993; 16: 183–8. [ Links ]
2. Aitken J. A free radical theory of male infertility. J Reprod Fertil Rev 1994; 6: 19–24. [ Links ]
3. Agarwal A, Ikemoto Y, Loughlin KR. Relationship of sperm parameters with levels of reactive oxygen species in semen specimens. J Urol 1994; 152: 107–10. [ Links ]
4. Weese D, Peaster M, Kyle K, Leach G, Zimmern P. Stimulated reactive oxygen species generation in the spermatozoa of infertile men. J Urol 1993; 149: 64–7. [ Links ]
5. Aitken J, Fisher H. Reactive oxygen species generation and human spermatozoa: the balance of benefit and risk. Bioassays 1994; 16: 259–67. [ Links ]
6. Thiele J, Freisleben H, Fuchs J, Ochsendorf F. Ascorbic acid and urate in human seminal plasma: determination and interrelationships with chemiluminiscence in washed semen. Hum Reprod 1995; 10: 110–15. [ Links ]
7. Lewis SE, Boyle PM, McKinney KA, Young IS, Thompson W. Total antioxidant capacity of seminal plasma is different in fertile and infertile men. Fertil Steril 1995; 64: 868–70. [ Links ]
8. World Health Organization. WHO Laboratory Manual for the Examination of Human Semen and Semen–Cervical Mucus Interaction. Cambridge, UK: Cambridge University Press; 1994. [ Links ]
9. Marmor D, Grob–Menendez F. Male infertility due to asthenozoospermia and flagellar anomaly: detection in routine semen analysis. Int J Androl 1991; 14: 108–16. [ Links ]
10. Politch JA, Wolff H, Hill JA, Anderson DJ. Comparison of methods to enumerate white blood cells in semen. Fertil Steril 1993; 60: 372–5. [ Links ]
11. Wolff H, Panhans A, Zebhauser M, Meurer M. Comparison of three methods to detect white blood cells in semen: leukocyte esterase dipstick test, granulocyte elastase enzyme immunoassay and peroxidase cytochemistry. Fertil Steril 1992; 58: 1260–2. [ Links ]
12. Bradford MM. A rapid sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein dye–binding. Anal Biochem 1976; 72: 248–54. [ Links ]
13. Marklund S, Marklund G. Involvement of the superoxide anion radical in the autoxidation of pyrogallol and a convenient assay for superoxide dismutase. Eur J Biochem 1974; 47(Suppl 3): 469–74. [ Links ]
14. Beutler E, Duron O, Mikus B. Improved method for determination of blood glutathione. J Lab Clin Med 1963; 61: 882–8. [ Links ]
15. Green LC, Wagner DA, Glogowski J, Skipper PL, Wishnok JS, Tannenbaum SR. Analysis of nitrite, nitrate and [15N] nitrate in biological fluids. Anal Biochem 1982; 126: 131–8. [ Links ]
16. Wade CR, van Rij AM. Plasma thiobarbituric acid reactivity: Reaction conditions and the role of iron, antioxidants and lipid peroxy radicals on the quantitation of plasma lipid peroxides. Life Sci 1988; 43: 1085–93. [ Links ]
17. Sharma RK, Agarwal A. Role of reactive oxygen species in male infertility. Urology 1996; 48: 835–50. [ Links ]
18. Aitken RJ, Clarkson JS, Fishel S. Generation of reactive oxygen species, lipid peroxidation and human sperm function. Biol Reprod 1989; 41: 183–97. [ Links ]
19. Aitken RJ, Buckingham D, Harkiss D. Use of xanthine oxidase free radical generating system to investigate the cytotoxic effects of reactive oxygen species on human spermatozoa. J Reprod Fertil 1993; 97: 441–50. [ Links ]
20. Iwasaki A, Gagnon C. Formation of reactive oxygen species in spermatozoa of infertile patients. Fertil Steril 1992; 57: 409–16. [ Links ]
21. De Lamirande E, Gagnon C. Human sperm hyperactivation in whole semen and its association with low superoxide scavenging capacity in seminal plasma. Fertil Steril 1993; 59: 1291–95. [ Links ]
22. Griveau JF, Le Lannou D. Reactive oxygen species and human spermatozoa: physiology and pathology. Int J Androl 1997; 20: 61–9. [ Links ]
23. Sikka SC, Rajasekaran M, Hellstrom WJ. Role of oxidative stress and antioxidants in male infertility. J Androl 1995; 16: 464–81. [ Links ]
24. Aitken RJ. Free radicals, lipid peroxidation and sperm function. Reprod Fertil Dev 1995; 7: 659–68. [ Links ]
25. Hellstrom WJ, Bell M, Wang R, Sikka SC. Effect of sodium nitroprusside on sperm motility, viability, and lipid peroxidation. Fertil Steril 1994; 61: 1117–22. [ Links ]
26. Bell M, Sikka S, Rajasekaran M, Hellstrom W. Time course of hydrogen peroxide induced changes in the lipid peroxidation of human sperm membranes. Adv Contracept Deliv Syst 1992; 8: 144–50. [ Links ]
27. Hockenbery DM, Oltvai ZN, Yin XM, Milliman CL, Korsmeyer SJ. Bc1–2 functions in an antioxidant pathway to prevent apoptosis. Cell 1993; 75: 241–51. [ Links ]
28. Forrest VJ, Kang YH, McClain DE, Robinson DH, Ramakrishnan N. Oxidative stress–induced apoptosis prevented by Trolox. Free Radie Biol Med 1994; 16: 675–84. [ Links ]
29. Ikeda M, Kodama H, Fukuda J, Shimizu Y, Murata M, Kumagai J, et al. Role of radical oxygen species in rat testicular germ cell apoptosis induced by heat stress. Biol Reprod 1999; 61: 393–9. [ Links ]
30. Shikone T, Billig H, Hsueh AJ. Experimentally induced cryptorchidism increases apoptosis in rat testis. Biol Reprod 1994; 51: 865–72. [ Links ]














