Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de investigación clínica
versión On-line ISSN 2564-8896versión impresa ISSN 0034-8376
Rev. invest. clín. vol.58 no.5 Ciudad de México sep./oct. 2006
Artículo de revisión
Células troncales mesenquimales: historia, biología y aplicación clínica
Mesenchymal stem cell; history, biology and clinical application
Eugenia Flores–Figueroa,* Juan José Montesinos,* Héctor Mayani*
* Laboratorio de Hematopoyesis y Células Troncales, Unidad de Investigación Médica en Enfermedades Oncológicas, Hospital de Oncología, Centro Médico Nacional Siglo XXI, IMSS
Reimpresos:
Dra. Eugenia Flores–Figueroa
Plaza Mayor 12 Lomas Verdes III
53120. Naucalpan, Estado de México.
Tel: 55 56276900, Ext. 22702 y 22705
Correo electrónico: eugenia.flores@imss.gob.mx
Recibido el 7 de septiembre de 2005.
Aceptado el 26 de abril de 2006.
ABSTRACT
In the last years, stem cells have drawn the attention of various sectors of society for many reasons. From the basic point of view, stem cells represent an ideal model to study cell differentiation and self–renewal mechanisms. However, their potential in cell therapy and regenerative medicine has triggered the increasing amount of knowledge in this area. Mesenchymal stem cells belong to the select group of adult stem cells. They have differentiation potential towards mesenchymal tissues such as bone, cartilage, stroma and fat. Recently, both in vivo and in vitro reports have shown a greater plasticity of mesenchymal stem cells, showing not only a mesenchymal cell fate but also those leading to endothelial, nervous and muscular lineages. For these reasons, the study of mesenchymal stem cells has gained great interest and many articles have been published. In the present review, we have presented a global vision of this topic, including its history, biologic features, sources, isolation methods and an overview on their clinical application.
Key words. Mesenchimal stem cell. Plasticity. Stroma. Cellulatherapy.
RESUMEN
En los últimos años, el tema de las células troncales o células madre ha llamado la atención a varios sectores de la sociedad por diversas razones. Desde el punto de vista básico, constituyen un inmejorable modelo para estudiar los mecanismos de diferenciación y autorrenovación celular. Sin embargo, es sin duda, su potencial en la terapia celular y la medicina regenerativa lo que ha disparado la generación de estudios y conocimientos sobre este tema. Las células troncales mesenquimales pertenecen al selecto grupo de células troncales de tejido adulto. Poseen un gran potencial de diferenciación a diversos tejidos mesenquimales, como hueso, cartílago, estroma y tejido graso. Reportes recientes, tanto in vitro como in vivo han demostrado una mayor plasticidad celular, ya que son capaces de originar células endoteliales, musculares e incluso células neuronales. Es por esto que el estudio de las células troncales mesenquimales ha cobrado un gran interés y ha generado una gran cantidad de información. En este trabajo de revisión se presenta una visión global sobre ellas, abarcando su historia, métodos de obtención, características biológicas, fuentes de obtención y aplicación clínica.
Palabras clave. Células troncales mesenquimales. Plasticidad. Estroma. Terapia celular. Células madre.
INTRODUCCIÓN
Las células troncales son un grupo específico de células indiferenciadas que tienen un potencial proliferativo elevado y que presentan dos características fundamentales: son capaces de autorrenovarse, es decir, de formar células idénticas a las células de origen, y tienen la capacidad de generar uno o más tipos celulares que desempeñan funciones especializadas en el organismo.1 Dependiendo de su origen, las células troncales pueden dividirse en células troncales embrionarias y somáticas. Las células troncales embrionarias (CTE) son células pluripotenciales, es decir, cada una de ellas es capaz de generar todos los tipos celulares del organismo. Por su parte, las células troncales somáticas son, en su mayoría, multipotenciales ya que pueden generar una gran variedad de tipos celulares dentro de un tejido específico.1
El estudio de las CTE humanas se ha visto interrumpido en muchos países por la enorme controversia ética que representan, al ser generadas a partir de los primeros estadios del desarrollo embrionario.2 Por otra parte, en los últimos años, ha crecido notablemente el interés en las células troncales somáticas de múltiples tejidos humanos, ya que además de ser de enorme interés biológico, éstas no representan ningún reto ético y muchas veces se obtienen de tejidos que son desechados, como la placenta o la sangre de cordón umbilical. En la actualidad, el estudio de las células troncales ha estado enfocado tanto a la generación de conocimientos básicos sobre su biología, como a su manipulación in vitro para su posible aplicación clínica.
Dentro del grupo de células troncales de adulto, las células troncales hematopoyéticas han sido las más estudiadas (desde de los años 50's), y en la actualidad se tiene un panorama bastante claro de su estructura y biología.1 La investigación sobre células troncales de otros tejidos ha sido más reciente. Particularmente, el estudio de las células troncales mesenquimales (MSC, por sus siglas en inglés) comenzó en la década de los 70's y estuvo enfocado primordialmente al conocimiento de su papel en la formación del estroma hematopoyético. Gracias a diversos estudios que han demostrado el amplio potencial de diferenciación de las MSC hacia tejidos neuronales y musculares, estas células han cobrado mayor importancia durante la última década.
Las MSC se localizan principalmente en la médula ósea y tienen la capacidad de dar origen a diversos tipos celulares, como los fibroblastos medulares o células reticulares, adipocitos, osteoblastos y condrocitos. Estudios realizados tanto in vivo como in vitro han demostrado la plasticidad de estas células, dando origen a células no hematopoyéticas como miocitos, tenocitos y células nerviosas, entre otras.3–6
A pesar de ser en la actualidad una opción terapéutica para múltiples enfermedades, el estudio de las MSC es controversial y no está exento de obstáculos. Hoy en día, por ejemplo, no se cuenta con una técnica estándar para su obtención, ni con una nomenclatura aceptada universalmente.
El campo de estudio de las MSC es muy fértil, y, como veremos a lo largo de esta revisión, estas células parecen ser una alternativa al uso clínico de las CTE.
HISTORIA DE LAS CÉLULAS TRONCALES MESENQUIMALES
El estudio de las MSC comenzó a finales de los años 60's y se extendió durante la década de los 70's, con los trabajos realizados por Friedenstein, et al.7–9 Este grupo, utilizando ratones y cobayos, describió por primera vez una población de células adherentes de médula ósea que formaban parte del estroma medular y que daban origen al microambiente hematopoyético. Dichas células fueron denominadas como mecanocitos estromales o unidades formadoras de colonias de fibroblastos (CFU–F, por sus siglas en inglés).
En la década de los 80's, varios grupos de investigación se dieron a la tarea de caracterizar a la población celular de médula ósea, capaz de originar el estroma medular, hueso y cartílago.10–12 Durante esta etapa, los investigadores trabajaron intensamente en la caracterización y la biología de las células troncales mesenquimales. Los estudios se basaban en modelos animales, principalmente ratones, a los que se les trasplantaban células de médula ósea de ratones singénicos.10
Piersma, et al. demostraron que las células de médula ósea contienen progenitores de fibroblastos, que podían ser trasplantados junto con las células hematopoyéticas.11 Por su parte, Owen et al. demostraron que estas células tenían la capacidad de originar tejido óseo, cartilaginoso y conjuntivo, y que a partir de una pequeña cantidad de células de médula ósea inoculadas en cámaras de difusión en modelos in vivo, se generaban una gran cantidad de células estromales, lo que dejaba claro el gran potencial de proliferación y diferenciación de estas células.12,13 Sin embargo, faltaban estudios con clonas aisladas que permitieran establecer si los osteoblastos, condrocitos y fibroblastos que originaban estos tres tejidos provenían de un progenitor común en la médula ósea o de distintos progenitores estromales.
Friedenstein et al. abordaron esta pregunta y en 1987 arrojaron los primeros resultados.10 Estos autores encontraron que las colonias de morfología fibroblastoide, formadas al cultivar in vitro una suspensión de células provenientes de la médula ósea, derivaban de un solo progenitor (CFU–F); demostraron también la gran capacidad proliferativa de las CFU–F, su habilidad para autorrenovarse y su multipotencialidad. Con base en la evidencia experimental obtenida hasta ese entonces, a finales de los 80's Owen y Friedenstein propusieron que existía una célula troncal presente en el tejido conjuntivo asociado a la médula ósea, capaz de dar origen a diferentes tipos celulares, entre los que se incluía el tipo osteogénico.10 Estos autores la denominaron como célula troncal estromal (Figura 1). Hasta ese momento, todos los estudios realizados habían sido en modelos animales. Sin embargo, años más tarde, Caplan et al. desarrollaron una metodología que permitía cultivar y trasplantar células mesenquimales de humanos adultos y obtener la formación de hueso.14
MÉTODOS DE OBTENCIÓN DE LAS CÉLULAS TRONCALES MESENQUIMALES
Desde los primeros estudios realizados por Friedenstein y Owen, se encontró que la población de células que se adhería al plástico en cultivo era heterogénea, tanto en morfología como en capacidad de diferenciación. Estos dos autores, por un lado, y más tarde Kuznetsov, demostraron que no todas las unidades formadoras de colonias de fibroblastos o CFU–F tenían el mismo potencial para dar origen a células de distintos linajes.10,15 Por lo tanto, se hizo necesario estandarizar las condiciones para cultivarlas y diferenciarlas in vitro.
Friedenstein et al. fueron los primeros en obtener, de manera consistente, células adherentes de médula ósea, las cuales incluían a las células troncales mesenquimales; hasta la fecha, este método de obtención sigue siendo utilizado. La metodología establecida por Friedenstein consistía en cultivar células provenientes de médula ósea de organismos adultos, después de un lapso de tiempo retiraba todas las células en suspensión y cultivaba a las células adheridas a la caja de cultivo. Las células adherentes eran heterogéneas, sin embargo, después de varias resiembras, predominaban células que crecían en forma de colonias fibroblastoides, denominadas células clonogénicas progenituras de fibroblastos o unidades formadoras de colonias de fibroblastos.16,17
Caplan et al., en la década de los 90's, lograron obtener y diferenciar MSC de humanos adultos, modificando el método utilizado por Friedenstein.18 Su metodología consistía en obtener médula ósea de aspirados de cresta iliaca de donadores sanos y células de médula de la epífisis femoral. Las células se obtenían en la fracción de baja densidad de un gradiente de Percoll. Después de tres días de cultivo las células no adherentes eran removidas y las células adherentes seguían siendo cultivadas in vitro. Los autores encontraron que de todas las células mononucleares sembradas, únicamente una baja proporción tenía la capacidad de adherirse y formar colonias. La mayor parte de las células adheridas tenía una morfología fibroblastoide, con pocas células poligonales, adipocíticas o redondas. La frecuencia que reportaron fue de 1 a 5 CFU–F por 100,000 células nucleadas de médula ósea que fueron sembradas. Las colonias se formaban entre los 14 y 21 días; sin embargo, después de ese periodo se daba un crecimiento exponencial y las células cubrían rápidamente el área de cultivo.
Actualmente, algunos grupos continúan utilizando el gradiente de Percoll para obtener a las MSC, sin embargo, otros grupos han utilizado gradientes de Ficoll.19,20–23Majumdar en 1998, realizó una comparación entre ambos métodos y encontró que al utilizar el gradiente de Percoll se obtenía una población más homogénea y pura de MSC; sin embargo, en este estudio también se utilizaron medios de cultivo diferentes, por lo que los datos no pueden ser concluyentes.24 En la actualidad, ambos métodos de obtención son aceptados.
La obtención de las MSC de médula ósea mediante gradientes de densidad tiene la desventaja de que en las primeras resiembras se encuentran tanto células endoteliales como macrófagos contaminando los cultivos, por lo que éstos son muy heterogéneos.23 Es por esta razón que recientemente se han tratado de implantar nuevas metodologías que permitan obtener MSC más puras y homogéneas.
Los métodos de separación celular empleados se basan tanto en algunas características físicas de las células, como su tamaño, así como en características inmunofenotípicas.25,26 De acuerdo con su inmunofe–notipo, las células pueden ser seleccionadas por dos métodos denominados selección positiva o selección negativa, ambos métodos requieren del uso de un citómetro de flujo o de una columna inmunomagnética. La selección positiva se basa en el reconocimiento por un anticuerpo de una molécula presente en la célula de interés. Este método es muy útil cuando el antígeno utilizado para reconocer a la célula se expresa únicamente en la célula de interés, puesto que, de lo contrario, se seleccionarían varios tipos celulares. A pesar de que en la literatura se han publicado algunos trabajos utilizando la selección positiva con anticuerpos dirigidos contra dos diferentes antígenos presentes en las MSC, como el anticuerpo STRO–1 y el receptor de baja afinidad del factor de crecimiento neuronal, estos antígenos tienen la desventaja de estar presentes en otros tipos celulares, como células eritroides y células nerviosas, respectivamente.27,28 El inconveniente de la selección positiva es que hasta la fecha no se cuenta con un anticuerpo que reconozca únicamente a MSC. La selección negativa, por otra parte, se basa en la eliminación de células distintas a la población de interés. En el caso específico de las MSC, se utilizan anticuerpos dirigidos contra macrófagos, linfocitos, megacariocitos y células endoteliales.23
CARACTERIZACIÓN DE LAS CÉLULAS TRONCALES MESENQUIMALES
Morfológicamente, las células troncales mesenquimales se caracterizan por presentar una morfología espigada, en forma de huso, con la presencia de un núcleo alargado, central, que contiene de dos a tres nucléolos (Figura 2). Aunque algunos autores han reportado que las capas de células troncales raesenquimales contienen células homogéneas en su morfología,29 existe una mayor evidencia de que estas capas son heterogéneas y contienen células, morfológicamente y al parecer, funcionalmente distintas. Desde los primeros estudios de Owen et al. (1980) se observó que las colonias de progenitores de células mesenquimales contenían varios tipos de células.30 Estos autores describieron colonias que contenían células fibroblastoides, fusiformes, las cuales formaban colonias compactas y colonias abiertas; otro tipo de células a las cuales denominaron de tipo epitelial eran células más pequeñas, con núcleos más intensamente teñidos y morfológicamente semejantes a células epiteliales. Un año más tarde, el trabajo publicado por Mets y Verdonk enfatizó la presencia de dos tipos celulares, uno denominado como tipo I, en el que las células eran pequeñas y fusiformes, y el tipo II, las cuales eran células más grandes, aplanadas y que proliferaban más lentamente.31 Recientemente, los estudios realizados por Prockop et al. han descrito tres tipos de células en los cultivos de MSC.21,32,33 Realizando estudios por citometría de flujo, estos investigadores separaron tres subpoblaciones, una de células pequeñas, fusiformes y agranulares, a la cual denominaron RS–1; otra de células pequeñas y granulares, denominada RS–2; y la última conformada por células más grandes y granulares a las cuales denominaron como células mesenquimales maduras o mMSC. Estos autores postularon que las células RS–1 corresponden a MSC progenituras, con un índice de proliferación elevado, que dan origen a las células RS–2 y estas últimas a las mMSC. Sin embargo, hasta ahora ésta es sólo una hipótesis y es necesario realizar estudios funcionales que permitan corroborarla. En un estudio reciente publicado por nuestro grupo, también reportamos la presencia de dos tipos de morfología en cultivos de células troncales mesenquimales. La mayoría de las células eran espigadas con morfología fibroblastoide, y una proporción menor de células en el cultivo presentaban un mayor tamaño y morfología romboide.23
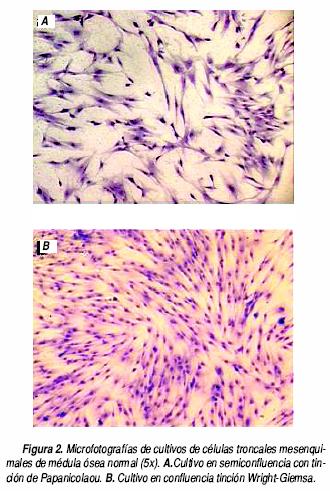
A principios de los años 90 ya se había demostrado la presencia de las MSC en la mayoría de los modelos animales y en humanos;7,8,13,30,34 a partir de entonces se les designa el nombre de células troncales mesenquimales (mesenchymal stem cells, en inglés).35 Sin embargo, faltaban estudios más detallados sobre su biología. Para llevar a cabo estos estudios, era necesario contar con una población purificada de estas células, y contar con marcadores de linaje y de estadio específico. Así, varios grupos de investigación se dieron a la tarea de buscar moléculas que estuvieran expresadas diferencial–mente en las MSC, tanto progenituras como maduras. Desafortunadamente, hasta ahora no se ha identificado una molécula que sea única de este tipo celular y que permita obtener o distinguir, de manera totalmente selectiva, a las MSC. Sin embargo, es importante recalcar que existen antígenos que se expresan de manera preferencial, aunque no exclusiva, en las células troncales mesenquimales. Así pues, para obtener y caracterizar a las MSC actualmente se utiliza una batería de anticuerpos monoclonales y diferentes tipos de tinciones.
Hebertson et al. utilizaron la expresión de la fosfatasa alcalina como marcador.36 Utilizando citometría de flujo, este grupo separó dos poblaciones (fosfatasa alcalina positiva y fosfatasa alcalina negativa) de células estromales de médula ósea de ratas. Al cultivar ambas poblaciones, encontraron que la población de células estromales que expresaban altos niveles de fosfatasa alcalina contenía progenitores osteogénicos, capaces de formar hueso. Esta población, además, carecía de la presencia de células adipocíticas y de macrófagos (a diferencia de la población control de médula ósea total) y se encontraba notablemente enriquecida en progenitores de osteoblastos. Posteriormente se observó que las MSC no expresan fosfatasa alcalina, hasta que han adquirido el compromiso de diferenciación hacia el linaje osteoblástico.19
Otra estrategia empleada por diversos grupos de investigadores ha sido el crear nuevos anticuerpos que reconozcan a las MSC y no a otros tipos celulares. Uno de los primeros anticuerpos generados que reconoce a células mesenquimales humanas es el STRO–1. Simmons y Torok–Storb en 1991, obtuvieron un anticuerpo monoclonal murino, como producto de la fusión entre una línea celular de mieloma murino y células de bazo de ratones BALB/c inmunizados con una población de células CD34+ de médula ósea. Éste es el único grupo que ha utilizado células hematopoyéticas y no células mesenquimales en cultivo para inmunizar a ratones.27 El fundamento de los autores se basó en dividir a la población CD34+ en subpoblaciones de células precursoras. Aunque se sabe que las células troncales mesenquimales son CD34", esta metodología los llevó a la generación del anticuerpo STRO–1 que reconoce a las células estromales de médula ósea como adipocitos, células de músculo liso, fibroblastos estromales y algunas CFU–F.27 Sin embargo, este anticuerpo también reconoce a células eritroides y no es expresado en todas las MSC.27,29
Caplan et al. generaron varias líneas celulares de hibridomas a partir de ratones inmunizados con células mesenquimales humanas expandidas in vitro.18 De todas las líneas que obtuvieron, se seleccionaron tres líneas celulares de hibridoma denominadas SH2, SH3 y SH4. Estas líneas secretaban anticuerpos que reconocían antígenos en la superficie de las MSC, y no reaccionaban con células hematopoyéticas. Ninguno de los anticuerpos mostró reacción con células diferenciadas en hueso o cartílago. El anticuerpo SH2 reaccionó con células mesenquimales de médula ósea, pero no con células del periosteo expandidas en cultivo. Ahora se conoce que el anticuerpo SH2 reconoce al antígeno CD105–endoglina y los anticuerpos SH3 y SH4 al antígeno CD73.37 Estos tres anticuerpos son parte del grupo de anticuerpos que hasta la fecha contribuyen a la caracterización de las células troncales mesenquimales.
Joyner et al. desarrollaron un anticuerpo contra fibroblastos estromales humanos en cultivo.38 El anticuerpo que describieron fue denominado HOP–26, y reacciona con una proporción pequeña de células nucleadas de médula ósea (< 1%); también reacciona fuertemente con fibroblastos estromales indife–renciados (osteoprogenitores) y con una gran proporción de CFU–F. Los osteoblastos son negativos para la tinción con este anticuerpo. Sin embargo, HOP–26 no ha sido utilizado con frecuencia.
Las MSC también han sido caracterizadas con anticuerpos ya conocidos y expresados en otros tipos celulares (Cuadro 1). Diversos trabajos concuerdan en que las células troncales mesenquimales no expresan los antígenos de células hematopoyéticas como: CD11b, CD14, CD31, CD34, CD43, CD45, CD56, CD68 y CD133; siendo positivos únicamente para el marcador de células hematopoyéticas CD90. 23,32,39–41
Las MSC son positivas para diversos receptores de factores de crecimiento y de matriz extracelular, como los receptores de las interleucinas 1, 3, 4, 6 y 7, el receptor del factor de crecimiento derivado de plaquetas (rPDGF), el receptor del factor de crecimiento neuronal (rNGF), los receptores del factor de crecimiento transformante beta I y II (rTGFβI y II), los receptores del factor de necrosis tumoral I y II (TNF I y TNFII), el receptor del interferón gama (IFNγ) y transferrina, así como para las moléculas de adhesión, ICAM–1, ICAM–2, VCAM–1, L–selectina, LFA–3, ALCAM, endoglina (CD105) y CD72.19,39,40,42 También expresan una variedad de integrinas incluyendo αl, α2, α3, α5, α6, αv, β1, β3 y β4.29,42 Por otra parte, estas células son negativas a las siguientes reacciones citoquímicas: fosfatasa alcalina, fosfatasa acida y sudan negro (Cuadro 1).40 Existe controversia sobre la expresión del antígeno STRO–1 y CD 133, ya que algunos autores no los encuentran, mientras que otros lo reportan incluso como método para obtenerlas.25,43,44
Diversas moléculas de gran relevancia en la hematopoyesis son producidas y secretadas por las células troncales mesenquimales. Tales moléculas incluyen a componentes de la matriz extracelular (como las colágenas I, III, IV y VI, laminina, trombospondina, tenacina y fibronectina), así como citocinas (incluyendo IL–6, IL–11, el factor inhibitorio de leucemia (LIF), el factor estimulante de colonias de macrófagos (M–CSF), el factor de células troncales (SCF), el ligando de FLT–3, la trombopoyetina (Tpo), el factor de crecimiento vascular–endotelial (VEGF), el factor de crecimiento de fibroblastos 1 (FGF–1), la proteína quimioatractante de monocitos (MCP–1), el factor de crecimiento de placenta (PIGF).39,45–48 Las MSC al ser estimuladas con IL–lα, incrementan los niveles de producción de IL–6, IL–11 y LIF, y producen bajos niveles de G–CSF y GM–CSF47 (Cuadro 1).
MULTIPOTENCIALIDAD DE LAS CÉLULAS TRONCALES MESENQUIMALES
El término multipotencialidad se refiere a la capacidad de una célula para dar origen a distintos tipos celulares dentro de un mismo tejido o capa embrionaria. Así, una célula troncal hematopoyética es capaz de dar origen a células sanguíneas tan distintas entre sí, morfológica y funcionalmente (ej. linfocito y un eritrocito), pero que pertenecen al mismo tejido, en este caso el hematopoyético.1
La capacidad multipotencial de las MSC comenzó a demostrarse in vivo desde su primera descripción, con los trabajos de Friedenstein.79 Estos trabajos demostraron que MSC cultivadas in vitro y trasplantadas en ratones secundarios, eran capaces de producir fibroblastos y osteoblastos. Sin embargo, estos primeros estudios, realizados en modelos animales, únicamente demostraban la capacidad osteogénica de estas células. Más adelante, los trabajos realizados por Owen et al. demostraron, también en modelos animales, la capacidad de las MSC para producir condrocitos y tejido conjuntivo.30 Sus estudios consistieron en cultivar células de médula ósea de conejo y trasplantarlas in vivo en cámaras de difusión. Ellos observaron que las células que crecían in vitro eran negativas para fosfatasa alcalina y para la reacción de Von Kossa. Sin embargo, al colocar a las células cultivadas in vitro en cámaras de difusión dentro de la cavidad peritoneal de los conejos, originaban una mezcla de tejido óseo, cartilaginoso y tejido conjuntivo. Estos autores demostraron que la capacidad de originar células osteoblásticas, cartilaginosas y fibroblásticas era única para las células mesenquimales de médula ósea, ya que fibroblastos aislados de bazo desarrollaban únicamente tejido conjuntivo.30
El potencial de las MSC humanas para producir células osteogénicas también ha sido demostrado.
Caplan, et al., lograron cultivar y trasplantar, en ratones desnudos, células troncales mesenquimales humanas y después de un periodo de tiempo observaron la formación de hueso.18 En dicho estudio se utilizaron capas de células estromales; posteriormente, Kuznetsov demostró, a nivel de una sola colonia de células troncales mesenquimales, su potencial osteo–génico.15
Los estudios de Pittenger demostraron la capacidad in vitro de las MSC humanas para diferenciarse en células adiposas, osteoblastos y condrocitos.29 Estos experimentos, realizados a partir de colonias de CFU–F aisladas, demostraron además, que la diferenciación de estas células depende de su ambiente, y que no todas las CFU–F tienen el mismo potencial de diferenciación.
PLASTICIDAD DE LAS CÉLULAS TRONCALES MESENQUIMALES
Estudios recientes sugieren que las MSC pueden diferenciarse no solamente en células del mesodermo, sino también pueden adoptar un destino endodermal o ectodermal, lo que se ha denominado como plasticidad celular. La plasticidad celular se define como la capacidad de una célula para diferenciarse en células maduras distintas a las de su tejido de origen; es la "flexibilidad" de una célula para sobrepasar la barrera de linaje y adoptar perfiles de expresión y fenotipos funcionales de células de otros tejidos.49
Varios grupos de investigación han estudiado intensamente la plasticidad de las MSC. Los primeros trabajos analizaron la capacidad de estas células para diferenciarse en células musculares o miocitos. Caplan, et al. lograron diferenciar células troncales mesenquimales de médula de rata en células con fenotipo miogénico (mioblastos y miotúbulos), después de haber sido tratadas con 5–azacitidinay amfotericina B.50
Gracias a los trabajos de Prockop, et al., quedó demostrada la capacidad de las MSC para diferenciarse in vivo en células de bazo, cartílago, médula y hueso.51 Sus estudios consistieron en cultivar células mesenquimales troncales que contenían una mutación en el gen de la colágena tipo I, para permitir su monitoreo. Posteriormente las células fueron trasplantadas en un ratón previamente radiado, y después de cinco meses se observó que las células del donador representaban hasta 12% de las células de médula ósea, bazo, hueso, cartílago y pulmones.
Sandhu, en 1996, realizó experimentos semejantes a los desarrollados por Prockop, encontrando que las MSC, después de dos meses de haber sido trasplantadas en un ratón inmunodeficiente, injertaban en los tejidos mesenquimales (médula y bazo), y además en hígado, timo y pulmón.52 Estos autores sugieren que estas células, al injertar, reemplazan a una proporción de las células troncales mesenquimales del receptor en la médula ósea, y que posteriormente participan en las funciones biológicas normales, sirviendo como una fuente de células progenituras de varios tejidos.52
En el año 2000, Sánchez–Ramos et al. demostraron que células estromales de médula ósea adulta, tanto de humanos como de ratones, podían ser inducidas in vitro a diferenciarse en células neuronales.53 Prockop et al. encontraron que las células troncales mesenquimales indiferenciadas expresan marcadores característicos de células neurales como la proteína IB asociada a microtúbulo (MAP1B) y vimentina. Al tratar los cultivos con agentes inductores neurales, que incrementan los niveles de cAMP intracelular, una cuarta parte de las células adquirían una morfología típica de células neurales, asociada con un incremento de la enolasa específica de neuronas (NSE) y vimentina.54 Es interesante el hecho de que las células neurales se han obtenido tanto de capas totales de MSC, como de subpoblaciones específicas, utilizando únicamente células de diámetro pequeño.41
La plasticidad de las MSC hacia tejido nervioso ha sido demostrada no solamente in vitro, sino también in vivo en modelos de trasplante. Zhao et al. purificaron MSC y las implantaron en la corteza de ratas, rodeando la zona isquémica que habían provocado una semana previa.55 Después de seis semanas, encontraron que las células troncales mesenquimales humanas habían injertado y expresaban marcadores de astrocitos, oligodendroglía y neuronas; y más aún, las ratas mostraban una recuperación de sus funciones sensomotoras. A pesar de los resultados, los autores concluyeron que probablemente la recuperación de las ratas se debía a las proteínas secretadas por las MSC humanas y no porque se hayan producido nuevas neuronas a partir de estas células.
Recientemente, Oswald et al. informaron que las MSC pueden ser inducidas in vitro a diferenciarse en células endoteliales maduras.56 Este grupo fue el primero en utilizar células mesenquimales con un inmunofenotipo característico de MSC y no de progenitor de célula endotelial (CD34" CD133) o de progenitor mesodermal.57,58
Los estudios in vivo e in vitro que demuestran la plasticidad de las MSC son apoyados por los resultados de los estudios de Tremain et al., y Seshi et al., que demuestran, mediante la técnica de microarreglos de expresión y de microSAGE, que estas células expresan transcritos no solamente de las líneas mesenquimales, como adipocitos, condrocitos, mioblas–tos, osteoblastos y de fibroblastos estromales, sino también, expresan transcritos característicos de linaje epitelial, neuronal y endotelial.59,60
NOMENCLATURA DE LAS CÉLULAS TRONCALES MESENQUIMALES
El término "célula troncal mesenquimal" (mesen–chymal stem cell, en inglés) fue utilizado por primera vez por Caplan en la década de los 90's;18 sin embargo, debido a que no existía un consenso acerca de las características que deberían tener estas células, durante la siguiente década surgieron muchos nombres, como progenitor estromal, célula progenitura mesenquimal, célula estromal de médula ósea, etcétera. Recientemente fue publicado un artículo de opinión por un grupo de especialistas encabezados por Edward Horwitz.61 Este artículo resume la posición del comité de células mesenquimales y células troncales de la Asociación Internacional de Terapia Celular. Este grupo establece ciertos criterios que deben evaluarse antes de denominar a una población de células mesenquimales como células troncales; entre éstos se incluyen la capacidad de diferenciación y de autorrenovación a largo plazo. Sin embargo, no especifican el número de linajes a los cuales deben de dar origen (osteoblastos, adipocitos) o si es necesario probar su plasticidad (diferenciación a células neuronales, endoteliales). Debido a que el término de MSC sólo puede ser aplicado a las células que posean propiedades de células troncales, este grupo propuso que a todas las células fibroblastoides de médula ósea que se adhieren al plástico se les denomine como células multipotenciales estromales mesenquimales.
Este grupo considera que las células capaces de formar colonias in vitro (CFU–F) pueden ser utilizadas como un índice de células troncales mesenquimales; sin embargo, de acuerdo con su definición anterior de capacidad de autorrenovación y capacidad de diferenciación, sería una caracterización incompleta.
Este artículo de opinión no resuelve en su totalidad el problema de la nomenclatura de las MSC, debido a que no establece con claridad cuántos y cuáles ensayos son suficientes para caracterizar a estas células. Aunado a este problema, se encuentra el que no existe un método de obtención y cultivo homogéneo entre los diferentes grupos de investigación, lo que dificulta su caracterización. Sin duda, los cultivos de células adherentes no son homogéneos, pero falta más información sobre la biología de las células troncales mesenquimales y su progenie para establecer un criterio adecuado de nomenclatura, obtención y caracterización.
FUENTES ALTERNATIVAS DE CÉLULAS TRONCALES MESENQUIMALES
No obstante que la fuente principal de las MSC es la médula ósea, diversos estudios señalan la posibilidad de obtenerlas de fuentes diferentes a este tejido. Así, algunos investigadores han detectado células en la circulación que presentan características y fenotipo semejante al de las MSC de médula ósea. Se ha informado la presencia de este tipo de células en la sangre periférica de individuos adultos normales,62 en la sangre periférica de algunos animales,63–65 y en la sangre periférica de fetos con edades gestacionales de 10 a 14 semanas.66
Minguell et al. detectaron una población celular adherente en la sangre periférica movilizada en 11/14 pacientes con cáncer de mama.67 Estas células expresaban fibronectina, colágena tipo I, ICAM–1, VCAM–1 y los antígenos SH–2 y SH–3, y se presentaban con una frecuencia de 0.63% (rango de 0.02–2.32). Aunque estos autores las definen como MSC de sangre periférica movilizada, grupos como el de Torok–Storb no están de acuerdo con estos hallazgos y sugieren que la población corresponde a células osteoclásticas y a sus progenitores, los cuales han sido previamente descritos por este grupo.68,69
Diversos reportes indican la presencia de MSC en la sangre de cordón umbilical.70–75 Las MSC de cordón umbilical comparten la expresión de antígenos característicos de MSC de médula ósea (SH–2, SH–3, SH–4, actina alfa de músculo liso [a–SMA], CD29 y CD49b, d y e),70 pero no expresan otros como el CD90, CD106 o CD146.69 Estudios funcionales han demostrado que las células troncales mesenquimales de sangre de cordón umbilical tienen la capacidad de diferenciarse en condrocitos, adipocitos, osteoblastos, hepatocitos, mioblastos y células neuronales.31,71,75
No obstante estos hallazgos, aún se considera controversial la presencia de MSC tanto en la sangre periférica, como en sangre de cordón umbilical, dado que no en todos los trabajos reportados ha sido posible su detección.76 Lo anterior puede deberse a la baja frecuencia de las células troncales mesenquimales en circulación, y a las distintas técnicas utilizadas en cada trabajo.
Por otra parte, también se han obtenido células con características similares a las MSC de médula ósea a partir de las paredes de la vena de cordón umbilical. Estas células tienen la capacidad de diferenciarse a células de linaje osteogénico, adipogénico y condrogénico y expresan marcadores como CD13, CD29, CD44, CD54, CD90, HLA–Clase I y α–SMA.77,78 La detección de MSC en las paredes de la vena de cordón umbilical permite reforzar los estudios que sugieren que este tipo de células está confinado a las paredes de los sinusoides venosos de la médula ósea.78,79
Hoy en día, varios grupos de investigación han publicado la posibilidad de obtener células troncales mesenquimales a partir de otra gran variedad de fuentes como fluido amniótico,80,81 páncreas fetal,82 placenta,81,83 gelatina de Wharton,84 y tejido adiposo.85 Aunque todavía no se cuenta con un protocolo estandarizado para llevar a cabo la obtención y purificación de las células troncales mesenquimales de estas fuentes y su completa caracterización, sin duda se abre una gran oportunidad de estudio para su aplicación clínica. Así pues, será necesario realizar estudios que permitan establecer si las MSC de estas fuentes alternativas tienen el mismo potencial y plasticidad que su contraparte de médula ósea. Un estudio reciente realizado por un grupo alemán, reporta que no existen diferencias morfológicas ni inmunofenotípicas entre las MSC de médula ósea, sangre de cordón umbilical y tejido adiposo; sin embargo, sus resultados indicaron que las MSC de sangre de cordón umbilical tienen un mayor potencial de expansión, pero un menor potencial de diferenciación, al no encontrar diferenciación al linaje adipocítico.86
APLICACIÓN CLÍNICA
La gran capacidad multipotencial y la plasticidad de las células troncales mesenquimales las hacen un blanco perfecto para su aplicación clínica. De hecho, gran parte de la literatura sobre células troncales mesenquimales reportada en los últimos cuatro años se refiere, precisamente, a este aspecto. Su uso clínico, presente y futuro, abarca enfermedades del sistema nervioso, esquelético, cardiaco y hematopoyético, entre otros (Figura 3), y está basado en una serie de estudios preclínicos, en modelos animales, algunos de los cuales se describen a continuación.
Como ya se ha discutido, diversos grupos han demostrado que estas células, después de haber sido cultivadas y expandidas in vitro, pueden ser trasplantadas. En 1983, Piersma et al. informaron que era posible trasplantar por vía intravenosa no solamente células hematopoyéticas, sino también las unidades formadoras de colonias CFU–F.87 Estos autores encontraron que después de tres meses de haber trasplantado a un ratón previamente irradiado, 50% de las CFU–F obtenidas de médula ósea provenían del donador. Posteriormente, quedó plenamente demostrado que en ratones irradiados, las células troncales mesenquimales injertan no solamente en médula ósea, sino en diversos tejidos como cartílago, bazo, hígado, pulmón y cerebro.52'88"90
En la mayoría de los estudios en modelos animales se utilizó la radiación como un tipo de acondicionamiento para el trasplante. Allers et al., sin embargo, estudiaron la distribución de las células troncales mesenquimales después de ser trasplantadas en ratones no irradiados y sin ningún tipo de acondicionamiento previo al trasplante.91 Este grupo encontró la presencia de las MSC en médula ósea, bazo y tejido mesenquimal, incluso después de un año postrasplante. Estos resultados apoyan el trasplantar MSC sin la necesidad de aplicar un tratamiento previo de quimioterapia o radiación a los pacientes. Otro modelo de estudio para evaluar el destino de las células trasplantadas es el trasplante in útero en ovejas. En este tipo de modelo, Liechty et al. trasplantaron células troncales mesenquimales en ovejas fetales en etapas tempranas de gestación.5 Los autores encontraron que las células humanas trasplantadas persistían en múltiples órganos después de 13 meses del trasplante. Las células trasplantadas se diferenciaron en condrocitos, adipocitos, miocitos, cardiomiocitos y células estromales de médula y timo.
En todos los estudios antes mencionados se utilizaron capas de células troncales mesenquimales obtenidas únicamente por adherencia. Sin embargo, un estudio realizado por Bensidhoum et al. demostró que dentro de dichas capas de células adherentes, existen subpoblaciones celulares con propiedades particulares que pueden ser empleadas de manera selectiva en modelos preclínicos.44 Estos autores reportaron que las células STRO–1 positivas tienen una mayor capacidad para injertar en diversos tejidos, mientras que las células STRO–1 negativas, si bien no son tan eficientes en los modelos in vivo, tienen una mayor capacidad para mantener la hematopoyesis in vitro. Basados en sus resultados, estos autores han sugerido que las MSC STRO–1 positivas pueden ser las células mesenquimales más apropiadas para utilizar en terapia génica y celular. La confirmación de estos resultados por otros grupos de investigación será fundamental para dar paso a la aplicación clínica de esta población celular.
Es importante hacer notar que el empleo de MSC en esquemas terapéuticos en humanos ya se ha realizado con éxito. Lazarus et al. han presentado evidencia al respecto, demostrando que las células troncales mesenquimales de humano pueden ser expandidas in vitro y trasplantadas en sujetos, sin causar efectos adversos; estas células son bien toleradas por los pacientes y pueden ser detectadas a distintos tiempos postrasplante.92
Las MSC también han sido utilizadas para mejorar el injerto de otras células. En estudios in vivo en el modelo de xenotrasplante en oveja fetal, se ha demostrado que el trasplante simultáneo de células hematopoyéticas con células troncales mesenquimales, tanto alogénicas como autólogas, resulta en un incremento del injerto a largo plazo de células humanas, así como de un mayor número de células sanguíneas circulantes del donador durante la gestación y después del nacimiento.93 Estos resultados pueden explicarse, al menos en parte, con los estudios recientes de Maitra et al., en donde reportaron que las MSC mejoran los resultados del trasplante alogénico promoviendo el injerto de las células hematopoyéticas y disminuyendo la enfermedad injerto contra hospedero (GVHD, por sus siglas en inglés), al suprimir la activación de células T.94
Otra alternativa importante en la terapia celular es utilizar a MSC para promover la angiogénesis. Diversos estudios utilizando modelos de isquemia, han demostrado que estas células tienen un efecto positivo en la recuperación del flujo sanguíneo.48 Al menos dos mecanismos han sido propuestos para explicar el papel de las células troncales mesenquimales en este proceso. Por un lado, existe evidencia experimental que indica la generación e incorporación de células endoteliales derivadas de las células troncales mesenquimales, a los capilares en formación, y por otra parte, un nuevo estudio ha demostrado que las MSC también promueven la angiogénesis a través de la secreción de citocinas como VEGF–A, FGF–2, IL–6, PIGF y MCP–1.95
Estas células han sido ampliamente utilizadas para la formación de cartílago en modelos animales. Por ejemplo, Murphy et al. han reportado trasplantes de células troncales mesenquimales de cabra en las rodillas de cabras, a las cuales se les había realizado una menisectomía y la resección del ligamento anterior.96 Después de un lapso de tiempo se encontró que había regeneración del tejido del menisco y una disminución en la destrucción del cartílago. Las células en el tejido reparado tenían el marcador de las células del donador.96
Sin duda, el potencial más prometedor del uso de las MSC es en aquellas enfermedades en las que hasta el momento no existe una terapia curativa, como es el caso de la osteogénesis imperfecta, el infarto al miocardio o la enfermedad de Parkinson, entre otras. Los estudios de terapia celular para tratar a la osteogénesis imperfecta han avanzado desde modelos murinos,89 hasta su aplicación clínica.97,98 Horwitz et al. realizaron tres trasplantes alogénicos de médula ósea en niños con osteogénesis imperfecta severa. Los investigadores encontraron que las MSC injertaron y que habían migrado e incrementado la formación de hueso en los tres niños.97
En la terapia de infartos al miocardio, los resultados han sido también favorables. Cuando se introducen células troncales mesenquimales en el área infartada del corazón, éstas previenen el remodelado anormal del tejido y mejoran su recuperación funcional, lo que resulta en una mejoría clínica de los pacientes.4 Aunque todavía falta por conocer el papel de las células troncales mesenquimales en la diferenciación del tejido cardiaco en la cicatriz, y su rechazo inmunológico, los resultados hasta ahora son alentadores.99,100
Sin duda, hoy en día las MSC son de gran interés para la biomedicina. Hasta el momento, el uso de estas células en la clínica ha probado no tener riesgos para el individuo, no son capaces de producir teratomas e inhiben el rechazo inmunológico al ser trasplantadas. Es por eso importante continuar con el estudio de estas células para conocer su biología, su capacidad de diferenciación y su papel en diversas enfermedades hematológicas, así como su aplicación en terapia celular y medicina regenerativa.
CONSIDERACIONES FINALES
El estudio de las MSC representa un área de la biomedicina que ha tenido y tendrá un crecimiento significativo, no sólo por su relevancia en la terapia celular sino incluso en el estudio de las enfermedades hematológicas y cáncer. Las células troncales mesenquimales presentan mecanismos de diferenciación al parecer distintos a los descritos para otro tipo de células troncales, por lo que son, además, un modelo muy interesante de estudio de la diferenciación y plasticidad celular. A pesar de tener en la actualidad un uso clínico, todavía queda mucha información faltante en la biología de estas células, por lo que será importante que en los siguientes años surjan trabajos que establezcan la jerarquía de diferenciación de las células troncales mesenquimales, que sean descritos nuevos antígenos que permitan su estudio y una nueva clasificación que esclarezca si la heterogeneidad morfológica que se ha descrito en diversos estudios refleja propiedades biológicas distintas.
AGRADECIMIENTOS
Agradecemos al Dr. Moisés Selman por la revisión y comentarios al manuscrito. Al Dr. Sebastián Castillo por haber proporcionado las fotografías de las células mesenquimales en cultivo. La Dra. Eugenia Flores Figueroa fue estudiante del Doctorado en Ciencias Biomédicas de la UNAM y recibió las becas del IMSS y del CONACYT. La Dra. Eugenia Flores–Figueroa, el Dr. Juan José Montesinos y el Dr. Héctor Mayani pertenecen al Sistema Nacional de Investigadores.
REFERENCIAS
1. Mayani H. A glance into somatic stem cell biology: basic principles, new concepts, and clinical relevance. Arch Med Res 2003; 34: 3–15. [ Links ]
2. Lisker R. Ethical and legal issues in therapeutic cloning and the study of stem cells. Arch Med Res 2003; 34: 607–11. [ Links ]
3. Prockop D. Marrow stromal cells as stem cells for nonhematopoietic tissues. Science 1997; 276: 71–4. [ Links ]
4. Pittenger MF, Martin BJ. Mesenchymal stem cells and their potential as cardiac therapeutics. Circ Res 2004; 95: 9–20. [ Links ]
5. Liechty KW, MacKenzie TC, Shaaban AF, Radu A, Moseley AB, Dean R, Marshak DR, Flake AW. Human mesenchymal stem cells engraft and demonstrate site–specific differentiation after in utero transplantation in sheep. Nat Med 2000; 6: 1282–6. [ Links ]
6. Bianco P, Gehron Robey O. Marrow stromal stem cells. J Clin Invest 2000; 105: 1663–8. [ Links ]
7. Friedenstein AJ, Petrakova KV, Kurolesova AI, Frolova GP. He–terotopic of bone marrow. Analysis of precursor cells for osteogenic and hematopoietic tissues. Transplantation 1968; 6: 230–47. [ Links ]
8. Friedenstein AJ, Chailakhjan RK, Lalykina KS. The development of fibroblast colonies in monolayer cultures of guinea–pig bone marrow and spleen cells. Cell Tissue Kinet 1970; 3: 393–403. [ Links ]
9. Friedenstein AJ, Ivanov–Smolenski AA, Chajlakjan RK, Gorskaya UF, Kuralesova AI, Latzinik NW, Gerasimow UW. Origin of bone marrow stromal mechanocytes in radiochimeras and heterotopic transplants. Exp Hematol 1978; 65: 440–4. [ Links ]
10. Owen M, Friedenstein AJ. Stromal stem cells: marrow–derived osteogenic precursors. Ciba Foundation Symposium 1988; 136: 42–60. [ Links ]
11. Piersma AH, Ploemacher RE, Brockbank KG. Transplantation of bone marrow fibroblastoid stromal cells in mice via the intravenous route. Br J Haematol 1983; 54: 285–90. [ Links ]
12. Ashton BA, Phil B, Allen TD, Howlett CR, Eaglesom CC, Hattori A, Owen M. Formation of bone and cartilage by marrow stromal cells in diffusion chambers in vivo. Clin Orthop Relat Res 1980; 151: 294–307. [ Links ]
13. Bab I, Ashton BA, Gazit D, Marx G, Williamson MC, Owen ME. Kinetics and differentiation of marrow stromal cells in diffusion chambers in vivo. J Cell Sci 1986; 84: 139–51. [ Links ]
14. Haynesworth SE, Goshima H, Golberg VM, Caplan I. Characterization of cells with osteogenic potential from human marrow. Bone 1992; 13: 81–8. [ Links ]
15. Kuznetsov S, Krebsbach PH, Satomura K, Kerr J, Riminucci M, Benayahu D, Robey PG. Single–colony derived strains of human marrow stromal fibroblasts form bone after transplantation in vivo. J Bone Miner Res 1997; 12: 1335–47. [ Links ]
16. Friedenstein AJ, Deriglasova UF, Kulagina NN, Panasuk AF, Rudakowa SF, Luria EA, Ruadkow IA. Precursors for fibroblasts in different populations of hematopoietic cells as detected by the in vitro colony assay method. Exp Hematol 1974; 2: 83–92. [ Links ]
17. Friedenstein AJ, Gorskaja JF, Kulagina NN. Fibroblast precursors in normal and irradiated mouse hematopoietic organs. Exp Hematol 1976; 4: 267–74. [ Links ]
18. Haynesworth SE, Baber MA, Caplan AI. Cell surface antigens on human marrow–derived mesenchymal cells are detected by monoclonal antibodies. Bone 1992; 13: 69–80. [ Links ]
19. Pittenger MF, Mackay AM, Beck SC, Jaiswal RK, Douglas R, Mosca JE, Moorman MA, Simonetti DW, Craig S, Marshak DR. Multilineage potential of adult human mesenchymal stem cells. Science 1999. 284: 143–7. [ Links ]
20. Colter DC, Class R, DiGiolamo CM, Prockop DJ. Rapid expansion of recycling stem cells in cultures of plastic–adherent cells from human bone marrow. Proc Natl Acad Sci USA 2000; 97: 3113–3218. [ Links ]
21. Sekiya I, Larson BL, Smith JR, Pochampally R, Cui JG, Prockop DJ. Expansion of human adult stem cells from bone marrow stroma: conditions that maximize the yields of early progenitors and evaluate their quality. Stem Cells 2002; 20: 530–41. [ Links ]
22. Flores–Figueroa E, Gutiérrez–Espíndola G, Guerrero–Rivera S, Pizzuto–Chavez J, Mayani H. Hemopoietic progenitor cells from patients with myelodysplastic syndromes: in vitro growth and long–term proliferation. Leuk Res 1999; 23: 385–94. [ Links ]
23. Flores–Figueroa E, Arana–Trejo RM, Gutiérrez–Espíndola G, Pérez–Cabrera A, Mayani H. Mesenchymal stem cells in myelodysplastic syndromes: phenotypic and cytogenetic characterization. Leuk Res 2005; 29: 215–24. [ Links ]
24. Majumdar MK, Keane–Moore M, Buyaner D, Hardy WB, Moorman MA, Mclntosh KR, Mosca JD. Characterization and functionality of cell surface molecules on human mesenchymal stem cells. J Biomed Sci 2003; 10: 228–41. [ Links ]
25. Shih–Chieh Hung, Nien–Jung C, Shie–Liang H, Hung L, Hsiao–Li M, Wai–Hee L. Isolation and characterization of size–sieved stem cells from human bone marrow. Stem Cells 2002; 20: 249–58. [ Links ]
26. Smith JR, Pochampally R, Perry A, Hsu SCh, Prockop DJ. Isolation of a highly clonogenic and multipotential subfraction of adult stem cells from bone marrow stroma. Stem Cells 2004; 22: 823–31. [ Links ]
27. Simmons PJ, Torok–Storb B. Identification of stromal cell precursors in human bone marrow by a novel monoclonal antibody, STRO–1. Blood 1991; 78: 55–62. [ Links ]
28. Quirici N, Soligo D, Bossalasco P, Servida F, Lumini C, Deliliers GL. Isolation of bone marrow mesenchymal stem cells by anti–nerve growth factor receptor antibodies. Exp Hematol 2002; 30: 783–91. [ Links ]
29. Pittenger MF, Mackay AM, Bewck SC, Jaiswal RK, Douglas R, Mosca JD, Moorman MA, Simonetti DW, Craig S, Marshak DR. Multilineage potential of adult human mesenchymal stem cells. Science 1999; 248: 143–7. [ Links ]
30. Ashton BA, Phil BSc, Allen TD, Howlett CR, Eaglesom CC, Hattori A, Owen M. Formation of bone and cartilage by marrow stromal cells in diffusion chambers in vivo. Clin Orthop Relat Res 1980; 151: 294–307. [ Links ]
31. Mets T, Verdonk G. Variations in the stromal cell population of human bone marrow during aging. Mech Ageing Dev 1981; 15: 41–9. [ Links ]
32. Colter DC, Class R, DiGiolamo CM, Prockop DJ. Rapid expansion of recycling stem cells in cultures of plastic–adherent cells from human bone marrow. Proc Natl Acad Sci USA 2000; 97: 3113–3218. [ Links ]
33. Prockop DJ, Sekiya I, Colter DC. Isolation and characterization of rapidly self–renewing stem cells from cultures of human marrow stromal cells. Cytotherapy 2001; 3: 393–6. [ Links ]
34. Zohar R, Sodek J, McCulloch AG. Characterization of stromal progenitor cells enriched by flow cytometry. Blood 1997; 90: 3471–81. [ Links ]
35. Caplan AI. Mesenchymal stem cells. J Orthop Res 1991; 9: 641–50. [ Links ]
36. Herbertson A, Aubin JE. Cell sorting enriches osteogenic populations in rat bone marrow stromal cell cultures. Bone 1997; 21: 491–500. [ Links ]
37. Javanzon EH, Beggs KJ, Flake AW. Mesenchymal stem cells: paradoxes of passaging. Exp Hematol 2004; 32: 414–25. [ Links ]
38. Joyner CJ, Bennett A, Triffitt JT. Identification and enrichment of human osteoprogenitor cells by using differentiation stage–specific monoclonal antibodies. Bone 1997; 21: 1–6. [ Links ]
39. Conget P, Minguell JJ. Phenotypical and functional properties of human bone marrow mesenchymal progenitor cells. J Cell Physiol 1999; 181: 67–73. [ Links ]
40. Guo Z, Yang J, Liu X, LiX, Hou C, Tang PH, Mao N. Biological features of mesenchymal stem cells from human bone marrow. Chin Med J 2001; 114: 950–3. [ Links ]
41. Shih–Chie Hung, Henrich Cheng, Chien–Yuan Pan, May J Tsai, Lung–Sen Kao, Hsiao–Li Ma. In vitro differentiation of size–sieved stem cells into electrically active neural cells. Stem Cells 2002; 20: 522–9. [ Links ]
42. Majumdar MK, Keane–Moore M, Buyaner D, Hardy WB, Moorman MA, Mclntosh KR, Mosca JD. Characterization and functionality of cell surface molecules on human mesenchymal stem cells. J Biomed Sci 2003; 10: 228–41. [ Links ]
43. Gronthos S, Graves SE, Ohta S, Simmons PJ. The STRO–1 + fraction of adult human bone marrow contains the osteogenic precursors. Blood 1994; 84: 4164–73. [ Links ]
44. Bensidhoum M, Chapel A, Francois S, Demarquay C, Mazurier C, Fouillard L, et al. Homing of in vitro expanded Stro–1– or Stro–1+ human mesenchymal stem cells into the NOD/SCID mouse and their role in supporting human CD34 cell engraftment. Blood 2004; 103: 3313–9. [ Links ]
45. Galmiche MC, Koteliansky VE, Briére J, Hervé P, Charbord P. Stromal cells from human long–term marrow cultures are mesenchymal cells that differentiate following a vascular smooth muscle differentiation pathway. Blood 1993; 82: 66–76. [ Links ]
46. Zhu GR, Zhou XY, Lu H, Zhou JW, Li AP, Xu W, et al. Human bone marrow mesenchymal stem cells express multiple hematopoietic growth factors. Zhongguo Shi Yan Xue Ye Xue Za Zhi 2003; 11: 115–19. [ Links ]
47. Majumdar MK, Thiede MA, Haynesworth SE, Bruder SP, Gerson SL. Human marrow–derived mesenchymal stem cells (MSCs) express hematopoietic cytokines and support long–term hematopoiesis when differentiated toward stromal and osteogenic lineages. J Hematother Stem Cell Res 2000; 9: 841–8. [ Links ]
48. Heil M, Ziegelhoeffer T, Mees B, Schaper W. A different outlook on the role of bone marrow stem cells in vascular growth. Bone marrow delivers software not hardware. Circ Res 2004; 94: 573–4. [ Links ]
49. Herzog EL, Chai Li, Krause DS. Plasticity of marrow–derived stem cells. Blood 2003; 102: 3483–93. [ Links ]
50. Wakitani S, Saito T, Caplan Al. Myogenic cells derived from rat bone marrow mesenchymal stem cells exposed to 5–azacytidine. Muscle Nerve 1995; 18: 1417–26. [ Links ]
51. Pereira RF, Halford KW, O'Hara MD, Leeper DB, Sokolov BP, Pollard MD et al. Cultured adherent cells from marrow can serve as long–lasting precursor cells for bone, cartilage, and lung in irradiated mice. Proc Natl Acad Sci USA 1995; 92: 4857–61. [ Links ]
52. Sandhu JS, Clark BR, Boynton EL, Atkins H, Messner H, Keating A, Hozumi N. Human hematopoiesis in SCID mice implanted with human adult cancellous bone. Blood 1996; 88: 1973–82. [ Links ]
53. Sanchez–Ramos J, Song S, Cardozo–Pelaez F, Hazzi C, Stede–ford T, Willing A, et al. Adult bone marrow stromal cells differentiate into neural cells in vitro. Exp Neurol 2000; 164: 247–56. [ Links ]
54. Deng W, Obrocka M, Fischer I, Prockop DJ. In vitro differentiation of human marrow stromal cells into early progenitors of neural cells by conditions that increase intracellular cyclic AMP. Biochem Biophys Res Commun 2001; 282: 148–52. [ Links ]
55. Zhao LR, Duan WM, Reyes M, Keene CD, Verfaillie CM, Low WC. Human bone marrow stem cells exhibit neural phenotypes and ameliorate neurological deficits after grafting into the ischemic brain of rats. Exp Neurol 2002; 174: 11–20. [ Links ]
56. Oswald J, Boxberger S, J0rgensen B, Feldmann S, Ehninger S, Bornhauser M, Werner C. Mesenchymal stem cells can be differentiated into endothelial cells in vitro. Stem Cells 2004; 22: 377–84. [ Links ]
57. Asahara T, Murohara T, Suillivan A, et al. Isolation of putative progenitor endotelial cells for angiogenesis. Science 1997; 275964–7. [ Links ]
58. Reyes M, Lund T, Lenvik T, Aguilar D, Koodle L, Verfaille CM. Purification and ex vivo expansion of postnatal human marrow mesodermal progenitor cells. Blood 2001; 98: 2615–25. [ Links ]
59. Tremain A, Korkko J, Ibberson D, Kopen GC, Digirolamo C, Phinney DG. MicroSAGE Analysis of 2,353 expressed genes in a single cell–derived colony of undifferentiated human mesenchymal stem cells reveals mRNAs of multiple cell lineages. Stem Cells 2001; 19: 408–18. [ Links ]
60. Seshi B, Kumar S, King D. Multilineage gene expression in human bone marrow stromal cells as evidenced by single–cell microarray analysis. Blood Cells Mol Dis 2003; 31: 268–85. [ Links ]
61. Horwitz EM, Le Blanc K, Dominici M, Mueller I, Slaper–Cortenbach I, Marini FC, Deans RJ, Krause DS, Keating A. Clarification of the nomenclature for MSC: The International Society for Cellular Therapy position statement. Cytotherapy 2005; 7: 393–5. [ Links ]
62. Zvaifler NJ, Marinova–Mutafchieva L, Adams G, Edwards CJ, Moss J, Burguer JA, Maini RN. Mesenchymal precursor cells in the blood of normal individuals. Arthritis Res 2000; 2: 477–88. [ Links ]
63. Huss R. Isolation of primary and immortalized CD34– hematopoietic and mesenchymal stem cells from various sources. Stem Cells 2000; 18: 1–9. [ Links ]
64. Huss R, Lange C, Weissinger EM, Kolb H, Thalmeier K. Evidence of peripheral blood–derived, plastic–adherent CD34–/low hematopoietic stem cell clones with mesenchymal stem cell characteristics. Stem Cells 2000; 18: 252–60. [ Links ]
65. Conrad C, Gottgens B, Kinston S, Ellwart J, Huss R. GATA transcription in a small rhodamine 123lowCD34+ subpopulation of a pheripheral blood–derived CD34~CD105+ mesenchymal cell line. Exp Hematol 2002; 887–95. [ Links ]
66. Campagnoli C, Roberts IAG, Kumar S, Bennett PR, Bellantuono LL, Fisk NM. Identification of mesenchymal stem/progenitor cell in human first–trimester fetal blood, liver and bone marrow. Blood 2001; 98: 2396–2402. [ Links ]
67. Fernández M, Simon V, Herrera G, Cao C, Del Favero H, Minguell JJ. Detection of stromal cells in peripheral blood progenitor cell collections from breast cancer patients. Bone Marrow Transplant 1997; 20: 265–71. [ Links ]
68. Purton LE, Mielcarek M, Torok–Storb B. Monocytes are likely candidate 'stromal' cell in G–CSF–mobilized peripheral blood. Bone Marrow Transplant 1998; 21: 1075–6. [ Links ]
69. Purton LE, Lee MY, Torok–Storb B. Normal human peripheral blood mononuclear cells mobilized with granulocyte colony stimulating factor have increased osteoclastogenic potential compared to nonmobilized blood. Blood 1996; 87: 1802–8. [ Links ]
70. Erices A, Conget P, Minguell JJ. Mesenchymal progenitor cells in human umbilical cord blood. Br J Hematol 2000; 109: 235–42. [ Links ]
71.Goodwin HS, Bicknese AR, Chien SN, Bogucki BD, Oliver DA, Quinn CO, Wall DA. Multilineage differentiation activity by cells isolated from umbilical cord blood: expression of bone, fat, and neural markers. Biol Blood Marrow Transplant 2001; 7: 581–8. [ Links ]
72. Gang EJ, Hong SH, Jeong JA, Hwang SH, Kim SW, Yang IH, Ahn C, Han H, Kim H. In vitro mesengenic potential of human umbilical cord blood–derived mesenchymal stem cells. Biochem Biophys Res Commun 2004; 321: 102–8. [ Links ]
73. Bieback K, Kern S, Kluter H, Eichler H. Critical parameters for the isolation of mesenchymal stem cells from umbilical cord blood. Stem Cells 2004; 22: 625–34. [ Links ]
74. Lee OK, Kuo TK, Chen W, Lee KD, Hsieh S, Chen T. Isolation of multipotent mesenchymal stem cells from umbilical cord blood. Blood 2004; 103: 1669–75. [ Links ]
75. Wang JF, Wang LJ, Wu YF, Xiang Y, Xie CG, Jia BB, et al. Mesenchymal stem/progenitor cells in human umbilical cord blood as support for ex vivo expansion of CD34+ hematopoietic stem cells and for chondrogenic differentiation. Hematol 2004; 89: 837–44. [ Links ]
76. Mareschi K, Biasin E, Piacibello W, Agglietta M, Madon E, Fagioli F. Isolation of human mesenchymal stem cells: bone marrow versus umbilical cord blood. Haematologica 2001; 86: 1099–1100. [ Links ]
77. Romanov YA, Svintsitskaya VA, Smirnov VN. Searching for alternative sources of posnatal human mesenchymal stem cells: candidate MSC–Like cells from umbilical cord. Stem Cells 2003; 21: 105–10. [ Links ]
78. Panepucci RA, Siufi JLC, Silva WA, Proto–Siquiera R, Neder L, Orellana M, et al. Comparison of gene expression of umbilical cord vein and bone marrow–derived mesenchymal stem cells. Stem Cells 2004; 22: 1263–78. [ Links ]
79. Bianco P, Riminucci M, Gronthos S, Robey PG. Bone Marrow Stromal Stem Cells: nature, biology, and potential applications. Stem Cells 2001. 19: 180–92. [ Links ]
80. in'tAnker PS, Scherjon SA, Kleijburg–van der Keur C, Noort WA, Claas FHJ, Willemze R, et al. Amniotic fluid as a novel source of mesenchymal stem cells for therapeutic transplantation. Blood 2003; 102: 1548–9. [ Links ]
81. in'tAnker PS, Scherjon SA, Kleij burg–van der Keur C, Groot–Swings MJS, Claas FHJ, Willemze R, et al. Isolation of mesenchymal stem cells of fetal or maternal origin from human placenta. Stem Cells 2004; 22: 1338–45. [ Links ]
82. Hu Y, Liao L, Wang Q, Ma L, Ma G, Jiang X, Zhao RC. Isolation and identification of mesenchymal stem cells from human fetal pancreas. J Lab Clin Med 2003; 141: 342–9. [ Links ]
83. Yen BL, Huang HI, Chien CC, Jui HY, Ko BS, Yao M, Shun CT, Yen ML, Lee MC, Chen YC. Isolation of multipotent cells from human term placenta. Stem Cells 2005; 23: 3–9. [ Links ]
84. Wang HS, Hung SC, Peng ST, Huang CC, Wei HM, Guo YJ, et al. Mesenchymal stem cells in the Wharton's jelly of the human umbilical cord. Stem Cells 2004; 22: 1330–7. [ Links ]
85. Dicker A, Le Blanc K, Astrom G, van Harmelen V, Gotherstrom C, Blomqvist L, et al. Functional studies of mesenchymal stem cells derived from adult human adipose tissue. Exp Cell Res 2005; 308: 283–90. [ Links ]
86. Kern S, Eichler H, Stoeve J, Kluter H, Bieback K. Comparative Analysis of Mesenchymal Stem Cells from Bone Marrow, Umbilical Cord Blood or Adipose Tissue. Stem Cells 2006; Enero 12. Publicación en línea. [ Links ]
87. Piersma AH, Ploemacher RE, Brockbank KG. Transplantation of bone marrow fibroblastoid stromal cells in mice via the intravenous route. Br J Haematol 1983; 54: 285–90. [ Links ]
88. Piersma AH, Brockbank KG, Ploemacher RE, Ottenheim CP. Recovery of hemopoietic stromal progenitor cells after lethal total–body irradiation and bone marrow transplantation in mice. Transplantation 1985; 40: 198–201. [ Links ]
89. Pereira RF, O'Hara MD, Laptev AV, Halford KW, Pollard MD, Class R, et al. Marrow stromal cells as a source of progenitor cells of nonhematopoietic tissues in transgenic mice with a phenotype of osteogenesis imperfecta. Proc Natl Acad Sci USA 1998; 95: 1142–7. [ Links ]
90. Azizi SA, Stokes D, Augelli BJ, DiGirolamo C, Prockop DJ. Engraftment and migration of human bone marrow stromal cells implanted in the brains of albino rats–similarities to astrocyte grafos. Proc Natl Acad Sci USA 1998; 95: 3908–13. [ Links ]
91. Allers C, Sierralta WD, Neubauer S, Rivera F, Minguell JJ, Conget PA. Dynamic of distribution of human bone marrow–derived mesenchymal stem cells after transplantation into adult unconditioned mice. Transplantation 2004; 78: 503–8. [ Links ]
92. Lazarus H, Haynesworth S, Gerson S, Rosenthal N, Caplan A. Ex vivo expansion and subsequent infusion of human bone marrow–derived stromal progenitor cells (mesenchymal progenitor cells): Implications for therapeutic use. Bone Marrow Transplant 1995; 16: 557–64. [ Links ]
93. Almeida–Porada G, Porada CD, Tran N, Zanjani ED. Cotransplantation of human stroma cell progenitors into preimmune fetal sheep results in early appearance of human donor cells in circulation and boosts cell levels in bone marrow at later time points alter transplantation. Blood 2000; 95: 3620–7. [ Links ]
94. Maitra B, Szekely E, Gjini K, Laughlin MJ, Dennis J, Haynesworth SE, Koc ON. Human mesenchymal stem cells support unrelated donor hematopoietic stem cells and suppress T–cell activation. Bone Marrow Transplant 2004; 33: 597–604. [ Links ]
95. Kinnaird T, Stabile E, Brunett MS, Lee CW, Barr S, Fuchs S, Epstein SE. Marrow–derived stromal cells express genes encoding a broad spectrum of arteriogenic cytokines and promote in vitro and in vivo arteriogenesis through paracrine mechanisms. Circ Res 2004; 94: 678–85. [ Links ]
96. Murphy JM, Kavalkovitch KW, Fink D, Barry FP. Regeneration of meniscal tissue and protection of articular cartilage by injection of mesenchymal stem cells. Osteoarthritis Cartilage 2000; 8 (Suppl B): S25. [ Links ]
97. Horwitz E. Transplantability and therapeutic effects of bone marrow–derived mesenchymal cells in children with osteogenesis imperfecta. Nat Med 1999; 5: 309–13. [ Links ]
98. Mauney JR, Volloch V, Kaplan DL. Role of adult mesenchymal stem cells in bone tissue engineering applications: current status and future prospects. Tissue Eng 2005; 11: 787–802. [ Links ]
99. Freyman T, Polin G, Osman H, Crary J, Lu M, Cheng L, Palasis M, Wilensky RL. A quantitative, randomized study evaluating three methods of mesenchymal stem cell delivery following myocardial infarction. Eur Heart J. En prensa. [ Links ]
100. Berry MF, Engler AJ, Woo YJ, Pirolli TJ, Bish LT, Jayasankar V, Morine KJ, Gardner TJ, Discher DE, Sweeney HL. Mesenchymal Stem Cell Injection After Myocardial Infarction Improves Myocardial Compliance. Am J Physiol Heart Circ Physiol. En prensa. [ Links ]














