Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de investigación clínica
versión On-line ISSN 2564-8896versión impresa ISSN 0034-8376
Rev. invest. clín. vol.58 no.5 Ciudad de México sep./oct. 2006
Artículo original
Interacciones entre polimorfismos del gen MTHFR, gestaciones e inicio de vida sexual modifican el riesgo para cáncer cérvico–uterino en una población del noreste de México
The effect of MTHFR polymorphisms, pregnancy and first intercourse on cervical cancer in a population from the Northeastern Mexico
Iván Delgado–Enciso,*** Sandra G. Martínez–Garza,* Augusto Rojas–Martínez,* Francisco Espinoza–Gómez,** Luis M. Canseco–Avila,* Oscar Vidal–Gutiérrez,*** José G. Garza–Leal,*** Oralia Barboza–Quintana,**** Juan P. Flores–Gutiérrez,**** Hugo A. Barrera–Saldaña,* Rocío Ortiz–López*
* Departamento de Bioquímica de la Facultad de Medicina, Universidad Autónoma de Nuevo León.
** Facultad de Medicina de la Universidad de Colima.
*** Departamentos de Ginecología y Obstetricia y
**** Anatomía Patológica del Hospital Universitario, Universidad Autónoma de Nuevo León.
Reimpresos:
Dra. Rocío Ortiz–López
Departamento de Bioquímica, Facultad de Medicina.
Universidad Autónoma de Nuevo León.
Av. Francisco. I. Madero y Dr. Aguirre Pequeño s/n. Col. Mitras Centro.
64460, Monterrey, N.L.
Tel: (81) 83294174. Fax: (81) 83337747
Correo electrónico: rortiz@fm.uanl.mx
Recibido el 16 de diciembre de 2005.
Aceptado el 11 de julio de 2006.
ABSTRACT
Objective. To investigate the possible association among MTHFR polymorfhisms, environmental factors and cervical cancer (CC) in the Mexican population.
Methods. Seventy patients with CC and 89 control women were questioned about clinical data and their 677 and 1298 genotypes of MTHFR gene were analized.
Results. Multipregnancies (0–2 vs. > 3, OR 2.1), an early age of first intercourse (IVS) (17 < vs. > 18 years, OR 4.3) or both factors (OR 3.5) were significantly associated with CC. MTHFR 677, 1298 polymorphisms and their combinations were not different between cases and controls. However, a significant association between pregnancies, TVS and MTHFR polymorphisms (presence of 1298C allele or 677TT genotype) was observed. The 1298C allele plus multipregnancies and IVS < 17 years, or both factors, increased 4.3, 5.3, and 11.8 times the risk for CC, respectively, while 677TT genotype changed the risk 2.0, 1.9, and 4.2 times, respectively.
Conclusion. The 1298C allele increases the risk of CC strongly in women with multipregnancies and early age of IVS, while 677TT genotype has a lower risk without becoming a protection factor.
Key words. Cervix neoplasms. Methylenetetrahydrofolate reductase. Folic acid. Pregnancy. First intercourse.
RESUMEN
Objetivo. Buscar la asociación entre polimorfismos de la enzima metilentetrahidrofolato reductasa (MTHFR), factores ambientales y cáncer cérvico–uterino (CaCU) en mujeres del noreste de México.
Métodos. Setenta pacientes con CaCU y 89 mujeres controles se sometieron a un interrogatorio clínico y a genotipificación de los polimorfismos 677C T y 1298A
T y 1298A C del gen MTHFR.
C del gen MTHFR.
Resultados. La multigestación (0–2 vs.> 3, OR 2.1), un temprano inicio de vida sexual (IVS) (17 < vs. > 18 años, OR 4.3) o la combinación de ambos factores (OR 3.5), estuvieron asociados significativamente al CaCU. Los polimorfismos de MTHFR 677, 1298 y sus combinaciones no fueron diferentes entre casos y controles. Sin embargo, se observó una interacción significativa entre las gestaciones, el IVS y los polimorfismos de MTHFR (presencia del alelo 1298C o del genotipo 677TT). El alelo 1298C combinado con multigestación, con un IVS < 17 años, o con ambos factores, incrementó el riesgo para CaCU en 4.3, 5.3 y 11.8 veces, respectivamente, en tanto que el genotipo 677TT modificó este riesgo a 2.0, 1.9, y 4.2 veces, respectivamente.
Conclusión. El alelo 1298C incrementa considerablemente el riesgo para CaCU en mujeres multigestas y con un IVS temprano, en tanto que el genotipo 677TT disminuye este riesgo, pero sin llegar a convertirse en un factor protector.
Palabras clave. Cáncer cérvico–uterino. Metilentetrahidrofalato reductasa. Ácido fólico. Gestación. Inicio de vida sexual.
INTRODUCCIÓN
El cáncer cérvico–uterino (CaCU) es un problema de salud pública en México y en el mundo.1 Es una enfermedad multifactorial y, hasta la fecha, el único factor vinculado directamente con su desarrollo es la infección crónica por los papilomavirus humanos (PVH) de alto riesgo.2 Sin embargo, aunque estos virus sean considerados agentes causales, su presencia en el cervix no equivale al desarrollo forzoso del CaCU, ya que factores genéticos del huésped o ambientales pueden proteger contra la transformación maligna o favorecerla.3
En estudios epidemiológicos4 y ensayos in vitro5 se ha demostrado que nutrientes como el folato podrían jugar un papel protector para el desarrollo de una neoplasia cervical. El mecanismo por el cual el folato podría reducir el riesgo de padecer cáncer no ha sido bien establecido.6 La deficiencia crónica de folato puede causar alteraciones en la síntesis o reparación del DNA,7 así como ocasionar cambios en su metilación, lo cual podría intervenir en la activación de oncogenes y en la inactivación de genes supresores de tumor.8 Además, se ha propuesto que la deficiencia de folato podría favorecer la integración del PVH en el genoma celular.9 Sin embargo, la biodisponibilidad del folato o sus metabolitos no está determinada sólo por la ingesta de éste, ya que diversas enzimas intervienen en su metabolismo. Entre ellas destaca la enzima metilentetrahidrofolato reductasa (MTHFR), que cataliza la síntesis de 5–metiltetrahidrofolato, que es la principal forma de folato circulante, el donador de carbonos para la remetilación de homocisteína a metionina y el precursor de S–adenosilmetionina. La S–adenosilmetionina es el donador universal de grupos metilo para las reacciones de metilación, incluyendo la del DNA.10 En 1995, Frostt et al. encontraron una mutación (polimorfismo) en la posición 677 (T por C) del gen de la MTHFR. Dicha mutación, ya sea en su estado homocigoto 677TT o heterocigoto 677CT, tiene una actividad enzimática significativamente reducida.11 En 1998, otro polimorfismo en la posición 1298 (C por A) del mismo gen de la MTHFR fue descubierto y asociado de igual manera con una actividad enzimática disminuida.12 Adicionalmente, se demostró que la combinación de ambos polimorfismos o heterocigotos mixtos (677CT–1298AC) produce una reducción mayor de la actividad enzimática que la ocasionada por la presencia de un solo polimorfismo.12 Individuos con genotipo 677TT o 1298CC han demostrado hipometilación del DNA,10,13 lo cual puede ser uno de los eventos moleculares que intervienen en fases tempranas de la carcinogénesis cervical.8
Muchos estudios han explorado el papel de las mutaciones del gen MTHFR en la génesis de diversos cánceres. El papel de los polimorfismos del gen MTHFR en lesiones cervicales premalignas o en CaCU es controversial, pues además de que hay pocos estudios, el genotipo 677TT ha sido identificado como factor de riesgo,14–16 como factor protector17 o sin importancia para la génesis del CaCU.18–20 Por otra parte, sobre el polimorfismo 1298 sólo existen dos estudios en CaCU, los cuales no reportan asociación entre ambas variables,19,20 en tanto que la combinación de los dos polimorfismos de MTHFR prácticamente no ha sido estudiada en CaCU.
México cuenta con una muy alta incidencia de CaCU (40.5 por 100,000 habitantes)21 y paralelamente presenta una de las frecuencias más altas en el mundo para la mutación 677T del gen MTHFR.22 Por lo anterior, resulta interesante analizar en población mexicana la asociación entre los polimorfismos del gen MTHFR con el CaCU, así como sus interacciones con factores ambientales.
MATERIAL Y MÉTODOS
Pacientes y controles
Se realizó interrogatorio clínico y después de firmar el consentimiento informado se recolectó sangre periférica en tubos con EDTA de 70 pacientes con diagnóstico anatomopatológico confirmado de CaCU y de 89 controles con citología cérvico–vaginal negativa para neoplasia intraepitelial. El tamaño de la muestra fue calculado para detectar un OR de 2.9, con un nivel de significancia del 95% y una potencia del 85% tomando en cuenta estimaciones previas del polimorfismo 677 de MTHFR en nuestra población.22 Todas las participantes fueron voluntarias y reclutadas en hospitales de referencia de la ciudad de Monterrey, Nuevo León, localidad ubicada en el noreste de México.
Aislamiento del DNA y análisis molecular de las mutaciones del gen MTHFR
De la sangre periférica se aisló DNA genómico mediante una técnica descrita previamente.22 Las genotipificaciones del gen MTHFR en las posiciones 677 y 1298 fueron realizadas mediante PCR y digestión alelo específica, como ha sido previamente descrito.11,12 La digestión para detectar la mutación 677T fue resuelta en electroforesis con geles de agarosa al 3%, en tanto que para detectar la mutación 1298C, se emplearon geles de poliacrilamida al 15%.
Análisis estadístico
De todas las variables analizadas se obtuvieron porcentajes y frecuencias. La frecuencia alélica fue obtenida dividiendo el número de alelos (T o C para 677 y A o C para 1298) entre la totalidad de alelos del grupo analizado. La correlación entre CaCU con los polimorfismos y con los factores ambientales se realizó por regresión logística univariada. La interacción de los factores ambientales con los polimorfismos de MTHFR se determinó mediante un análisis multivariado con discriminación retrógrada de variables (backwars elimination, en inglés), ajuste de Bonferroni y el análisis de los productos de interacción, de acuerdo con lo propuesto por Katz.23 La razón de momios (OR) con su intervalo de confianza (IC) y la 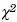 de Wald fue calculada con el programa computarizado Logistic Regression.24 El equilibrio de Hardy–Weinberg para cada alelo en cada población fue calculado usando el programa computarizado "Online HWE and Association Testing (SNP)".25 La estimación de la fracción atribuible poblacional (FAP) se realizó utilizando los OR como equivalente a riesgo relativo, considerando que se trata de un estudio de casos y controles no pareado y con un tiempo de exposición prolongado. La significancia estadística fue interpretada a valores de p < 0.05.
de Wald fue calculada con el programa computarizado Logistic Regression.24 El equilibrio de Hardy–Weinberg para cada alelo en cada población fue calculado usando el programa computarizado "Online HWE and Association Testing (SNP)".25 La estimación de la fracción atribuible poblacional (FAP) se realizó utilizando los OR como equivalente a riesgo relativo, considerando que se trata de un estudio de casos y controles no pareado y con un tiempo de exposición prolongado. La significancia estadística fue interpretada a valores de p < 0.05.
RESULTADOS
El promedio de edad de los casos fue de 46 años (rango de 22 a 73) y el de los controles fue de 44 años (rango de 27 a 69), sin encontrar diferencias significativas entre ambos grupos (IC 95% 0.9–1). Las frecuencias alélicas para 677T y 677C fueron de 0.5 para cada alelo en casos y en controles. Para la mutación 1298C, la frecuencia alélica fue de 0.20 y 0.15 en casos y controles, respectivamente. Las distribuciones genotípicas de los polimorfismos en ambas poblaciones (Cuadro 1) estuvieron acordes con el equilibrio de Hardy–Weinberg. Los polimorfismos 677 o 1298 de MTHFR, analizados por separado o combinados, no se encontraron asociados al desarrollo de CaCU (Cuadro 2).
En cuanto a los factores ambientales estudiados, cabe señalar que para el análisis del inicio de vida sexual activa (IVSA), la edad de corte para un IVSA temprano se tomó a los 18 años considerando que éste es el límite inferior del intervalo de confianza del promedio general de esta variable y que la regresión logística muestra que entre los 17 y 18 años se presenta el punto de inflexión de la curva de correlación (los mayores OR se encuentran entre estos grupos de edad –datos no mostrados). Tomando en cuenta lo anterior, se determinó que el IVSA a los 17 años o menos, la multigestación (tres o más embarazos) o la combinación de ambos elementos fueron factores de riesgo para CaCU (Cuadro 3). El análisis multivariado de las características demográficas muestra que sólo el IVSA temprana y la multigestación continuaron teniendo efecto, independientemente de la edad y entre ambas se nota una discreta interacción positiva.
El cuadro 4 muestra cómo se modifica el riesgo de padecer CaCU con las interacciones que existen entre el IVSA, las gestaciones y los polimorfismos de MTHFR. Se demuestra que el alelo 1298C incrementa considerablemente el riesgo para CaCU en mujeres multigestas y con un IVSA temprano, llegando a elevar el riesgo para CaCU hasta 11 veces cuando este alelo se asocia con ambas variables. Por el contrario, el genotipo 677TT disminuye el riesgo otorgado por un IVSA temprano (de 4.3 a 1.9 veces), así como el riesgo generado por la multigestación, aunque muestra un ligero efecto de riesgo al combinarse con ambas variables. Por otra parte, la edad del diagnóstico, que previamente fue identificada por Sull, et al., como uno de los factores determinantes para que los polimorfismos de MTHFR influyeran en el riesgo de padecer CaCU,15 no presentó relevancia en la población estudiada, tanto de manera aislada como combinada con los polimorfismos de MTHFR (dato no mostrado). Las FAP porcentuales para cada factor de riesgo se muestran en los cuadros 2 y 3. Cabe mencionar que aunque generalmente se recomienda calcular la FAP solamente cuando los OR no cruzan la unidad, en los cuadros 2 y 3 se incluyeron todos los valores con fines ilustrativos, lo cual explica que en algunos puntos el intervalo de confianza de la FAP sea negativo.
DISCUSIÓN
El metabolismo del folato puede intervenir en el desarrollo del CaCU, pues se ha reportado que la infección por PVHs y la cronicidad de la misma se ven reducidas en mujeres con niveles elevados de folato sanguíneo.27 Adicionalmente se ha postulado que la deficiencia de folato podría favorecer la integración del PVH en el genoma celular.9 Tomando en cuenta que la infección por VPH es el principal factor de riesgo para CaCU se puede asumir entonces que el folato podría modificar grandemente el riesgo para desarrollar esta neoplasia. Los niveles sanguíneos de folato dependen en gran medida de la ingesta y de las diversas enzimas que intervienen en su metabolismo, entre las cuales destacan la MTHFR y la dihidrofolato reductasa (DHFR). El presente trabajo sobre CaCU no determinó la ingesta o los niveles sanguíneos de folato y se enfocó únicamente al estudio de polimorfismos del gen de la MTHFR, la cual es la enzima del metabolismo del folato más estudiada y asociada a neoplasias. A continuación se discuten los resultados obtenidos al respecto.
En el grupo control, las frecuencias alélicas y genotípicas de los polimorfismos de MTHFR son similares a lo previamente reportado para población mexicana22,28–32 o para descendientes mexicanos residentes en Estados Unidos de América (EUA).33 Estos resultados confirman que la población mexicana presenta uno de los más altos porcentajes de homoci–gotos 677TT (22.5% en nuestro estudio, distribución mundial con rango de 2 a 30%),34 que se combina con una de las frecuencias más bajas reportadas para homocigotos 1298C (2.2% en nuestro estudio, distribución mundial con rango de 1.4 a 12.8%).35 Esto último es congruente con la idea que sostiene que la evolución compensa la alta frecuencia de la mutación 677T con una baja presencia de la 1298C.36 Es importante destacar que encontramos 2.2% de homocigotos 1298C, lo cual es muy similar a lo publicado recientemente para una población del centro de México (2.3%),37 rechazando los reportes que mencionan que este genotipo es nulo en nuestra población.36,38 La frecuencia de heterocigotos compuestos 677CT–1298AC (18%) fue similar a la de Turquía (21.6%), Holanda (20%) y Canadá (15%), pero muy superior a la de afroamericanos (4–6%).33,39
El análisis de los polimorfismos 677 y 1298 de MTHFR, por separado o combinados entre sí, no muestran ninguna asociación con CaCU, siendo esto concordante con estudios previos.18,20 Sin embargo, cuando se combinan los polimorfismos de MTHFR con el IVSA temprano y la multigestación, se observa una interacción significativa que modifica el riesgo de padecer CaCU. El resultado más relevante del presente estudio es la interacción positiva existente entre el alelo 1298C con el IVSA temprano y la multigestación. Este alelo eleva el riesgo de la multigestación de 2.1 a 4.3 veces y el del IVSA temprano de 4.3 a 5.3 veces. Sin embargo, la interacción más importante ocurre cuando se combina la multigestación y el IVSA temprano, ya que en las mujeres con estos dos factores, el alelo 1298C eleva de 3.5 a 11.8 veces el riesgo de padecer CaCU. Este alelo no ha sido reportado previamente como factor de riesgo en CaCU; sin embargo, sí ha sido identificado como tal (combinado con factores ambientales) en cáncer de esófago.40 El alelo 1298C de MTHFR podría intervenir en la génesis del CaCU al ocasionar hipometilación del DNA,13 lo cual se ha propuesto como uno de los eventos moleculares que intervienen en fases tempranas de la carcinogénesis.8 Este riesgo sólo sería significativo tras múltiples embarazos o cuando se comienza la exposición a PVHs (mediante el IVSA) en edades tempranas, cuando según diversos autores, el epitelio cervical es más susceptible a la infección por estos virus.41,42 Previamente se ha establecido que un IVSA temprano incrementa la prevalencia de infecciones por PVHs,43,44 por lo que es probable que la interacción encontrada entre IVSA temprana y el alelo 1298C de MTHFR pueda ser un reflejo de una interacción directa entre infección por PVH y MTHFR.
Otros resultados interesantes son las FAP porcentuales. Estos datos nos indican el porcentaje de la incidencia de CaCU que podría ser quitada si el factor de riesgo es eliminado de la población. Con base en ello se determinó que la incidencia de CaCU podría reducirse en un 47 o 36% si el IVSA temprano o la multigestación fueran eliminados, lo cual tiene implicaciones sanitarias muy relevantes y dignas de consideración en programas de salud pública. Por otra parte, la combinación del IVSA temprano y/o la multigestación con el alelo 1298C, a pesar de elevar grandemente el riesgo en las mujeres portadoras de esta combinación, la FAP no es tan elevada (19 o 20%) debido a que la prevalencia de esta combinación (exposición) es muy baja en la población.
Por otra parte, el genotipo 677TT disminuye el riesgo otorgado por un IVSA temprano y por la multigestación. Este resultado es contrario a lo reportado por Piyathilake, et al., quienes encontraron que pacientes que han tenido partos y que son portadoras del alelo 677T, tienen 23 veces más riesgo de desarrollar una neoplasia cervical.16 También es contrario a lo encontrado por Sull, et al., los cuales mencionan que en mujeres menores de 40 años, el riesgo para CaCU conferido por la multiparidad (dos o más partos) o el IVSA antes de los 26 años, se incrementa en combinación con el genotipo 677TT (de 2.1 a 3.9 veces y de 2.2 a 4.2 veces, respectivamente).15 Sin embargo, el que el genotipo 677TT disminuya el riesgo de la multigestación y del IVSA temprano, concuerda con dos recientes estudios que identifican al alelo 677T como un factor protector para displasias cervicales45 y CaCU,17 aunque esta protección no fue determinada con base en el riesgo otorgado por otros factores. La protección del genotipo 677TT para una neoplasia también ha sido informada de manera clara para algunos tipos de leucemias,46 para cáncer de vejiga47 y en algunos reportes sobre cáncer de colon.48 Sin embargo, el mecanismo por el cual este genotipo ayuda a proteger a los individuos de padecer una neoplasia no ha sido claramente dilucidado. Se ha propuesto que la actividad reducida de la enzima MTHFR ocasiona una transformación menos eficiente de 5, 10, metilenetetrahidrofolato a 5 metilenetetrahidrofolato, lo cual ocasiona alteraciones en el ciclo de la homocisteína, pero trae consigo una acumulación intracelular de los metabolitos del folato que intervienen en el proceso de síntesis de DNA, lo cual podría conferir el factor protector.46
En CaCU y en todos los tipos de neoplasias, el polimorfismo 1298 de MTHFR ha sido mucho menos estudiado que el polimorfismo 677 y en pocas ocasiones se estudian las interacciones de los polimorfismos con factores ambientales. En el presente estudio encontramos que el polimorfismo 1298 puede jugar un papel muy importante en la génesis del CaCU cuando se combina con factores ambientales, lo que indica que es muy aconsejable incluir a este polimorfismo cuando se investiga el gen MTHFR en neoplasias. También es relevante señalar que aunque los alelos 677T y 1298C de MTHFR ocasionan un decremento sobre la actividad enzimática, sin duda ambas mutaciones pueden tener implicaciones diferentes en la génesis de los cánceres, pues en algunas neoplasias el alelo 677T puede estar asociado sin que el alelo 1298 tenga relevancia y viceversa.49,50 En la población estudiada se puede inferir que ambos polimorfismos influyen de manera diferente en los diversos procesos en los cuales la enzima MTHFR está involucrada, pues mientras el 1298C incrementa el riesgo de CaCU, el 677T lo reduce.
Finalmente, cabe mencionar que a pesar de que la muestra estudiada no es grande, lo cual se refleja en lo amplio de los intervalos de confianza, las principales asociaciones resultan muy significativas, incluyendo sus respectivos valores de FAP, que en algunos casos alcanza niveles de alta prioridad y por tanto podrían ser extrapolados con certidumbre a la población, por lo menos a la del noreste de México. En conclusión podemos decir que existe una interacción entre los polimorfismos de MTHFR, la multigestación y el IVSA temprano en la población estudiada. Dicha interacción propicia que el alelo 1298C incremente fuertemente el riesgo para CaCU en mujeres multigestas y con un IVS temprano; en tanto que el genotipo 677TT disminuye este riesgo, sin que llegue a considerarse un factor protector. Diferencias ambientales entre distintas poblaciones podrían explicar los resultados diversos que se han encontrado cuando se estudian los polimorfismos de MTHFR en relación con CaCU u otras neoplasias y hace imprescindible tomar en cuenta a los factores ambientales en futuros estudios. Investigaciones en diversas poblaciones son necesarias para seguir evaluando el papel de los polimorfismos en el gen MTHFR y su relación con factores ambientales en la génesis de CaCU.
REFERENCIAS
1. World Health Organization. Annex Table 2 Deaths by cause, sex and mortality stratum in WHO regions, estimates for 2002. In: The World Health Report 2003. [ Links ]
2. Lowy DR, Howley PM. Papillomaviruses (chapter 66). In: Fields Virology, 4th edition. Fields BN, Howley PM, Griffin DE (Editors). Philadelphia, EU: Lippincott Williams & Wilkins Publishers; 2001, pp. 2197–2264. [ Links ]
3. Delgado El, Rojas MA, Barrera SHA, Ortiz LR. Los virus: Una importante causa de neoplasias en los seres humanos. Rev Invest Clin 2004; 56: 495–506. [ Links ]
4. Hernandez BY, McDuffie K, Wilkens LR, Kamemoto L, Goodman MT. Diet and premalignant lesions of the cervix: evidence of a protective role for folate, riboflavin, thiamin, and vitamin B12. Cancer Causes Control 2003; 14: 859–70. [ Links ]
5. Mathur RS, Mathur SP. In vitro downregulation of growth factors by insulin–like growth factor binding protein–3 in cervical cancer. Gynecol Oncol 2003; 91: 410–15. [ Links ]
6. Piyathilake CJ, Henao OL, Macaluso M, Cornwell PE, Meleth S, Heimburger DC, Partridge EE. Folate is associated with the natural history of high–risk human papillomaviruses. Cancer Res 2004; 64: 8788–93. [ Links ]
7. Giovannucci E, Stampfer MJ, Colditz GA, Hunter DJ, Fuchs C, Rosner BA, Speizer FE, Willett WC. Multivitamin use, folate, and colon cancer in women in The Nurses' Health Study. Ann Intern Med 1998; 129: 517–24. [ Links ]
8. Fowler BM, Giuliano AR, Piyathilake C, Nour M, Hatch K. Hypomethylation in cervical tissue: is there a correlation with folate status? Cancer Epidemiol Biomarkers Prev 1998; 7: 901–6. [ Links ]
9. Eichholzer M, Luthy J, Moser U, Fowler B. Folate and the risk of colorectal, breast and cervix cancer: the epidemiological evidence. Swiss Med Wkly 2001; 131: 539–49. [ Links ]
10. Stern LL, Mason JB, Selhub J, Choi SW. Genomic DNA hypomethylation, a characteristic of most cancers, is present in peripheral leukocytes of individuals who are homozygous for the C677T polymorphism in the methylenetetrahydrofolate reductase gene. Cancer Epidemiol Biomarkers Prev 2000; 9: 849–53. [ Links ]
11. Frosst P, Blom HJ, Milos R, Goyette P, Sheppard CA, Matthews RG, Boers GJ, den Heijer M, Kluijtmans LA, van den Heuvel LP, et al. A candidate genetic risk factor for vascular disease: a common mutation in methylenetetrahydrofolate reductase. Nat Genet 1995; 10: 111–13. [ Links ]
12. van der Put NM, Gabreels F, Stevens EM, Smeitink JA, Trijbels FJ, Eskes TK, van den Heuvel LP, Blom HJ. A second common mutation in the methylenetetrahydrofolate reductase gene: an additional risk factor for neural–tube defects? Am J Hum Genet 1998; 62: 1044–51. [ Links ]
13. Friso S, Girelli D, Trabetti E, Olivieri O, Guarini P, Pignatti PF, Corrocher R, Choi SW. The MTHFR 1298A>C polymorphism and genomic DNA methylation in human lymphocytes. Cancer Epidemiol Biomarkers Prev 2005; 14: 938–43. [ Links ]
14. Goodman MT, McDuffie K, Hernandez B, Wilkens LR, Bertram CC, Killeen J, Le Marchand L, Selhub J, Murphy S, Donlon TA. Association of methylenetetrahydrofolate reductase polymorphism C677T and dietary folale wilh Ihe risk of cervical dysplasia. Cancer Epidemiol Biomarkers Prev 2001; 10: 1275–80. [ Links ]
15. Sull JW, Jee SH, Yi S, Lee JE, Park JS, Kim S, Ohrr H. The effect of methylenetetrahydrofolate reductase polymorphism C677T on cervical cancer in Korean women. Gynecol Oncol 2004; 95: 557–63. [ Links ]
16. Piyalhilake CJ, Macaluso M, Johanning GL, Whileside M, Heimburger DC, Giuliano A. Methylenetetrahydrofolate reductase (MTHFR) polymorphism increases the risk of cervical intraepithelial neoplasia. Anticancer Res 2000; 20: 1751–7. [ Links ]
17. Zoodsma M, Nolte IM, Schipper M, Oosterom E, van der Steege G, de Vries EG, te Meerman GJ, van der Zee AG. Methylenetetrahydrofolate reductase (MTHFR) and susceptibility for (pre)neoplastic cervical disease. Hum Genet 2005; 116: 247–54. [ Links ]
18. Lambropoulos AF, Agorastos T, Foka ZJ, Chrisafi S, Constantinidis TC, Bontis J, Kotsis A. Methylenetetrahydrofolate reductase polymorphism C677T is not associated to the risk of cervical dysplasia. Cancer left 2003; 191: 187–91. [ Links ]
19. Kang S, Kim JW, Kang GH, Park NH, Song YS, Kang SB, Lee HP. Polymorphism in folate– and methionine–metabolizing enzyme and aberrant CpG island hypermethylation in uterine cervical cancer. Gynecol Oncol 2005; 96: 173–80. [ Links ]
20. Gerhard DS, Nguyen LT, Zhang ZY, Borecki IB, Coleman BI, Rader JS. A relationship between methylenetetrahydrofolate reductase variants and the development of invasive cervical cancer. Gynecol Oncol 2003; 90: 560–5. [ Links ]
21. Wrong diagnosis 2004. Prevalence and incidence of cervical cancer. Available from URL: http://www.wrongdiagnosis.com/c/cervical_cancer/prevalence.htm (Accessed 2005 July 28). [ Links ]
22. Delgado–Enciso I, Martinez–Garza SG, Rojas–Martinez A, Ortiz–Lopez R, Bosques–Padilla F, Calderon–Garciduenas AL, Zarate–Gomez M, Barrera–Saldana HA. 677T mutation of the MTHFR gene in adenomas and colorectal cancer in a population sample from the Northeastern Mexico. Preliminary results. Rev Gastroenterol Mex 2001; 66: 32–7. [ Links ]
23. Katz MH. Multivariable analysis. Chap 9, Cambridge UK Cambridge University Press; 1999, pp. 118–40. [ Links ]
24. Pezullo JC, Svllivan KM. Logistic regression, version 05–07–20, Available from URL: http://members.aol.com/johnp71/logistic.htm (Accessed 2005 July 28) [ Links ]
25. Strom TM, Wienker TF. Online HWE and Association Testing (SNP). Available from URL: http://ihg.gsf.de/cgi-bin/hw/hwa1.p1 (Accessed 2005 nov 28). [ Links ]
26. Shah SM, Arif AA, Delclos GL, Khan AR. Prevalence and correlates of smoking on the roof of the world. Tob Control. 2001; 10:4. [ Links ]
27. Piyathilake CJ, Henao OL, Macaluso M, Cornwell PE, Meleth S, Heimburger DC, Partridge EE. Folate is associated with the natural history of high–risk human papillomaviruses. Cancer Res 2004; 64: 8788–93. [ Links ]
28. Martinez de Villarreal LE, Delgado–Enciso I, Valdez–Leal R, Ortiz–Lopez R, Rojas–Martinez A, Limon–Benavides C, et al. Folate levels and N(5),N(10)–methylenetetrahydrofolate reductase genotype (MTHFR) in mothers of offspring with neural tube defects: a case–control study. Arch Med Res 2001; 32: 277–82. [ Links ]
29. Mutchinick OM, Lopez MA, Luna L, Waxman J, Babinsky VE. High prevalence of the thermolabile methylenetetrahydrofolate reductase variant in Mexico: a country with a very high prevalence of neural tube defects. Mol Genet Metab 1999; 68: 461–7. [ Links ]
30. Ruiz–Arguelles GJ, Garces–Eisele J, Reyes–Nunez V, Ramirez–Cisneros FJ. Primary thrombophilia in Mexico. II. Factor V G1691A (Leiden), prothrombin G20210A, and methylenetetrahydrofolate reductase C677T polymorphism in thrombophilic Mexican mestizos. Am J Hematol 2001; 66: 28–31. [ Links ]
31. González–Herrera L, García–Escalante G, Caslillo–Zapala I, Canto–Herrera J, Ceballos–Quintal J, Pinlo–Escalante D, el al. Frequency of the thermolabile variant C677T in the MTHFR gene and lack of association with neural tube defects in the State of Yucatan, Mexico. Clin Genet 2002; 62: 394–8. [ Links ]
32. Wilcken B, Bamforth F, Li Z, Zhu H, Ritvanen A, Renlund M, Stoll C, Alembik Y, Dott B, Czeizel AE, Gelman–Kohan Z, et al. Geographical and ethnic variation of the 677C>T allele of 5,10 methylenetetrahydrofolate reductase (MTHFR): findings from over 7000 newborns from 16 areas world wide. J Med Genet 2003; 40: 619–25. [ Links ]
33. Esfahani ST, Cogger EA, Caudill MA. Heterogeneity in the prevalence of methylenetetrahydrofolate reductase gene polymorphisms in women of different ethnic groups. J Am Diet As–soc 2003; 103: 200–7. [ Links ]
34. Botto LD, Yang Q. 5,10–Methylenetetrahydrofolate reductase gene variants and congenital anomalies: a HuGE review. Am J Epidemiol 2000; 151: 862–77. [ Links ]
35. Robien K, Ulrich CM. 5,10–Methylenetetrahydrofolate reductase polymorphisms and leukemia risk: a HuGE minireview. Am J Epidemiol 2003; 157: 571–82. [ Links ]
36. Reyes–Engel A, Munoz E, Gaitan MJ, Fabre E, Gallo M, Die–guez JL, Ruiz M, Morell M. Implications on human fertility of the 677C T and 1298A
T and 1298A C polymorphisms of the MTHFR gene: consequences of a possible genetic selection. Mol Hum Reprod 2002; 8: 952–7. [ Links ]
C polymorphisms of the MTHFR gene: consequences of a possible genetic selection. Mol Hum Reprod 2002; 8: 952–7. [ Links ]
37. Gueant–Rodriguez RM, Gueant JL, Debard R, Thirion S, Hong LX, Bronowicki JP, et al. Prevalence of methylenetetrahydrofolate reductase 677T and 1298C alleles and folate slalus: a comparative sludy in Mexican, West African, and European populations. Am J Clin Nutr 2006; 83: 701–7. [ Links ]
38. Barber R, Shalal S, Hendricks K, Joggerst B, Larsen R, Suarez L, Finnell R. Investigation of folale pathway gene polymorphisms and Ihe incidence of neural tube defects in a Texas hispanic population. Mol Genet Metab 2000; 70: 45–52. [ Links ]
39. Sazci A, Ergul E, Kaya G, Kara I. Genotype and allele frequencies of the polymorphic methylenetetrahydrofolate reductase gene in Turkey. Cell Biochem Fund 2005; 23: 51–4. [ Links ]
40. Gao CM, Toshiro T, Wu JZ, Cao HX, Liu YT, Ding JH, Li SP, Su P, Hu X, Kai HT, Kazuo T. A case–control study on the polymorphisms of methylenetetrahydrofolate reductase 1298A C and susceptibility of esophageal cancer. Zhonghua Liu Xing BingXue Za Zhi 2004; 25: 341–5. [ Links ]
C and susceptibility of esophageal cancer. Zhonghua Liu Xing BingXue Za Zhi 2004; 25: 341–5. [ Links ]
41. Chaouki N, Bosch FX, Munoz N, Meijer CJ, El Gueddari B, El Ghazi A, Deacon J, Castellsague X, Walboomers JM. The viral origin of cervical cancer in Rabal, Morocco. Int J Cancer 1998; 75: 546–54. [ Links ]
42. Munoz N, Bosch FX, de Sanjose S, Shah KV. The role of HPV in the etiology of cervical cancer. Mutat Res 1994; 305: 293–301. [ Links ]
43. Collins SI, Mazloomzadeh S, Winter H, Rollason TP, Blomfield P, Young LS, Woodman CB. Proximity of first intercourse to menarche and the risk of human papillomavirus infection: a longitudinal study. Int J Cancer 2005; 114: 498–500. [ Links ]
44. Collins SI, Mazloomzadeh S, Winter H, Rollason TP, Blomfield P, Young LS, Woodman CB. Proximity of first intercourse to menarche and the risk of human papillomavirus infection: a longitudinal study. Int J Cancer 2005; 114: 498–500. [ Links ]
45. Henao OL, Piyathilake CJ, Waterbor JW, Funkhouser E, Johanning GL, Heimburger DC, Partridge EE. Women with polymorphisms of methylenetetrahydrofolate reductase (MTHFR) and methionine synthase (MS) are less likely to have cervical intraepithelial neoplasia (CIN) 2 or 3. Int J Cancer 2005; 113: 991–7. [ Links ]
46. Wiemels JL, Smith RN, Taylor GM, Eden OB, Alexander FE, Greaves MF. United Kingdom Childhood Cancer Study investigators. Methylenetetrahydrofolate reductase (MTHFR) polymorphisms and risk of molecularly defined subtypes of childhood acule leukemia. Proc Natl Acad Sci USA 2001; 98: 4004–9. [ Links ]
47. Moore LE, Wiencke JK, Bales MN, Zheng S, Rey OA, Smith AH. Investigation of genetic polymorphisms and smoking in a bladder cancer case–control study in Argentina. Cancer Lett 2004; 211: 199–207. [ Links ]
48. Polymorphisms in genes involved in folate metabolism and colorectal neoplasia: a HuGE review. Am J Epidemiol 2004; 159(5): 423–43. [ Links ]
49. Shrubsole MJ, Gao YT, Cai Q, Shu XO, Dai Q, Hebert JR, Jin F, Zheng W. MTHFR polymorphisms, dietary folate intake, and breast cancer risk: results from the Shanghai Breast Cancer Study. Cancer Epidemiol Biomarkers Prev 2004; 13: 190–6. [ Links ]
50. Keku T, Millikan R, Worley K, Winkel S, Eaton A, Biscocho L, Martin C, Sandier R. 5,10–Methylenetetrahydrofolate reductase codon 677 and 1298 polymorphisms and colon cancer in African Americans and whites. Cancer Epidemiol Biomarkers Prev 2002; 11: 1611–21. [ Links ]














