Services on Demand
Journal
Article
Indicators
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de investigación clínica
On-line version ISSN 2564-8896Print version ISSN 0034-8376
Rev. invest. clín. vol.58 n.5 Ciudad de México Sep./Oct. 2006
Artículo original
Enfermedad de Kikuchi–Fujimoto (linfadenitis histiocítica necrosante). Estudio clinicopatológico e inmunohistoquímico de 14 casos y su diagnóstico diferencial con otras linfadenitis necrosantes reactivas y neoplásicas
Kikuchi–Fujimoto disease (histiocytic necrotizing lymphadenopathy) clinicopathologic and immunohistochemical study of 14 cases and its differential diagnosis with other reactive and neoplastic necrotizing lymphadenopathies
Macrina Gutiérrez–Castro,* Beatriz De León–Bojorge,* Teresa Cuesta–Mejías,* Javier Baquera–Heredia,* –Alvaro Padilla–Rodríguez,*,** Carlos Ortiz–Hidalgo*,**
* Departamento de Patología, Centro Médico ABC.
** Departamento de Biología Celular y Tisular. Universidad Panamericana.
Reimpresos:
Dr. Carlos Ortiz Hidalgo
Departamento de Patología Centro Médico ABC
Sur 136 No. 116 Col. Las Americas
01120, México, D.F.
Tel: 5230–8171
Correo electrónico: cortiz@abchospital.com
Recibido el 28 de febrero de 2006.
Aceptado el 21 de junio de 2006.
ABSTRACT
Kikuchi–Fujimoto disease also known as histiocytic necrotizing lymphadenopaty (HNL) is a rare entity, originally described in Japanese population, although currently it has been described all over the world. It is more frequent in young women and it is usually located in cervical lymph nodes. We report 14 cases of HNL in Mexican population, their clinicopathological and immunohistochemical study as well as a comparative study with other necrotizing lymphadenopaties due to B or T–cell lymphomas, tuberculosis, Epstein Barr virus infection, and non–specific necrosis. In our study we found that there was more expression of the immunomarkers CD68, MPO, CD123 and antikerat in OSCAR in the cases of HNL in contrast with the lesser or even null expression of the same markers in the necrotized lymph nodes of the comparative study group.
Key words. Kikuchi–Fujimoto disease. Necrotizing lymphadenitis. Plasmocytoid dendrocytes. Citokeratin positive interstitial reticulum cells.
RESUMEN
La enfermedad de Kikuchi–Fujimoto o linfadenitis histiocítica necrosante (LHN) es una entidad poco frecuente, inicialmente descrita en población japonesa. Sin embargo, actualmente se ha descrito alrededor de todo el mundo. Es más frecuente en mujeres jóvenes y su localización habitual es en ganglios linfáticos cervicales. Presentamos estudio clinicopatológico de 14 casos de LHN en pacientes mexicanos, y los comparamos con linfadenitis necrosantes secundarias a linfomas B y T, tuberculosis, virus de Epstein Barr y necrosis inespecífica. Encontramos mayor expresión de los anticuerpos CD68, MPO, CD 123 y antiqueratina OSCAR en los casos de LHN comparados con la expresión baja o nula de los mismos anticuerpos en las necrosis ganglionares del grupo comparativo.
Palabras clave. Enfermedad de Kikuchi–Fujimoto. Linfadenitis necrosante. Dendrocitos plasmocitoides. Células intersticiales reticulares citoquetarinas positivas.
INTRODUCCIÓN
La enfermedad de Kikuchi–Fujimoto o linfadenitis histiocítica necrosante (LHN) sin infiltración granulocítica, fue descrita en 1972 de forma independiente por dos patólogos japoneses, Kikuchi1 y Fujimoto.2 Posteriormente se publicaron casos aislados, o series clinicopatológicas similares en otras partes del mundo.3–9 La LHN es un proceso que afecta sobre todo a mujeres, habitualmente en la tercera década de la vida, aunque se han descrito casos desde los dos años de edad10 hasta los 75 años.6 Se caracteriza por crecimiento de ganglios linfáticos cervicales frecuentemente dolorosos, que suelen asociarse con fiebre (en 30 a 50% de los casos) y leucopenia (en 25 a 58%). Su curso es autolimitado, desaparece habitualmente entre dos a tres meses, siendo poco frecuentes las recidivas, que éstas han sido informadas en aproximadamente 3% de los casos, alguna vez hasta 12 años después.11 Los ganglios afectados presentan morfología peculiar que es diagnóstica (vide infra); sin embargo, la diferenciación con procesos linfoproliferativos malignos, como linfomas, o reactivos, como el lupus eritematoso sistémico (LES), puede resultar extremadamente difícil.3–9 Menos frecuentemente, la LHN puede afectar ganglios no cervicales o presentarse como poliadenopatías múltiples (se presentan poliadenopatías en 1.3 a 22.2% de los casos).3,6,9 Algunos síntomas ocasionales que manifiestan los pacientes de LHN son: pérdida de peso, vómitos, hepatoesplenomegalia, erupciones cutáneas, sudoración nocturna, dolor musculoesquelético, dolor torácico o abdominal o incluso diversos síntomas neurológicos.4,6,12 La rara afectación extraganglionar está documentada en la piel, miocardio y médula ósea. 4,9,12,13–18
Histológicamente en los ganglios linfáticos se distinguen áreas focales de necrosis en parches, con infiltrados de histiocitos (que coexpresan CD68 y mieloperoxidasa), dendrocitos plasmocitoides (CD123 positivos) e inmunoblastos, mezclados con restos (detritos) celulares y ausencia característica de neutrófilos. Además, hay participación de las llamadas células reticulares intersticiales citoqueratina positivas (CIRC). Este cuadro histológico se puede identificar alternando con áreas de hiperplasia folicular y expansión paracortical. La LHN puede presentarse en tres formas histológicas que son: tipo proliferativo, tipo necrosante y tipo xantomatoso (vide infra), y su diagnóstico diferencial se hace con otras linfadenitis necrosantes como la del lupus eritematoso sistémico, linfadenitis necrosantes reactivas, así como linfomas necrosados.
En este trabajo informamos las características clinicopatológicas e inmunohistoquímicas de 14 casos de ganglios linfáticos con diagnóstico de enfermedad de Kikuchi–Fujimoto o linfadenitis histiocítica necrosante, haciendo énfasis en la expresión inmunohistoquímica de histiocitos, dendrocitos plasmocitoides y células intersticiales reticulares citoqueratina positivas (CIRC). Además, comparamos la inmunohistoquímica de casos de LHN con la de ganglios linfáticos necrosados por otras causas como linfomas no Hodgkin T, linfomas no Hodgkin B difuso de células grandes, linfadenopatía por lupus, tuberculosis y necrosis por virus de Epstein–Barr.
MATERIAL Y MÉTODOS
De los archivos del Departamento de Patología de Centro Médico ABC, se seleccionaron 14 casos diagnosticados como linfadenopatía histiocítica necrosante (LHN) o enfermedad de Kikuchi–Fujimoto. Además, se escogieron 10 casos de ganglios linfáticos necrosados, por otras causas diferentes a la LHN, que incluyeron: linfadenitis lúpica (dos casos), linfadenitis granulomatosa tuberculosa (dos casos), linfoma B difuso de células grandes (dos casos), linfoma T (un linfoma anaplásico de células grandes y un linfoma T periférico –sin otra especificación–) (dos casos), ganglio linfático con necrosis acentuada inespecífica (un caso), y necrosis ganglionar por virus Epstein–Barr (EBV) (un caso).
Se realizaron cuatro cortes de cada bloque de parafina seleccionado para análisis por inmunohistoquímica con los siguientes anticuerpos: CD68 (clona PG–M1, DAKO/dilución l:50/tiempo de incubación dos horas/recuperación con Trilogy), Mieloperoxidasa (MPO) (Cell Marque/dilución l:1000/tiempo de incubación 30 minutos/sin recuperación), OSCAR (queratina 7, 8, 18, 19, Phenopath, Seatle Washington/Alien Gown/dilución l:50/tiempo de incubación dos horas/recuperación con Trilogy) y CD123 (eBioscience/dilución l:50/tiempo de incubación dos horas/recuperación con Trilogy).
La interpretación de las inmunorreacciones de todos los anticuerpos estudiados fue de la siguiente manera: tres + + + cuando la positividad fue en 65 a 100% de las células evaluadas; dos + + cuando la positividad fue en 30 a 65% de las células evaluadas; una + cuando la positividad fue en 5 a 30% de células evaluadas y negativa cuando la marcación fue menos de 5% o no había reacción en ninguna de las células evaluadas.
RESULTADOS
Se obtuvieron 14 biopsias de ganglio linfático con diagnóstico de LHN (Cuadro 1). En seis de los casos no pudimos obtener la edad de los pacientes. De los ocho casos restantes, las edades variaron entre tres y 37 años, con un promedio de 34.47 y una mediana de 37. Hubo 11 mujeres y tres hombres. Los ganglios linfáticos estuvieron localizados en: cuello (cervical) 11 casos, un caso en ganglio axilar (sin especificar lado) y en dos casos no tuvimos la información.

En el grupo comparativo se estudiaron 10 biopsias de ganglios linfáticos con necrosis, diagnosticados como: linfadenitis lúpica (dos casos), linfadenitis granulomatosa por tuberculosis (dos casos), linfoma no Hodgkin B difuso de células grandes (dos casos), linfoma no Hodgkin T, dos casos (uno periférico –sin otra especificación– y otro linfoma anaplásico de células grandes), ganglio linfático con necrosis inespecífica (un caso), y una necrosis ganglionar por virus Epstein–Barr (EBV) (un caso).
Los resultados en cada grupo fueron los siguientes:
Enfermedad de Kikuchi–Fujimoto (14 casos)
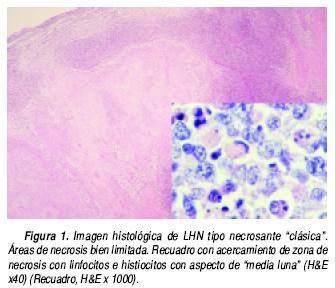
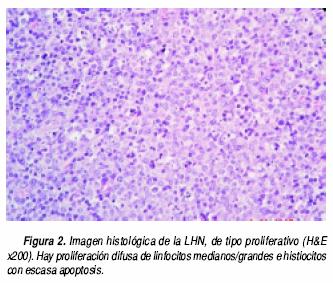
Once de los casos correspondieron al tipo necrosante, dos casos al tipo xantomatoso y uno al tipo proliferativo. Los 11 casos del tipo necrosante presentaron extensa necrosis coagulativa del tejido linfoide, con apoptosis (cariorrexis), y ausencia de polimorfonucleares neutrófilos. La necrosis estaba predominantemente localizada en la zona paracortical, con extensión variable a la corteza y médula (Figura 1). La necrosis estaba rodeada por mantos de histiocitos de núcleos irregulares hipercromáticos, algunos de ellos con aspecto de "medialuna" (Figura 1), con abundante citoplasma eosinófilo. Los dos casos del tipo proliferativo estaban compuestos por una mezcla de histiocitos y monocitos plasmocitoides, con distribución difusa y escaso componente ganglionar residual. No presentaban necrosis, como la observada en el tipo necrosante, pero había un número variable de células con apoptosis (fragmentos nucleares cariorrécticos) (Figura 2). Si predominaba la presencia de histiocitos espumosos se clasificó como tipo xantomatoso (dos casos), independientemente de la presencia o ausencia de necrosis (Figura 3). En dos casos hubo combinación de tipos que incluyeron necrótico y xantomatoso (ver Discusión).

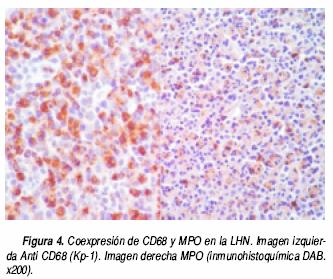
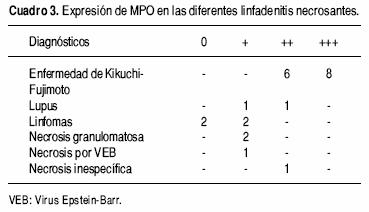
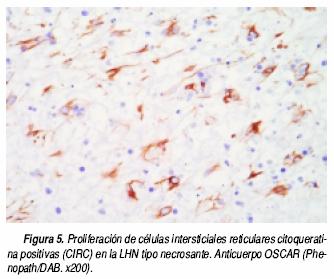
Por inmunohistoquímica (Cuadro 2) todos los casos de enfermedad de Kikuchi–Fujimoto fueron positivos en el componente histiocítico con el anticuerpo CD68, tanto de la zona de necrosis como en las áreas reactivas adyacentes. Todos los casos presentaron expresión de MPO en los mismos histiocitos positivos al CD68 (Figura 4) (Cuadro 3). Con el anticuerpo OSCAR, hubo inmunomarcación positiva en las CIRC en todos los casos. Las CIRC tenían núcleo pequeño ovalado, con cromatina granular y pequeño nucléolo, con escaso citoplasma de aspecto "dendrítico". Esta positividad fue exclusiva en las CIRC, citoplásmica y membranosa, y predominaron alrededor de la necrosis –con escasas células positivas dentro de la necrosis– y en la zona subcapsular de los ganglios linfáticos (Figura 5). Todos los casos presentaron en forma aislada o en grupos, numerosos dendrocitos plasmocitoides (DP) que predominaron alrededor de vénulas de endotelio alto y algunos con disposición subcapsular y otros rodeando la zona de necrosis. Estos DP presentaron núcleo de cromatina finamente granular y citoplasma escaso y resultaron positivos al CD 123 con expresión variable (Cuadro 4) (Figura 6).


Grupo comparativo
En los casos de pacientes diagnosticados con lupus eritematoso sistémico y linfadenitis (linfadenitis lúpica) (dos casos) los ganglios linfáticos presentaron necrosis en forma geográfica, moderada hiperplasia folicular con inmunoblastos y células plasmáticas irregularmente esparcidas, además de incremento en la vasculatura y presencia de cuerpos hematoxifílicos, distribuidos en forma irregular. Por inmunomarcación el CD68 presentó positividad de 1+ y 2 + , con coexpresión de MPO de 2+ y 1 + , respectivamente, en componente histiocítico. Con el anticuerpo anti–queratina OSCAR, un caso presentó positividad en escasas células CIRC, bordeando las zona de necrosis, y el otro fue negativo. Con el CD123, un caso presentó escasos dendrocitos plasmocitoides, de distribución predominante perivascular y el otro fue negativo.
Los dos casos de linfadenitis granulomatosa por tuberculosis, presentaron granulomas epitelioides con necrosis caseosa, rodeados por células gigantes tipo Langhans, células epitelioides y linfocitos, además se encontró positividad por inmunohistoquímica para el anticuerpo anti–PPD y bacilos ácido–alcohol resistentes. Por inmunomarcación hubo expresión en el componente histiocítico con CD68, presentando coexpresión de MPO de 1+ en ambos casos. Con el anticuerpo OSCAR, se resaltó el componente de CIRC con positividad leve en un caso, y fue negativo en el otro. Estas CIRC estaban en el tejido linfoide no necrótico, distribuidas uniformemente. Por medio de la inmunomarcación con CD123, se identificaron, en los dos casos, dendrocitos plasmocitoides con intensidad de 2+ y 1 + , respectivamente, formando grupos alrededor de vénulas de endotelio alto y en forma focal bordeando un granuloma.
El caso del ganglio con necrosis inespecífica presentó infarto del parénquima ganglionar con abundantes neutrófilos e histiocitos, lo cual descartó el diagnóstico de LHN. Por inmunohistoquímica la población linfoide fue mixta (células B y células T), y la inmunomarcación para queratina negativa, lo que descartó proceso neoplásico linfoide o metastásico, respectivamente. Por inmunomarcación, el CD68 y la MPO fueron positivos en el componente histiocítico que presentó distribución difusa tanto en la zona de necrosis como en las áreas linfoides residuales, las CIRC resultaron positivas con el anticuerpo OSCAR, mostrando disposición subcapsular y alrededor de la necrosis, y el CD123 fue positivo en dendrocitos plasmocitoides, presentes en grupos alrededor de vénulas de endotelio alto.
El ganglio linfático con necrosis por virus Epstein–Bar presentó necrosis geográfica extensa y proliferación de linfocitos tanto T como B, proliferación histiocítica y linfocitos activados CD30+ que expresaron además la proteína latente de membrana (LMP–1) en forma intensa y multifocal. Se identificó coexpresión leve de CD68 y MPO en histiocitos tanto en la zona de necrosis como en las áreas linfoides residuales. Los anticuerpos OSCAR y CD123 fueron negativos.
En los dos casos de linfomas difusos de células grandes B necrosados, presentaron proliferación histiocítica de 2 + , distribuida uniformemente en las áreas no necróticas. En las zonas de necrosis, hubo solamente escasos histiocitos CD68 positivos. Llama la atención que esta proliferación histiocítica no coexpresó mieloperoxidasa y la inmunomarcación con los anticuerpos OSCAR, para identificar CIRC y CD123 para DP, resultaron ambas negativas.
Los dos linfomas necrosados con inmunofenotipo T presentaron proliferación histiocítica difusa CD 68 positiva, con escasa presencia de histiocitos en las zonas de necrosis. El componente histiocítico fue más intenso en el linfoma anaplásico de células grandes (3 + ), que en el linfoma T periférico NOS (2 + ). Sin embargo, sólo en este último hubo coexpresión leve de mieloperoxidasa y CD68 en los histiocitos. El CD123 fue negativo en ambos casos y a diferencia de los linfomas B, hubo proliferación de células reticulares intersticiales queratina positivas (CIRC) en ambos casos, distribuidas en forma difusa, (Cuadro 5).

DISCUSIÓN
En 1972 Kikuchi1 (Figura 7) y Fujimoto,2 en Japón, describieron de forma independiente un tipo peculiar de linfadenitis necrosante que afectaba principalmente ganglios linfáticos cervicales de mujeres jóvenes y que tenía un curso clínico autolimitado. Las primeras referencias de esta entidad fueron limitadas a la población asiática; sin embargo, posteriormente, a mediados de los años 80's la LHN fue informada en diferentes partes del mundo.3,4,6 Esta entidad ha sido conocida como linfadenitis histiocítica necrosante, enfermedad o linfadenitis de Kikuchi, y enfermedad de Kikuchi–Fujimoto.

La etiología de la LHN es desconocida. Se le ha atribuido origen autoinmune similar al que ocurre con el LES 6,13–17 u origen infeccioso, asociándolo con diversos microorganismos entre los que se encuentran Yersinia enterocolítica, Brucella, Toxoplasma o diversos virus como el virus de Epstein–Barr, herpes virus 6, HTLV1 y parvovirus B19.3,5,18–25 Morfológicamente la arquitectura de los ganglios linfáticos puede estar parcialmente conservada y existir folículos residuales con centros germinales reactivos. Hay áreas de necrosis irregular y ocasionalmente confluentes, distribuidas predominantemente en la zona paracortical (Figura 1). La necrosis consiste en depósitos fibrinoides eosinófilos brillantes, que constituyen restos (detritus) celulares con numerosas células en apoptosis (fragmentos nucleares) rodeados por cúmulos grandes de macrófagos (histiocitos) de citoplasma claro. En ocasiones la necrosis tisular está representada sólo por numerosas células en apoptosis (restos de células y polvo nuclear) esparcidas dentro de grandes agregados de histiocitos. Las células apoptóticas (restos celulares) son activamente fagocitadas por los histiocitos, que son células con abundante citoplasma eosinófilo y núcleo periférico comprimido, dando el aspecto de "media luna", que recuerda parcialmente a las células en "anillo de sello". En las áreas de histiocitosis también hay linfocitos pequeños T activados y células plasmáticas. La ausencia de neutrófilos y eosinófilos es una característica distintiva de esta lesión. En la periferia de las áreas necróticas y alrededor de las vénulas de endotelio alto, están grupos de dendrocitos plasmacitoides e inmunoblastos.
Las lesiones tempranas (tipo proliferativo) muestran necrosis mínima y escasa fagocitosis, y están formadas por agregados de linfocitos medianos/ grandes, inmunoblastos (linfocitos transformados), histiocitos y dendrocitos plasmocitoides. Es en estos casos (tipo proliferativo) donde hay mayor problema diagnóstico histopatológico, pues el cuadro puede ser confundido con linfomas de alto grado. En un segundo estadio (tipo necrosante), que representa la fase diagnóstica histológica clásica, la apoptosis de células individuales con necrosis confluente es el cuadro histológico predominante, y durante la resolución de la necrosis hay repoblación con linfocitos e histiocitos espumosos (tipo xantomatoso).26 Patrones mixtos pueden ser encontrados, principalmente la combinación de proliferativo y necrótico; en nuestros casos dos mostraron combinación de patrón necrótico y xantomatoso.26
Al igual que lo referido en la literatura, en todos nuestros casos de LHN observamos una importante proliferación de histiocitos CD68 positivos, que al microscopio de luz, muchos de ellos presentaron núcleo con aspecto de "media luna". La positividad al CD68 fue citoplásmica de dos cruces en 15.38% de los casos y tres cruces en 84.61% de los casos. Todos los casos presentaron coexpresión con MPO, tal como ha sido referido en el estudio realizado por Pileri S, et al., donde sugirieron que esta coexpresión ocurre en monocitos de sangre periférica que se acumulan en el ganglio linfático bajo circunstancias no conocidas, donde el sistema de MPO de los monocitos posiblemente sustituya la MPO de los neutrófilos ausentes en estos sitios de inflamación. Por ello los monocitos de sangre periférica (MPO+/CD68+) pueden ser atraídos a los tejidos durante procesos inflamatorios particulares, tal como ocurre en la LHN, donde hay escasez o ausencia de granulocitos y, sin embargo, se requiere de MPO.27
El segundo tipo celular que prolifera en la LHN son los dendrocitos plasmocitoides. Este componente representa un tipo celular escaso en los ganglios linfáticos y que originalmente fueron referidos como células T plasmocitoides, o monocitos plasmocitoides, basado en su morfología similar a las células plasmáticas. Los DP expresan CD4 y se encuentran localizados en las áreas T del ganglio linfático, predominantemente alrededor de vénulas de endotelio alto. Posteriormente estas células fueron renombradas dendrocitos plasmocitoides por su inmunofenotipo consistente con células del sistema dendrítico. Los DP son positivos al CD123, que identifica al receptor a de la interleucina 3 (IL–3), presente en estas células y necesario para su diferenciación y función.28 En nuestro estudio hubo importante proliferación de estas células, resaltadas con el CD123, principalmente en los ganglios linfáticos con enfermedad de Kikuchi–Fujimoto, donde todos resultaron positivos; cinco casos con una positividad de dos cruces (35.71%) y nueve casos con una positividad de tres cruces (64.28%). Esta proliferación de dendrocitos plasmocitoides al igual que lo referido en la literatura, tuvo localización en grupos, alrededor de vénulas de endotelio alto y en algunos casos entre los grupos de histiocitos o en la periferia de las áreas de necrosis. Por el contrario, hubo una baja o nula expresión de estas células en los ganglios con necrosis por otras causas.
En el caso de las células reticulares intersticiales positivas a citoqueratina (CIRC), nuestros hallazgos coinciden con lo expresado en trabajos previos29 que describen la presencia de estas células en la enfermedad de Kikuchi–Fujimoto. Sin embargo, en este estudio utilizamos una citoqueratina de amplio espectro llamada OSCAR que reconoce a los grupos de queratina 7,8,18 y 19, y ha sido informado por Gown, et al. como más sensible para la identificación de CIRC.30 Estas células intersticiales citoqueratina positivas estuvieron presentes en forma difusa y constante en la LHN, en nuestro estudio, siendo la antiqueratina OSCAR positiva con 2 y 3 + , de predominio subcapsular y alrededor de la necrosis. A diferencia de los ganglios linfáticos del grupo comparativo, hubo una escasa o nula expresión de CIRC que se reflejó con negatividad o expresión débil con el anticuerpo OSCAR. Este hallazgo podría ser de utilidad en el diagnóstico diferencial de la LHN con otros ganglios linfáticos necrosados, como en los casos de linfadenitis necrosadas por tuberculosis, linfomas de Hodgkin y no Hodgkin necrosados, linfadenitis lúpica y linfadenitis por EBV que no presentaron la proliferación de estas células CIRC (Cuadro 5).
Las dificultades en el diagnóstico y la importancia de diferenciar la LHN de otras patologías que afectan al ganglio linfático, en especial del linfoma, han sido enfatizadas en varios estudios.6,7 El análisis detallado de la morfología del ganglio linfático es fundamental; sin embargo, en ocasiones la histología puede simular otras linfadenitis necrosadas. Es en estos casos, como lo muestra este estudio, cuando el uso de la inmunohistoquímica nos puede ayudar para hacer evidentes diferencias entre linfadenitis necrosantes.
CONCLUSIONES
La enfermedad de Kikuchi–Fujimoto pasa por diferentes fases histológicas (Cuadro 6) y dentro de los diagnósticos diferenciales a considerar se encuentran procesos neoplásicos y reactivos que incluyen linfomas necrosados, linfadenitis lúpica, linfadenitis granulomatosa y necrosis ganglionar inespecífica. Es importante hacer esta diferencia dado que, tanto el tratamiento como el pronóstico son diferentes, sobre todo con los linfomas. El análisis cuidadoso del ganglio linfático y la inmunohistoquímica pueden ser de utilidad. El uso de la queratina OSCAR nos ayuda a resaltar las CIRC que proliferan en mayor cantidad y distribución en la LHN que en los ganglios linfáticos necrosados por otras causas como linfomas, linfadenitis lúpica, granulomatosa o por EBV.
El CD123 puede ser de utilidad, al expresarse mayormente en la LHN, y destacar los grupos de dendrocitos plasmocitoides, los cuales proliferan en la LHN, y en los ganglios linfáticos con necrosis por otras causas, son escasos o están ausentes.
La coexpresión de CD68 y MPO es sugerente de LHN, pero no exclusiva. Esta coexpresión puede presentarse, aunque en menor proporción, en las necrosis ganglionares por entidades como linfadenitis granulomatosa y linfadenitis lúpica, principalmente.
A pesar de que fueron pocos los casos de los grupos comparativos, con los resultados obtenidos en este trabajo y apoyado en estudios previos,26–29 sugerimos el uso de los anticuerpos antiqueratina OSCAR, CD123, CD68 y MPO para diferenciar la LHN de otros tipos de necrosis ganglionares, los cuales brindan una mayor precisión en el diagnóstico de esta entidad.
REFERENCIAS
1. Kikuchi M. Lymphadenitis showing focal reticulum cell hyperplasia with nuclear debris and phagocytes: A clinic–pathological study. Nippon Ketsueki Gakkai Zasshi 1972; 35: 379–80. [ Links ]
2. Fujimoto Y, Kozima Y, Yamaguchi K. Cervical subacute necrotizing lymphadenitis. A new clinic–pathologic entity. Naika 1972; 20: 920–7. [ Links ]
3. Pileri S, Kikuchi M, Helbron D, Lennert K. Histiocytic necrotizing lymphadenitis without granulocytic infiltration. Virchows Arch a Pathol Anat Histol 1982; 395: 257–71. [ Links ]
4. Turner RR, Martin J, Dorfman RF. Necrotizing lymphadenitis: a study of 30 cases. Am J Surg Pathol 1983; 7: 115–23. [ Links ]
5. Rivano MT, Falini B, Stein H, Canino S, Ciani C, Gerdes J, Ribacchi R, Gobbi M, Pileri S. Histiocytic necrotizing lymphadenitis without granulocytic infiltration (Kikuchi's lymphadenitis). Morphological and immunohistochemical study of eight cases. Histopathology 1987; 11: 1013–27. [ Links ]
6. Dorfman RF, Berry GJ. Kikuchi's histiocytic necrotizing lymphadenitis: an analysis of 108 cases with emphasis on differential diagnosis. Semin Diagn Pathol 1988; 5: 329–45. [ Links ]
7. Chamulak GA, Brynes RK, Nathwani BN. Kikuchi–Fujimoto disease mimicking malignant lymphoma. Am J Surg Pathol 1990; 14: 514–23. [ Links ]
8. Tsang WY, Chan JK, Ng CS. Kikuchi's lymphadenitis. A morphologic analysis of 75 cases with special reference to unusual features. Am J Surg Pathol 1994;18:219–31. [ Links ]
9. Kuo TT. Kikuchi's disease (histiocytic necrotizing lymphadenitis). A clinicopathologic study of 79 cases with an analysis of histologic subtypes, immunohistology, and DNA ploidy. Am J Surg Pathol 1995; 19: 798–809. [ Links ]
10. Chuang Ch, Yan D, Chiu Ch. Clinical and laboratory manifestations of Kikuchi's disease in children and differences between patients with and without prolonged fever. Pediatr Infect Dis J 2005; 24: 551–4. [ Links ]
11. Blewitt RW, Kumar SN, Abraham JS. Recurrence of Kikuchi's lymphadenitis after 12 years. J Clin Pathol 2000; 53: 157–8. [ Links ]
12. Spies J, Foucar K. The histopathology of cutaneous lesions of Kikuchi's disease. Am J Surg Pathol 1999; 23: 1040–7. [ Links ]
13. Tumiati B, Bellelli A, Portioli I, Prandi S. Kikuchi's disease in systemic lupus erythematosus: an independent or dependent event? Clin Rheumatol 1991; 10: 90–3. [ Links ]
14. Litwin MD, Kirkham B, Henderson DR, Milazzo SC. Histiocytic necrotising lymphadenitis in systemic lupus erythematosus. Ann Rheum Dis 1992; 51: 805–7. [ Links ]
15. el–Ramahi KM, Karrar A, Ali MA. Kikuchi disease and its association with systemic lupus erythematosus. Lupus 1994; 3: 409–11. [ Links ]
16. Eisner MD, Amory J, Mullaney B, Tierney L, Browner WS. Necrotizing lymphadenitis associated with systemic lupus erythematosus. Semin Arthritis Rheum 1996; 26: 477–82. [ Links ]
17. Chen YH, Lan JL. Kikuchi disease in systemic lupus erythematosus: clinical features and literature review. J Microbiol Immunol Infect 1998; 31: 187–92. [ Links ]
18. Yen A, Fearneyhough P, Raimer SS, Hudnall SD. EBV–associated Kikuchis, histiocytic necrotizing lymphadenitis with cutaneous manifestations. J Am Acad Dermatol 1997; 36: 342–6. [ Links ]
19. Rodríguez MJ, Martin MV, Báez JM, Gil JL. Kikuchi–Fujimoto necrotizing lymphadenitis associated with brucellosis. Sangre (Bare). 1992; 37: 201–4 [ Links ]
20. Kikuchi M, Yoshizumi T, Nakamura H. Necrotizing lymphadenitis: possible acute toxoplasmic infection. Virchows Arch A Pathol Anat Histol 1977; 376: 247–53. [ Links ]
21. Rodríguez JN, Aguayo DM, Elizalde J, Martino ML, Moreno MV, Lara C, Prados D. Kikuchi–Fujimoto disease associated with acute infection by herpes virus 6. Sangre (Bare) 1996; 41: 387–90. [ Links ]
22. Bataille V, Harland CC, Behrens J, Cook MG, Holden CA. Kikuchi disease (histiocytic necrotizing lymphadenitis) in association with HTLV1. Br J Dermatol 1997; 136: 610–12. [ Links ]
23. Huh J, Kang GH, Gong G, Kim SS, Ro JY, Kim CW. Kaposi's sarcoma–associated herpes virus in Kikuchi's disease. Hum Pathol 1998; 29:1091–6. [ Links ]
24. Meyer O, Kahn MF, Grossin M, Ribard P, Belmatoug N, Morinet F, Fournet JC. Parvovirus B19 infection can induce histiocytic necrotizing lymphadenitis (Kikuchi's disease) associated with systemic lupus erythematosus. Lupus 1991; 1: 37–41. [ Links ]
25. Yufu Y, Matsumoto M, Miyamura T, Nishimura J, Nawata H, Ohshima K. Parvovirus B19–associated haemophagocytic syndrome with lymphadenopathy resembling histiocytic necrotizing lymphadenitis (Kikuchi's disease). Br J Haematol 1997; 96: 868–71. [ Links ]
26. Onciu M, Medeiros LJ. Kikuchi–Fujimoto lymphadenitis. Adv Anat Pathol 2003; 10: 204–11. [ Links ]
27. Pileri S, Facchetti F, Ascani S, Sabattini E, Poggi S, Piccioli M, Rondelli D, Vergoni F, Zinzani PL, Piccaluga PP, Falini B, Isaacson PG. Myeloperoxidase expression by histiocytes in Kikuchi's and Kikuchi–Like lymphadenopathy. Am J Pathol 2001; 159: 915–24. [ Links ]
28. Facchetti F, De Wolf–Peeters C, Van Den Oord J. Plasmacytoid monocytes (so–called plasmacytoid T–cells) in Kikuchi's lymphadenitis. Am J Clin Pathol 1989; 92: 42–50. [ Links ]
29. Ortiz–Hidalgo C, Torres J. Citokeratin–positive interstitial reticulum cells in Kikuchi–Fujimoto disease. App Immunohistochem Mol Morphol 2002; 10: 194–5. [ Links ]
30. Gown AM, Yaziji H, Barry TS, Hwang HC. OCSAR, a novel broad anti–cytokeratin monoclonal antibody optimized for diagnostic immunohistochemistry. Mod Pathol 2003; 16: 322. [ Links ]















