Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de investigación clínica
versión On-line ISSN 2564-8896versión impresa ISSN 0034-8376
Rev. invest. clín. vol.58 no.4 Ciudad de México jul./ago. 2006
Rincón del residente
Evidencias de la participación del peroxinitrito en diversas enfermedades
Role of peroxynitrite anion in different diseases
Yolanda I. Chirino,* Marisol Orozco–lbarra,* José Pedraza–Chaverrí*
* Departamento de Biología, Facultad de Química, Universidad Nacional Autónoma de México.
Reimpresos:
M en C Yolanda Irasema Chirino–López
Facultad de Química, Edificio B 2º. Piso Lab 209
Ciudad Universitaria, UNAM
04510, México, D.F.
Tel. y Fax: 5622–3515.
Correo electrónico: irasemachirino@hotmail.com
Recibido el 9 de agosto de 2005.
Aceptado el 19 de enero de 2006.
ABSTRACT
Peroxynitrite (ONOO–) is a reactive nitrogen specie produced by the reaction between nitric oxide (NO• ) and super–oxide anion (O2.–). NO• is produced by nitric oxide synthase (NOS) and O2.– is formed by the addition of an electron to O2 in enzymatic as well as nonenzymatic way. NADPH oxidase and xanthine oxidase are some of the enzymes involved in O2.–formation. ONOO – is an oxidant specie which is able to modify a great number of biomolecules such as aminoacids, proteins, enzymes and cofactors. ONOO – is able to induce nitration leading to the formation of 3–nytrotyrosine. This change has been widely studied, and although it is not only produced by ONOO –, but also by other reactive nitrogen species, it has been accepted like footprint of ONOO –. The excessive production of reactive nitrogen species is known as nitrosative stress that is able to induce structural damage leading to the loss of cell function. Furthermore, synthetic metalloporphyrins that metabolize ONOO – in a specific way are being used to determine if ONOO – is involved in different diseases, such as Alzheimer, Huntington, diabetes, hypertension, arthritis, colitis, cardiac and renal complications. Finally, these metalloporphyrins may be of potential therapeutic value in diseases related to ONOO – production.
Key words. Peroxynitrite. Reactive nitrogen species. Nitrosative stress.
RESUMEN
El peroxinitrito (ONOO–) es una especie reactiva de nitrógeno formada por la reacción entre el óxido nítrico (NO•) y el anión superóxido (O2 .– ). El NO' es sintetizado por la sintasa de óxido nítrico (NOS) y el O2•– se puede sintetizar de forma no enzimática, por la adición de un electrón al O2 o por medio de diversas enzimas como la NADPH oxidasa y la xantina oxidasa. El ONOO –es una especie oxidante capaz de modificar un gran número de biomoléculas entre las que se encuentran aminoácidos, proteínas, enzimas y cofactores de enzimas. El ONOO– puede inducir nitración de residuos de tirosina promoviendo la formación de 3–nitrotirosina (3–NT). Esta modificación ha sido muy estudiada y aunque no es producida exclusivamente por ONOO– sino también por otras especies reactivas de nitrógeno, se acepta actualmente como una evidencia de la formación de ONOO–. El aumento excesivo de este último, así como de otras especies reactivas de nitrógeno se conoce como estrés nitrosativo y puede causar daño estructural alterando la funcionalidad de las células. Por otra parte, se han desarrollado una serie de metaloporfirinas que descomponen específicamente al ONOO– y éstas han ayudado a determinar que el ONOO – es una especie implicada en enfermedades como Alzheimer, Huntington, diabetes, hipertensión, artritis, colitis y diversas complicaciones cardiacas y renales. Además, estas metaloporfirinas pueden ser de utilidad terapéutica en aquellas enfermedades asociadas a la producción de ONOO–.
Palabras clave. Peroxinitrito. Especies reactivas de nitrógeno. Estrés nitrosativo.
INTRODUCCIÓN
Las células de organismos aerobios producen continuamente especies reactivas de oxígeno (ERO) como parte de sus procesos metabólicos. Las ERO son moléculas químicamente reactivas derivadas del oxígeno y este término incluye metabolitos que pueden o no ser radicales libres (RL). Dentro de las ERO se encuentran el anión superóxido (O2.–), el peróxido de hidrógeno (H2O2) y el radical hidroxilo (OH •). Las ERO tienen funciones fisiológicas definidas, por ejemplo, el O2•– producido por NADPH oxidasa tiene un papel bactericida. Otro ejemplo es el H2O2, molécula que se forma por la adición de un electrón y dos protones al O2• –. Esta molécula no es un radical libre, pero puede atravesar membranas biológicas y por lo tanto difundir a muchos organelos. El H2O2 tiene una importante función como molécula de señalización intracelular1 e interviene en la formación de ácido hipocloroso (HOC1), una especie producida por acción de la enzima mieloperoxidasa (MPO) presente en fagosomas y neutrófilos para combatir infecciones bacterianas.
Las ERO son neutralizadas por el sistema de defensa antioxidante. Sin embargo, un desequilibrio entre la producción y la neutralización de las ERO por la defensa antioxidante se conoce como estrés oxidativo. Este desequilibrio se puede presentar por una producción excesiva de ERO, por una disminución de las defensas antioxidantes o una combinación de ambos eventos. Si el estrés oxidativo persiste, conducirá a daño a moléculas y eventualmente a tejidos.1
Por su parte, las especies reactivas de nitrógeno (ERN) incluyen especies derivadas de nitrógeno que pueden o no ser RL. Entre las ERN se encuentran los radicales óxido nítrico (NO•) y dióxido de nitrógeno (NO2•) y los no radicales catión nitronio (NO2+) y peroxinitrito (ONOO –), entre otros. Dentro de las ERN, el NO• es de gran importancia debido a que es una molécula de señalización que está involucrada en numerosos procesos biológicos. Entre las funciones de NO• se encuentran el control de la presión sanguínea actuando como factor de relajación de vasos y de músculo liso,2 la participación en procesos de neurotransmisión, es componente del sistema inmune en la vía fagocítica y recientemente se ha demostrado que regula caspasas, las cuales están involucradas en procesos apoptóticos.3
Se han descrito un gran número de fisiopatologías donde se postula al aumento de las ERO y de las ERN como fuentes que contribuyen de forma importante en el desarrollo de enfermedades como Alzheimer, Huntington, diabetes e hipertensión, entre otras. Lo anterior se debe a que tanto el estrés oxidativo como el nitrosativo pueden tener como resultado daño estructural en la célula, como la lipoperoxidación de las membranas, la oxidación y nitración de proteínas y el daño al DNA.
FORMACIÓN DEL PEROXINITRITO
El ONOO– es una ERN formada por la reacción entre el O2.– y el NO• (Figura 1, Cuadro 1). El O2.– puede ser producido por enzimas como NADPH oxidasa, xantina oxidasa (XO), lipooxigenasa (LOX), sintasa de óxido nítrico (NOS) desacoplada, P450 oxidasa y citocromo b5 y por vías no enzimáticas en diversos sitios celulares por la adición de un electrón al oxígeno molecular (Figura 1). Por otra parte, el NO• es sintetizado por la NOS a partir de L–arginina, O2 y nicotinamida adenín dinucleótido fosfato (NA–DPH) (Figura 1). Existen tres isoformas de esta enzima, producto de tres genes distintos: la tipo I o neuronal (nNOS) y tipo III o endotelial (eNOS) son constitutivas y reguladas por concentraciones intra–celulares de calcio. La isoforma tipo II o inducible (iNOS) es independiente de calcio y regulada transcripcionalmente por citocinas como interferón y o productos bacterianos como lipopolisacárido. Todas son homodímeros con un dominio reductasa en el extremo carboxilo donde se localiza un sitio de unión a flavin mononucleótido (FMN), flavin adenina dinucleótido (FAD) y NADPH, además poseen un dominio oxigenasa en el extremo amino donde se localiza un grupo hemo, un sitio de unión a tetrahidrobiopterina y uno a L–arginina.4 Los electrones donados por el NADPH, FMN y FAD fluyen del dominio reductasa al dominio oxigenasa para la síntesis de NO•.4
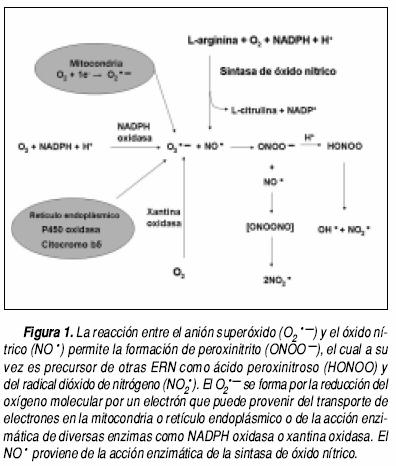
FORMACIÓN DE ESPECIES REACTIVAS DERIVADAS DE NITRÓGENO
Se han identificado dos isómeros del ONOO–, la forma cis y la forma trans, siendo esta última más reactiva debido a que es más inestable que la forma cis.5 Además, el ONOO– puede protonarse bajo condiciones fisiológicas para formar el ácido peroxinitroso (ONOOH), el cual puede descomponerse en OH• y NO2•. Entre las ERN también se encuentran los radicales NO• y NO2• y los no radicales como el catión nitrosonio (NO + ), el anión nitroxilo (NO–), el tetraóxido de dinitrógeno (N2O4), el trióxido de dinitrógeno (N2O4), el ONOOH, el alquilperoxinitrito (RONOO) y el ONOO.5 El término estrés nitrosativo indica el daño estructural ocasionado por la excesiva producción de ERN. Por otra parte, el ONOO– en presencia de dióxido de carbono (CO2) da lugar a la formación del anión nitrosoperoxicarboxilato (ONOOCO2–),6 el cual puede isomerizarse en 65–70% a CO2 y NO2• y 30–35% a NO2• y radical carbonato (CO3.–).7 En el cuadro 1 se presentan una serie de reacciones que involucran la formación de ERN.
REACTIVIDAD DEL ONOO–
El ONOO– es una especie muy oxidante que puede reaccionar con un amplio número de moléculas como aminoácidos, iones metálicos, proteínas y co–factores, entre otros. El ONOO– reacciona directamente con aminoácidos como cisteína, metionina y triptófano e indirectamente con aminoácidos como fenilalanina, histidina y tirosina.8 Este último aminoácido es convertido a 3–nitrotirosina (3–NT) y ha sido utilizado como un marcador de la presencia de ONOO–. Sin embargo, el ONOO– no es la única especie capaz de inducir la formación de 3–NT. El cloruro de nitrilo (NO2C1)9 y el N2O4 (Cuadro 1) son también capaces de nitrar. La modificación indirecta a aminoácidos ocurre cuando éstos reaccionan con derivados del ONOO– como el OH • y el NO2•10
La formación de 3–NT se ha encontrado en numerosos modelos experimentales de enfermedad y es por ello que se han desarrollado diversos métodos específicos para su identificación, entre los que se encuentran técnicas de inmunohistoquímica, western blot y cromatografía líquida de alta resolución (HPLC).11
El ONOO– puede reaccionar con proteínas que contienen iones metálicos como hierro, cobre o manganeso.10 Estas modificaciones pueden inducir cambios conformacionales en la estructura tridimensional de las proteínas causando la pérdida de su función.
Por ejemplo, mediante la exposición de proteínas purificadas a ONOO–, se ha determinado que esta especie es capaz de inactivar una gran variedad de enzimas. Se sabe que proteínas del citoesqueleto como la actina, la tirosina hidroxilasa y la prostaciclina sintasa, entre otras, al ser blanco del ONOO– pierden su actividad biológica.12 El ONOO– también inactiva enzimas como la superóxido dismutasa (SOD), una enzima antioxidante capaz de dismutar el O2.–a H2O2, la aconitasa, enzima del ciclo de Krebs, y la gliceraldehído 3 fosfato deshidrogenasa, enzima de la glicólisis, entre otras. El ONOO– puede oxidar moléculas que actúan como cofactores para diferentes enzimas, como es el caso de la tetrahidrobiopterina, cofactor de la NOS13 y de la tirosina hidroxilasa. Esta especie también puede oxidar al glutatión reducido (GSH), cofactor de la glutatión peroxidasa (GPx), una enzima que reduce el H2O2 a agua.14 El GSH es una molécula antioxidante muy importante en la célula y su depleción está asociada al incremento de especies reactivas de oxígeno y de la lipoperoxidación.15 Estudios realizados mediante resonancia demuestran que el ONOO– reacciona con el urato 16 veces más rápido que con el ascorbato y tres veces más rápido que con la cisteína. Esta interacción produce un radical libre intermediario que es inhibido por ascorbato o cisteína. La velocidad de reacción entre el ONOO– y el urato aumenta en presencia de ascorbato y cisteína.13 De esta forma se demuestra que el ONOO– puede causar depleción de importantes antioxidantes como el ascorbato y cisteína favoreciendo un estado prooxidante.
Lo anterior muestra al ONOO– como una especie tóxica para la célula dada su capacidad para inducir modificaciones en todos estos niveles. Por otra parte, la GPx es una enzima antioxidante capaz de remover H2O2 y otros peróxidos, y se ha descrito que esta enzima, la cual es abundante en riñon, es capaz de detoxificar ONOO–.16 El ONOO– reacciona con la selenocisteína presente en la GPx generando nitritos.17 Con base en lo anterior, se ha postulado que otras proteínas con residuos de selenocisteína pueden actuar en forma similar.
Con el fin de investigar la participación del ONOO– en diversos modelos experimentales, se han desarrollado moléculas capaces de descomponer esta especie. Mediante estudios espectroscópicos, cinéticos y cromatográficos se ha determinado que metaloporfirinas hidrosolubles como 5,10,15,20–tetrakis (2',4',6'–trimetil–3,5 disulfonatofenil) porfirinato de hierro (FeTMPS), 5,10,15,20–tetrakis (4'–sulfonato–fenil) porfirinato de hierro (FeTPPS), 5,10,15,20–tetrakis (N–metil–4'–piridil) porfirinato de hierro (FeTMPyP) y tetrakis–2–(trietilen glicol monometil éter) piridil porfirina de cloruro de hierro (FP15), en concentraciones micromolares son capaces de catalizar la isomerización de ONOO– a NO3– bajo condiciones fisiológicas (37 °C a pH 7.4).18 Por medio de experimentos adicionales se ha comprobado que el NO3 – no es un agente oxidante. Estas metaloporfirinas y otras estrategias, entre las que se encuentran marcadores de estrés nitrosativo como la 3–NT, son de gran utilidad debido a que permiten el estudio del ONOO– en diferentes patologías.
EVIDENCIAS DEL ONOO– EN LA PATOGÉNESIS DE DIVERSAS ENFERMEDADES
Alzheimer
La enfermedad de Alzheimer está caracterizada por la deposición del péptido β–amiloide, el cual está formado por 39 a 42 aminoácidos, y se origina por acción de secretasas a partir de la proteína transmembranal precursora del amiloide.19 Se ha descrito que el péptido β–amiloide induce estrés oxidativo y recientemente se ha demostrado que las ERN también están involucradas, prueba de ello es el aumento en la nitración de proteínas en pacientes que presentaron enfermedad de Alzheimer.19 También se ha encontrado que la neurotoxicidad del péptido β–amiloide en cocultivos de neuronas y de glía es bloqueada por las metaloporfirinas FeTPPS y FeTMPyP, lo que sugiere la importante participación del ONOO– en este proceso tóxico.20
Otra de las alteraciones asociadas a esta enfermedad es la formación de ovillos neurofibrilares formados por microtúbulos de cistoesqueleto asociados a la proteína tau. Recientemente se ha encontrado que esta proteína es susceptible a nitración y que la nitración anormal de tau favorece la pérdida de su función y su consecuente agregación, lo cual contribuye a la neurodegeneración observada en esta enfermedad.21 Finalmente, en estudios postmortem se encontró nitración de proteínas en astrocitos y neuronas piramidales asociados a placas seniles y en astrocitos no asociados a placas seniles en cerebro de pacientes que padecieron la enfermedad de Alzheimer, pero no en sujetos sanos.22
Huntington
La enfermedad de Huntington es una condición hereditaria caracterizada por movimientos corporales anormales, demencia y problemas psiquiátricos. El sitio primario de pérdida neuronal y atrofia es el núcleo estriado.23 En un modelo experimental inducido por ácido quinolínico se ha observado que la administración de FeTPPS24 o de piruvato25 disminuye la nitración de proteínas y la neurotoxicidad demostrando que la formación de ONOO– está involucrada en la patogénesis de esta enfermedad. También se ha encontrado que la carnitina26 y el factor de crecimiento nervioso27 previenen el daño neurotóxico y la formación de ONOO– en los diferentes modelos de la enfermedad de Huntington.
Isquemia focal cerebral y neurotoxicidad por metanfetamina
La administración de las FeTPPS y FeTMPyP previene la neurotoxicidad y la fragmentación de DNA inducidas por isquemia focal cerebral, aun si se administran seis horas después de la oclusión de la arteria cerebral media.28 También se ha demostrado que el FeTPPS previene la neurotoxicidad dopaminérgica inducida por metanfetamina.29 Estos hallazgos demuestran la participación del ONOO– en ambos modelos experimentales.
Disfunción cardiaca
Se ha encontrado que ONOO– está implicado en la disfunción cardiaca inducida por la hiperlipidemia,30 por endotoxinas31 y por citocinas proinflamatorias como interleucina–1 β, interferón–γ, γ factor de necrosis tumoral a.32 Esto se afirma ya que el FeTPPS previene la nitración de proteínas, la formación de ditirosina y la disfunción cardiaca inducida por estas condiciones. Por otra parte, se ha observado que la administración de doxorrubicina, una antraciclina empleada en el tratamiento de diferentes tipos de cáncer como leucemias, linfomas, entre otros, ejerce efectos cardiotóxicos mediados por ONOO–.33 El FP15 previno la cardiotoxicidad inducida por doxorubicina, el aumento en la lipoperoxidación y la formación de 3–NT.33 También se encontró que el FP15 redujo el área de infarto en corazón después de la isquemia y reperfusión en cerdos34 demostrando así el papel tóxico del ONOO–. Recientemente se ha demostrado que el ONOO– también está implicado en el rechazo al trasplante cardiaco.35 La administración de la metalo–porfinina WW85, que descompone al ONOO–, prolongó la sobrevivencia, mejoró la función del injerto y disminuyó el rechazo al trasplante.35 Estos efectos funcionales se acompañaron de la disminución de la nitración de proteínas, de la activación de la poli ADP ribosa polimerasay de la lipoperoxidación.
Diabetes
La diabetes representa un factor de riesgo para el desarrollo de otras enfermedades como hipertensión y aterosclerosis, entre otras.36 Existe evidencia que demuestra la participación del estrés nitrosativo en este padecimiento. Por ejemplo, se ha demostrado un incremento en la inmunotinción de 3–NT en islotes β–pancreáticos de ratones con diabetes autoinmune. La inmunotinción en los islotes β–pancreáticos de ratones diabéticos fue mayor que en los islotes de ratones normoglicémicos.37 Este trabajo sugiere la participación del ONOO– en el desarrollo de la diabetes autoinmune. La participación del ONOO– en la diabetes se comprobó de una manera específica mediante el uso de FP15. Este compuesto protegió del desarrollo de la disfunción vascular y cardiaca en el modelo de diabetes inducida por estreptozotocina. El tratamiento con FP15 también redujo la presencia de 3–NT en islotes β pancreáticos.38 Otra de las complicaciones asociadas a la diabetes es la neuropatía diabética, que también se ha relacionado con la formación de ONOO–. La inmunorreactividad de 3–NT en el nervio ciático, las alteraciones funcionales y la deficiencia energética se previnieron mediante la administración de FP15.39 En aorta de ratas con diabetes tipo 2 se encontró un aumento de O2.–y disminución en la biodisponibildad de NO•. También se encontró un aumento en la expresión de eNOS, así como un decremento en los niveles de tetrahidrobiopterina. Estos datos sugerían que la NOS se encontraba desacoplada, situación en que produce preferentemente O2.–. La exposición a inhibidores de la NOS y NADPH oxidasa, como L–NAME y difeniliodieneiodio, respectivamente, redujeron la producción de O2.–. Además, se encontraron marcadores de daño oxidativo como isoprostano F2 α III, proteínas oxidadas y nitradas.36
Hipertensión
Entre los principales eventos que provocan hipertensión, se encuentran la generación de especies reactivas de oxígeno como O2.– y OH• y la pérdida del efecto vasodilatador del NO• al reaccionar con el O2.–,40 ya que se ha establecido que existe una sobreproducción de este anión en la hipertensión.41 La reacción entre el O2.–y el NO• es extremadamente rápida, por lo que existe la posibilidad de la acumulación de ONOO–, lo que ocasionaría daño celular severo.42 Un ejemplo de ello se observa en un estudio in vitro en células de músculo liso de aorta de rata, donde la exposición a ONOO – indujo apoptosis en forma dependiente de la concentración, mediada por la activación de endonucleasas.43
En forma endógena, la exposición a ONOO– ocurre cuando reaccionan el NO' sintetizado por la eNOS del endotelio y el O2.– producido por diversas fuentes entre las que se encuentran la cadena de transporte de electrones, la NADPH oxidasa e incluso la eNOS desacoplada. El ONOO– puede conducir a disfunción endotelial y desembocar en procesos de hipertensión. En otro estudio in vitro en cultivos de aorta torácica de rata, se encontró un incremento de especies oxidantes medidas por la oxidación de diclorofluorosceína.44 La exposición a SOD y a L–NAME disminuye la formación de especies oxidantes,44 lo cual sugiere que el ONOO– podría contribuir al desarrollo y/o complicaciones de padecimientos como hipertensión. Lo anterior es evidencia indirecta de la participación del ONOO– en la hipertensión; sin embargo, aún faltan estudios concluyentes para demostrar la participación directa de esta importante especie en esta patología. Además, hay evidencias de daño por ERN en la hipertensión experimental inducida por infusión de angiotensina II. En dicho modelo se ha demostrado la nitración de la enzima Mn–SOD y la disminución de 50% de su actividad.45 Ya que dicha enzima metaboliza el O2.– a H2O2, su inactivación conduce a un aumento del O2.–, un sustrato en la formación del ONOO–. También se ha observado tinción positiva para 3–NT en la aorta de ratas con hipertensión espontánea. La administración de un compuesto que mimetiza a la SOD (M40403) previno la formación de 3–NT, sugiriendo que el ONOO– es el compuesto que está llevando a cabo la nitración debido a que requiere de O2.– para formarse.46 En otro modelo de hipertensión inducido por la coartación de la aorta también se encontró un aumento de 3–NT.47 Adicionalmente, en un modelo de ratas con hipertensión espontánea48 se encontró un aumento en la nitración de proteínas en aorta y que esta alteración está asociada a la disfunción endotelial en estas ratas. Los autores sugieren que dichos hallazgos son una evidencia del aumento en la producción de ONOO– secundario a la inactivación oxidativa de NO•.48
Enfermedades pulmonares
El ácido oleico se ha empleado en diversos modelos experimentales para reproducir y estudiar las alteraciones encontradas en el daño agudo pulmonar en humanos. Algunas de las alteraciones descubiertas en esta patología incluyen aumento en la actividad de MPO, malondialdehído (MDA) y 3–NT, las cuales disminuyen por la administración del antioxidante N–acetilcisteína.49 Por otra parte, ya se ha reportado que en este tipo de lesiones al pulmón está involucrado el estrés oxidativo y es posible que parte del daño se deba además al aumento de 3–NT en este modelo. Una evidencia directa de la participación del ONOO– del daño inducido por isquemia y reperfusión del pulmón, es el efecto protector que se observa por la administración de FP15.50
Artritis y colitis
Mabley, et al.51 demostraron en un modelo murino que el ONOO– está involucrado en la patogénesis de dos enfermedades: artritis y colitis. La artritis se indujo al administrar colágena intradérmica y la colitis mediante la ingestión de dextrán sulfato de sodio en el agua. La administración de FP15 en ambos modelos redujo los niveles de MDA, así como un aumento en la actividad de la MPO. El efecto protector del FP15 sugiere la participación del ONOO– en estas patologías.
Enfermedades renales
Existe un número creciente de evidencias que involucran la participación de ERN en la fisiopatología de enfermedades renales. En un modelo in vivo de nefropatía diabética inducida con estreptozotocina se encontró un aumento de lipoperoxidación, de especies reactivas de oxígeno y productos de glicosilación avanzada, así como de proteínas nitradas en riñon.52 En otros estudios se ha demostrado por medio de atrapadores de ONOO– que esta especie es directamente responsable de algunas de las alteraciones observadas en modelos in vivo e in vitro. Por otra parte, en la insuficiencia renal crónica existe una deficiencia en los niveles de NO•, debido a que éste pierde su actividad biológica al reaccionar con el O2.– formando ONOO –. Este último es producido por diversas fuentes, entre las que se ha identificado a la NADPH oxidasa.53 En el caso de la insuficiencia renal aguda, también se ha encontrado evidencia de la participación del ONOO– en el daño renal. Por ejemplo, uno de los principales efectos secundarios de la administración de cisplatino, un agente antineoplásico, es la insuficiencia renal aguda, en la cual se presentan alteraciones como nitración de proteínas, necrosis tubular, aumentó de nitrógeno de urea y creatinina en suero. La administración de FeTPPS, previene parcialmente las alteraciones observadas por la administración de este agente antineoplásico. Esto demuestra la contribución directa del ONOO– en los procesos nefrotóxicos inducidos por la administración de cisplatino.54 La gentamicina es un antibiótico de la familia de los aminoglucósidos usado contra infecciones causadas por bacterias gramnegativas. La nefrotoxicidad es uno de los principales efectos adversos de este antibiótico, caracterizado por la presencia de estrés oxidativo e incremento de 3–NT, lo que sugiere la participación del ONOO– en este modelo.55 También se ha demostrado aumento en los niveles renales de 3–NT en ratas con insuficiencia renal aguda inducida por dicromato de potasio.56 Noiri, et al.51 demostraron que el aumento renal de los niveles de 3–NT y la disfunción renal inducidos por isquemia y reperfusión, se previnieron al administrar ebselen, compuesto atrapador de ONOO–. Así, se evidenció el papel de esta ERN en este modelo de daño renal. Finalmente, se ha demostrado la presencia de estrés nitrosativo por medio del aumento de los niveles circulantes y renales de 3–NT en las ratas con nefrectomía 5/6, un modelo de insuficiencia renal crónica.58
PERSPECTIVAS
Es necesario profundizar y ampliar los estudios con las metaloporfirinas que descomponen al ONOO– , ya que han demostrado su papel benéfico en varias enfermedades en donde participa esta ERN. Estos compuestos serán de gran utilidad también para poder precisar el papel exacto del ONOO– en la inducción del estrés nitrosativo debido a que en la actualidad la presencia de 3–NT se sigue considerando como sinónimo de la generación de ONOO–, aun cuando otras ERN también pueden inducir la nitración de tirosina. Finalmente, se requieren estudios adicionales en otras enfermedades y modelos experimentales para poder precisar la participación del ONOO–.
AGRADECIMIENTOS
PAPIT IN227103 y CONACyT 40009–M.
REFERENCIAS
1. Halliwell B. Oxidants and human disease: some new concepts. FASEB J 1987; 1: 358–64. [ Links ]
2. Furchgott RF, Zawadzki JV. The obligatory role of endothelial cells in the relaxation of arterial smooth muscle by acetylcholine. Nature 1980, 288; 373–6. [ Links ]
3. Vertuani S, Angusti A, Manfredini S. The antioxidants and pro–antioxidants network: an overview. Curr Pharm Des 2004; 10: 1677–94. [ Links ]
4. Kone BC. Nitric oxide synthesis in the kidney: isoforms, biosynthesis, and functions in health. Semin Nephrol 2004; 24: 299–315. [ Links ]
5. Symons MC. Cis– and trans–conformations for peroxynitrite anions. J Inorg Biochem 2000; 78: 299–301. [ Links ]
6. Motterlini R, Green CJ, Foresti R. Regulation of heme oxygenase–1 by redox signals involving nitric oxide. Antioxid Redox Signal 2002; 4: 615–24. [ Links ]
7. Valdez LB, Alvarez S, Arnaiz SL, Schopfer F, Carreras MC, Poderoso JJ, Boveris A. Reactions of peroxynitrite in the mitochondrial matrix. Free Radie Biol Med 2000; 29: 349–56. [ Links ]
8. Pietraforte D, Salzano AM, Marino G, Minetti M. Peroxynitrite–dependent modifications of tyrosine residues in hemoglobin. Formation of tyrosyl radical(s) and 3–nitrotyrosine. Amino Acids 2003; 25: 341–50. [ Links ]
9. Eiserich JP, Hristova M, Cross CE, Jones AD, Freeman BA, Halliwell B, van der Vliet A. Formation of nitric oxide–derived inflammatory oxidants by myeloperoxidase in neutrophils. Nature 1998; 391: 393–7. [ Links ]
10. Alvarez B, Radi R. Peroxynitrite reactivity with amino acids and proteins. Amino Acids 2003; 25: 295–311. [ Links ]
11. Tarpey MM, Wink DA, Grisham MB. Methods for detection of reactive metabolites of oxygen and nitrogen: in vitro and in vivo considerations. Am J Physiol Regul Integr Comp Physiol 2004; 286: R431–R444. [ Links ]
12. Virag L, Szabo E, Gergely P, Szabo C. Peroxynitrite–induced cytotoxicity: mechanism and opportunities for intervention. Toxicol Lett 2003; 140: 113–24. [ Links ]
13. Kuzkaya N, Weissmann N, Harrison DG, Dikalov S. Interactions of peroxynitrite with uric acid in the presence of ascorbate and thiols: Implications for uncoupling endothelial nitric oxide synthase. Biochem Pharmacol 2005; 70: 343–54. [ Links ]
14. Yu H, Liu J, Liu X, Zang T, Luo G, Shen J. Kinetic studies on the glutathione peroxidase activity of selenium–containing glutathione transferase. Comp Biochem Physiol B Biochem Mol Biol 2005; 141: 382–9. [ Links ]
15. Rajasekaran NS, Sathyanarayanan S, Devaraj NS, Devaraj H. Chronic depletion of glutathione (GSH) and minimal modification of LDL in vivo: its prevention by glutathione mono ester (GME) therapy. Biochim Biophys Acta 2005; 1741: 103–12. [ Links ]
16. de Haan JB, Stefanovic N, Nikolic–Paterson D, Scurr LL, Croft KD, Mori TA, Hertzog P, Kola I, Atkins RC, Tesch GH. Kidney expression of glutathione peroxidase–1 is not protective against streptozotocin–induced diabetic nephropathy. Am J Physiol Renal Physiol 2005; 289: F544–F551. [ Links ]
17. Sies H, Sharov VS, Klotz LO, Briviba K. Glutathione peroxidase protects against peroxynitrite mediated oxidations. A new function for selenoproteins as peroxynitrite reducíase. J Biol Chem 1997; 272: 27812–17. [ Links ]
18. Jensen MP, Riley DP. Peroxynitrite decomposition activity of iron porphyrin complexes. Inorg Chem 2002; 41: 4788–97. [ Links ]
19. Sultana R, Boyd–Kimball D, Poon HF, Cai J, Pierce WM, Klein JB, Markesbery WR, et al. Oxidative modification and down–regulation of Pinl in Alzheimer's disease hippocampus: A redox proteomics analysis. Neurobiol Aging 2006, en prensa. [ Links ]
20. Xie Z, Wei M, Morgan TE, Fabrizio P, Han D, Finch CE, Longo VD. Peroxynitrite mediates neurotoxicity of amyloid beta–peptidel–42– and lipopolysaccharide–activated microglia. J Neurosci 2002; 22: 3484–92. [ Links ]
21. Zhang YJ, Xu YF, Chen XQ, Wang XC, Wang JZ. Nitration and oligomerization of tau induced by peroxynitrite inhibit its microtubule–binding activity. FEBS Lett 2005; 579: 2421–7. [ Links ]
22. Luth HJ, Munch G, Arendt T. Aberrant expression of NOS isoforms in Alzheimer's disease is structurally related to nitrotyrosine formation. Brain Res 2002; 953: 135–43. [ Links ]
23. Browne S, Bowling A, MacGarvey U, Baik M, Berger S, Muqit, M, et al. Oxidative damage and metabolic dysfunction in Huntington's disease: selective vulnerability of the basal ganglia. Ann Neurol 1997; 41: 646–53. [ Links ]
24. Pérez–de la Cruz V, González–Cortes C, Galván–Arzate S, Pérez–Severiano F, Ali SF, Pedraza–Chaverri J, Santamaría A. Excitotoxic brain damage involves peroxynitrite–mediated mitochondrial dysfunction, caspase–3 activation and DNA fragmentation in a model of Huntington's disease in rats: protective role of iron porphyrinate Fe(TPPS). Neuroscience 2005; 135: 463–74. [ Links ]
25. Ryu JK, Kim SU, McLarnon JG. Blockade of quinolinic acid–induced neurotoxicity by pyruvate is associated with inhibition of glial activation in a model of Huntington's disease. Exp Neurol 2004; 187: 150–9. [ Links ]
26. Matthews RT, Yang L, Jenkins BG, Ferrante RJ, Rosen BR, Kaddurah–Daouk R, Beal MF. Neuroprotective effects of creatine and cyclocreatine in animal models of Huntington's disease. J Neurosci 1998; 18: 156–63. [ Links ]
27. Galpern WR, Matthews RT, Beal MF, Isacson O. NGF attenuates 3–nitrotyrosine formation in a 3–NP model of Huntington's disease. Neuroreport 1996; 7: 2639–42. [ Links ]
28. Thiyagarajan M, Kaul CL, Sharma SS. Neuroprotective efficacy and therapeutic time window of peroxynitrite decomposition catalysts in focal cerebral ischemia in rats. Br J Pharmacol 2004; 142: 899–911. [ Links ]
29. Imam SZ, Islam F, Itzhak Y, Slikker W Jr, Ali SF. Prevention of dopaminergic neurotoxicity by targeting nitric oxide and peroxynitrite: implications for the prevention of methamphetamine–induced neurotoxic damage. Ann N Y Acad Sci 2000; 914: 157–71. [ Links ]
30. Onody A, Csonka C, Giricz Z, Ferdinandy P. Hyperlipidemia induced by a cholesterolrich diet leads to enhanced peroxynitrite formation in rat hearts. Cardiovasc Res 2003; 58: 663–70. [ Links ]
31. Lancel S, Tissier S, Mordon S, Marechal X, Depontieu F, Scherpereel A, et al. Peroxynitrite decomposition catalysts prevent myocardial dysfunction and inflammation in endotoxemic rats. J Am Coll Cardiol 2004; 43: 2348–58. [ Links ]
32. Ferdinandy P, Danial H, Ambrus I, Rothery RA, Schulz R. Peroxynitrite is a major contributor to cytokine–induced myocardial contractile failure. Circ Res 2000; 87: 241–7. [ Links ]
33. Pacher P, Liaudet L, Bai P, Mabley JG, Kaminski PM, Virag L, et al. Potent metalloporphyrin peroxynitrite decomposition catalyst protects against the development of doxorubicin–induced cardiac dysfunction. Circulation 2003; 107: 896–904. [ Links ]
34. Bianchi C, Wakiyama H, Faro R, Khan T, McCully JD, Levitsky S, Szabo C, Sellke FW. A novel peroxynitrite decomposer catalyst (FP–15) reduces myocardial infarct size in an in vivo peroxynitrite decomposer and acute ischemia–reperfusion in pigs. Ann Thorac Surg 2002; 74: 1201–7. [ Links ]
35. Pieper GM, Nilakantan V, Chen M, Zhou J, Khanna AK, Henderson JD Jr, et al. Protective mechanisms of a metalloporphyrinic peroxynitrite decomposition catalyst, WW85, in rat cardiac transplants. J Pharmacol Exp Ther 2005; 314: 53–60. [ Links ]
36. Bitar MS, Wahid S, Mustafa S, Al–Saleh E, Dhaunsi GS, Al–Mulla F. Nitric oxide dynamics and endothelial dysfunction in type II model of genetic diabetes. Eur J Pharmacol 2005; 511: 53–64. [ Links ]
37. Suarez–Pinzon WL, Szabo C, Rabinovitch A. Development of autoimmune diabetes in NOD mice is associated with the formation of peroxynitrite in pancreatic islet beta–cells. Diabetes 1997; 46: 907–11. [ Links ]
38. Szabo C, Mabley JG, Moeller SM, Shimanovich R, Pacher P, Virag L, et al. Part I: pathogenetic role of peroxynitrite in the development of diabetes and diabetic vascular complications: studies with FP15, a novel potent peroxynitrite decomposition catalyst. Mol Med 2002; 8: 571–80. [ Links ]
39. Obrosova IG, Mabley JG, Zsengeller Z, Charniauskaya T, Abatan OI, Groves JT, Szabo C. Role for nitrosative stress in diabetic neuropathy: evidence from studies with a peroxynitrite decomposition catalyst. FASEB J 2005; 19: 401–3. [ Links ]
40. Li JM, Shah AM. Endothelial cell superoxide generation: regulation and relevance for cardiovascular pathophysiology. Am J Physiol Regul Integr Comp Physiol 2004; 287: R1014–R1030. [ Links ]
41. Patterson ME, Mouton CR, Mullins JJ, Mitchell KD. Interactive effects of superoxide anion and nitric oxide on blood pressure and renal hemodynamics in transgenic rats with inducible malignant hypertension. Am J Physiol Renal Physiol 2005; 289: F754–F759. [ Links ]
42. Fortuno A, Jose GS, Moreno MU, Diez J, Zalba G. Oxidative stress and vascular remodelling. Exp Physiol 2005; 90: 457–62. [ Links ]
43. Li J, Li W, Su J, Liu W, Altura BT, Altura BM. Peroxynitrite induces apoptosis in rat aortic smooth muscle cells: possible relation to vascular diseases. Exp Biol Med 2004; 229: 264–9. [ Links ]
44. Chang T, Wang R, Wu L. Methylglyoxal–induced nitric oxide and peroxynitrite production in vascular smooth muscle cells. Free Radie Biol Med 2005; 38: 286–93. [ Links ]
45. Guo W, Adachi T, Matsui R, Xu S, Jiang B, Zou MH, et al. Quantitative assessment of tyrosine nitration of manganese superoxide dismutase in angiotensin II–infused rat kidney. Am J Physiol Heart Circ Physiol 2003; 285: H1396–H1403. [ Links ]
46. Cuzzocrea S, Mazzon E, Dugo L, Di Paola R, Caputi AP, Salvemini D. Superoxide: a key player in hypertension. FASEB J 2004; 18: 94–101. [ Links ]
47. Barton CH, Ni Z, Vaziri ND. Enhanced nitric oxide inactivation in aortic coarctation–induced hypertension. Kidney Int 2001; 60: 1083–7. [ Links ]
48. Ma XL, Gao F, Nelson AH, Lopez BL, Christopher TA, Yue TL, Barone FC. Oxidative inactivation of nitric oxide and endothelial dysfunction in stroke–prone spontaneous hypertensive rats. J Pharmacol Exp Ther 2001; 298: 879–85. [ Links ]
49. Koksel O, Cinel I, Tamer L, Cinel L, Ozdulger A, Kanik A, Ercan B, Oral U. N–acetylcysteine inhibits peroxynitrite–mediated damage in oleic acid–induced lung injury. Pulm Pharmacol Ther 2004; 17: 263–70. [ Links ]
50. Naidu BV, Fraga C, Salzman AL, Szabo C, Verrier ED, Mulligan MS. Critical role of reactive nitrogen species in lung ischemia–reperfusion injury. J Heart Lung Transplant 2003; 22: 784–93. [ Links ]
51. Mabley JG, Liaudet L, Pacher P, Southan GJ, Salzman AL, Szabo C. Part II: beneficial effects of the peroxynitrite decomposition catalyst FP15 in murine models of arthritis and colitis. Mol Med 2002; 8: 581–90. [ Links ]
52. de Haan JB, Stefanovic N, Nikolic–Paterson D, Scurr LL, Croft KD, Mori TA, et al. Kidney expression of glutathione peroxidase–1 is not protective against streptozotocin–induced diabetic nephropathy. Am J Physiol Renal Physiol 2005; 289: F544–F551. [ Links ]
53. Modlinger PS, Wilcox CS, Aslam S. Nitric oxide, oxidative stress, and progression of chronic renal failure. Semin Nephrol 2004; 24: 354–65. [ Links ]
54. Chirino YI, Hernandez–Pando R, Pedraza–Chaverri J. Peroxynitrite decomposition catalyst ameliorates renal damage and protein nitration in cisplatin–induced nephrotoxicity in rats. BMC Pharmacol 2004; 4: 20. [ Links ]
55. Pedraza–Chaverri J, Barrera D, Maldonado PD, Chirino YI, Macias–Ruvalcaba NA, Medina–Campos ON, et al. S–allylmercaptocysteine scavenges hydroxyl radical and singlet oxygen in vitro and attenuates gentamicin–induced oxidative and nitrosative stress and renal damage in vivo. BMC Clin Pharmacol 2004; 4: 5. [ Links ]
56. Barrera D, Maldonado PD, Medina–Campos ON, Hernandez–Pando R, Ibarra–Rubio ME, Pedraza–Chaverri J. HO–1 induction attenuates renal damage and oxidative stress induced by K2Cr2O7. Free Radie Biol Med 2003; 34: 1390–8. [ Links ]
57. Noiri E, Nakao A, Uchida K, Tsukahara H, Ohno M, Fujita T, Brodsky S, Goligorsky MS. Oxidative and nitrosative stress in acute renal ischemia. Am J Physiol Renal Physiol 2001; 281: F948–F957. [ Links ]
58. Vaziri ND, Ni Z, Oveisi F, Liang K, Pandian R. Enhanced nitric oxide inactivation and protein nitration by reactive oxygen species in renal insufficiency. Hypertension 2002; 39: 135–41. [ Links ]














