Services on Demand
Journal
Article
Indicators
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de investigación clínica
On-line version ISSN 2564-8896Print version ISSN 0034-8376
Rev. invest. clín. vol.58 n.2 Ciudad de México Mar./Apr. 2006
Rincón del residente
Dimorfismo sexual inmunitario: ¿pueden los esteroides sexuales polarizar el perfil de citocinas Th1/Th2?
Immune sexual dimorphism: Can sex steroids affect the Thl/Th2 cytokine profile?
Marco A. De León–Nava,* Jorge Morales–Montor*
* Departamento de Inmunología. Instituto de Investigaciones Biomédicas, Universidad Nacional Autónoma de México.
Reimpresos:
Dr. Jorge Morales–Montor
Departamento de Inmunología. Instituto de Investigaciones Biomédicas,
Universidad Nacional Autónoma de México, AP 70228,
04510, México D.F.
Tel: 55+56223854, fax 5556223369.
Correo electrónico: jmontor66@biomédicas.unam.mx
Recibido el 19 de julio de 2005.
Aceptado el 20 de octubre de 2005.
ABSTRACT
Cytokine secretion is a crucial aspect in immune system modulation. The secretion pattern of these molecules determines the immune response type that will confront a particular antigen, and this pattern can be at least of two types. A Thl pattern, effective to eliminate mainly intracellular pathogens and a Th2 pattern, crucial to eradicate extra cellular pathogens. There are many immunological factors that affect expression of these proteins and auto regulate the Th1/Th2 balance, but there are few evidences about effect of other protagonists of mammals physiology. This review focuses on the regulation of the Th1/Th2 cytokine secretion pattern of immune cells by sexual steroids. The evidences indicate that cytokines and steroids form a common chemical language effective to keep the balance between immune and endocrine systems. Alterations of this delicate network can explain different pathologies where gender–associated differences exist and where sexual steroids are crucial factors.
Key words. Sex steroids. Polarization. Immune response. Cytokines. Th1, Th2
RESUMEN
La secreción de citocinas es uno de los aspectos más importantes en la modulación de la respuesta inmune. El patrón de secreción de estas moléculas determina el tipo de respuesta inmune que confrontará a un antígeno particular. Ésta puede ser al menos de dos tipos: la respuesta Th1 (encargada principalmente de controlar patógenos intracelulares) y la respuesta Th2 (involucrada en el control de patógenos extracelulares). Existe una autorregulación del balance del tipo de respuesta Th1/Th2 por mecanismos inmunológicos que pueden afectar la expresión de estas proteínas, pero poco se sabe con respecto al papel de otros protagonistas de la fisiología de los mamíferos. En esta revisión se discuten los trabajos referentes al efecto de los esteroides sexuales en la regulación de la secreción de citocinas Th1/Th2 por parte de células del sistema inmune. Las evidencias indican que las citocinas y los esteroides constituyen un lenguaje químico común para el funcionamiento balanceado de los sistemas inmune y endocrino. La alteración de la delicada comunicación entre estos sistemas puede explicar diversas patologías en que existe susceptibilidad asociada al sexo, y en las que los esteroides sexuales son factores clave.
Palabras clave. Esteroides sexuales. Polarización. Respuesta inmune. Citocinas. Th1, Th2.
INTRODUCCIÓN
El sistema inmune de los mamíferos tiene la extraordinaria capacidad de distinguir entre lo propio y lo ajeno del organismo, y ha evolucionado para proveer mecanismos flexibles y dinámicos capaces de enfrentar y eliminar específicamente una gran variedad de agentes patógenos. Para llevar a cabo estas acciones, posee un repertorio de células altamente especializadas que llevan a cabo distintas funciones con precisión y eficacia. Estas células son finamente reguladas por moléculas secretadas por los componentes propios del sistema inmune, pero también son susceptibles a la regulación por parte de moléculas aparentemente lejanas de lo inmunológico. Originalmente se creía que este sistema era autorregulado en un grado considerable; sin embargo, cada vez es más claro que, junto con el sistema neuroendocrino, ambos sistemas forman una interconexión directa y bidireccional.1 Así, los sistemas fisiológicos que integran a los organismos complejos interactúan entre sí formando redes de mutuo control, que favorecen el cumplimiento correcto de sus funciones específicas y las más generales del organismo entero.2
De forma que la respuesta inmunológica, como una respuesta homeostática bajo control fisiológico, contribuye al mantenimiento de la integridad de las células corporales y de los tejidos.3 Estas funciones las lleva a cabo no sólo mediante las moléculas específicas del sistema, sino también mediante las hormonas que están presentes en el microambiente de las células inmunológicas que pueden restringir su autonomía, probablemente por su acción sobre sus receptores específicos.3 La comunicación inmunoendocrina eficiente implica, entonces, la existencia de vías aferentes y eferentes que constituyen un sistema complejo de retroalimentación. Cuando se producen alteraciones en esta red, se desencadenan patologías que involucran a los diferentes componentes de la misma.
Es claro que, al igual que otras células corporales, las células del sistema inmunológico reciben la influencia del sistema endocrino, particularmente porque la respuesta inmunológica es, tal vez, el único fenómeno fisiológico en el cual la amplificación de su respuesta está basada en la proliferación celular y la transformación específica de sus componentes. Este proceso requiere, a su vez, de cambios metabólicos y factores de crecimiento que hacen a esta respuesta particularmente dependiente del control endocrino.4
Como ya se mencionó, las interacciones inmunoendocrinas son muy complejas, e involucran un asombroso grado de evolución y comunicación bioquímica. Los esteroides sexuales figuran de manera prominente en estas interacciones. Por lo que se antoja lógico pensar que, además de los diferentes factores inmunes implicados en la regulación de la compleja red inmunoendocrina, el género puede ser un factor importante en determinar el patrón de secreción de moléculas clave de la respuesta inmunológica, como las citocinas.5 Lo anterior sugiere que los esteroides sexuales pueden ser los responsables de estas diferencias entre género.
En este trabajo se revisan diferentes aspectos sobre el efecto de los esteroides sexuales en la secreción de citocinas por parte de células del sistema inmune y en particular de los linfocitos T colaboradores.
DICOTOMÍA TH1/TH2
Una población particular de células T, los linfocitos T colaboradores (CD4+), es la encargada de organizar una respuesta inmune apropiada contra un reto antigénico particular mediante la polarización de la respuesta inmune. Las dos principales subclases de células T colaboradoras, designadas como Th1 y Th2, poseen diferentes patrones de producción de citocinas y, como consecuencia, juegan diferentes papeles durante la respuesta inmune. Estas subclases se describieron originalmente con base en el patrón de producción de citocinas por parte de células T de ratón,6 pero el concepto también ha encontrado aplicación en células humanas.7–9 Las células Th1 secretan principalmente interleucina (IL)–2 e interferón (IFN)–γ, mientras que las células Th2 se caracterizan por la secreción de IL–4, IL–5, IL–6, IL–9, IL–10 e IL–13. Cada subclase coordina una serie de funciones inmunes coordinadas para controlar a algunos patógenos y padecimientos en particular, pero puede ser inefectiva, o hasta patológica, en respuesta a otro tipo de retos inmunológicos.7,10
Esta diversidad funcional en el sistema inmune ha sido propuesta para explicar una gama de fenómenos patológicos11,12 que incluyen la infección, la alergia y la autoinmunidad.9,13,14 Además, el paradigma se ha extendido a las distintas poblaciones de células del sistema inmune: linfocitos T citotóxicos,15 linfocitos B,16 células dendríticas,17 macrófagos,18 células NK19 y, actualmente, a las células T reguladoras, todas ellas importantes en la síntesis de citocinas.
DIMORFISMO SEXUAL DE LA RESPUESTA INMUNE
La determinación del genotipo sexual en la concepción, seguida por el desarrollo fisiológico y endocrinológico provocan múltiples y complejas diferencias entre machos y hembras en muchas especies sexualmente dimórficas. Empezando desde la infancia y a lo largo de la edad reproductiva, se presentan diferencias basadas en la producción, secreción y concentraciones circulantes de estrógenos, progesterona y testosterona. La base de estas diferencias se encuentra principalmente en la función y desarrollo del eje hipotálamo–pituitaria–gónadas (HPG).2,20 Las complejas interacciones entre las hormonas producidas por el eje HPG y otras hormonas, además de productos de genes independientes del sexo, producen un fenotipo de macho o de hembra. Aunque existe una gran variación entre individuos, el fenotipo de hembra se caracteriza típicamente por elevaciones cíclicas de estrógenos y progesterona y bajos niveles de andrógenos. En contraste, el fenotipo hormonal de macho se caracteriza por bajos niveles de estrógenos y progesterona y altos niveles de andrógenos.21
De lo anterior, se deduce que una diferencia en niveles de esteroides sexuales entre un sexo y otro, pudiera también determinar la diferencia entre la respuesta inmune de uno u otro sexo al mismo estímulo antigénico, o, determinar funciones inmunológicas diferentes entre ambos sexos. Aunque fue en 1979 cuando se publicaron los primeros reportes describiendo la presencia de receptores de esteroides sexuales en timo,22 la primera observación que evidenció una conexión entre el sistema inmune y el endocrino fue hecha por el científico italiano Calzolari en 1898, cuando publicó que el timo de conejos castrados antes de la madurez sexual era más grande que el de los animales controles.23 Sin embargo, esta observación despertó poco interés y pasó casi inadvertida. En 1940, Chiodi hizo una observación similar con respecto a los efectos de la castración sobre el peso del timo.24 La observación adicional de que el reemplazo de los andrógenos revirtió la hipertrofia tímica inducida por la castración, sugirió fuertemente que estos esteroides sexuales fueron los mediadores de este efecto.
Posteriormente, el dimorfismo inmunológico se demostró con la observación de que las hembras de diferentes especies producen niveles más altos de inmunoglobulinas circulantes, y típicamente presentan una respuesta inmune de tipo humoral más pronunciada en contra de la infección. La producción de una variedad de anticuerpos autorreactivos también es más frecuente en las hembras. Se ha comprobado que los estrógenos incrementan la respuesta de células B tanto in vivo como in vitro, mientras los andrógenos y la progesterona disminuyen la producción de anticuerpos. Las hormonas sexuales, además, modulan una gran cantidad de fenómenos implicados en la respuesta inmune, incluyendo la maduración y selección de timocitos, el tránsito celular, la proliferación de linfocitos, la expresión de moléculas y receptores del complejo mayor de histocompatibilidad clase II y la producción de citocinas. De acuerdo con estas observaciones, se sugiere que los estrógenos potencian la inmunidad mediada por células B y suprimen algunos aspectos dependientes de células T. La testosterona parece suprimir tanto la respuesta mediada por células T como la mediada por células B.25–28
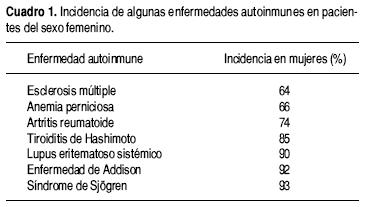
Son varias las evidencias que apoyan este efecto de los esteroides sexuales sobre fenómenos específicos. Por ejemplo, las observaciones clínicas y epidemiológicas de que las enfermedades autoinmunes son más comunes en mujeres que en hombres y que son más frecuentes durante la edad reproductiva de las mujeres sugieren que estas hormonas son factores clave en determinar estas diferencias. De acuerdo con datos proporcionados por los sistemas de salud de varios países, se sabe que más de 75% de las personas que padecen una enfermedad autoinmune son mujeres y que existen casos extremos, específicamente el lupus eritematoso sistémico, en que de cada 10 pacientes, nueve son mujeres29,30 (Cuadro 1).
Otro aspecto en que se han observado diferencias asociadas al sexo es durante diversas enfermedades infecciosas. Éstas incluyen dimorfismo sexual inmunitario o dimorfismo sexual asociado a parámetros de la infección.2,31 También abarca distintos parásitos y hospederos (Cuadro 2). Estas diferencias asociadas al sexo sugieren un papel importante de los esteroides sexuales como moduladores del sistema inmune. De los diversos aspectos moleculares que regulan a este sistema, aún no ha sido explorado con detalle el efecto que tienen los esteroides sexuales en la producción de citocinas. A continuación se resume los fenómenos inmunológicos que regulan los diferentes esteroides sexuales estudiados a la fecha, y su posible mecanismo molecular.
ESTRÓGENOS
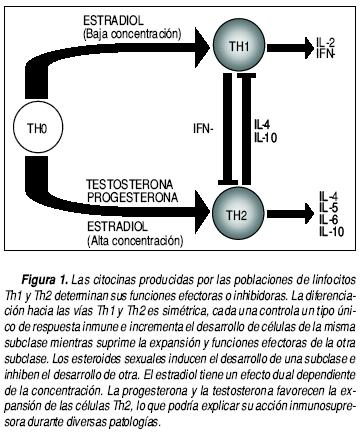
Los estrógenos son producidos principalmente en el ovario y, de las distintas formas que existen, el 17–β–estradiol es la forma circulante más común. Dentro de la gran cantidad de acciones que pueden ejercer, una que podría ser importante es la modulación de la inmunidad y la autoinmunidad.32 Uno de los mecanismos por medio de los cuales podría hacerlo es por la regulación de la secreción de citocinas. En un estudio en ratones hembras gonadectomizadas, la administración de estradiol promovió una fuerte respuesta de células TH1, medida por la cantidad de células productoras de IFN–γ.33 En estudios que implican procesos inflamatorios dependientes de células T, se encontró que los estrógenos regulan, y no sólo reducen, el número de células en el sitio de inflamación además de que disminuyen la expresión de marcadores de activación como CD40, CD44, CD69 y el receptor de IL–2.34 Además, los niveles de expresión de IL–2 e IFN–γ fueron disminuidos y los de IL–4 e IL–10 aumentados.35 En otros trabajos también se ha mostrado que los estrógenos inducen un incremento en la producción de citocinas Th2 como la IL–5, y la disminución de citocinas Th1 como la IL–2.36 Estudios adicionales han sugerido que, bajo ciertas circunstancias, los estrógenos podrían favorecer una respuesta tipo Th1. A nivel molecular se ha descubierto que la región promotora del gen del IFN–γ tiene un elemento de respuesta a estrógenos y se ha encontrado un incremento en los transcritos de este gen en linfocitos estimulados con estrógenos.37 En general, los estrógenos parecen tener una acción dual sobre la polarización de la respuesta inmune que depende de la concentración del esteroide. Algunos estudios sugieren que el estradiol puede potenciar tanto la producción de citocinas Th1 (IFN–γ) como de citocinas Th2 (IL–10). En estos estudios, altas concentraciones de estradiol (> 5,000 pg mL1) estimulan la secreción de IL–10 por parte de clonas de células T, mientras bajas concentraciones estimulan la secreción de IFN–γ. Estas observaciones también demostraron que el estradiol tiene un efecto bifásico en la secreción de TNF–α, potenciando su producción a bajas concentraciones y disminuyéndola a altas dosis38,39 (Figura 1). Este efecto dual del estradiol también se ha observado durante enfermedades inflamatorias crónicas. Los efectos de esta hormona pueden ser pro o antiinflamatorios si la concentración es baja o alta, respectivamente.40 En el cuadro 3 se muestran los efectos reportados a la fecha sobre las diferentes células inmunitarias.
PROGESTINAS
Una de las progestinas más importantes es la progesterona, que es una hormona clave en el establecimiento y mantenimiento del embarazo. Se sabe que este esteroide contribuye, mediante diversas acciones, a la supresión de la inmunidad materna contra el feto. Una de estas acciones se da mediante la modulación de la secreción de citocinas Th1/Th2.41 Miyaura e Iwata42 descubrieron que la progesterona inhibe directamente la expansión clonal de células Th1 mientras que potencian la diferenciación de las células Th2. También se ha comprobado que la progesterona induce la secreción de IL–4 e IL–5.43 El consenso general es que la progesterona tiene efectos antiinflamatorios, inhibiendo el desarrollo de células tipo Th1 mientras promueve la respuesta tipo Th2.44 Así, un cambio hacia el patrón Th2 (IL–4, IL–5, IL–6) podría beneficiar al feto, mientras el desarrollo de células Th1 (IL–2, IFN–γ y TNF–α) podría ser dañino.45 Otra evidencia que indica que la progesterona tiene influencia en la polarización de la respuesta inmune, es por las alteraciones en la secreción de citocinas durante la fase lútea del ciclo menstrual. Durante esta fase del ciclo menstrual de mujeres regulares la respuesta inmune se inclina hacia una respuesta tipo Th2, reflejada como un incremento en la producción de IL–4.46 Estos resultados sugieren que el incremento en las concentraciones de progesterona y estradiol durante la fase lútea del ciclo menstrual juega un papel en la desviación de la respuesta inmune hacia una respuesta tipo Th2. Existe también una relación entre la producción de citocinas y la de hormonas sexuales en mujeres que padecen alguna enfermedad autoinmune. Tal es el caso del lupus eritematoso sistémico: se ha descubierto que estas pacientes presentan altos niveles séricos de estradiol y progesterona, mientras que el número de células que secretan IFN–γ está reducido significativamente.47 El cuadro 3 resume los efectos de la progesterona sobre células blanco del sistema inraunitario.
Andrógenos
La testosterona y la dihidrotestosterona (DHT) son los dos andrógenos sexuales biológicamente más importantes. La testosterona a concentraciones fisiológicas actúa sobre los macrófagos, inhibiendo la producción de IL–1, IL–6 y TNF–a. En líneas celulares de macrófagos de ratón, la testosterona induce la síntesis de IL–10 y tiene efectos antiinflamatorios mediante la inhibición de TNF–α, mientras que el estradiol incrementa la producción de TNF–α y disminuye la síntesis de IL–10 en cultivos estimulados con lipopolisacárido (LPS).48 En otro trabajo con monocitos, se observó que la testosterona, a concentraciones fisiológicas, es capaz de incrementar el porcentaje de células productoras de IL–1 P e IL–12.49 El efecto de la testosterona sobre la producción de IL–10 también se ha observado en linfocitos T CD4+ de ratón, mediado por el receptor de andrógenos.50 Aunque se ha observado que la testosterona no tiene efecto en la producción de IFN–γ por leucocitos humanos,51 recientemente se descubrió que, en el bazo de ratones, este esteroide incrementa la expresión del gen del IFN–γ y de genes regulados por esta citocina.52 En contraste, en otro trabajo con ratones, se encontró que este andrógeno disminuye la secreción de IFN–y y de TNF–a.53 Este aparente efecto dual de la testosterona en la producción de IFN–γ se observó en células mononucleares de sangre periférica de conejos machos. De acuerdo con este estudio, la acción del esteroide en la producción de IFN–y depende de factores inherentes al animal, como el estatus hormonal, o factores estacionales. Es decir, después del tratamiento con testosterona la producción de IFN–γ disminuye si es primavera, pero se incrementa si es otoño. Estos efectos se asocian también al rango social y a otros aspectos endocrinos del animal.54 Otras evidencias indican que, en pacientes con deficiencias en la producción de andrógenos, la falta de acción de la testosterona puede afectar el balance de citocinas, lo que provoca que tanto la inmunidad celular como la inmunidad humoral sean activadas y, en ciertos casos, provoquen el desarrollo de enfermedades autoinmunes55 (Cuadro 3).
Por otra parte, es común que se confundan los efectos de la testosterona y la DHT y pocas veces se discriminan las acciones de ambas hormonas. Sin embargo, existen trabajos en que se demuestra la acción directa de la DHT en células T de ratón. En uno de estos trabajos se encontró que la exposición directa de linfocitos T de ratón a DHT in vitro redujo la producción de IL–4, IL–5 e IFN–γ después de la activación con anti–CD3, sin que esto tuviera efecto en la producción de IL–2.56 Una reducción de IL–4 e IL–5 provocada por la DHT también se detectó en otro trabajo con células de ratón.57 Además de reducir la producción de IFN–γ, también se ha encontrado que en células de bazo de ratones castrados la DHT disminuye la producción de IL–2 y promueve la liberación de IL–10, lo que sugiere que este andrógeno es capaz de regular negativamente, directa e indirectamente, a través de la liberación de IL–10, la respuesta tipo Thl.58 Durante el curso de la infección con la larva del helminto Taenia crassiceps, en los ratones machos, castrados y restituidos con testosterona y dihidrotestosterona, las cargas parasitarias disminuyeron considerablemente mientras que los niveles de IL–2 e IFN–γ se incrementaron.59
A pesar de que los andrógenos tienen efecto en la secreción de citocinas es difícil afirmar que son capaces de polarizar la respuesta inmune hacia una respuesta tipo Th1 o tipo Th2. Como se ha comprobado mediante las observaciones al respecto, los andrógenos pueden afectar al mismo tiempo la secreción de citocinas tanto del tipo 1 como del tipo 2 y este efecto puede ser dependiente de la concentración de los andrógenos, así como del estatus hormonal del individuo.
MECANISMOS DE ACCIÓN DE LOS ESTEROIDES SEXUALES EN CÉLULAS DEL SISTEMA INMUNE
La secreción de citocinas provocada por el efecto directo de los esteroides sexuales en células del sistema inmune puede darse mediante distintas vías. Los posibles mecanismos de acción de los esteroides en el sistema inmune incluyen, como en cualquier tejido endocrino clásico, la acción por vía genómica o por vía no genómica.60 De acuerdo con la teoría de acción genómica, los esteroides se unen a receptores específicos presentes en el citoplasma y funcionan como factores de transcripción. Además de la acción genómica, existen evidencias de que los esteroides pueden actuar mediante efectos rápidos no genómicos y que la transmisión de estos efectos se debe a la presencia de receptores específicos de membrana. Así, los efectos no genómicos sobre la función celular implican las convencionales cascadas de segundos mensajeros. Si bien estos mecanismos de acción han sido descritos en órganos del sistema endocrino, se han acumulado evidencias de que estas acciones también pueden operar en el sistema inmune. Así, ya se ha descubierto que receptores clásicos de esteroides están presentes en células de timo61 y bazo.62 Algunos trabajos indican que las acciones de la testosterona sobre células T son mediadas no sólo a través del receptor intracelular de andrógenos, sino también mediante un receptor de andrógenos de membrana sobre la superficie celular.63 De acuerdo con este descubrimiento, existe un patrón de expresión diferencial, entre el receptor de andrógenos intracelular (RAi) y un receptor de andrógenos membranal (RAm), asociado a la maduración de células T. Mientras que en células T de timo se encuentra un RAi funcional y no se expresa el RAm en cantidades significativas para un efecto biológico, en células T de bazo se expresa un RAm funcionalmente activo, pero el RAi presente no muestra funcionalidad en la vía genómica. Esto indica que el patrón de expresión del RAi y del RAm puede variar en una célula determinada durante su desarrollo y que la actividad inmunosupresora atribuida a la testosterona puede implicar células T de timo en enfermedades autoinmunes y células T de bazo en enfermedades infecciosas.64 No se sabe aún si ocurre algún tipo de regulación similar asociado a los estrógenos, la progesterona y sus receptores. También falta esclarecer en qué tipo de células del sistema inmune los esteroides sexuales tienen los efectos más profundos.
Otra posible acción de las hormonas esteroides, a través de sus receptores intracelulares y membranales sobre distintas células inmunitarias, puede implicar una regulación de una respuesta inmune contra algún patógeno particular que requiera la acción de estas hormonas de manera rápida e inmediata, mediante la vía no genómica, o requiera una respuesta con un retraso específico en el tiempo, mediante la vía genómica. Cabe entonces especular sobre la posibilidad de que la vía no genómica regule, predominantemente, la respuesta inmune innata mientras que la vía genómica haga lo propio con la respuesta inmune adaptativa. El éxito en la erradicación del patógeno invasor puede así implicar la acción no sólo del sistema inmune sino también, de manera directa o indirecta, de factores del sistema endocrino.
APLICACIONES DE LOS ESTEROIDES EN LA REGULACIÓN DE LA RESPUESTA INMUNE
Los efectos antiinflamatorios de los glucocorticoides se conocen desde hace más de 50 años. Sin embargo, poco se ha avanzado con respecto a utilizar otras hormonas esteroides como tratamiento para reducir la severidad de enfermedades autoinmunes o infecciosas. Con las evidencias que actualmente se acumulan sobre el papel inmunomodulador de los esteroides sexuales y con el avance en el uso y optimización de estas hormonas y sus diversos análogos, la influencia de otros esteroides (además de los glucocorticoides), sobre el sistema inmune es un área de intensa investigación. Ya se ha demostrado que los andrógenos adrenales de 19 carbonos pueden tener efectos tanto proinflamatorios como antiinflamatorios. Uno de los esteroides que ha generado mayor interés es la dehidroepiandrosterona (DHEA). La DHEA es el esteroide adrenal más abundante y es un intermediario central en la vía metabólica que produce las hormonas sexuales. Los niveles sanguíneos de DHEA declinan rápidamente después de los 35–40 años en la mayoría de los individuos, esto coincide con la aparición de algunas enfermedades como el cáncer y algunos desórdenes metabólicos. La terapia de reemplazo de DHEA ha sido probada como una manera de rejuvenecer al sistema inmune, pero con resultados dispares. Mientras que en roedores se han obtenido buenos resultados, en humanos no se han logrado muchos avances. Los beneficios preclínicos incluyen protección contra la diabetes, cáncer, enfermedades cardiovasculares, enfermedades autoinmunes como el lupus. A pesar de estos avances hace falta todavía mayor cantidad de estudios sobre la acción de los esteroides sexuales en el sistema inmune.
CONSIDERACIONES FINALES
Recientemente se ha descubierto que las células T reguladoras tienen distintas funciones efectoras durante la respuesta inmune. Es cada vez más grande el número de trabajos que atribuyen a estas células acciones clave para suprimir una respuesta inmune contra antígenos propios, previniendo enfermedades autoinmunes. También existen evidencias de que las células T reguladoras controlan respuestas inmunes contra bacterias, virus, parásitos y hongos. La remoción o reducción de esta población celular puede provocar el desarrollo espontáneo de varias enfermedades autoinmunes y puede potenciar la respuesta inmune contra diversos agentes patógenos. A pesar de la importancia biológica de estas células, no escapan a la regulación por parte de los esteroides sexuales. Se ha descubierto ya que el estradiol contribuye al incremento del número de estas células,65 sugiriendo que podría jugar un papel clave en la supresión de una respuesta inmune exacerbada. Sin embargo, todavía hace falta llevar a cabo distintos estudios sobre el efecto de los esteroides sexuales sobre las células T reguladoras. Así, se abre la posibilidad de que la terapia hormonal sea una opción prometedora para combatir o poder manipular el tipo de respuesta inmune a favor de la salud del paciente.
CONCLUSIONES
Las citocinas y las hormonas constituyen un lenguaje químico común para la comunicación entre los sistemas inmune y neuroendocrino. Tal comunicación sugiere un papel inmunorregulador de los esteroides que hasta el momento no se ha valorado en su verdadera dimensión. Los esteroides sexuales, como los andrógenos y los estrógenos, podrían operar suprimiendo o activando la función celular con base en un estímulo diferente y en el tejido blanco, proporcionando, en parte, una explicación a las diferentes susceptibilidades, entre mujeres y hombres, hacia algunas infecciones y enfermedades autoinmunes. En conjunto, estas evidencias sugieren que el efecto de los esteroides sexuales no puede generalizarse y afirmar que un esteroide en particular tiene un efecto específico potenciando o inhibiendo el desarrollo de células Th1 o Th2. La acción de estas hormonas en las células del sistema inmune debe más bien determinarse mediante la detección de cada citocina en particular, así todavía son necesarios diversos estudios para esclarecer los efectos de los esteroides sexuales en la producción de citocinas y particularmente los andrógenos puesto que han recibido poca atención con respecto a los estrógenos y la progesterona. Un entendimiento más claro de esta red de interacciones inmunoendocrinas está cambiando considerablemente nuestra concepción de la fisiología y podría afectar profundamente el tratamiento de diversas enfermedades.
REFERENCIAS
1. Besedovsky HO, Del Rey A. Immune–neuro–endocrine interactions: facts and hypotheses. Endocr Revs 1996; 17: 64–102. [ Links ]
2. Morales–Montor J, Chavarria A, De León MA, Del Castillo LI, Escobedo EG, Sánchez EN, Vargas JA, Hernández–Flores M, Romo–González T, Larralde C. Host gender in parasitic infections of mammals: an evaluation of the female host supremacy paradigm. J Parasitol 2004; 90: 531–46. [ Links ]
3. Armstrong MD, Klein JR. Immune–endocrine interactions of the hypothalamus–pituitary–thyroid axis: integration, communication and homeostasis. Arch Immunol Ther Exp (Warsz) 2001; 49: 231–7. [ Links ]
4. Chikanza IC, Grossman AB. Reciprocal interactions between the neuroendocrine and immune systems during inflammation. Rheum Dis Clin North Am 2000; 26: 693–711. [ Links ]
5. Giron–Gonzalez JA, Moral FJ, Elvira J, Garcia–Gil D, Guerrero F, Gavilán I, Escobar L. Consistent production of a higher TH1:TH2 cytokine ratio by stimulated T cells in men compared with women. Eur J Endocrinol 2000; 43: 31–6. [ Links ]
6. Mosmann TR, Cherwinski H, Bond MW, Giedlin MA, Coffman RL. Two types of murine helper T cell clone. I. Definition according to profiles of lymphokine activities and secreted proteins. J Immunol 1986; 136: 2348–57. [ Links ]
7. Abbas AK, Murphy KM, Sher A. Functional diversity of helper T lymphocytes. Nature 1996; 383: 787–93. [ Links ]
8. Lucey DR, Clerici M, Shearer GM. Type 1 and type 2 cytokine dysregulation in human infectious, neoplastic, and inflammatory diseases. Clin Microbiol Rev 1996; 9(4): 532–62. [ Links ]
9. Mosmann TR, Sad S. The expanding universe of T–cell subsets: Th1, Th2 and more. Immunol Today 1996; 17: 138–46. [ Links ]
10. Mosmann TR, Coffman RL. TH1 and TH2 cells: different patterns of lymphokine secretion lead to different functional properties. Annu Rev Immunol 1989; 7: 145–73. [ Links ]
11. Romagnani S. Lymphokine production by human T cells in diseases states. Annu Rev Immunol 2004; 12: 227–57. [ Links ]
12. D'Ambrosio D, Iellem A, Colantonio L, Clissi B, Pardi R, Sinigaglia F. Localization of Th–cell subsets in inflammation: differential thresholds for extravasation of Th1 and Th2 cells. Immunol Today 2000; 19: 568–74. [ Links ]
13. Jankovic D, Sher A, Yap G. Th1/Th2 effector choice in parasitic infection: decision making by committee. Curr Opin Immunol 2001; 13: 403–9. [ Links ]
14. Kidd P. Th1/Th2 balance: the hypothesis, its limitations, and implications for health and disease. Altern Med Rev 2003; 8: 223–46. [ Links ]
15. Sad S, Marcotte R, Mosmann TR. Cytokine–induced differentiation of precursor mouse CD8+ T cells into cytotoxic CD8+ T cells secreting Thlor Th2 cytokines. Immunity 1995; 2: 271–9. [ Links ]
16. Amel Kashipaz MR, Huggins ML, Lanyon P, Robins A, Powell RJ, Todd I. Assessment of Bel and Be2 cells in systemic lupus erythematosus indicates elevated interleukin–10 producing CD5+ B cells. Lupus 2003; 12: 356–63. [ Links ]
17. Moser M, Murphy M. Dendritic cell regulation of TH1–TH2 development. Nat Immunol 2000; 1: 199–205. [ Links ]
18. Mantovani A, Sozzani S, Locati M, Allavena P, Sica A. Macrophage polarization: tumor–associated macrophages as a paradigm for polarized M2 mononuclear phagocytes. Trends Immunol 2002; 23: 549–55. [ Links ]
19. Cooper MA, Fehniger TA, Caligiuri MA. The biology of human natural killer–cell subsets. Trends Immunol 2001; 22: 633–40. [ Links ]
20. Grossman CJ, Roselle GA, Mendenhall CL. Sex steroid regulation of autoimmunity. J Steroid Biochem Molec Biol 1991; 40: 649–59. [ Links ]
21. Wilson JD, Foster DW. Williams textbook of endocrinology. 1997; 8ª ed. EUA: Saunders. [ Links ]
22. Grossman CJ, Sholiton LJ, Nathan P. Rat thymic estrogen receptor. I. Preparation, location, and physiochemical properties. J Steroid Biochem 1979; 11: 1233–40. [ Links ]
23. Calzolari A. Rescherches experimentales sur un rapport probable entre la function du thymus et celle des testicules. Arch Ital Biol 1898; 30: 71. [ Links ]
24. Chiodi H. The relationship between the thymus and the sexual organs. Endocrinol 1940; 26: 107. [ Links ]
25. Grossman CJ. Possible underlaying mechanism of sexual dimorphism in the immune response, fact and hypothesis. J Steroid Biochem 1989; 34: 241–51. [ Links ]
26. Bebo BF, Schuster JC, Vandenbark AA, Offner H. Androgens alter the cytokine profile and reduce encephalitogenicity of myelin–reactive T cells. J Immunol 1999; 162: 35–40. [ Links ]
27. Da Silva JA. Sex hormones and glucocorticoids: interactions with the immune system. Ann N Y Acad Sci 1999; 876: 102–18. [ Links ]
28. Olsen NJ, Kovacs WJ. Effects of androgens on T and B lymphocyte development. Immunol Res 2001; 23(2–3): 281–8. [ Links ]
29. Jacobson DL, Gange SJ, Rose NR, Grahan MH. Epidemiology and estimated population burden of selected autoimmune diseases in the United States. Clin Immunol Immunopathol 1997; 84: 223–43. [ Links ]
30. Cooper GS, Stroehla BC. The epidemiology of autoimmune diseases. Autoimmun Rev 2003; 2: 119–25. [ Links ]
31. Zuk M, McKean A. Sex differences in parasite infections: Patterns and processes. Int J Parasitol 1996; 26(10): 1009–23. [ Links ]
32. Lahita RG, Bradlow HL, Kunkel HG, Fishman J. Alterations of estrogen metabolism in SLE. Arthritis Rheum 1979; 22: 1198–1200. [ Links ]
33. Maret A, Coudert JD, Garidou L, Foucras G, Gourdy P, Krust A, Dupont S, Chambón P, Druet P, Bayard F, Guery JC. Estradiol enhances primary antigen–specific CD4 T cell responses and Th1 development in vivo. Essential role of estrogen receptor alpha expression in hematopoietic cells. Eur J Immunol. 2003; 33: 512–21. [ Links ]
34. Salem ML, Hossain MS, Nomoto K. Mediation of the immunomodulatory effect of beta–estradiol on inflammatory responses by inhibition of recruitment and activation of inflammatory cells and their gene expression of TNF–a and IFN–g. Int Arch Allergy Immunol 2000; 121: 235–45. [ Links ]
35. Salem ML, Matsuzaki G, Kishihara K, Madkour GA, Nomoto K. β–estradiol suppresses T cell–mediated delayed–type hyper–sensitivity through suppression of antigen–presenting cell function and Th1 induction. Int Arch Allergy Immunol 2000; 121: 161–9. [ Links ]
36. Ahmed SA, Gogal RM, Walsh JE, Saunders G. Estrogen induces defects in T cell functions of mice. FASEB J 1996; 10: 961–5. [ Links ]
37. Fox HS, Bond BL, Parslow TG. Estrogen regulates the IFN–γ promoter. J Immunol 1991; 146: 4362–7. [ Links ]
38. Gilmore W, Weiner LP, Corréale J. Effect of estradiol on cytokine secretion by proteolip protein–specific T cell clones isolated from multiple sclerosis patients and normal control subjects. J Immunol 1997; 158: 446–51. [ Links ]
39. Corréale J, Arias M, Gilmore W. Steroid hormone regulation of cytokine secretion by proteolipid protein–specific CD4+ T cell clones isolated from multiple sclerosis patients and normal control subjects. J Immunol 1998; 161: 3365–74. [ Links ]
40. Cutolo M. Estrogen metabolites: increasing evidence for their role in rheumatoid arthritis and systemic lupus erythematosus. J Rheumatol 2004; 31: 419–21. [ Links ]
41. Piccinni MP. T cell cytokines in pregnancy. Am J Reprod Immunol 2002; 47(5): 289–94. [ Links ]
42. Miyaura H, Iwata M. Direct and indirect inhibition of Th1 development by progesterone and glucocorticoids. J Immunol 2002; 168: 1087–94. [ Links ]
43. Piccinni MP, Maggi E, Romagnani S. Role of hormone–controlled T–cell cytokines in the maintenance of pregnancy. Biochem Soc Trans 2000; 28(2): 212–15. [ Links ]
44. Piccini MP, Scaletti C, Maggi E, Romagnani S. Role of hormone–controlled Th1–and Th2–type cytokines in successful pregnancy. J Neuroinmunol 2000; 109: 30–3. [ Links ]
45. Ragusa A, de Carolis C, del Lago A, Miriello D, Ruggiero G, Brucato A, Pisoni MP, Muscara M, Merati R, Maccario L, Nobili M. Progesterone supplement in pregnancy: an immunologic therapy? lupus 2004; 13(9): 639–42. [ Links ]
46. Faas M, Bouman A, Moesa H, Heineman MJ, de Leij L, Schuiling G. The immune response during the luteal phase of the ovarian cycle: a Th2–type response? Fertil Steril 2000; 74(5): 1008–13. [ Links ]
47. Verthelyi D, Petri M, Ylamus M, Klinman DM. Disassociation of sex hormone levels and cytokine production in SLE patients, lupus 2001; 10(5): 352–8. [ Links ]
48. D'Agostino P, Milano S, Barbera C, Di Bella G, La Rosa M, Ferlazzo V, Farruggio R, Miceli DM, Miele M, Castagnetta L, Cillari E. Sex hormones modulate inflammatory mediators produced by macrophages. Ann N Y Acad Sci 1999; 876: 426–9. [ Links ]
49. Posma E, Moes H, Heineman MJ, Faas MM. The effect of testosterone on cytokine production in the specific and non–specific immune response. Am J Reprod Immunol 2004; 52(4): 237–43. [ Links ]
50. Liva SM, Voskuhl RR. Testosterone acts directly on CD4+ T lymphocytes to increase IL–10 production. J Immunol 2001; 167: 2060–7. [ Links ]
51. Le N, Yousefi S, Vaziri N, Carandang G, Ocariz J, Cesario T. The effect of beta–estradiol, progesterone and testosterone on the production of human leukocyte derived interferons. J Ciol Regul Homeost Agents 1988; 2(4): 199–204. [ Links ]
52. Wunderlich F, Dkhil MA, Mehnert LI, Braun JV, El–Khadragy M, Borsch E, Hermsen D, Benten WP, Pfeffer K, Mossmann H, Krucken J. Testosterone responsiveness of spleen and liver in female lymphotoxin beta receptor–deficient mice resistant to blood–stage malaria. Microbes Infect 2005; 7(3): 399–409. [ Links ]
53. Matejuk A, Hopke C, Vandenbark AA, Hum PD, Offner H. Middle–age male mice have increased severity of experimental autoimmune encephalomyelitis and are unresponsive to testosterone therapy. J Immunol 2005; 174(4): 2387–95. [ Links ]
54. Muscettola M, Massai L, Lodi L, Briganti F, Fontani G, Lupo C. IFN–gamma production in rabbits: behavioral and endocrine correlates. Life Sci 2003; 72(12): 1331–43. [ Links ]
55. Yesilova Z, Ozata M, Kocar IH, Turan M, Pekel A, Sengul A, Ozdemir IC. The effects of gonadotropin treatment on the immunological features of male patients with idiopathic hypogonadotropic hypogonadism. J Clin Endocrinol Metab 2000; 85(1): 66–70. [ Links ]
56. Araneo BA, Dowell T, Diegel M, Daynes RA. Dihydrotestosterone exerts a depressive influence on the production of interleukin–4 (IL–4), IL–5, and gamma–interferon, but not IL–2 by activated murine T cells. Blood 1991; 78: 688–99. [ Links ]
57. Moynihan JA, Callahan TA, Kelley SP, Campbell LM. Adrenal hormone modulation of type 1 and type 2 cytokine production by spleen cells: dexamethasone and dehydroepiandrosterone suppress interleukin–2, interleukin–4, and interferon–γ production in vitro. Cell Immunol 1998; 184: 58–64. [ Links ]
58. Angele MK, Knoferl MW, Ayala A, Bland KI, Chaudry IH. Testosterone and estrogen differently effect Th1 and Th2 cytokine release following trauma–haemorrhage. Cytokine 2001; 16: 22–30. [ Links ]
59. Morales–Montor J, Baig S, Hallal–Calleros C, Damián RT. Taenia crassiceps: androgen reconstitution of the host leads to protection during cysticercosis. Exp Parasitol 2002; 100(4): 209–16. [ Links ]
60. Falkenstein E, Tillmann HC, Christ M, Feuring M, Wehling M. Multiple actions of steroid hormones —a focus on rapid, non–genomic effects. Pharmacol Rev 2000; 52: 513–55. [ Links ]
61. Bridges ED, Greenstein BD, Khamashta MA, Hughes GR. Specificity of estrogen receptors in rat thymus. Int J Immunopharmacol 1993; 15: 927–32. [ Links ]
62. Sakazaki H, Ueno H, Nakamuro K. Estrogen receptor alpha in mouse splenic lymphocytes: possible involvement in immunity. Toxicol Lett 2002; 133(2–3): 221–9. [ Links ]
63. Benten WP, Becker A, Schmitt–Wrede HP, Wunderlich F. Developmental regulation of intracellular and surface androgen receptors in T cells. Steroids 2002; 67: 925–31. [ Links ]
64. Auci DL, Ahlem C, Li M, Trauer R, Dowding C, Paillard F, et al. The immunobiology and therapeutic potential of androstene hormones and their synthetic derivatives: novel anti–inflammatory and immune regulating steroid hormones. Mod Asp Immunobiol 2003; 3: 64–70. [ Links ]
65. Polanczy MJ, Carson BD, Subramanian S, Afentoulis M, Vandenbark AA, Ziegler SF, Offner H. Cutting edge: Estrogen drives expansion of the CD4+CD25+ regulatory T cell compartment. J Immunol 2004; 173: 2227–30. [ Links ]














