Services on Demand
Journal
Article
Indicators
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de investigación clínica
On-line version ISSN 2564-8896Print version ISSN 0034-8376
Rev. invest. clín. vol.57 n.6 Ciudad de México Nov./Dec. 2005
Artículo original
Ultraestructura de la retinopatía causada por la hiperoxia en ratas en desarrollo
Ultra structure of retinopathy induced by hyperoxia in developing rats
Luz Marina Rojas,* Katiuska Benítez,* Sor Marilú Suárez,* Alpidio Boada–Sucre,** Yleana Ramírez,* María Auxiliadora Romero,*** Gilma Hernández*
* Instituto de Investigaciones en Biomedicina y Ciencias Aplicadas, Universidad de Oriente (IIBCA–UDO).
** Instituto de Estudios Científicos y Tecnológicos. Universidad Nacional Experimental Simón Rodríguez (IDECYT–UNESR).
*** Posgrado en Biología Aplicada. Núcleo de Sucre, Universidad de Oriente.
Reimpresos:
M. Sc. Luz Marina Rojas
Instituto de Investigaciones en Biomedicina y Ciencias Aplicadas (IIBCA–UDO).
Universidad de Oriente. Núcleo de Sucre,
IIBCA–UDO, Cerro del Medio, Cumaná,
C.P. 6101. Edo. Sucre. Venezuela.
Fax: 0293–4521297. Tel. Ofic: 0293–4302140.
Apartado de correo 094.
Recibido el 13 de octubre de 2004.
Aceptado el 30 de agosto de 2005.
ABSTRACT
In order to evaluate the effect of postnatal hyperoxia on retinal structure, newborn rats were exposed to different oxygenation intervals (80 ± 1%) with three interruptions of 21% (30 min each). Four groups of rats were exposed from birth to the 6th, 9th, 12th and 14th postnatal day, respectively and another group was placed under normoxia. After this period all oxygenated groups and the controls remained under normoxia until they were 30 days old for the structural analysis of retina. Retinal histology was carried out using conventional techniques for transmission electron microscopy (TEM). In the ganglion cell layer of the retina from rats exposed for 9 days to hyperoxia, capillaries with large projections toward the lumen, were observed as a possible consequence of cellular edema of endothelium. The most severe damage was observed in rats exposed to hyperoxia during 12 and 14 days, showing mitochondrias swollen up and without crests in the areas surrounding the capillaries, necrosis and apoptosis processes, dense bodies, cells with swollen cytoplasms and rupture of the plasmatic membrane. The results suggest that postnatal hyperoxia causes severe damages to the retina in developing rats with a direct relationship between the time exposed to oxygen and ultra structural damages.
Key words. Retina. Retinopathy. Hyperoxia. Ultrastructure. Photoreceptors.
RESUMEN
Con el propósito de evaluar el efecto de la hiperoxia posnatal sobre la estructura retiniana se analizaron retinas de ratas recién nacidas expuestas a diferentes periodos de oxigenación (80 ±1%), con tres interrupciones de 21% (30 min c/u). Cuatro grupos de ratas fueron expuestas desde su nacimiento hasta el 6to, 9no, 12mo y 14to días de vida y otro grupo fue mantenido en normoxia. Después de este periodo tanto los grupos expuestos a la hiperoxia como los controles permanecieron en normoxia hasta una edad de 30 días para el análisis estructural de la retina. La histología se hizo usando técnicas convencionales para microscopía electrónica de transmisión (MET). En la capa de células ganglionares de la retina de ratas expuestas a nueve días de hiperoxia, se observaron capilares con notables proyecciones hacia la luz, posiblemente como consecuencia de edema celular del endotelio. El daño más intenso fue observado en las ratas expuestas a hiperoxia durante 12 y 14 días, mostrando mitocondrias hinchadas y sin crestas en las áreas circundantes a los capilares, procesos de necrosis y apoptosis, cuerpos densos, células con citoplasmas hinchados y con ruptura de la membrana plasmática. Los resultados sugieren que la hiperoxia posnatal causa graves daños a la retina en las ratas en desarrollo, con una relación directa entre el tiempo de exposición al oxígeno y los daños ultraestructurales.
Palabras clave. Retina. Retinopatía. Hiperoxia. Ultraestructura. Fotorreceptores.
INTRODUCCIÓN
La retinopatía del prematuro (ROP) es una retinopatía proliferativa inducida por isquemia, la cual afecta a los niños prematuros de muy bajo peso.1 Esta enfermedad es la principal causa de alteraciones visuales y ceguera en los recién nacidos pretérminos, sobre todo de los más inmaduros con un peso entre 750 g y 1 kg.2,3 La incidencia de ROP se ha incrementado en los últimos años debido a los grandes avances para hacer sobrevivir niños de muy bajo peso al nacer.2
El desarrollo de la red sanguínea del ojo comienza desde la parte central–posterior hacia la periferia y culmina justo antes de nacer el niño.4 Por consiguiente, cuando el niño nace prematuro, la retina no ha completado aún su desarrollo y la periferia del ojo carece de vasos sanguíneos. La retina inmadura al verse expuesta a la hiperoxia extrauterina, genera una regulación anómala en la producción del factor de crecimiento vascular (VEGF) provocando una disminución de la vascularización normal.2,5 Esta alteración en el desarrollo de la vascularización de la retina puede llevar a un proceso de proliferación fibrovascular, el cual ocasiona un desprendimiento parcial o total de la retina con la consiguiente pérdida de la agudeza visual. No todos los bebés que nacen prematuramente padecen de ROP, pero cuando esto sucede, pueden perder parcial o totalmente la visión.6
La retinopatía inducida por oxígeno (OIR), observada en animales recién nacidos (gatos, perros, cerdos, ratas y ratones) expuestos posnatalmente a hiperoxia, imita la ROP humana, debido a que éstos poseen al nacer una vasculatura retinal rudimentaria muy parecida a los infantes prematuros.7
La ROP, además de conducir a un anormal crecimiento de los vasos sanguíneos retinales, ocasiona también deterioro de la función de los bastones, lo cual puede ser determinado con el electrorretinograma(ERG).8,9
Reducciones graves en la amplitud del ERG fueron reportadas en cerdos recién nacidos expuestos posnatalmente a altos niveles de oxígeno.10 Por otra parte, ha sido demostrado que las ratas expuestas a 80% de oxígeno en los primeros once días de vida, presentan en la siguiente semana una reducción significativa en la sensibilidad de la respuesta de los bastones junto con una atenuación de uno de los potenciales oscilatorios.11
Se ha demostrado que las ratas recién nacidas, expuestas durante los primeros 14 días de vida en un ambiente hiperóxico desarrollan anomalías retinianas, que a nivel estructural se reflejan en una disminución del grosor de la capa plexiforme externa (CPE) y del número de células horizontales (NCH) y a nivel funcional en una disminución de la amplitud de la onda b del ERG.11–14 Existe una correlación oxigenodependiente entre la duración de la exposición al oxígeno y la disminución en la amplitud del ERG escotópico (en ausencia de luz), así como en el decrecimiento del grosor de la CPE y el NCH.11–14 La intensidad de estos daños depende, en gran parte, del estado de madurez de la retina al momento de comenzar la hiperoxia, originando un mayor deterioro cuando ésta comienza en la segunda semana de vida de la rata que si transcurre durante la primera.13
Recientemente se analizó la concentración de glutatión reducido (GSH) en los glóbulos rojos y la patología retiniana y coroidal en ratas en desarrollo sometidas a diferentes periodos de hiperoxia (80% ± 1 02).15 Se constató una disminución significativa del GSH indicando que ocurrió un gran estrés oxidativo y daños estructurales graves en la retina y la coroides, posiblemente producto de la hiperoxia.
En vista de la poca información existente acerca de los daños estructurales presentados en la retina de individuos con ROP, el presente estudio tiene como objetivo evaluar los efectos de la hiperoxia sobre la ultraestructura retiniana de ratas en desarrollo.
MATERIAL Y MÉTODOS
Se utilizaron ratas Sprague–Dawley procedentes del Instituto Venezolano de Investigaciones Científicas (IVIC).
Las ratas recién nacidas fueron colocadas en incubadoras. La iluminación de la caja de las ratas varió entre 20–30 cd/m2. Estos niveles de luz están por debajo de los que han sido considerados como causantes de degeneración de la retina en las ratas albinas.
Desde el día de su nacimiento, las ratas fueron expuestas diariamente a 80 ± 1% de oxígeno con tres interrupciones de 21% de oxígeno. Cada interrupción tuvo una duración de 30 min.12 El nivel de oxígeno en la incubadora fue mantenido a 80 ± 1% utilizando un analizador de oxígeno (7820 Oxygen Monitoring System), el cual fue conectado a la incubadora y calibrado diariamente.
Los ejemplares tratados se sometieron a diferentes regímenes de hiperoxia desde el día de su nacimiento al 6to, 9no, 12mo y 14to día de vida. Después del periodo de oxigenación, las ratas fueron mantenidas en un ambiente normóxico hasta una edad de 30 días. Para evitar las complicaciones pulmonares que con frecuencia son señaladas en las ratas adultas expuestas a la hiperoxia, las madres fueron alternadas cada día con las madres de los individuos control.12 De esta manera, estos controles, los cuales permanecieron en un ambiente normóxico, recibieron las madres de los pequeños expuestos al oxígeno y viceversa.
Para los análisis histológicos fueron estudiados cuatro animales por régimen de hiperoxia. La histología fue realizada de acuerdo con técnicas previamente utilizadas.15 Inmediatamente después del sacrificio el ojo fue enucleado, se le hizo una incisión a nivel de la ora serrata y rápidamente fue fijado completo durante 30 minutos en glutaraldehído a 3% en tampón fosfato 0.1 M, pH 7.4. Luego la retina, aún inmersa en glutaraldehído fue cortada, seleccionando para el estudio el sector central.
Para evaluar la morfología se realizaron cortes semifinos con cuchilla de vidrio, los cuales se tiñeron con azul de toluidina y se examinaron en un fotomicroscopio Zeiss. Para los análisis ultraestructurales se realizaron cortes finos (60–70 nm) obtenidos con una cuchilla de diamante y fueron contrastados con acetato de uranilo y citrato de plomo. Los cortes fueron observados y fotografiados con un microscopio electrónico de transmisión Hitachi H–600.
RESULTADOS
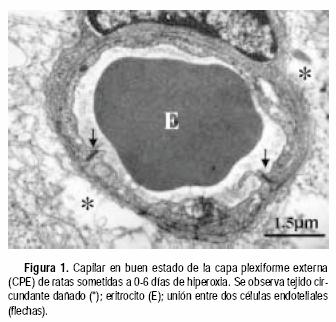
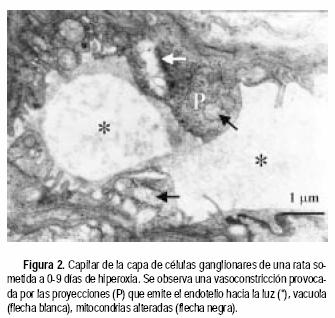
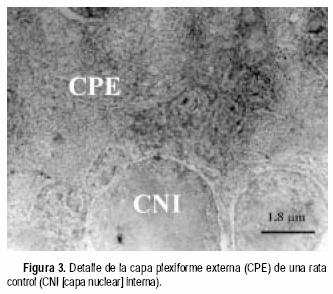
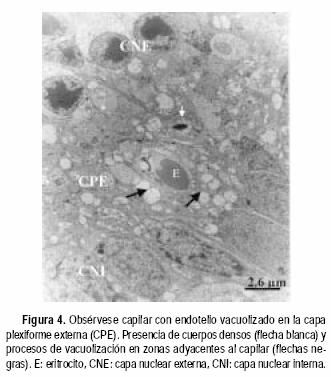
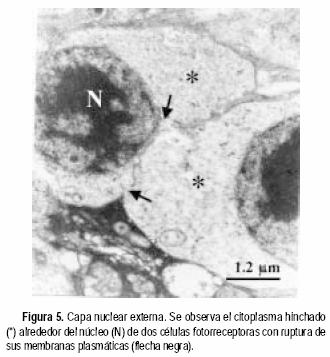
Las ratas expuestas a la hiperoxia los primeros seis y nueve días de vida mostraron algunos daños a nivel de los capilares sanguíneos y sus zonas aledañas. En la CPE de animales sometidos a seis días de hiperoxia se observaron capilares en aparente buen estado; sin embargo, el tejido circundante a los mismos se encontraba Usado (Figura 1). Por otro lado, en la capa de células ganglionares (CCG) de animales de nueve días de exposición al oxígeno, se observa una disminución del diámetro de sección de los capilares, posiblemente como consecuencia de edema celular del endotelio (Figura 2). En las zonas vecinas al capilar se observan mitocondrias hinchadas y sin crestas. Comparadas con las controles (Figura 3), las ratas expuestas a la hiperoxia durante 12 y 14 días mostraron daños ultraestructurales más graves. Se observaron mitocondrias hinchadas y sin crestas en el endotelio capilar de la CPE (Figura 4). Además, en las zonas adyacentes de este mismo capilar se evidenció la presencia de un cuerpo denso y procesos de vacuolización. En la capa nuclear externa (CNE) se observaron células con citoplasmas hinchados y con ruptura de la membrana plasmática conduciendo a una comunicación inusual entre dos células fotorreceptoras vecinas (Figura 5). Estas células hinchadas presentan un citoplasma electrón–transparente comparadas con las células normales a su alrededor.
En ratas expuestas a hiperoxia durante 14 días, además de las anormalidades ya señaladas, se observaron segmentos externos de fotorreceptores tanto con discos de membranas normales, como separados o en desorden (Figuras 6A y 6B).

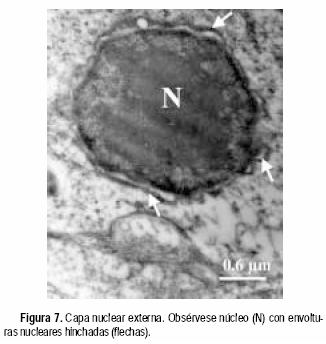
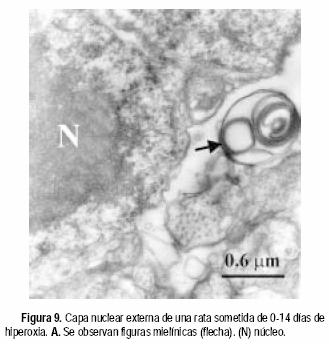
En la CNE se evidenciaron muchos núcleos con envolturas nucleares hinchadas (Figura 7) y núcleo destruido producto, probablemente, de un proceso de necrosis celular (Figura 8). En esta misma capa se manifestaron abundantes figuras mielinicas (Figura 9) y la presencia de cuerpos apoptóticos (Figura 10).


La fibrosis, crecimiento del tejido de cicatrización provocado por el crecimiento irregular de nuevos vasos sanguíneos en zonas retinianas sin riego, no fue observada en el tejido analizado. Esto pudo ser debido, en parte, a que sólo analizó la retina central y la fibrosis se observa en la periferia donde hay proceso de neovascularización.
DISCUSIÓN
Ultraestructuralmente, se observa una disminución del diámetro de sección de los capilares, en la capa de células ganglionares (CCG) de la retina de ratas expuestas a nueve días de hiperoxia. La respuesta inicial de la circulación retinal a las altas concentraciones de oxígeno en animales de laboratorio, es un daño estructural irreversible sobre el desarrollo del endotelio o revestimiento de los capilares retinales. Esto puede traer como consecuencia que los vasos sanguíneos más jóvenes sean obliterados regulándose de esta manera el flujo de sangre y la oxigenación de la retina interna.8
Cuando un individuo nace con una madurez incompleta de su vasculatura retinal y es sometido a altas concentraciones de oxígeno durante sus primeros 14 días de vida, el retorno a oxígeno normal está acompañado de una retinopatía vasoproliferativa severa.16 El oxígeno necesario para el desarrollo de la retina externa (epitelio pigmentado, capa fotorreceptora) es suministrado por la coroides. Durante la hiperoxia, la coroides suministra o provee excesivas concentraciones de oxígeno a la retina, de tal forma que la tensión de oxígeno está aumentada no solamente en la retina externa, sino también en la retina interna produciendo vaso–obliteración retinal.17 Cuando el individuo es devuelto a un ambiente normóxico, la circulación coroidal es inadecuada produciéndose de esta manera hipoxia relativa en la retina interna3 y también puede ocurrir hipoxia relativa de la coroides y fotorrecepto–res.18 Para recompensar esta hipoxia ocurre una neovascularización marcada que es el origen de las consecuencias más severas de la ROP.19
El daño neuronal está asociado con un incremento de aminoácidos excitatorios, glutamato y aspartato en el medio extracelular, los cuales podrían prolongar la activación de receptores de membrana y alterar la homeostasis del Ca2+ intracelular, frecuentemente involucrado en el mecanismo de muerte celular.20,21
Con el propósito de analizar el mecanismo por el cual ocurre la acumulación extracelular de aminoácidos endógenos como aspartato, glutamato, glicina, taurina, alanita y GABA, se utilizaron cultivos de células retinianas bajo estrés oxidativo inducido por ascorbato/Fe2+ en comparación con hipoxia inducida químicamente con oligomicina más cianida o condiciones de isquemia (hipoxia inducida más ácido iodoacético o deoxiglucosa).22 Se evaluó la correlación entre la liberación de los aminoácidos, los cambios en la homeostasis intracelular de Ca2+, la depolarización de las membranas y la carga de energía de las células retinianas, con el objetivo de conocer los mecanismos de muerte celular excitotóxica. Bajo las tres condiciones experimentadas ocurrió:
1. Una liberación de los aminoácidos endógenos en ausencia de estimulación, aunque por diferentes mecanismos intracelulares.
2. Después del estrés oxidativo, la acumulación de aspartato, glutamato y GABA en el medio extracelular es dependiente del Ca2+, mientras que la acumulación de aminoácidos que ocurre bajo condiciones de hipoxia o isquemia es un mecanismo principalmente independiente del Ca2+.
3. En condiciones de isquemia se observó un descenso en el estatus de energía de las células retinianas, lo cual se correlaciona con un incremento en la liberación de aminoácidos, especialmente aspartato y glutamato.
La CCG también mostró mitocondrias hinchadas y sin crestas en las zonas vecinas a los capilares; en ratas expuestas a la hiperoxia durante nueve días. Los efectos tóxicos de la hiperoxia son más obvios en las mitocondrias,8 las cuales aparecen hinchadas debido a la entrada de agua y sodio a la célula, ya que el proceso activo de la bomba sodio y potasio se detiene. Periodos de hipoxia relativa producen también una alteración en las mitocondrias frenando la fosforilación oxidativa y disminuyendo así la producción de ATP.23 La capa fotorreceptora de las ratas expuestas a 14 días de hiperoxia, reveló discos de membrana separados en los segmentos externos de los bastones. Los fotorreceptores requieren enormes cantidades de energía y oxígeno para la síntesis y disposición de los discos de los segmentos externos.24 Con la hipoxia relativa inducida por un cambio de hiperoxia a normoxia, la exigencia de oxígeno para el desarrollo de los fotorreceptores podría ser recibida incompletamente produciéndose de esta manera distrofia hipóxica que modifica la estructura de los segmentos externos.1125
La retina de los animales sometidos a la hiperoxia durante 12 y 14 días, mostró áreas de degeneración donde se percibe la pérdida total de la estructura celular. Tales hallazgos son característicos de un mecanismo de muerte celular conocido como necrosis. También se observó cierta cantidad de apoptosis en las partes periféricas a la zona dañada. Los primeros signos de degeneración se observan en las mitocondrias, las cuales se hinchan y su estructura interna tiende a desaparecer. Estas alteraciones son una consecuencia de la pérdida del control de la permeabilidad selectiva de la membrana celular que causa edema celular y vesiculación y que, finalmente, lleva a la ruptura de la membrana plasmática con salida del contenido intracelular.26 Las figuras mielínicas, envolturas nucleares hinchadas y cuerpos densos en la retina de ratas expuestas a 12 y 14 días de oxigenación son hallazgos característicos de lesiones irreversibles a la célula.
Las figuras mielínicas son pilas de bicapas fosfolipídicas en forma de esferas, cilindros y espirales que se desarrollan donde quiera que las células son destruidas. Probablemente, cuando la célula muere hay proteólisis severa en la membrana celular y el citoesqueleto y los fosfolípidos quedan libres.23
La presencia de envolturas nucleares hinchadas puede estar asociada con alteraciones de proteínas nucleares que son degradadas. Se ha determinado que los núcleos de los fotorreceptores se dañan en retinas expuestas al oxígeno.11
En las ratas la exposición a la hiperoxia durante los primeros 14 días de vida repercuten en la reducción paulatina del grosor de la capa plexiforme externa (CPE) y del número de células horizontales (NCH).13 Dado que la exposición a la hiperoxia puede impedir la formación de sinapsis en la CPE, la reducción del NCH puede ser consecuencia de procesos degenerativos que se desatan por su incapacidad en establecer conexiones sinápticas verdaderas o por su hipersensibilidad al oxígeno.13
El estado oxidativo de los glóbulos rojos puede ser usado como un índice biológico del daño oxidativo retinal.27 Existe una alta similitud entre las células de la retina humana y los glóbulos rojos en lo que respecta a su estructura de membrana (cadenas muy largas de ácidos grasos polinsaturados, susceptibles a la oxidación), su metabolismo (alta demanda de glucosa y oxígeno) y sus mecanismos antioxidantes.28
Analizando la concentración de glutatión reducido (GSH) en los glóbulos rojos de las ratas sometidas a hiperoxia durante los primeros seis, nueve, 12 y 14 días de vida, se demostró que, comparados con el control, los individuos expuestos durante los primeros seis y nueve días presentaron una disminución significativa (68 y 54%) de los niveles de GSH, respectivamente.15 Las ratas expuestas durante 12 días, por el contrario, mostraron sólo una ligera declinación en estos niveles (13%). No obstante, en las expuestas durante 14 días, los niveles de GSH superaron las del control en 34%. La disminución del GSH en los eritrocitos de las ratas expuestas los primeros seis y nueve días de edad pudo deberse a una sobreproducción de radicales libres. Posiblemente durante los primeros nueve días, se activen los mecanismos de defensa provocando una disminución de los niveles de GSH y esto pudiera ser resultado de la activación de enzimas, tales como la glutatión peroxidasa.29 A una hiperoxia más prolongada (12 días), los niveles de GSH tienden a ser nivelados, llegando inclusive a superar los controles en el tratamiento de 14 días; esto, probablemente, como un proceso adaptativo del organismo.
Nuestros resultados sugieren que existe una relación directa entre el tiempo que dura la hiperoxia y la aparición de una serie de anormalidades ultraestructurales que indican la existencia de un daño severo en la retina de las ratas que posiblemente sea mediado por el gran estrés oxidativo al que ésta ha estado sometida.
AGRADECIMIENTO
Este estudio fue financiado por el Fondo Nacional de Ciencia, Tecnología e Innovación (FONACIT), el Consejo de Investigación del Núcleo de Sucre de la Universidad de Oriente (CINS–UDO) y el Instituto de Investigaciones en Biomedicina y Ciencias Aplicadas de la Universidad de Oriente (IIBCA–UDO). Los autores agradecen a José Luis Prin, Antonio Gómez y Milagro Moreno por su asistencia técnica.
REFERENCIAS
1. Mechoulam H, Pierce E. Retinopathy of prematurity: molecular pathology and therapeutic strategies. Am J Pharmacogenomic 2003; 3: 261–77. [ Links ]
2. Grunauer N, Iriondo M, Serra A, Krauel J, Jiménez R. Retinopatia del premature Casuística de los años 1995–2001. Annales de Pediatría 2003; 58: 471–7. [ Links ]
3. Beby F, Burillon C, Putet G, Denis P. Retinopathy of prematurity. Results of fundus examination performed in 94 preterm infants. J Fran Ophtalmol 2004; 27: 337–44. [ Links ]
4. Pierce EA, Foley ED, Smith LEH. Regulation of vascular endotelial growth factor by oxygen in a model of retinopathy of prematurity. Arch Ophthalmol 1996; 114: 1219–54. [ Links ]
5. Trese M. Retinopathy of prematurity. In: Retina. Tomo III. Ryan (ed.). Boston: Blackwell Scientific Publications; 1989; pp. 551–63. [ Links ]
6. Reynaud X, Dorey C. Extraretinal neovascularization induced by hypoxic episodes in the neonatal rat. Investigative Ophthalm Vis Scien 1994; 35: 3169–77. [ Links ]
7. Garner A. The role of hyperoxia in the etiology of retinopathy of prematurity. Docum Ophthalmologica 1990; 74: 187–93. [ Links ]
8. Reisner D, Hansen R, Findl O, Petersen R, Fulton A. Dark–adapt–ed thresholds in children with histories of mild retinopathy of prematurity. Invest Ophthalm Vis Scien 1997; 38: 1175–83. [ Links ]
9. Penn J, Thum L, Rhem M, Dell S. Effects of oxygen rearing on the electroretinogram and GFA–protein in the rat. Invest Ophthalm Vis Scien 1988; 29: 1623–30. [ Links ]
10.Reynaud X, Hansen R, Fulton A. Effect of prior oxygen exposure on the electroretinographic responses of infant rats. Invest Ophthalm Vis Scien 1995; 36: 2071–9. [ Links ]
11. Lachapelle P, Dembinska O, Rojas LM, Benoit J, Almazan G, Chemtop S. Persistent functional and structural retinal anomalies in newborn rats exposed to hyperoxia. Canad J Phys Pharmacol 1999; 77: 1–8. [ Links ]
12. Dembinska O, Rojas LM, Varma D, Chemtob S, Lachapelle P. Graded contribution of retinal maturation to the development of oxygen–induced retinopathy in rats. Invest Ophthalm Vis Scien 2001; 42: 1111–18. [ Links ]
13. Dembinska O, Rojas LM, Chemtob S, Lachapelle P. Evidence for a brief period of enhanced oxygen susceptibility in the rat model of oxygen–induced retinopathy. Invest Ophthalm Vis Scien 2002; 43: 2481–90. [ Links ]
14. Rojas LM, Suárez SM, Lemus M, Benítez K, Ramírez Y, Mitchell M, Boada–Sucre A. Estrés oxidativo como posible causante de retinopatía en ratas en desarrollo sometidas a hyperoxia. Interciencia 2004; 29: 556–61. [ Links ]
15. Ricci B. Effects of hyperbaric, normobaric and hypobaric oxygen supplementation on retinal vessels in newborn rats: a preliminary study. Experimental Eye Research 1987; 44: 459–64. [ Links ]
16. Alder V, Ben–Num J, Cringle S. Profiles and oxygen consumption in cat retina with occluded retinal circulation. Invest Ophthalm Vis Scien 1990; 31: 1029–34. [ Links ]
17. Wolbarsht M, George G, Shearing W, Kylstra J, Landers M. Retinopathy of prematurity: A new look at an old disease. Ophthalmic Surg 1983; 14: 919–24. [ Links ]
18. Robbins S, Conaway J, Ford B, Roberto K, Penn J. Detection of vascular endothelial growth factor (VEGF) protein in vascular and non–vascular cells of the normal and oxygen–injured rat. Growth Factors 1997; 14: 229–41. [ Links ]
19. Schousboe A, Frandsen A, Wahl P, Krogsgaard–Larsen P. Excitatory amino acid–induced cytotoxicity in culture neurons: role if intracellular Ca2+ homeostasis. In: Glutamate Cell Death and Memory (Ascher P, Choi DW, and Christen Y, Eds.). Heidelberg: Springer–Verlag; 1991, pp. 137–52. [ Links ]
20. Frandsen A, Schousboe A. Excitatory amino acid–mediate cytotoxicity and calcium homeostasis in culture neurons. J Neuroch 1993; 60: 1202–11. [ Links ]
21. Rego CA, Santos MS, Oliveira CR. Oxidative stress, hipoxia, and ischemia–like conditions increase the release of endogenous amino acids by distinct mechanisms in culture retinal cells. J Neuroch 1996; 66: 2506–16. [ Links ]
22. Majno G, Joris I. Cells, tissues and disease: Principles of general pathology. USA: Blackwell Science; 1996, pp. 227. [ Links ]
23. Young R. Visual cells and the concept of renewal. Invest Ophthalm Vis Scien 1976; 15: 700–25. [ Links ]
24. Fulton A, Reynaud X, Hansen R, Lemere C, Parker C, Williams T. Rod photoreceptors in infant rats with a history of oxygen exposure. Invest Ophthalm Vis Scien 1999; 40: 168–73. [ Links ]
25. Ramirez C, Carracedo J, Moreno C, Guerra F. Apoptosis y enfermedad. Alergol Inmunol Clin 1999; 14: 367–74. [ Links ]
26. Thornalley P, McLellan A, Lo T, Sonksen P. Negative association between erythrocyte reduced glutathione concentration and diabetic complications. Clin Sci 1996; 91: 575–82. [ Links ]
27. De la Paz M, Zhang J, Fridovich I. Antioxidant enzymes of the human retina: Effect of age on enzyme activity of macula and periphery. Curr Eye Res 1996; 15: 273–8. [ Links ]
28. Clahsen P, Moison R, Holtzer C, Berger H. Recycling of glutathione during oxidative stress in erythrocytes of the newborn. Pediatr Res 1992; 32: 399–402. [ Links ]














