Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de investigación clínica
versão On-line ISSN 2564-8896versão impressa ISSN 0034-8376
Rev. invest. clín. vol.57 no.3 Ciudad de México Mai./Jun. 2005
Foro clínico
Predicción de malignidad en neoplasias endocrinas del páncreas
Malignance prediction in pancreas endocrine neoplasias
Carlos Fernández–del Castillo*
* Cirujano Titular, Massachusetts General Hospital.
Reimpresos:
Carlos Fernández–del Castillo A, MD
Escuela de Medicina de Harvard
Massachusetts General Hospital
15 Parkman Street, WANG 336#
Boston MA 02114. U.S.A.
Phone 617–726–5644.
Recibido el 27 de enero de 2005.
Aceptado el 2 de mayo de 2005.
CASO CLÍNICO
El caso corresponde a un paciente masculino de 57 años de edad, casado, músico profesional, sin antecedentes familiares relevantes y con historia personal de tuberculosis pulmonar tratada hace más de 10 años. No tiene antecedente tabáquico o de alcoholismo. Negó tomar medicamentos y describió alergia a la aspirina manifestada por edema palpebral.
El padecimiento actual lo inició cuatro semanas antes de su ingreso cuando presentó dolor epigástrico intermitente y de tipo ardoroso que no respondió inicialmente a antiácidos ni a omeprazol. Al persistir con el dolor se le practicó un ultrasonido del abdomen, el cual mostró hígado y vesícula normales, y una masa hipoecoica en el cuerpo del páncreas.
El dolor desapareció a los pocos días, y se practicó una tomografía axial computarizada, la cual confirmó la presencia de una tumoración en la unión del cuerpo y cola del páncreas. La lesión medía 1.3 cm y era de aspecto quístico con paredes hipervasculares (Figura 1). El resto de las estructuras y órganos intraabdominales era de aspecto normal. Posteriormente, el paciente se sometió a un ultrasonido endoscópico mediante el cual se realizó biopsia por aguja fina. El resultado de la biopsia se informó como compatible con tumor neuroendocrino, con algunas células atípicas. El paciente negó síntomas de disfunción hormonal, al igual que pérdida de peso o síntomas gastrointestinales fuera del dolor epigástrico que presentó inicialmente y el cual no recurrió. Los exámenes de laboratorio, incluyendo niveles de insulina, glucagón, polipéptido pancreático y el marcador tumoral CA 19–9 se encontraron en límites normales.

Posteriormente se practicó exploración quirúrgica abierta. La única anormalidad fue el tumor pancreático que era de consistencia firme. Se llevó a cabo una pancreatectomía distal con preservación del bazo. El paciente fue dado de alta a los pocos días sin complicaciones.
El reporte de patología describió un tumor endocrino pancreático de 1.5 cm de diámetro con un patrón infiltrativo y escasa necrosis. No se observó invasión linfática o vascular. Las mitosis eran infrecuentes y los márgenes negativos. Por immunohistoquímica se demostró positividad para cromogranina, enolasa neuronal y sinaptofisina. La tinción para Ki–67 mostró positividad en 1–2% de las células, lo cual es similar al páncreas normal.
El paciente se mantuvo asintomático. A los seis y 12 meses se practicó una tomografía del abdomen que no mostró anormalidades. A los dos años se realizó otra tomografía en la cual se observaron tres lesiones hepáticas consistentes con metástasis de tumor neuroendocrino. Se decidió por un manejo conservador, y seis meses después el paciente continúa asintomático y las lesiones hepáticas no se han incrementado en número o tamaño.
Se trata, pues, de un paciente en la sexta década de la vida, con un tumor neuroendocrino no funcionante, resecado, y que recurre en forma de metástasis hepáticas dos años después. A pesar de que el paciente presentó inicialmente con dolor abdominal, no es remoto pensar que el tumor haya sido un hallazgo incidental, ya que el tumor era muy pequeño, el dolor fue autolimitado y de tipo ardoroso, y nunca hubo evidencia de pancreatitis.
PERSPECTIVA HISTÓRICA
Morbus incertae sedis. Así describió Giovanni Battista Morgagni a la diabetes mellitus en su obra magistral publicada en 1765, y en la cual correlacionó, en forma acertada, la anatomía patológica y la clínica de cientos de enfermedades. Por más de tres mil años la sede anatómica de la diabetes y la función endocrina del páncreas permanecieron en un misterio. No fue sino hasta el final del siglo XIX que se estableció esta conexión y, poco después, en 1921, que se descubrió la insulina por Banting y Best.1 Este descubrimiento, y la observación por clínicos astutos de los síntomas derivados del exceso de la administración de insulina, llevaron al poco tiempo a la descripción clínica de los tumores endocrinos del páncreas con sobreproducción de insulina.
La primera operación de insulinoma la llevó a cabo el Dr. William Mayo, en 1926. Es de interés que el paciente era un médico quien se autodiagnosticó después de haber sufrido síntomas de hiperinsulinismo por más de 20 meses. El diagnóstico lo confirmó el Dr. Russell Wilder, quien fuera jefe de Endocrinología en la Clínica Mayo. Desafortunadamente, durante la operación se encontró un tumor grande en la cola del páncreas con múltiples metástasis hepáticas. La resección no se pudo llevar a cabo y el paciente murió un mes después. La primera resección curativa de insulinoma la llevó a cabo el Dr. Roscoe Graham, en Toronto, en 1929.1 En 1944, Alien O. Whipple, el padre de la cirugía pancreática, reportó 134 casos de hiperinsulinismo, de los cuales 106 habían sido operados (la casuística personal del Dr. Whipple fue de 39 casos de insulinoma explorados, en los cuales encontró el tumor en 35).2
La identificación de otras hormonas y de los síndromes que resultan de su sobreproducción, eventualmente llevó al diagnóstico y tratamiento de otros tumores endocrinos del páncreas. Sin embargo, desde un principio se vio que existían tumores procedentes de los islotes que no tenían traducción clínica. Estos tumores no funcionantes, inicialmente se diagnosticaban únicamente por autopsia o cuando el tumor era lo suficientemente grande para causar síntomas por compresión (ictericia, obstrucción duodenal, etc.). El advenimiento de la radiología moderna ha permitido la identificación, diagnóstico y tratamiento de estos tumores no funcionantes en forma más temprana.
La dificultad para determinar malignidad en los tumores endocrinos del páncreas ha sido reconocida por los patólogos desde que los primeros tumores de este tipo fueron resecados. La Dra. Virgina Frantz es una de las pioneras y figuras más destacadas en la patología quirúrgica del páncreas, en particular de los tumores neuroendocrinos. Ella trabajó en el Presbyterian Hospital de la Universidad de Columbia en Nueva York, donde Whipple era el cirujano, y enfatizó que muchos de estos tumores, aunque tengan apariencia relativamente benigna y ausencia de metástasis o invasión local, deben clasificarse como de "comportamiento incierto", ya que el pronóstico no podía predecirse.3
ASPECTOS GENERALES
Las neoplasias endocrinas del páncreas son tumores epiteliales poco frecuentes. Se estima que su incidencia anual es de un caso por cada 150,000 habitantes (para comparación, la incidencia del cáncer exocrino del páncreas es de 10 por 100,000). Pueden tener comportamiento benigno o maligno y se clasifican como funcionantes o no funcionantes, y estos últimos de acuerdo con el péptido que producen en exceso4 (Cuadro 1).

La presentación clínica es variable. Los tumores funcionantes generalmente se presentan con síntomas relacionados a hipersecreción hormonal, con síndromes muy variados y característicos. Los tumores no funcionantes usualmente se presentan como efecto de masa. Recientemente ha habido un incremento en el número de tumores detectados en forma incidental a consecuencia de estudios radiológicos hechos por otro motivo. Si bien la mayoría de los tumores detectados de esta manera son no funcionantes, algunos con secreción hormonal, no muy aparente clínicamente, llegan a identificarse de esta manera.
En la última década ha habido avances importantes en la localización de tumores funcionantes, mediante el uso de ultrasonido endoscópico y cintigrafía de los receptores de somatostatina usando octreótido radiactivo ("octreoscan").5 Esta última técnica, además de utilizarse para localizar tumores pequeños no aparentes por resonancia magnética, tomografía, o ultrasonido endoscópico, tiene utilidad para detectar metástasis de tumores neuroendocrinos.
Aunque la discusión del tratamiento de las neoplasias endocrinas del páncreas no es el objetivo de esta revisión, cabe mencionar que el manejo de los tumores que se encuentran localizados es quirúrgico, ya sea con enucleación (si los tumores son pequeños) o con resección pancreática formal (operación de Whipple, pancreatectomía distal, pancreatectomía media o pancreatectomía total en casos selectos).6 La cirugía tiene un papel más limitado en pacientes con enfermedad metastásica, aunque en casos seleccionados se llega a emplear resección hepática e incluso trasplante hepático.5 Los análogos de somatostatina se utilizan, fundamentalmente, para el manejo de los síntomas, pero tienen también efecto antitumoral. El interferón alfa y varios agentes quimioterapéuticos se han utilizado con resultados variables.7
El pronóstico de los pacientes con neoplasias endocrinas del páncreas depende, principalmente, del estadio del tumor al momento de la presentación.8,9 En general son tumores con un curso indolente, y no es raro ver pacientes con metástasis que viven por muchos años.8 La mejor sobrevida es para aquellos pacientes cuyos tumores se encuentran localizados y son resecados en forma completa. En este grupo se encuentran más de 90% de los insulinomas, aproximadamente 60% de los gastrinomas y de 10 a 20% de los tumores no funcionantes.5 Por definición, todos los tumores que se clasifican como "benignos" están en esta categoría, pero también algunos que a priori son clasificados como malignos con base en invasión de estructuras vecinas o presencia de metástasis linfáticas contiguas y que han sido resecados en forma completa. Es, precisamente, la incapacidad para predecir el comportamiento de estos tumores "benignos" lo que ha frustrado a clínicos y a patólogos por más de ocho décadas, ya que en algunos de estos pacientes se obtiene una curación permanente, pero en otros se observa recurrencia que, eventualmente, lleva a la muerte. El caso presentado es un paradigma de esta situación, ya que el paciente tenía un tumor endocrino pequeño del páncreas que fue completamente resecado y carecía de invasión a estructuras vecinas o ganglios linfáticos y, sin embargo, recurrió en forma de metástasis hepáticas a los dos años.
CLASIFICACIÓN DE CAPELLA
En 1995, Capella, et al. propusieron clasificar los tumores endocrinos del páncreas con base en el tamaño, parámetros histológicos (incluyendo diferenciación), invasión vascular y linaje funcional, creando cuatro subgrupos denominados (I) benigno, (II) "borderline", (III) de baja malignidad, y (IV) de alta malignidad10 (Cuadro 2). Esta clasificación fue validada por Heymann, et al., en un grupo de 82 tumores esporádicos,11 quienes encontraron que ninguno de los 30 pacientes clasificados en el grupo I desarrolló metástasis o murió a consecuencia del tumor. Sin embargo, la mayoría de esos tumores eran insulinomas, y cabe hacer notar que en los 37 pacientes del grupo III (supuestamente de baja malignidad) hubo metástasis en 70% y muerte relacionada al tumor en 27%.
Más recientemente, Hochwald, et al. aplicaron la clasificación de Capella en 136 casos del Memorial Sloan–Kettering12 y cuestionaron su utilidad. Estos autores encontraron que tres de 15 pacientes con tumores clasificados como benignos y cuatro de ocho clasificados como "borderline" recurrieron o murieron por la enfermedad, y propusieron abandonar esta nomenclatura y clasificar a todos los tumores neuroendocrinos (con la excepción de los microadenomas, que son tumores que miden menos de 5 mm) como potencialmente malignos.
En la experiencia del Massachusetts General Hospital, 39 de 101 tumores endocrinos del páncreas (resecados con intento curativo) fueron categorizados como benignos de acuerdo con la clasificación de Capella, y tres de ellos (7.7%) murieron con recurrencia tumoral.13 Esta cifra es preocupante para un tumor "benigno", y demuestra que este sistema de clasificación tiene limitaciones.
TAMAÑO DEL TUMOR Y FUNCIONALIDAD
Tradicionalmente, el tamaño ha sido uno de los factores más importantes en la predicción de comportamiento maligno en tumores endocrinos, y de hecho es Benigno un parámetro determinante en la clasificación de Capella. Schindel, et al., en una serie de 100 neoplasias endocrinas del páncreas, encontraron una diferencia significativa en la sobrevida actuarial a cinco años comparando pacientes con tumores menores y mayores de 2 cm (100% vs. 68%, respectivamente).14 La serie del Memorial Sloan–Kettering también muestra una mejor sobrevida para los tumores menores a 2 cm, pero este parámetro dejó de ser significativo con análisis multivariado.12 En la experiencia del Massachusetts General Hospital, el tamaño promedio del tumor fue 3.7 cm con una mediana de 2.5 cm y un rango de 0.4 a 17 cm, y no encontramos ninguna correlación entre el tamaño y la posibilidad de recurrencia o sobrevida.13
El estado funcional del tumor tiene una influencia positiva en su comportamiento a largo plazo, aunque en gran parte esto se debe a la preponderancia de insulinomas en las diferentes series. En un reporte de la Cleveland Clinic, la sobrevida a 10 años en pacientes con insulinoma fue de 92%, comparada con 68% y 55% en gastrinomas y tumores no–funcionantes, respectivamente.15 En nuestra experiencia, 37 de los 101 tumores eran insulinomas, y la frecuencia de recurrencia o muerte por tumor fue 13%, comparada con 41% en tumores no funcionantes.13 Otras series concuerdan con esta observación,6,14 pero otras más no han encontrado diferencia significativa entre tumores funcionantes y no funcionantes.12,16
CARACTERÍSTICAS HISTOLÓGICAS Y PROLIFERACIÓN CELULAR
La presencia de invasión vascular y perineural es considerada por muchos patólogos como un indicador de malignidad, y en efecto su presencia correlaciona con un curso clínico adverso.13,17 Sin embargo, se encuentran en un porcentaje bajo de los tumores, y su ausencia no garantiza un comportamiento benigno. Lo mismo sucede con la necrosis, cuya presencia es un indicador de curso agresivo. En nuestra serie, sólo dos de 10 pacientes, cuyos tumores tenían focos microscópicos de necrosis, se encontraban vivos y libres de recurrencia,13 indicando una alta especificidad para este indicador, pero, nuevamente, con poca sensibilidad.
La detección del antígeno Ki–67 (mediante el anticuerpo monoclonal MIB–1) indica proliferación nuclear. Varios estudios han mostrado que si el índice de proliferación es mayor a 5%, los tumores se asocian a un comportamiento agresivo,17,18 aunque existen problemas técnicos para la ejecución e interpretación del ensayo.
Citoqueratina 19
La citoqueratina 19 (CK–19) es un miembro de la familia de filamentos intermedios que durante el desarrollo fetal se expresa en todas las células epiteliales, incluyendo los islotes pancreáticos. Al avanzar el desarrollo, en las células endocrinas la expresión disminuye gradualmente hasta desaparecer por completo, pero en las células ductales permanece en forma intensa, y de hecho su presencia se utiliza como un marcador ductal.19
En un trabajo reciente sobre neoplasias endocrinas ducto–insulares del páncreas, por serendipia notamos que los únicos dos pacientes (de 15 reportados) que murieron a consecuencia del tumor tenían positividad para CK–19 en el componente endocrino.20 Esto nos llevó a evaluar 101 tumores endocrinos del páncreas resecados con intento curativo, y a comparar la utilidad de este marcador con otros factores pronósticos, incluyendo la clasificación de Capella.13 Por análisis univariado encontramos que la presencia de mitosis, invasión vascular, necrosis, invasión perineural, Ki–67 y CK–19 son variables estadísticamente significativas (la clasificación de Capella no tuvo valor significativo). Después de análisis multivariado, solamente la tinción positiva para CK–19 permaneció como variable independiente con una significancia muy alta (p = 0.0008).
En los 54 casos en los que se pudo evaluar CK–19 por imunohistoquímica, encontramos positividad en 28. Esta fue focal en 13 casos y difusa (más de 90% de las células) en 15. Trece de los 23 casos con CK–19 (+) (56%) que tenían seguimiento adecuado tuvieron recurrencia o murieron a consecuencia del tumor, mientras que ninguno de los 25 pacientes con negatividad para esta citoqueratina tuvieron un curso adverso (todos estaban vivos y sin evidencia de tumor con un promedio de seguimiento de 44 meses). La sobrevida actuarial a cinco años fue de 47% para el grupo de CK–19 (+), y de 100% para el grupo de CK–19 (–) (Figura 2). No hubo diferencia cuando se comparó positividad focal contra difusa.13
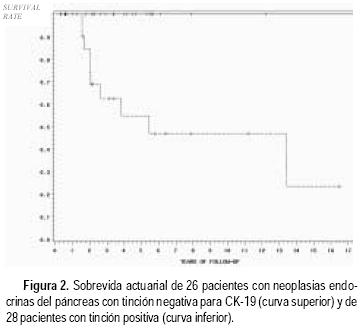
La necrosis y la invasión vascular tuvieron casi la misma especificidad que CK–19 para identificar comportamiento maligno, sin embargo, la CK–19 fue mucho más sensible, indicando de esta manera un potencial importante como marcador pronóstico por su valor predictivo negativo. Las limitaciones de la clasificación de Capella se hicieron evidentes por el desarrollo de recurrencia y eventual muerte de tres pacientes con tumores "benignos", uno de los cuales tenía un insulinoma, y los otros dos tumores no–funcionantes que medían entre 1 y 2 cm, y los cuales fueron positivos para CK–19.
Estos resultados nos llevaron a proponer que todos los tumores neuroendocrinos del páncreas que tengan necrosis, invasión vascular, invasión perineural, o positividad para CK–19 sean considerados como malignos, mientras que aquellos tumores sin ninguno de estos parámetros muy probablemente van a tener un curso benigno. Esta propuesta se encuentra en espera de validación.
COROLARIO
Es interesante hacer notar que "a posteriori" se realizó imunohistoquímica para CK–19 en el tumor de este paciente, y que ésta salió positiva. De acuerdo con la clasificación de Capella, este tumor se hubiera catalogado como benigno, ya que tenía un tamaño menor a 2 cm. Si bien tenía presencia de necrosis focal y era un tumor no funcionante (ambos factores pronósticos adversos), tenía otras características que no sugerían un comportamiento maligno (ausencia de invasión, índice mitótico bajo) y la recurrencia en forma de metástasis hepáticas dos años después de la resección fue un evento inesperado.
CONCLUSIÓN
Los tumores endocrinos del páncreas son neoplasias poco frecuentes. La predicción de malignidad tradicionalmente ha sido un reto para el patólogo y el clínico, y los diferentes parámetros y clasificaciones propuestas para este fin tienen limitaciones. La presencia de necrosis, invasión vascular, o invasión perineural tienen un valor predictivo positivo para el diagnóstico de malignidad muy alto, pero no un buen valor predictivo negativo. La presencia de citoqueratina 19 mediante immunohistoquímica es un parámetro recientemente descrito que mostró un valor predictivo negativo muy elevado (100%), y por tanto, una vez validado por otros, podría contribuir a refinar el diagnóstico entre tumores endocrinos del páncreas, benignos y malignos.
PREGUNTAS Y RESPUESTAS
1. Dr. Eucario León Rodríguez (Departamento de Hematología y Oncología, INNSZ). ¿Se hizo análisis multivariado en el estudio? ¿Se dividieron los grupos en el índice de Capella? Dr. Carlos Fernández del Castillo (Massachussets General Hospital): Es interesante que por análisis univariado la clasificación de Capella no mostró tener significancia estadística. Sí, hicimos análisis multivariado y la única variable que resultó significativa en forma independiente fue la presencia o ausencia de citoqueratina 19.
2. Dr. Gerardo Gamba (Unidad de Fisiología Molecular, INNSZ e Instituto de Investigaciones Biomédicas, UNAM). ¿Qué pensarías de que los tumores neuroendocrinos del páncreas puedan variar la hormona que secretan?
Dr. Fernández del Castillo: Este es un fenómeno que está bien descrito y, en casos avanzados, no es infrecuente encontrar variación en la producción hormonal o de marcadores al irse desdiferenciando el tumor.
3. Dr. Guillermo Robles Díaz (Médico Adscrito al Departamento de Gastroenterología, INNSZ). ¿Qué pasa con la citoqueratina y los tumores de origen neuroendocrino en duodeno?
Dr. Fernández del Castillo: No tenemos experiencia con los tumores neuroendocrinos duodenales y la citoqueratina, aunque es muy probable que un alto porcentaje sea positivo, ya que la mucosa duodenal expresa este marcador.
4. Dr. José de Jesús Villalobos Pérez (Miembro Honorario del Departamento de Gastroenterología, INNSZ). ¿Qué conducta quirúrgica se debe seguir en un paciente que tiene un tumor pancreático citoqueratina positivo?
Dr. Fernández del Castillo: Por el momento no es posible hacer recomendaciones con base en este estudio. En general, se recomienda resección quirúrgica en todos los tumores neuroendocrinos del páncreas siempre y cuando se encuentren localizados. Es posible que en un futuro, si otros estudios confirman el alto valor predictivo negativo de la citoqueratina 19, pudiera ofrecerse a los pacientes una alternativa de ablación (por ejemplo con alcohol o radiofrecuencia) en tumores con CK–19 negativa (y que, por lo tanto, tienen menos agresividad.
5. Dr. Sergio Ponce de León Rosales (Subdirector de Servicios Paramédicos, INNSZ). ¿Sería conveniente relacionar la citoqueratina en los sujetos que ya tenían metástasis previamente?
Dr. Fernández del Castillo: Yo creo que es una excelente idea, y si se encuentra una alta positividad, daría más peso a las observaciones de este estudio.
6. Dr. Luis Uscanga Domínguez (Director de Enseñanza, INNSZ). ¿Están tomando alguna decisión para el manejo de los enfermos con esta información?
Dr. Fernández del Castillo: Por el momento, no estamos utilizando esta información para proponer tratamiento adyuvante, pero ciertamente es posible que si se confirman estas observaciones por otros grupos, se justifique poner a estos pacientes en un monitoreo más estrecho y quizá dar quimioterapia o radioterapia en forma profiláctica después de la resección.
7. Dr. Alfredo López Ponce (Residente de ler. año de Endocrinología, INNSZ). ¿De qué se puede echar mano para predecir clínicamente el pronóstico en los pacientes que no tienen síntomas? Dr. Fernández del Castillo: Fuera de la cirugía que permite examinar el tumor para obtener los parámetros pronósticos, hoy por hoy no tenemos otras formas de predecir el pronóstico.
8. Dr. Eucario León Rodríguez. ¿Cuál es la diferencia en el tiempo de seguimiento de los dos grupos de citoqueratina 19 positivos?
Dr. Fernández del Castillo: Hay una pequeña diferencia a favor del grupo con citoqueratina 19 positiva, pero no es significativa.
9. Dr. Eucario León Rodríguez. ¿Tienen alguna experiencia en el uso de microarreglos para predecir la tendencia de estos tumores?
Dr. Fernández del Castillo: No tenemos experiencia por el momento, pero ciertamente es un campo fértil para investigación.
REFERENCIAS
1. Howard JM, Hess W. History of the pancreas: mysteries of a hidden organ. New York: Kluger Academic/Plenum Publishers; 2002. [ Links ]
2. Whipple AO. Hyperinsulinism in relation to pancreatic tumors. Surgery 1944; 16: 289–305. [ Links ]
3. Frantz VK. Tumors of islet cells with hyperinsulinism. Benign, malignant and questionable. Ann Surg 1940; 112: 161–76. [ Links ]
4. Deveny CW. Islet cell tumors: an overview. In: Beger H, Warshaw AL, Buchler M, Carr–Locke DL, Neoptolemos JP, Rusell CG, et al. (eds.). The Pancreas. Blackwell Science; 1998, p. 1183–6. [ Links ]
5. Jensen RT. Carcinoid and pancreatic endocrine tumors: recent advances in molecular pathogenesis, localization, and treatment. Current Opinion in Oncology 2000; 12: 368–77. [ Links ]
6. Phan GQ, Yeo CJ, Hruban RH, Lillemoe KD, Pitt H, Cameron JL. Surgical experience with pancreatic and peripancreatic neuroendocrine tumors: review of 125 patients. J Gastrointest Surg 1998; 2: 473–82. [ Links ]
7. Pelley RJ, Bukowski RM. Recent advances in systemic therapy for gastrointestinal neuroendocrine tumors. Current Opinion in Oncology 1999; 11: 32–7. [ Links ]
8. Chu QD, Hill HC, Douglass HO, Driscoll D, Smith JL, Nava HR, et al. Predictive factors associated with long–term survival in patients with neuroendocrine tumors of the pancreas. Ann Surg Oncol 2002; 9: 855–62. [ Links ]
9. Solorzano CC, Lee JE, Pisters PW, Vauthery JN, Ayers GD, Jean ME, et al. Nonfunctioning islet cell carcinoma of the pancreas: survival results in a contemporary series of 163 patients. Surgery 2001; 130: 1078–85. [ Links ]
10. Capella C, Heitz PU, Hofler H, Solcia E, Kloppel G. Revised classification of neuroendocrine tumours of the lung, pancreas and gut. Virchows Archiv 1995; 425: 547–60. [ Links ]
11. Heymann MF, Joubert M, Nemeth J, Franc B, Visset J, Hamy A, et al. Prognostic and immunhistochemical validation of the Capella classification of pancreatic neuroendocrine tumors: an analysis of 82 sporadic cases. Histopathology 2000; 36: 421–32. [ Links ]
12. Hochwald SN, Zee SY, Conlon KC, Colleoni R, Louie O, Brennan M, et al. Prognostic factors in pancreatic endocrine neoplasms: an analysis of 136 cases with a proposal for low–grade and intermediate–grade groups. J Clin Oncol 2002; 20: 2633–42. [ Links ]
13. Deshpande V, Fernández–del Castillo C, Muzikansky A, Deshpande A, Zuckerberg L, Warshaw AL, et al. Cytokeratin 19 is a powerful predictor of survival in pancreatic endocrine tumors. Am J Surg Pathol 2004; 28: 1145–53. [ Links ]
14. Schindl M, Kaczirek K, Kaserer K, Niederle B. Is the new classification of neuroendocrine pancreatic tumors of clinical help? World J Surg 2000; 24: 1312–18. [ Links ]
15. Broughan TA, Leslie JD, Soto JM. Pancreatic islet cell tumors. Surgery 1986; 99: 671–8. [ Links ]
16. White TJ, Edney JA, Thompson JS, Karrer FW, Moor BJ. Is there a prongostic difference between functional and nonfunctional islet cell tumors? Am J Surg 1994; 168: 627–30. [ Links ]
17. Wick MR, Graeme–Cook F. Pancreatic Neuroendocrine Neoplasms: a current summary of diagnostic, prognostic, and differenctial diagnostic information. Am J Clin Pathol 2001; 115: S28–S45. [ Links ]
18. Gentil Perret A, Mosnier JF, Buono JP. The relationship between MIB–1 proliferation index and outcome in pancreatic neuroendocrine tumors. Am J Clin Pathol 1998; 109: 286–93. [ Links ]
19. Bouwens L, Lu WG, De Krijer R. Proliferation and differentiation in the human fetal endocrine pancreas. Diabetologia 1997; 40: 398–404. [ Links ]
20. Deshpande V, Selig MK, Gunnlaugur PN, Fernández–del Castillo C, Lauwers GY. Ductulo–insular pancreatic endocrine neooplasms: clinicopathologic analysis of a unique subtype of pancreatic endocrine neoplasms. Am J Surg Pathol 2003; 27: 461–8. [ Links ]














