Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de investigación clínica
versión On-line ISSN 2564-8896versión impresa ISSN 0034-8376
Rev. invest. clín. vol.57 no.3 Ciudad de México may./jun. 2005
Artículo de revisión
Mecanismos moleculares de acción de los ácidos grasos poliinsaturados y sus beneficios en la salud
Molecular mechanisms of action and health benefits of polyunsaturated fatty acids
Maricela Rodríguez–Cruz,* Armando R. Tovar,** Martha del Prado,* Nimbe Torres**
* Unidad de Investigación Médica en Nutrición, Centro Médico Nacional Siglo XXI, IMSS.
** Departamento de Fisiología de la Nutrición, Dirección de Nutrición, Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán.
ABSTRACT
Essential polyunsaturated fatty acids (PUFAs), linoleic acid n6 (LA) and linolenic acid (ALA) n3 obtained from the diet are precursors of the long–chain polyunsaturated fatty acids (Lc–PUFAs) arachidonic acid (AA) and docosahexaenoic acid (DHA) respectively. Consumption of PUFAs is related with a better neurological and cognitive development in newborns. It has been demonstrated that consumption of n–6 and n–3 PUFAs decreases blood triglycerides by increasing fatty acid oxidation through activation of PPARα or by reducing the activation of SREBP–1 inhibiting lipogenesis. Dietary PUFAs activate PPARα and PPARγ increasing lipid oxidation, and decreasing insulin resistance leading in a reduction of hepatic steatosis. Beneficial effects of PUFAs have been observed in humans and in animals models of diabetes, obesity, cancer, and cardiovascular diseases. It is important to promote the consumption of PUFAs. Main food sources of PUFAs n–6 are corn, soy and safflower oil, and for PUFAs n–3 are fish, soy, canola oil and, flaxseed. Finally FAO/WHO recommends an optimal daily intake of n6/n3 of 5–10:1.
Key words. Polyunsaturated fatty acids. Linoleic acid, a Linoleic acid. Desaturases.
RESUMEN
Los ácidos grasos poliinsaturados indispensables (AGPIs), ácido linoleico n–6 y ácido linolénico n–3 se obtienen a través de la dieta y son precursores de los ácidos grasos poliinsaturados de cadena larga (AGPIs–CL) araquidónico (AA) y docosahexaenoico (ADH), respectivamente. El consumo de AGPIs está relacionado con un mejor desarrollo cerebral fetal y cognoscitivo del recién nacido. Los AGPIs pueden reducir la concentración de triacilgliceroles en la sangre a través de la oxidación de ácidos grasos por medio de la activación de PPARα o a través de la represión de SREBP–1 que inhibe la lipogénesis. El consumo de AGPIs puede ser benéfico en el control de ciertas enfermedades como la diabetes mellitus y la obesidad en la que los AGPIs activan a PPARα estimulando la oxidación de lípidos y disminuyendo la resistencia a la insulina y la esteatosis hepática. En el caso del cáncer los AGPIs pueden servir como agentes citotóxicos para ciertas células tumorales. Debido a su efecto hipolipémico y a su efecto antiinflamatorio, los AGPIs podrían tener efectos benéficos en la prevención de enfermedades cardiovasculares. Las principales fuentes alimenticias de AGPIs n–6 son los aceites de maíz, de cártamo y de soya, y las de AGPIs n–3 son la linaza y los aceites de pescados, canola y de soya. Finalmente, la FAO/ OMS recomienda un consumo óptimo de AGPIs diario en una proporción n–6: n–3 de 5–10: 1/día.
Palabras clave. Ácidos grasos poliinsaturados. Ácido linoleico. Ácido α–linolénico. Desaturasas.
INTRODUCCIÓN
El cuerpo humano requiere de aproximadamente 50 nutrimentos que son indispensables para su funcionamiento y desarrollo, dentro de los cuales se encuentran las vitaminas, los minerales, los aminoácidos (proteínas), los hidratos de carbono y los lípidos.
Los lípidos forman parte de los tejidos de plantas y animales y son clasificados como a) esteróles, b) fosfolípidos, c) esfingomielinas, d) ceras y e) grasas. Los principales componentes de todas las grasas son los ácidos grasos, que pueden ser saturados, monoinsaturados (AGMI) o poliinsaturados (AGPIs). Las grasas que contienen una gran proporción de ácidos grasos saturados son sólidas a temperatura ambiente y se conocen como grasas saturadas. Estas grasas son generalmente de origen animal como la manteca, el sebo y la mantequilla. Por el contrario, la mayoría de las grasas vegetales son ricas en ácidos grasos poliinsaturados o monoinsaturados, excepto las grasas de palma y coco que son muy saturadas y generalmente son líquidas a temperatura ambiente.1
El descubrimiento de que algunos ácidos grasos puedan actuar como ligandos de factores de transcripción indican que estos ácidos grasos no son meramente moléculas pasivas que aportan energía, sino que también son reguladores metabólicos. El objetivo de esta revisión es describir de manera crítica algunos aspectos relevantes más actuales de los AGPIs, desde su función estructural en las membranas celulares, hasta su función como reguladores de la expresión génica de enzimas involucradas en el metabolismo de los lípidos. Finalmente se abordará su importancia en la salud, en la enfermedad, así como sus recomendaciones dietarias y las principales fuentes alimenticias.
ÁCIDOS GRASOS
Los ácidos grasos son ácidos monocarboxílicos de cadena larga, que generalmente contienen un número par de átomos de carbono, normalmente entre 8 y 22 (Figura 1). Esto se debe a que su síntesis biológica tiene lugar mediante la adición sucesiva de unidades de acetil CoA. Sin embargo, también existen ácidos grasos con un número impar de átomos de carbono, que probablemente derivan de la metilación de un ácido graso de cadena par. Los ácidos grasos presentes en el organismo se encuentran en su forma saturada, principalmente como ácido palmítico, o en la forma insaturada debido a la presencia de dobles ligaduras. Los ácidos grasos insaturados pueden ser monoinsaturados y poliinsaturados.

Ácidos grasos indispensables
Existen dos AGPIs que el organismo no puede sintetizar, el ácido linoleico (AL) y el ácido alfa linolénico (ALN), que deben obtenerse de la dieta y se les conoce como ácidos grasos indispensables (AGIs). Estos ácidos grasos pertenecen a la familia n–6 o n–3, también conocidos como ω–6 u ω–3, respectivamente. Estas dos familias se diferencian por la posición del primer doble enlace, contando a partir del extremo metilo de la molécula del ácido graso.2 La indispensabilidad es debido a que los mamíferos carecen de las enzimas necesarias para insertar dobles enlaces en los átomos de carbono que están más allá del carbono 9 a partir del carboxilo terminal.
El AL es una molécula de 18 átomos de carbonos con dos dobles ligaduras, la primera se localiza en el sexto carbono a partir del metilo terminal, su nomenclatura es 18:2 n6 y pertenece a la familia n–6. El ALN también es una molécula de 18 átomos de carbonos con tres dobles ligaduras, la primera se encuentra en el tercer carbono a partir del metilo terminal, su nomenclatura es 18:3 n3 y pertenece a la familia n–3.
Dentro del organismo, los AGIs se pueden convertir en otros AGPIs de cadena más larga (AGPIs–CL) con más instauraciones, como el ácido araquidónico (AA), el ácido eicosapentaenoico (AEP) y el ácido docosahexaenoico (ADH).2
METABOLISMO DE LOS ÁCIDOS GRASOS POLIINSATURADOS
Digestión, absorción y transporte
Los ácidos grasos que provienen de la dieta entran a los enterocitos por medio de una proteína que transporta ácidos grasos localizada en la pared intestinal. Los ácidos grasos con más de 14 carbonos, como es el caso del AL y ALN, se esterifican para formar triacilgliceroles dentro del enterocito y pasan a la circulación sanguínea a través de la vía linfática en forma de quilomicrones (Figura 2).
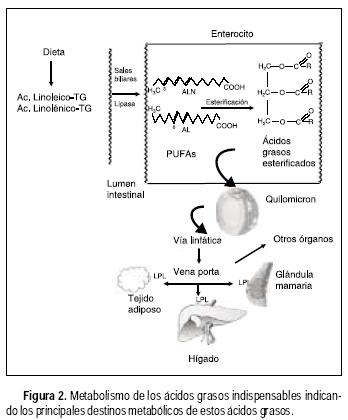
La enzima lipoproteína lipasa (LPL), que se encuentra en la pared interna de los capilares sanguíneos hidroliza los triacilgliceroles presentes en las lipoproteínas de los quilomicrones liberando ácidos grasos incluyendo AGPIs.
Los AGPIs libres se incorporan en los triacilgliceroles del tejido adiposo e inhiben la expresión génica de enzimas involucradas en la lipogénesis; en el músculo incrementan la oxidación de ácidos grasos y reducen la acumulación de triacilgliceroles;3 en la glándula mamaria lactante se utilizan para la síntesis de los lípidos de la leche,4 en el hígado son incorporados a triacilgliceroles y suprimen la síntesis de lípidos y estimulan la oxidación de ácidos grasos.5
Biosíntesis de AA y ADH
Dentro del hígado el AL y el ALN son elongados y desaturados para formar AGPIs–CL. La biosíntesis de AGPIs–CL se lleva a cabo en los microsomas del retículo endoplásmico de los hepatocitos. El AA, el principal producto de la familia n–6, se sintetiza a partir del AL a través de una secuencia alterna de desaturaciones y elongaciones dependientes de malonil coenzima A (CoA). La misma vía metabólica usa el ALN para producir ADH y AEP, que son los principales productos de la familia n3.2 Las enzimas que realizan las desaturaciones son la Δ6D y la Δ5D desaturasas. La primera desaturación es efectuada por la Δ6D y es el paso limitante en la síntesis de AGPIs–CL.6 El AL y el ALN compiten por las mismas enzimas A5D y A6D desaturasas7 y se considera que esta última también es importante en la síntesis de ADH n–38 (Figura 3). Esta competencia explica por qué el consumo elevado de ácido linoleico reduce el nivel de ADH n–3.
El metabolismo enzimático de los ácidos grasos; ADH, AA, γ–linolénico (GLN n–6), dihomo–γ–linolénico (DHGLN n–6) y AEP produce una amplia variedad de productos oxidados a los que, en conjunto, se les denomina eicosanoides (Figura 3). Dentro del grupo de los eicosanoides se encuentran los leucotrienos, tromboxanos y prostaglandinas. Estos compuestos no se discutirán en esta revisión; sin embargo, es importante mencionar que son secretados por la célula hacia el fluido intersticial y su acción es paracrina sobre las células cercanas. Las prostaglandinas promueven la contracción del músculo liso incluyendo el del intestino y el del útero. También regulan el dolor y la inflamación en todos los tejidos. Los tromboxanos regulan la función plaquetaria y por lo tanto la coagulación. Debido a las funciones de los eicoesanoides, es probable que muchos de los signos de la deficiencia de los AGIs se deban a alteraciones del metabolismo de los eicosanoides.9 El AA es el precursor de los prostanoides (prostaglandinas y tromboxanos) de la serie 2 y de los leucotrienos de la serie 4, mientras que el AEP es el precursor de los prostanoides de la serie 3 y leucotrienos de la serie 5.10
Regulación del metabolismo de los AGPIs
a) Efecto de los AGPIs sobre la síntesis y la oxidación de los ácidos grasos. En 1952, Kinsell, et al. y Groen, et al. fueron los primeros en reportar que la sustitución de grasa animal por aceite vegetal en la dieta de humanos producía una disminución en la concentración de colesterol en suero. En 1957 la acción hipocolesterolémica e hipotrigliceridémica del ácido linoleico en humanos se confirmó por varios grupos de investigación,11 observándose que el consumo de este ácido graso disminuía la concentración de triacilgliceroles y colesterol en un 50% en sujetos hiperlipémicos.12
Con base en esto, Ahrens postuló que el ácido linoleico de la dieta cambia la distribución del colesterol entre el plasma y los tejidos. Paralelamente, Nestel y Steinberg observaron que el ácido linoleico se utiliza principalmente en rutas oxidativas. Posteriormente se demostró que la mitocondria hepática de la rata oxida al ácido linoleico 10 veces más rápido que un ácido graso saturado, como el ácido palmítico.13
Estos hallazgos indicaban que probablemente el efecto hipocolesterolémico del ácido linoleico podría deberse a cambios en el metabolismo de los ácidos grasos, más que a cambios en el metabolismo del colesterol. La adición del 2% de ácido linoleico a una dieta alta en hidratos de carbono libre de grasa suprime en un 70% la biosíntesis hepática de ácidos grasos y las actividades de la sintasa de los ácidos grasos (FAS) y de la glucosa 6 fosfato deshidrogenasa,14 enzimas involucradas en la lipogénesis. Actualmente se sabe que los AGPIs dietarios inducen la expresión génica de enzimas responsables de la oxidación de ácidos grasos y reprimen la expresión de enzimas lipogénicas5,15–17 a través de diferentes mecanismos:
a) AGPIs y proteína de unión a elementos regulatorios de esteróles (SREBP–1). Las SREBPs (por sus siglas en inglés: sterol regulatory element binding protein) son una familia de factores de transcripción formada por tres miembros SREBP–1a, 1c y 2.
SREBP–2 regula genes involucrados en el metabolismo de colesterol, mientras que SREBP–1a y le regulan genes involucrados en la lipogénesis. La SREBP–1 se sintetiza como una proteína precursora de 125 kDa unida al retículo endoplásmico. La proteína activa de 68 kDa se libera por un rompimiento proteolítico en el aparato de Golgi por la acción de la SCAP (SCAP, por sus siglas en inglés: SREBP cleavage activating protein; proteína que activa el rompimiento de SREBP). El SREBP–1 activo se traslada hacia el núcleo donde se une a elementos de respuesta a esteróles (SRE, por sus siglas en inglés sterol regulatory elements) de genes que participan en el metabolismo de los lípidos.18 Recientemente se han propuesto diferentes mecanismos por los cuales los AGPIs regulan la lipogénesis a través de SREBP–1. El primero sugiere que los AGPIs reducen la forma nuclear activa de SREBP–1 en ratas.16 Segundo, los AGPIs disminuyen la estabilidad del mensajero de SREBP–1,17 y tercero suprimen la expresión del RNAm de SREBP–1.15 Por lo que dietas con alto contenido en AGPIs favorecerán la disminución de SREBP–1 y como consecuencia disminuirán la lipogénesis (Figura 4).
b) AGPIs y receptores activados por proliferadores de peroxisomas (PPAR). Los PPARs (por sus siglas en inglés: proliferator peroxisome activator receptor) son receptores nucleares que pertenecen a la familia de factores de transcripción involucrados en la regulación de la homeostasis de los lípidos. Los PPARs presentan 3 isoformas (α, δ y γ) y se activan por concentraciones micromolares de AGPIs, por eicosanoides derivados del ácido araquidónico y también por medicamentos hipolipemiantes, como los fibratos y proliferadores de peroxisomas.19,20 Los AGPIs se unen con mayor afinidad a PPARα. El PPARα activado se une a elementos de respuesta para PPAR llamados PPER (elemento de respuesta para PPAR) que se encuentran en genes involucrados en el transporte y oxidación de lípidos, y en la termogénesis.5 Los AGPIs n–3 son más potentes que los AGPIs n–6 como activadores de PPAR in vivo. Los metabolitos de los AGPIs como los eicosanoides o ácidos grasos oxidados son los más potentes activadores de PPAR debido probablemente a su elevada insaturación.5 La activación de los PPARs por los AGPIs, particularmente por la familia n3, puede ofrecer una explicación de los beneficios reportados de este tipo de ácidos grasos en la disminución de triacilgliceroles debido a un aumento en la oxidación de los ácidos grasos.
c) AGPIs y Δ5 y Δ6 desaturasas (Δ5D, Δ6D). Como ya se mencionó anteriormente el AL y ALN provenientes de la dieta son convertidos a AGPIs–CL. La velocidad de conversión está determinada por la actividad de la Δ6D y Δ5D desaturasas. Estas dos desaturasas tienen la característica de que su expresión y actividad enzimática se reprime por AGPIs21,22 y se induce con insulina a través de SREBP–I23,es inducido por PPARs,24 una dieta libre de grasa o con una dieta que contenga AGMIs, como el ácido oleico (18:1, de la familia n9) como única fuente de grasa21,22,25 (Figura 4). La expresión génica de la Δ6D y la Δ5D se induce en ratones transgénicos que sobreexpresan a la SRE–BP–1.24 Esto se debe a que la región promotora del gen Δ6D contiene un elemento regulatorio de esteróles de unión a SREBP–126 (Figura 4).
AGPIs EN LA SALUD
AGPIs en la nutrición materna
La nutrición materna es de crucial importancia no sólo durante la lactancia sino también durante el embarazo y aún antes de la concepción. El crecimiento y el desarrollo del feto dependen del aporte materno de los AGIs.27 Se ha reportado una asociación entre una menor ingestión de vitaminas y AGPIs y una mayor incidencia de bajo peso al nacer.28 Otros estudios han reportado una correlación entre la nutrición materna durante el tercer trimestre y los lípidos séricos de los recién nacidos.29 Estos resultados resaltan la necesidad de un adecuado estado nutricio de ácidos grasos desde las etapas tempranas del embarazo y durante la lactancia, con la finalidad de lograr una buena transferencia de ácidos grasos al feto, por la placenta, y al recién nacido a través de la leche humana.
Dado que la composición de los ácidos grasos de la leche se modifica con la dieta materna, se han observado incrementos de ADH en la leche de madres suplementadas con este ácido graso.30,31 Además, se ha observado que la ingesta materna de AL se refleja en la leche pocas horas después de su consumo.4
Asimismo, el consumo materno de ADH durante el embarazo parece ser importante para el desarrollo mental de los niños. Se ha mostrado que los hijos de madres suplementadas con aceite de pescado (rico en ADH) durante el embarazo y la lactancia tienen mejores resultados en diferentes pruebas cognoscitivas a los 4 años de edad que el grupo suplementado con aceite de maíz, que es rico en ácido linoleico.32
Durante el desarrollo fetal y placentario se requiere de AGPIs–CL. El AL atraviesa la placenta, porque es mayor su concentración en la madre que en el feto; por el contrario, el ácido araquidónico (AA) se encuentra en mayor proporción en el feto. Se ha propuesto que la placenta transporta de forma selectiva AA y ADH desde el compartimiento materno hacia el feto, lo que da por resultado enriquecimiento de los AGPIs–CL en los lípidos circulantes del feto. Esto ocurre durante el tercer trimestre, cuando las demandas fetales para el crecimiento neural y vascular son mayores.33 Algunos autores sugieren que el retardo de crecimiento intrauterino está relacionado con niveles más bajos de AA, mientras que el grado de prematurez se asocia con una deficiencia de ADH DH 29,34,35
AGPIs en los recién nacidos
La ingesta de los lípidos en la gestación y durante el primer año de vida del humano es fundamental, no sólo para cubrir las necesidades de energía, sino también como vehículo de las vitaminas liposolubles para favorecer la absorción de éstas y como fuente importante de AGIs.33 Los AGPIs n3 y n6 son básicos para el desarrollo cerebral fetal y cognoscitivo del recién nacido,36 ya que los fosfolípidos que integran las membranas celulares del sistema nervioso contienen grandes cantidades de este tipo de ácidos grasos.37 El ADH y el AA son los principales componentes del cerebro, ya que se encuentran en más del 30% de los ácidos grasos que forman los fosfolípidos de las membranas.38 Los bastones de la retina tienen más del 50% de los ácidos grasos de la familia n3, principalmente ADH. Las membranas de estas células contienen pigmentos fotosensibles que absorben la luz e inician la excitación visual, esto genera señales eléctricas que son transmitidas a la corteza occipital en milisegundos. Estos cambios rápidos requieren la presencia de ADH, ya que se han observado cambios en la función de la retina en ratas alimentadas con una dieta deficiente en ácidos grasos n3, presentando una disminución en las señales eléctricas generadas por la luz.37
Los AGPIs–CL n3 y n6 que requieren los humanos durante la gestación y después del nacimiento provienen principalmente de la transferencia placentaria (provienen de la síntesis hepática de la madre) o de la dieta (leche humana) respectivamente.39 La síntesis de AGPIs–CL se lleva a cabo, también en el hígado fetal y de recién nacidos, aunque las actividades enzimáticas de la A6D y A5D desaturasas son bajas comparadas con el hígado de adulto. Recientemente nosotros hemos demostrado la presencia y la inducción de la A5 y A6 desaturasas en glándula mamaria de ratas40 lo que indica que este tejido tiene la capacidad de sintetizar AGPIs–CL que deben estar presentes en la leche materna. Los recién nacidos tienen una limitada capacidad para elongar y desaturar AL y ALN, para producir AA y ADH, respectivamente.4142 Así, la síntesis fetal o del recién nacido es insuficiente para proporcionar las cantidades requeridas de AGPIs–CL para las diversas funciones, por lo que los recién nacidos dependen de la presencia de estos ácidos grasos en su dieta. La leche materna es la fuente principal de estos ácidos grasos para el recién nacido ya que ésta aporta AL, ALN, AA y el ADH.43
La acumulación de AGPIs en el feto tiene lugar principalmente durante el último trimestre de embarazo.44 Esto hace que el recién nacido pretérmino tenga una vulnerabilidad especial para tener deficiencia de este tipo de ácidos grasos, dada la falta de reservas de tejido adiposo al nacer y de la inmadurez metabólica para elongar y desaturar el AL y el ALN. Así que el neonato prematuro necesita una fuente de AGPIs–CL, los que podrían ser proporcionados por la leche de su propia madre o por fórmulas suplementadas. Debido a esto, los niños pretérmino han sido el modelo inicial para investigar el efecto de la deficiencia de los ácidos grasos en humanos. Los resultados de estas investigaciones muestran que los neonatos prematuros alimentados con una fórmula láctea suplementada con ácidos grasos de cadena larga n3 y n6 tienen una mejor función visual y cognoscitiva que los alimentados con la misma fórmula láctea sin suplemento.45
Por otro lado, los estudios con niños nacidos a término indican que los niveles de ADH en la corteza cerebral son más altos cuando son amamantados, en comparación con los alimentados con fórmula láctea. Esta diferencia se debe a que la leche humana contiene ADH.46 Algunos reportes sugieren que los grupos de infantes alimentados al seno materno tienen mejores resultados en pruebas psicométricas que los infantes que son alimentados con fórmula láctea.47
AGPIs EN LA ENFERMEDAD
Existen una variedad de estudios realizados en humanos que muestran los posibles efectos de los AGPIs en diferentes enfermedades (Cuadro 1). La mayoría de las investigaciones se han enfocado al estudio del consumo de los AGPIs en la diabetes, algunos tipos de cánceres y enfermedades cardiovasculares entre otras.
AGPIs en la diabetes mellitus
La diabetes mellitus es una enfermedad multigénica y multifactorial que se caracteriza principalmente por hiperglicemia, presencia de resistencia a la insulina (RI), hipertrigliceridemia y desarrollo de complicaciones vasculares. Se han propuesto que los AGPIs pueden tener un efecto benéfico en el desarrollo o control de la diabetes a través de diferentes mecanismos. Uno de éstos se refiere a la capacidad de los AGPIs para actuar como ligandos activadores de PPARγ. PPARγ activo estimula la diferenciación de los preadipocitos a adipocitos, lo que genera en esta célula un aumento en los receptores para insulina reduciendo de esta manera la resistencia a la insulina. Otro mecanismo de acción de los AGPIs es la protección de las células beta pancreáticas del daño causado por el aumento en radicales libres producidos durante la diabetes.48,49
Sin embargo, aún existe controversia con respecto a los efectos benéficos de los AGPIs en la diabetes en el humano. Un estudio denominado "Nurses Health Study" de los Estados Unidos reportó que el riesgo de desarrollar diabetes está inversamente asociado con el consumo de grasa poliinsaturada.50 Por otro lado, otro estudio realizado en 35,988 mujeres quienes inicialmente no tenían diabetes, mostró que el consumo de AGPIs tiene un efecto protector ya que se observó una disminución del 40% en la incidencia de diabetes tipo 2.51 Además, estudios epidemiológicos realizados en esquimales han mostrado una menor prevalencia de enfermedades cardiovasculares y diabetes mellitus debido a su alto consumo habitual de AGPIs n–3 que es alrededor de 14 g/día.52 También se ha observado en mujeres y hombres de 64 a 87 años que el consumo de pescado disminuye significativamente la intolerancia a la glucosa comparado con los que no lo consumen.53 Asimismo, se ha mostrado una asociación entre los niveles bajos de la hemoglobina glicosilada con una alta proporción de grasa poliinsaturada/saturada en la dieta.54 En contraste, otras investigaciones no muestran efectos benéficos en el consumo de los AGPIs. Woodman y cois. (2001) evaluaron el efecto del ADH y el AEP sobre el control de la glucosa en 59 sujetos con diabetes tipo 2 los cuales consumieron Aglaia de ADH o AEP durante seis semanas. Sus resultados mostraron efectos adversos, ya que se observó un aumento en la concentración de la glucosa en el ayuno.55
Las diferencias encontradas en estos estudios se pueden deber a varios factores como:
1. Control sobre la cantidad de ácidos grasos consumidos, ya que en algunos estudios estos ácidos grasos se les proporcionan a los sujetos y en otros el consumo se evaluó a través de cuestionarios de frecuencia de alimentos.
2. El uso de medicamentos, los cuales podrían interferir con la acción de los AGPIs.
3. El grado de obesidad y de resistencia a la insulina.
4. La duración de la administración del ácido graso.
Es importante considerar el tiempo de consumo de estos AGPIs, ya que se ha reportado un aumento en la concentración de la glucosa en las primeras semanas55 y otros investigadores han observado el mismo efecto; sin embargo, la concentración de glucosa regresa a niveles normales a las 12 semanas, tiempo en que proporcionaron el aceite de pescado rico en ADH y AEP.56
Aunque existen fuertes evidencias tanto en humanos como en animales de que los AGPIs presenten un efecto protector en contra del desarrollo de la diabetes mellitus, es necesario realizar más estudios en donde sea posible controlar los factores antes mencionados para de esta manera confirmar si los AGPIs realmente tienen un efecto protector de esta enfermedad.
AGPIs en la obesidad
Dentro de los principales factores de riesgo para la obesidad se encuentran la historia familiar, un gasto energético basal disminuido y un coeficiente respiratorio alto lo cual indica una tasa baja de oxidación de grasa. Estos factores de riesgo se han reportado en la población americana. Se ha sugerido que la epidemia de obesidad en esta población es probablemente debida en parte a que su dieta es baja en AGPIs.57 Se han propuesto diferentes mecanismos por los cuales los AGPIs puedan retrasar o controlar el desarrollo de la obesidad. Los AGPIs son reguladores negativos de la lipogénesis hepática, la cual es mediada por la represión de SREBP–1. Se ha observado, que el consumo de AGPIs por ratones obesos disminuye la forma madura de la proteína SREBP–1 y por lo tanto se reduce la expresión de genes lipogénicos como la sintasa de los ácidos grasos, y la esteroil CoA desaturasa–1 en el hígado de estos ratones. Como consecuencia, tanto la hiperglicemia e hiperinsulinemia se mejoran con la administración de AGPIs, efecto similar al producido por los activadores de PPARα. Los AGPIs mejoran las alteraciones bioquímicas y metabólicas asociadas con la obesidad, tales como la esteatosis hepática y la resistencia a la insulina en ratones.16 En humanos, los AGPIs de la familia n3 se oxidan más rápido que los ácidos grasos saturados, ya que tienen la característica especial de incrementar la termogénesis y como consecuencia reducen la eficiencia de depositar grasa corporal. Los AGPIs ejercen su efecto en el metabolismo de lípidos aumentando la transcripción de la proteína desacoplante–3, induciendo genes que codifican para proteínas involucradas en la oxidación de ácidos grasos (p. ej. carnitina palmitoil transferasa y la acil–CoA oxidasa), y al mismo tiempo disminuye la transcripción de genes que codifican para proteínas involucradas en la síntesis de lípidos (sintasa de los ácidos grasos.58,59
Por otra parte, la obesidad actualmente se considera como una enfermedad inflamatoria, ya que en niños y adultos con sobrepeso y obesidad presentan altas concentraciones de proteína C reactiva, interleucina 6, factor de necrosis tumoral–6 y leptina, los cuales son marcadores de inflamación. Los AGPIs–CL inhiben la producción de estas citocinas proinflamatorias e incrementan el número de receptores de insulina en varios tejidos.60
Además, estudios realizados en adipocitos de sujetos obesos han demostrado que el ácido eicosapentaenoico aumenta la expresión del RNAm para PPARyy que existe una correlación positiva entre la expresión de PPARγ en tejido adiposo subcutáneo con las concentraciones de AEP, sugiriendo fuertemente el efecto positivo del AEP en la regulación de PPARγ en el tejido adiposo.61 Sin embargo, a la fecha no existen estudios epidemiológicos que muestren que el consumo de estos AGPIs reduzca el desarrollo de la obesidad. Se requieren de mayores estudios metabólicos y epidemiológicos en humanos que prueben los efectos benéficos de los AGPIs observados en modelos animales.
AGPIs en el cáncer
Las causas del cáncer no están definidas claramente, pero se sabe que tanto los factores internos y externos como el tipo de dieta juegan un papel muy importante para iniciar y promover la carcinogénesis. Se estima que alrededor de 35% de todas las muertes por cáncer están relacionadas con la dieta. La cantidad y el tipo de grasa de la dieta consumida pueden ser importantes en el desarrollo del cáncer humano.62
Evidencias epidemiológicas en humanos y en raurinos han sugerido que la ingestión de AGPIs–CL de la familia n3, abundantes en el aceite de pescado, tienen efectos benéficos en el cáncer. No se conocen exactamente los mecanismos bioquímicos por los cuales los AGPIs–CL n3 inhiben el desarrollo celular en algunos tumores. Sin embargo, estudios realizados en roedores y en células tumorales del humano, han propuesto algunas hipótesis que involucran diferentes vías de señalamiento:
1. El ADH induce el arresto del ciclo celular debido a la desfosforilación de la proteína pRB 1, que se encuentra en su forma activa y detiene el ciclo celular. Además, el ADH promueve la apoptosis,63 de líneas celulares humanas de cáncer de páncreas y de leucemia.64
2. Los AGPIs son citotóxicos para ciertas células tumorales in vitro, esta acción citotóxica puede estar relacionada con la peroxidación de sus dobles enlaces, lo que genera un estrés oxidativo persistente debido al incremento en la producción de radicales libres, los cuales dañan el ADN.62 Esto es apoyado por el estudio de Hawkins RA y cois, en el cual se observó que la apoptosis es precedida por un incremento en la peroxidación de lípidos.64
3. Otra de las hipótesis sugiere, que los AGPIs n–3 de la dieta suprimen el crecimiento celular del tumor a través de la inhibición de la ciclooxigenasa, enzima que regula la síntesis de prostaglandinas (PGs). Esta propuesta surgió dado que existe en tumores de mama y en metástasis entre otras neoplasias, comparadas con tejidos normales, una mayor cantidad de PGs que son productos metabólicos del AA. Sin embargo, esta hipótesis está en controversia dado que se demostró en ratones una supresión del crecimiento celular independiente de la ciclooxigenasa de células tumorales de colon implantadas.
En este estudio los ratones fueron alimentados con una dieta suplementada con aceite de pescado (rica en AGPIs n–3, DAH y AEP) o con aceite de cártamo (rica en AGPIs n–6, AL), y la inhibición de la proliferación celular se observó solamente en los animales alimentados con aceite de pescado.62
Un metaanálisis de 97 estudios sobre los efectos de grasas saturadas, monoinsaturadas y poliinsaturadas n–3 y n–6 en la incidencia de tumor mamario que incluyeron 12,800 murinos indican que los AGPIs n–6 favorecen el desarrollo del tumor, mientras que los AGPIs n–3 tienen un efecto protector pequeño el cual no fue estadísticamente significativo.65 Estos hallazgos confirman lo reportado previamente sobre el efecto de los AGPIs n–6 en el desarrollo y crecimiento de tumores transplantados en roedores in vivo.66
No se conoce el mecanismo mediante el cual los AGPIs n–6 favorecen la proliferación celular. Sin embargo, en hepatoma de rata se ha observado un aumento en el ácido 13–hidroxioctadecadienoico (13–HODE) cuyo precursor es el AL, el cual es un agente mitogénico responsable del crecimiento celular.67
En el humano existen pocas investigaciones acerca de los efectos adversos del consumo de los APGIs n–6. Estudios realizados en hombres alimentados con una dieta alta en AGPIs n–6 muestran una mayor incidencia de carcinomas en comparación con el grupo control.66 Sin embargo, estos resultados no se han confirmado en otros estudios, por lo que surge la necesidad de efectuar más investigaciones que aclaren tal efecto. Es importante hacer énfasis que aunque existe poca información en humanos que sugiere que el exceso en el consumo de AL predispone al desarrollo de algún tipo de cáncer, algunos investigadores recomiendan que el consumo de este ácido graso no exceda el 10% de la energía total consumida.66
Por el contrario, estudios realizados en roedores indican que los ácidos grasos de la familia n3 (ALN, ADH y el AEP) inhiben el desarrollo de algún tipo de tumor67 o tienen un efecto protector en las etapas iniciales del desarrollo del cáncer cuando se les administra un agente carcinógeno (azoximetano).68
En humanos, los estudios de casos y controles sugieren que el consumo de aceites de pescado y de vegetales ricos en ácidos grasos de la familia n3 disminuyen el riesgo de desarrollar ciertos tumores, en especial del tracto digestivo (colon, estómago, esófago y recto) y de la próstata.69,62 Se ha observado además que los esquimales que consumen pescados abundantes en AGPIs n–3, y los pescadores japoneses quienes tienen el consumo más alto de pescado per capita en el mundo, tienen concentraciones altas de AGPIs n–3, como el AEP en la sangre lo cual está relacionado con menor incidencia de cáncer de mama y de colon.70
Otros estudios realizados en 24 países europeos entre 1984 y 1987, mostraron en hombres y mujeres una relación inversa entre la mortalidad causada por cáncer de colon, y un alto consumo de grasa de pescado.71,72 La evidencia de estos estudios indica que el aceite de pescado proporciona protección contra la carcinogénesis colorrectal.
Aunque otros estudios de casos y controles no muestran efecto protector en el cáncer colorrectal70 se ha observado un menor riesgo relativo de desarrollar este cáncer cuando el consumo de pescado por hombres y mujeres es alto en comparación con la gente que consume pescado con menor frecuencia.70,73
La gran mayoría de los estudios realizados a la fecha le confieren un efecto protector a los AGPIs n–3 contra el desarrollo de algunos tumores como colorrectal, tumor de mama, del tracto digestivo y de próstata. Además, se ha observado que los AGPIs n–6 tienen un efecto contrario. Sin embargo, debido a algunas limitaciones de algunos estudios como la cantidad y tiempo del consumo de ácidos grasos, es posible que sea la causa de los resultados contradictorios de los efectos protectores de los AGPIs n–3. En vista de estos resultados, es necesario realizar estudios epidemiológicos en poblaciones, proporcionándoles en su dieta los alimentos ricos en AGPIs n–3 en cantidades similares a las que consumen las poblaciones en las que se ha observado un efecto protector.
AGPIs en enfermedades cardiovasculares
El interés en la posible acción antiateroesclerótica de los AGPIs n–3 surgió desde que Bang, et al., en 1976, atribuyeron la baja mortalidad de los esquimales por enfermedad cardiaca isquémica a un elevado consumo de AGPIs n–3 en sus dietas.74 Se ha observado que concentraciones sanguíneas de marcadores de la inflamación, como la proteína C reactiva, citocinas, interleucina 6 y 1, y el factor de necrosis tumoral a son predictivos del riesgo de enfermedad cardiovascular.70,75–77 Además, la proteína C reactiva ejerce un efecto directo pro–inflamatorio sobre el endotelio humano.78 Se ha propuesto que el efecto protector de los AGPIs para evitar el desarrollo de enfermedades cardiovasculares es a través de la inhibición de la respuesta inflamatoria, además de la supresión de moléculas de adhesión, de su efecto hipolipidémico79 y de la alteración de la función electrofisiológica de las células del corazón, de manera que reducen su excitabilidad haciéndolas menos vulnerables a la fibrilación ventricular.63,74
Diversos estudios en humanos han mostrado que la suplementación de aceite de pescado suprime la producción de citocinas proinflamatorias de las células mononucleares sanguíneas e inhibe la proliferación de linfocitos, lo que suprime la respuesta inflamatoria.80 Asimismo, las evidencias de estudios epidemiológicos y clínicos realizados en hombres y mujeres demuestran que el ALN n–3 tiene un efecto cardioprotector, dado por una disminución significativa en la proteína C reactiva.81 Además, otros estudios han mostrado que el ADH disminuye la expresión de moléculas de adhesión en el endotelio y en células mononucleares de sangre periférica reduciendo así la adhesión celular.77
Estudios poblacionales en hombres de 25 a 74 años muestran que el consumo dietario de aceite de pescado (rico en AEP n–3 y ADH n–3), se asocia con una disminución del 50% en el riesgo de paro cardiaco.79 Esto podría estar dado, al menos en parte, por el efecto de los AGPIs dietarios sobre la composición de los ácidos grasos de la membrana celular de los miocitos cardiacos.82
Actualmente existe controversia sobre si el consumo dietario de AGPIs–CL n–3 (ADH, AEP) reduce la isquemia cardiaca, ya que este efecto no se ha confirmado en humanos.82 También existe controversia con otras enfermedades cardiovasculares, esto surge a la luz de un estudio reciente realizado in vitro en células endoteliales humanas, en donde se observó que el AL y en menor grado el ALN estimulan el desarrollo de un ambiente pro–inflamatorio dentro del endotelio vascular.83
Los datos de los diferentes estudios sugieren que el efecto benéfico en la función cardiovascular se debe a la disminución de las grasas saturadas y/o a la sustitución de la grasa saturada por AGPIs. Sin embargo, se ha observado que el consumo de dietas bajas en grasa saturada y poliinsaturada, y altas en hidratos de carbono, reducen la concentración sanguínea de HDL y aumentan los niveles de triacilgliceroles, lo que incrementa el riesgo de desarrollar enfermedades cardiovasculares.84 Por otro lado, un estudio en 80,082 mujeres entre 34 y 59 años de edad, Frank, et al. (2004) muestra que el reemplazo de grasa saturada y de ácidos grasos insaturados trans por ácidos grasos no hidrogenados monoinsaturados o poliinsaturados (AL) previene el desarrollo de enfermedad coronaria en mujeres de manera más significativa en comparación con sólo reducir el consumo de grasa saturada.85
Estos resultados sugieren que el consumo adecuado de AGPIs se utilice como una estrategia para disminuir el riesgo de enfermedad cardiovascular. Sin embargo, este efecto no se ha demostrado en todos los estudios, posiblemente debido a las diferencias en el número de los sujetos estudiados, la inadecuada medición de la dieta, la no cuantificación de los ácidos grasos transinsaturados, que en su conjunto pueden subestimar el efecto benéfico de los AGPIs.
AGPIs en la dermatitis atópica
La dermatitis atópica es una enfermedad de la piel que tiene una patogenia compleja, la cual inicia del tercer al sexto mes de vida, afecta al 3% de los niños y es muy rara en los adultos. Las lesiones de la piel tienden a ser eritematosas y vesiculares.86 Esta enfermedad se conoce desde que Burr y Burr descubrieron en 1929 que ratas alimentadas con una dieta libre de grasa tenían descamación de la piel y su crecimiento se detenía; estos efectos se revertían cuando se agregaba grasa a la dieta. En 1933 Hansen encontró que los pacientes con dermatitis atópica tenían bajas concentraciones de AGIs en la sangre. Cuando estos pacientes eran alimentados con aceite de maíz (rico en ácido linoleico), las alteraciones en la piel desaparecían.86
Estas investigaciones establecieron que una deficiencia de los AGIs de la familia n6 conduce a procesos inflamatorios en la piel de animales y del humano. Sin embargo, recientemente se ha propuesto que no existe deficiencia de AL en el eczema atópico. Esto se sugiere del hecho que las concentraciones de AL se encuentran elevadas en la sangre, en la leche y en el tejido adiposo de pacientes con eczema atópico, mientras que las concentraciones de los metabolitos del AL se encuentran anormalmente disminuidas. Esto indica que existe una conversión reducida del ácido linoleico al ácido γ–linolénico. La administración del ácido γ–linolénico en estos pacientes mejora en la mayoría pero no en todos los casos la condición de la piel.87
Aunque aún existen discrepancias de esto, la mayoría de los investigadores que han estudiado la bioquímica del eczema atópico, han llegado a la conclusión de que el metabolismo de los AGIs en estos pacientes es anormal.
FUENTES ALIMENTICIAS DE LOS AGPIs
Las principales fuentes alimenticias de los ácidos grasos n–3 son los aceites vegetales y el pescado. El pescado es una importante fuente de AEP y ADH, mientras que el ALN se encuentra principalmente en los cloroplastos de los vegetales de hojas verdes, en los aceites de soya, en la cañóla y en la linaza. Entre otras fuentes de ácidos grasos n–3 se encuentran las semillas, las nueces y algunas frutas. Entre los alimentos que contienen más ALN se encuentra el aceite de cañóla (7.9–9.3 g/100 g alimento), de soya (6.8 g/100 g alimento) y la linaza (14.2–22.8 g/100 g alimento). Aunque esta última es la más enriquecida con ALN no es un alimento que se consuma comúnmente en nuestro país. Con respecto al AEP y el ADH, algunos aceites de pescado como el de sardina, salmón y bacalao son ricos en estos ácidos grasos. El aceite de bacalao es el más enriquecido ya que contiene 13.2 y 10.9 g/100 g de aceite AEP y ADH, respectivamente. De manera interesante el contenido de estos ácidos grasos puede variar entre los diferentes tipos de pescado (Cuadro 2).
Con respecto a los ácidos grasos de la familia n–6, las principales fuentes de AL son los aceites de origen vegetal. En el cuadro 2 se puede observar que el AL es más abundante en los aceites de cártamo (74 g/100 alimento), girasol (65 g/100 g alimento), maíz (58 g/100 g alimento) y soya (51 g/100 g alimento). Las fuentes alimenticias del AA son algunos alimentos de origen animal, como la yema de huevo, la carne, el hígado y el aceite de bacalao.
Debido a que el AL se encuentra en los aceites comestibles, granos y leguminosas, y que los alimentos de origen animal proveen suficientes cantidades de AA (ambos del tipo n–6), nos podría llevar a suponer que la alimentación de AGIs del tipo n–6 no es un problema. Sin embargo, debido a que en nuestra dieta no se consume habitualmente la linaza y el aceite de cañóla, alimentos que son ricos en ALN, podría presentarse una baja ingesta en los ácidos grasos de la familia n–3. Además, en nuestro país es muy bajo el consumo de pescado. De manera que los AGIs del tipo n–3 son muy escasos en la dieta común de nuestro país, en comparación con los de la familia n6 y por ello, dadas las costumbres alimentarias de la población en general, podría existir deficiencia de ácidos grasos del tipo n–3.
RECOMENDACIONES DE LOS AGPIs
Los AGPIs contribuyen con 7% del consumo total de energía y con 19–22% del consumo de energía proveniente de la grasa en las dietas de adultos. Estas cantidades se encuentran dentro del consumo recomendado para hombres y mujeres. El AL es el principal AGPI y comprende del 84–89% de la energía total de los AGPIs, mientras que el AL contribuye con 9–11% de esta energía. El AA proporciona < 0.1% del consumo de energía, y el AEP y el ADH juntos aportan < 0.1–0.2% de la energía total. Esto indica que los AGPIs contribuyen en menor grado al consumo de grasa total en la dieta.88
Actualmente, la dieta es muy alta en ácidos grasos n6 siendo la relación n6/n3 de 20–30:1. Esta relación esta dada por una baja ingesta de pescado y otros alimentos ricos en AGPIs n–3 y por un elevado consumo de alimentos ricos en ácidos grasos n6.79 Debe existir un balance entre el consumo de los ácidos grasos n3 y n6, ya que un exceso en cualquiera de estos ácidos grasos afecta el catabolismo del otro, reduciendo su incorporación a los tejidos y alterando sus efectos biológicos. Esto se debe a que existe competencia por las enzimas que actúan sobre las dos familias de estos ácidos grasos. Aunque no se ha establecido oficialmente la ingesta óptima de AGPIs, se ha estimado que los requerimientos del humano para el AL son de aproximadamente 2 a 7 g/día, ola 3% del total de la energía consumida. La FAO/WHO recomienda consumos más altos de AL (4.5 a 5.7% de energía) para mujeres embarazadas.10,89
En cuanto a la ingesta de los AGPIs n–3, la FAO/ OMS recomienda un consumo óptimo de 1.1 a 1.5g/ día (0.8 a l.lg/día de AL, y 0.3 a 0.4g/día de AEP y ADH).10,90 Para los lactantes, se suele tomar como referencia la composición de la leche humana.91 Si bien su perfil de ácidos grasos se modifica con la dieta materna, se observa que contiene alrededor de 5% de AGIs, con 1% de AGPI–CL, expresados en función de las calorías totales.34 Sin embargo, para los recién nacidos que no son alimentados con leche materna existen en el mercado fórmulas infantiles enriquecidas con ADH y AA. Se han propuesto las siguientes recomendaciones para la dieta infantil: AL 10%, ALN 1.5%, AA 0.5%, ADH 0.35% y AEP < 0.1%, expresados como porcentaje de los ácidos grasos totales.79 Estas cifras son muy similares a las reportadas para la leche materna por Koletzko, et al.91 Algunos organismos tales como el comité de expertos de FAO/OMS,34 entre otros, recomiendan que las fórmulas deben contener ADH y AA, mientras que la FDA lo está considerando.
Se recomienda que el consumo de ácidos grasos en la dieta esté en una proporción n–3:n–6 de 5–10:1. Sin embargo, en Suecia se ha recomendado que esta proporción sea de 5:1, y en Japón se cambió la recomendación de 4:1 a 2:1.88
CONCLUSIONES
Los AGIs, AL y ALN se pueden convertir en otros AGPI–CL con más instauraciones, como el AA, el AEP y el ADH. Estos ácidos grasos participan en el control de la expresión de genes del metabolismo de los ácidos grasos y triacilgliceroles inhibiendo la lipogénesis y favoreciendo la oxidación de ácidos grasos, lo que disminuye los niveles de triacilgliceroles.
Además, el crecimiento y desarrollo del feto en el humano dependen del aporte materno de estos ácidos grasos. Debido a esto, la nutrición materna es de crucial importancia no sólo durante la lactancia, sino también durante el embarazo y aun antes de la concepción. Dado que la composición de ácidos grasos de la leche es un reflejo de los ácidos grasos de la dieta, es necesario que la madre consuma éstos, ya que su ingestión desde el embarazo parece ser importante para el desarrollo cerebral del feto y del neonato; sobre todo durante el tercer trimestre, cuando las demandas fetales para el crecimiento vascular y neuronal son mayores, ya que los fosfolípidos que integran las membranas celulares del sistema nervioso contienen grandes cantidades de este tipo de ácidos grasos. Así los recién nacidos pretérmino son vulnerables a la deficiencia de este tipo de ácidos grasos debido a la falta de reservas de tejido adiposo al nacer. Por lo que el neonato prematuro necesita una fuente de AGPIs–CL, los cuales podrían ser proporcionados por la leche materna o con fórmulas suplementadas.
Es importante resaltar que actualmente existen estudios enfocados a conocer la participación de los AG–PIs para el control o prevención de algunas enfermedades como diabetes mellitus; algunos tipos de cánceres, especialmente del tracto digestivo; dermatitis atópica, y obesidad. Evidencia epidemiológica también sugiere que el consumo de AGPIs tenga un efecto protector sobre el desarrollo de enfermedad cardiovascular. Además, aunque no están establecidas oficialmente las recomendaciones de la ingesta para ácidos grasos en México, se debe tratar de mantener un equilibrio en el consumo de los ácidos grasos n3 y n6.
REFERENCIAS
1. Golbitz P. Soya & oilseed bluebook. Golbitz P (ed.). Massachusetts; 2000. [ Links ]
2. Sprecher H. Long chain fatty acid metabolism. In: Polyunsaturated fatty acids in human nutrition. Braceo U, Deckelbaum RJ (ed). New York: Raven Press; 1992, p. 13–23. [ Links ]
3. Baur L, Connor J, Pan DA, Kriketos AD, Storlien LH. The fatty acid composition of skeletal muscle membrane phospholipid: its relationship with the type of feeding and plasma glucose levels in young children. Metabolism 1998; 47: 106–12. [ Links ]
4. Del Prado M. Contribution of dietary and newly formed arachidonic acid to human milk lipids in women eating a low fat diet. Am J Clin Nutr 2001; 74: 242–7. [ Links ]
5. Clarke SD. Polyunsaturated fatty acid regulation of gene transcription: A Molecular mechanism to improve the metabolic 25 syndrome. J Nutr 2001; 131: 1129–32. [ Links ]
6. De Antueno RJ, Knickle LC, Smith H, Elliot M, Allen SJ, Nwaka S, Winther MD. Activity of human D5 and D6 desaturases on multiple n–3 and n–6 polyunsaturated fatty acids. FEBS Letters 2001; 509: 77–80. [ Links ]
7. Brenner RR. The role of fats in human nutrition. San Diego, CA: Academic Press; 1989. [ Links ]
8. D'Andrea S, Guillou H, Jan S, Catheline D, Thibault J, Bouriel M, Rioux V, Legrand P. The same rat D6–desaturase not only acts on 18–but also on 24–carbon fatty acids in very–long–chain polyunsaturated fatty acid biosynthesis. Biochem J 2002; 364: 49–55. [ Links ]
9. Nelson DL, Cox MM. Lehninger Principles of Biochemistry. New York: Worth Publishers; 2000. [ Links ]
10. Simopoulos AP. Omega–3 fatty acids in health and disease and in growth and development. Am J Clin Nutr 1991; 54: 438–63. [ Links ]
11. Ahrens EHJ. Nutritional factors and serum lipids levels. Am J Med 1957; 23: 928–48. [ Links ]
12. Nichaman MZ, Sweeley CC, Olson RE. Plasma fatty acids in normolipemic and hyperlipemic subjects during fasting and af ter linoleate feeding. Am J Clin Nutr 1967; 20: 1057–69. [ Links ]
13. Bjorntorp P. Rates of oxidation of different fatty acids in isolated rat iver mitochondria. J Biol Chem 1968; 243: 2130–2. [ Links ]
14. Allmann DW, Gibson DM. Fatty acid synthesis during early linoleic acid deficiency in the mouse. J Lipid Res 1965; 6: 51–62. [ Links ]
15. Kim HJ, Takahashi M, Ezaki O. Fish oil feeding decreases mature sterol regulatory element–binding protein 1 (SREBP–1) by 33 down–regulation of SREBP–1 c mRNA in mouse liver. J Biol Chem 1999; 274: 25892–8. [ Links ]
16. Sekiya M, Yahagi N, Matsuzaka T, Najima Y, Nakakuki M, Nagai R, et al. Polyunsaturated fatty acids ameliorate hepatic steatosis in obese mice by SREBP–1 suppression. Hepatology 2003; 38(6): 1529–39. [ Links ]
17. Yahagi N, Shimano H, Hasty AH, Amemiya–Kudo M, Okazaki H, Tamura Y, et al. Ishibashi S, Yamada N. A crucial role of 36 sterol regulatory element–binding protein–1 in the regulation of lipogenic gene expresión by polyunsaturated fatty acids. J Biol Chem 1999; 274: 35840–4. [ Links ]
18. Manzano N, Torres N, Tovar AR. Mecanismo de acción de las proteínas que se unen a los elementos regulatorios de esteróles (SREBPs) en la biosíntesis de colesterol y ácidos grasos. Rev Invest Clin 2002; 54: 145–53. [ Links ]
19. Kliewer SA, Sundseth SS, Jones SA, Brown PJ, Wisely GB, Koble CS, et al. Fatty acids and eicosanoids regulate gene expression through direct interactions with peroxisome proliferator– activated receptors a and g. Proc Nati Acad Sci 1997; 94: 4318–23. [ Links ]
20. Wahle KWJ, Rotondo D, Heys SD. Polyunsaturated fatty acids 40, (PUFAs) and gene expression in mammalian systems. Proc Nutr Soc 2003; 62: 349–60. [ Links ]
21. Cho HP, Nakamura MT, Clarke SD. Cloning, expression, and nutritional regulation of the mammalian D–6 desaturase. J Biol Chem 1999; 274: 471–7. [ Links ]
22. Cho HP, Nakamura M, Clarke SD. Cloning, expression, and fatty acid regulation of the human D–5 desaturase. J Biol Chem 1999; 274: 37335–9. [ Links ]
23. Shimano H, Yahagi N, Amemiya–Kudo M, Hasty AH, Osuga J, Tamura Y, et al. Sterol regulatory element–binding protein–1 as a key transcription factor for nutritional induction of lipogenic enzyme genes. J Biol Chem 1999; 274: 35840–4. [ Links ]
24. Matsuzaka T, Shimano H, Yahagi N, Amemiya–Kudo M, Yoshikawa T, Hasty AH, et al., Sone H, Gotoda T, Ishibashi S, Yamada N. Dual regulation of mouse D5– and D6–desaturase gene expression by SREPB–1 and PPARa. J Lipid Res 2002; 43: 107–14. [ Links ]
25. Nakamura MT, Nara TY. Gene regulation of mammalian desaturasas. Bioch Soc Trans 2002; 30: 1076–9. [ Links ]
26. Nara TY, He WS, Tang C, Clarke SD, Nakamura M. The E–box like sterol regulatory element mediates the suppression of human D–6 desaturase gene by highly unsaturated fatty acids. Biochem Biophys Res Commun 2002; 296: 111–7. [ Links ]
27. Crawford MA, Costeloe K, Doyle W, Leaf A, Leighfield MJ, Meadows N, Phylactos A. Essential fatty acids in early development. In: Polyunsaturated fatty acids in human nutrition. Braceo U, Deckelbaum RJ (Ed). New York: Raven Press; 1992, p. 93–109. [ Links ]
28. Crawford MA. Are deficits of arachidonic and docosahexaenoic acids responsible for the neural and vascular complications of preterm babies? Am J Clin Nutr 1997; 66: 1032S–1041S. [ Links ]
29. Al MD, Badart SA. Fat intake of women during normal pregnancy: relationship with maternal and neonatal essential fatty acid status. J Am Coll Nutr 1996; 15: 49–55. [ Links ]
30. Jensen RG, Lammi–Keefe CJ, Henderson RA, Bush VJ, Ferris AM.Effect of dietary intake of w–6 and w–3 fatty acids on the fatty acid composition of human milk in North America. J Pediatr 1992; 120: 87S–92S. [ Links ]
31. Makrides M, Neumann MA, Gibson RA. Effect of maternal docosahexaenoic acid (DHA9) supplementation on breast milk composition. Eur J Clin Nutr 1996; 50: 352–7. [ Links ]
32. Helland IB, Smith L, Saarem K, Saugstad OD, Drevon CA. Maternal supplementation with very–long–chain n–3 fatty acids during pregnancy and lactation augments children's IQ at 4 years of age. Pediatr 2003; 111: 39–44. [ Links ]
33. Uauy–Dahach R, Mena P. Nutritional role of omega–3 fatty acids during the perinatal period. Clin Perinatal 1995; 22: 157–75. [ Links ]
34. Comité. FWE, FAO/WHO Expert Comité. Food and Nutrition. Fats and oils in Human. Nutrition 1995; 57: 49–55. [ Links ]
35. Crawford MA. The role of essential fatty acids in neural development: implications for perinatal nutrition. Am J Clin Nutr 1993; 57(Suppl.): 703S–710S. [ Links ]
36. Uauy R, Peirano P, Hoffman D, Mena P, Birch D, Birch E. Role of essential fatty acids in the function of the developing nervous system. Lipids 1996; 31: 167S –176S. [ Links ]
37. Bourre JM, Francios M, Youyou A, Dumont O, Piciotti M, Pascal G, Durand G. The effects of dietary a–linolenic acid on the composition of nerve membrane, enzimatic activitiy, amplitude of electro–physiological parameters, resistence to poisons and performance of learning tasks in rats. J Nutr 1989; 119: 1880–90. [ Links ]
38. Martinez M. Tissue levels of polyunsaturated fatty acids during early human development. J Pediatr 1992; 120: 129S–138S. [ Links ]
39. Litman BJ, Mitchell DC. A role for phospholipids polyunsaturation in modulating membrane protein function. Lipids 1996; 31: 193–7. [ Links ]
40. Rodriguez M, Tovar AR, Torres N. Transcriptional regulation of D6 and D5 desaturases by dietary linoleic acid content in lactating mammary gland. International Society for research into human milk and lactation. Cambridge, England: Queens College; 2004. [ Links ]
41. Poisson JP, Dupuy RP, Sarda P, Descomps B, Narce M, Rieu D, Crastes de Paulet A. Evidence that liver microsomes of human neonates desaturate essential fatty acids. Biochem Biophys Acta 1993; 1167: 109–13. [ Links ]
42. Rodriguez A, Sarda P, Nessmann C, Boulot P, Legera CL, Descomps B. D6 and D5–desaturase activities in the human fetal liver: kinetic. Lipid Res 1998; 39: 1825–32. [ Links ]
43. Hamosh M, Salem JN. Long–chain polyunsaturated fatty acids. Biol Neonate 1998; 74: 106–20. [ Links ]
44. Clandinin MT, Chappell JE, Leong S, Heim T, Sawyer PR, Chance GW. Intrauterine fatty acid accretion rates in human brain: implication for fatty acid requirements. Early Hum Dev 1980; 4: 121–9. [ Links ]
45. Uauy RD, Birch DG, Birch EE, Tyson JE, Hoffman DR. Effect of dietary omega–3 fatty acids on retinal function of very–low–birth wight neonates. Pediatr Res 1990; 28: 485–92. [ Links ]
46. Farquharson J, Cockburn F, Patrick WA, Jamieson EC, Logan RW. Infant cerebral cortex phospholipid fatty–acid composition and diet. Lancet 1993; 430: 810–3. [ Links ]
47. Innis SM. Polyunsaturated fatty acid nutrition term gestation infants. In: Developing brain and behaviour; the role of lipids in infant formula. Dobbing J (Ed). London: Academic Press; 1997, p. 103–67. [ Links ]
48. Suresh Y, Das UN. Long–Chain polyunsaturated fatty acids and chemically induced diabetes mellitus: Effect of w–6 fatty acids. Nutrition 2003; 19: 93–114. [ Links ]
49. Suresh Y, Das UN. Long–Chain polyunsaturated fatty acids and chemically induced diabetes mellitus. Effect of w–3 fatty acids. Nutrition 2003; 19: 213–28. [ Links ]
50. Salmerón J, Hu FB, Manson JE, Stampfer MJ, Colditz GA, Rimm EB, Willett WC. Dietary fat intake and risk of type 2 diabetes in women. Am J Clin Nutr 2001; 73: 1019–26. [ Links ]
51. Meyer KA, Kushi LH, Jacobs DR, Folsom AR. Dietary fat and incidence of type 2 diabetes in older Iowa women. Diabetes Care 2001; 24: 1528–35. [ Links ]
52. Feskens EJ, Kromhout D. Epidemiologic studies on Eskimos and fish intake. Ann NY Acad Sci 1993; 683: 9–15. [ Links ]
53. Feskens EJ, Bowles CH, Kromhout D. Inverse association between fish intake and risk of glucose intolerance in normoglycemic elderly men and women. Diabetes Care 1991; 14: 935–41. [ Links ]
54. Harding AH, Sargeant LA, Welch A, Oakes S, Luben RN. Fat consumption and HbAlc levels. Diabetes Care 2001; 24: 1911–6. [ Links ]
55. Woodman RJ, Mori TA, Burke V, Puddey IB, Watts GF, Beilin LJ. Effects of purified eicosapentaenoic and docosahexaenoic acids on glycemic control, blood pressure, and serum lipids in type 2 diabetic patients with treated hypertension. Am Clin J Nutr 2002; 76: 1007–15. [ Links ]
56. Hendra TJ, Britton ME, Roper DR. Effects of fish oil supplements in NIDDM subjects. Controlled study. Diabetes Care 1990; 13: 821–9. [ Links ]
57. Holman RT. The slow discovery of the importance of w3 essential fatty acids in human health. J Nutr 1998; 128: 427S–433S. [ Links ]
58. Alfenas RC, Mates RD. Effect of fat sources on satiety. Obes Res 2003; 11: 183–7. [ Links ]
59. Clarke SD. Polyunsaturated fatty acid regulation of gene transcription: a mechanism to improve energy balance and insulin resistence. Brit J Nutr 2000; 83: 59S–66S. [ Links ]
60. Das UN. Is obesity an inflammatory condition? Nutrition 2001; 17: 953–66. [ Links ]
61. Chambrier C, Bastard JP, Rieusset J, Chevillotte E, Bonnefont–Rousselot D, Therond P, et al. H. Eicosapentaenoic acid induces mRNA expression of peroxisome proliferator–activated receptor g. Obes Res 2002; 10: 518–25. [ Links ]
62. Eynard AR–V, Number (may–June). Role of dietary polyunsaturated fatty acids (PUFA) on tumorigenesis. Cancer Journal 1996; 9. [ Links ]
63. Siddiqui RA, Shaikh SR, Sech LA, Yount HR, Stillwell W, Zaloga GP. Omega 3–fatty acids: health benefits and cellular mechanisms of action. Mini Rev Med Chem 2004; 4: 859–71. [ Links ]
64. Hawkins RA, Sangster K, MJ. A. Apoptotic death of pancreatic cancer cells induced by polyunsaturated fatty acids varies with double bond number and involves an oxidative mechanism. J Pathol 1998; 185: 61–70. [ Links ]
65. Fay MP, Freedman LS, Clifford C, Midhtune DN. Effect of different types and amounts of fat on the development of mammary tumors in rodents: a review. Cancer Research 1997; 57: 3979–88. [ Links ]
66. Eritsland J. Safety considerations of polyunsaturated fatty acids. Am J Clin Nutr 2000; 71: 197–201. [ Links ]
67. Sauer LA, Dauchy RT, Blask DE. Mechanism for the antitumor and anticachectic effects of n–3 fatty acids. Cancer Research 2000; 60: 5289–95. [ Links ]
68. Davidson LA, Nguyen DV, Hokanson RM, Callaway ES, Iseff RB, Turne ND, et al. Chemopreventive n–3 polyunsaturated fatty acids reprogram genetic signatures during colon cancer initiation and progression in the rat. Cancer Research 2004; 64: 6797–804. [ Links ]
69. Fernandez E, Chatenoud L, Vecchia CL, Negri E, Franceschi S. Fish consumption and cancer risk. Am J Clin Nutr 1999; 70: 85–90. [ Links ]
70. Bartsch H, Nair J, Owen RW. Dietary polyunsaturated fatty acids and cancers of the breast and colorectum: emerging evidence for their role as risk modifiers. Carcinogenesis 1999; 20: 2209–18. [ Links ]
71. Caygill CPJ, Hill MJ. Fish, n–3 fatty acids and human colorectal and breast cancer. Eur J Cancer Prev 1995; 4: 329–32. [ Links ]
72. Caygill CP, Charlett A, Hill MJ. Fat, fish oil and cancer. Brit J Cancer 1996; 74: 159–64. [ Links ]
73. Gaard M, Tretli S, EB. L. Dietary factors and risk of colon cancer: a prospective study of 50,535 young Norwegian men and women. Eur J Cancer Prev 1996; 5: 445–54. [ Links ]
74. Kang JX, Leaf A. Prevention of fatal cardiac arrhythmias by polyunsaturated fatty acids. Am J Clin Nutr 2000; 71: 202S–207S. [ Links ]
75. Gimbrone MA, Topper JN, Nagel T, Anderson KR, García–Cadena G. Endothelial dysfunction, hemodynamic forces, and atherogenesis. Ann NY Acad Sci 2000; 902: 230–9. [ Links ]
76. Libby P, Ridker PM, Maceri A. Inflammation and atherosclerosis. Circulation 2002; 105: 1135–43. [ Links ]
77. Zhao G, Etherton TD, Martin KR, West SG, Gillies PJ, Kris–Etherton PM. Dietary a–linolenic acid reduces inflammatory and lipid cardiovascular risk factors in hypercholesterolemic men and women. J Nutr 2004; 134: 2991–7. [ Links ]
78. Pasceri V, Willerson JT, Yeh ET. Direct proinflammatory efect of C–reactive protein on human endothelial cell. Circulation 2000; 102: 2165–8. [ Links ]
79. Simopoulos AP. Essential fatty acids in health and chronic disease. Am J Clin Nutr 1999; 70: 560–9. [ Links ]
80. Meydani SN, Endres S, Woods MM, Goldin BR, Soo O, Morrill–Labrode A, et al. G. Oral (n–3) fatty acid suplementation suppresses cytokine production and lymphocyte proliferation comparation beetween young and older women. J Nutr 1991; 121: 547–55. [ Links ]
81. Djousse L, Folsom AR, Province MA, Hunt SC, Ellison RC. Dietary linoleic acid and carotid atherosclerosis: The National Heart, Lung, and Blood Institute, family heart study. Am Clin J Nutr 2003; 77: 819–25. [ Links ]
82. Siscovick D, Raghunathan TE, King I, Weinmann S, Bovbjerg VE, Kushi L, et al. Dietary intake of long–chain n–3 polyunsaturated fatty acids and the risk of primary cardiac arrest. Am J Clin Nutr 2000; 71: 208S–212S. [ Links ]
83. D'Agostino RB, Lee ML, Belanger AJ, Cupples LA, Anderson K, WB. K. Relation of pooled logist regression to time dependent Cox regression analysis: the Framingham Heart Study. Stat Med 1990; 9: 1501–15. [ Links ]
84. Mensink RP, MB. K. Effect of dietary fatty acid on serum lipids and lipoproteins: a meta–analysis of 27 trials. J Arterioacl Thromb 1992; 12: 911–9. [ Links ]
85. Hu FB, Stampfer MJ, Manson JE, Rimm E, Colditz GA, Rosner BA, et al. Dietary fat intake and the risk of coronary heart disease in women. N Engl J Med 1997; 337: 1491–9 [ Links ]
86. Juhlin L. Long chain fatty acids and atopic dermatitis. En: Polyunsaturated fatty acids in human nutrition. Braceo U, Deckelbaum RJ (Ed). New York: Raven Press; 1992, p. 211–8. [ Links ]
87. Horrobin DF. Essential fatty acid metabolism and its modification in atopic eczema. Am J Clin Nutr 2000; 71: 367S–372S. [ Links ]
88. Kris–Etherton PM, Taylor DS, Yu–Poth S, Huth P, Moriarty K, Fishell V, Hargrove RLZG, Etherton TD. Polyunsaturated fatty acids in the food chain in the United States. Am Clin J Nutr 2000; 71: 179–88. [ Links ]
89. Emken EAD, TX: American Heart Association, 1995, p. 9–18. Proceeding from the Scientific Conference on omega–3 fatty acids in nutrition, Vascular Biology, and Medicine, omega–3 fatty acids in nutrition. Dallas, TX. 1995. [ Links ]
90. Metcalf RG, James MJ, Mantzioris E, Cleland LG. A practical approach to increasing intakes of n–3 polyunsaturated fatty acids: use of novel foods enriched with n–3 fats. Eur J Clin Nutr 2003; 57: 1605–12. [ Links ]
91. Koletzko B, Thiel I, Abiodun PO. The fatty acid composition of human milk in Europa and Africa. J Pediatr 1992; 120: 62S–70S. [ Links ]
92. Metcalf RG, James MJ, Cleland LG. A practical approach to increasing intakes of n–3 polyunsaturated fatty acids: use of novel foods enriched n–3 fats. Eur J Clin Nutr 2003; 57: 1605–12. [ Links ]
93. Library USNA. United States National Agricultural Library. Nutrient Data Laboratory www.nal.usda.gov [ Links ]
94. (INC) TItNC. www.inc.treenuts.org [ Links ]
95. Friedberg CE, Heine RJ, Janssen MJ, Grobbee DE. Fish oil and glycemic control in diabetes. A meta analysis. Diabetes Care 1998; 21: 494–500. [ Links ]
96. Farmer A, Montori V, Dinneen S, Ciar C. Fish oil in people with type 2 diabetes mellitus (Cochrane Review). John Wiley & Sons, Ltd. Chichester, UK, 2004. [ Links ]
97. Kobayashi M, Sasaki S, Hamada GS, Tsuganes S. Serum n–3 fatty acids, fish consumption and cancer mortality in six Japanese populations and Brazil. Jpn J Cancer Res 1999; 90: 914–21. [ Links ]
98. Ascherio A, Rimm EB, Stampfer MJ, Giovannucci EL, Willet WC. Dietary intake of marine n–3 fatty acids, fish intake, and the risk of coronary disease among men. N Engl J Med 1995; 332: 977–82. [ Links ]
99. Hu FB, Bronner L, Willett WC, Stampfer MJ, Rexrode KM, Albert CM, et al. Fish and omega–3 fatty acid intake and risk of coronary disease in women. JAMA 2002; 287: 1815–21. [ Links ]
100. Hu FB, Cho E, Rexrode KM, Albert CM, Manson JE. Fish and long–chain w–3 fatty acid intake and risk of coronary heart disease and total mortality in diabetic women. Circulation 2003; 107: 1852–7. [ Links ]
101. Mozaffarian D, Ascherio A, Hu FB, Stampfer MJ, Willett WC, Siscovick DS, Rimm EB. Interplay between different polyunsaturated fatty acid and risk of coronary heart disease in men. Circulation 2005; 111: 157–64. [ Links ]














